Post hier weer al je vragen, passies, trauma's en andere dingen die je uit je slaap houden met betrekking tot de vakken:
• Natuurkunde
• Informatica
• Scheikunde
• Biologie
• Algemene Natuurwetenschappen
• ... en alles wat verder in de richting komt.
Van MBO tot WO, hier is het topic waar je een antwoord kunt krijgen op je vragen.
Opmaak: http://betahw.mine.nu/index.php: site van GlowMouse om formules te kunnen gebruiken in je posts (op basis van Latexcode wordt een plaatje gegenereerd dat je vervolgens via het aangegeven linkje kunt opnemen).
Parallel schakeling Weerstand Spoel Condensator (RLC) en dan frequentie bepalen zodat er resonantie optreedt.
R=100ohm
L=2H
C=10uF
In serie snap ik (resonantie is daar XL=XC) het maar parallel is nog vaag.
hoeveel maal hoger is dan de geluidsintensiteit geworden?
Voor elke verdubbeling in intensiteit krijg je toch een verhoging van 3dB? Dan is de intensiteit toch met 2^10 = 1024. Met een factor 1024 toegenomen?
Antwoordmodel van dit tentamen geeft dit antwoord namelijk niet als optie.
Die 3dB is een benadering, het is niet precies 3dBquote:Op donderdag 14 april 2011 20:47 schreef Physics het volgende:
Als de volumeknop harder wordt gezet tot het geluid 30 dB is toegenomen,
hoeveel maal hoger is dan de geluidsintensiteit geworden?
Voor elke verdubbeling in intensiteit krijg je toch een verhoging van 3dB? Dan is de intensiteit toch met 2^10 = 1024. Met een factor 1024 toegenomen?
Antwoordmodel van dit tentamen geeft dit antwoord namelijk niet als optie.
Goede link opzich, staan alleen een paar foutjes in de tabel, bij 30 dB (ook bij 40 dB) zijn de waardes in zowel de eerste als de tweede kolom een factor tien te laagquote:Op vrijdag 15 april 2011 04:09 schreef Lyrebird het volgende:
http://www.natuurkunde.nl/artikelen/view.do?supportId=398485
In mijn lesboek natuurkunde stond volgens mij een fout over een brekingsindex. Er stond namelijk dat nlucht->water = nlucht/nwater. Maar dit hoort toch: nlucht->water = nwater/nlucht te zijn?
Verder heb ik nog een vraag over verval (straling). Er zijn isotopen van stoffen die via meerdere soorten straling vervallen. Een voorbeeld hiervan is O-19. Dit vervalt via ß- straling en γ straling. Maar moet je in de vervalreactie dan allebei deze stralingen zetten, of twee vervalvergelijken waarbij in de één bèta min straling voorkomt, en in de ander gammastraling? Want bij veel isotopen staan er meerdere soorten stralingen waarin het vervalt, en aangezien dit op het CSE gaat komen, wil ik dit goed snappen.
Bij voorbaat dank
[ Bericht 0% gewijzigd door #ANONIEM op 03-05-2011 17:28:22 ]
Bedoel je met nlucht de geluids- of lichtsnelheid in lucht? In dat geval lijkt mij dat het gewoon klopt wat in het boek staat, als je van medium 1 naar medium 2 gaat, geldt n=c1/c2 (met c de geluidssnelheid in het betreffende medium).quote:Op dinsdag 3 mei 2011 17:09 schreef Mark94 het volgende:
Ik heb een aantal vragen m.b.t. natuurkunde (5havo).
In mijn lesboek natuurkunde stond volgens mij een fout over een brekingsindex. Er stond namelijk dat nlucht->water = nlucht/nwater. Maar dit hoort toch: nlucht->water = nwater/nlucht te zijn?
Staat er niets in de vraag welke straling er vrijkomt? Ik dacht dat dat er bij ons altijd bij stond namelijk, als het er niet bij staat zou ik het zo ook niet direct weten.quote:Verder heb ik nog een vraag over verval (straling). Er zijn isotopen van stoffen die via meerdere soorten straling vervallen. Een voorbeeld hiervan is O-19. Dit vervalt via ß- straling en γ straling. Maar moet je in de vervalreactie dan allebei deze stralingen zetten, of twee vervalvergelijken waarbij in de één bèta min straling voorkomt, en in de ander gammastraling? Want bij veel isotopen staan er meerdere soorten stralingen waarin het vervalt, en aangezien dit op het CSE gaat komen, wil ik dit goed snappen.
Bij voorbaat dank
In je vervalreactie zet je alleen deeltjes met massa en/of lading, gamma straling heeft dit beide niet en hoef je dus nooit in de vergelijking te zetten. In dit geval krijg je dus 19/8 O -> 0/-1 e + 19/9 Fquote:Op dinsdag 3 mei 2011 17:09 schreef Mark94 het volgende:
Verder heb ik nog een vraag over verval (straling). Er zijn isotopen van stoffen die via meerdere soorten straling vervallen. Een voorbeeld hiervan is O-19. Dit vervalt via ß- straling en γ straling. Maar moet je in de vervalreactie dan allebei deze stralingen zetten, of twee vervalvergelijken waarbij in de één bèta min straling voorkomt, en in de ander gammastraling? Want bij veel isotopen staan er meerdere soorten stralingen waarin het vervalt, en aangezien dit op het CSE gaat komen, wil ik dit goed snappen.
Bij voorbaat dank
Oh lichtsnelheid. Maar als licht via lucht naar een andere stof gaat, breekt hij naar de normaal toe. Dan zou de brekingsindex groter dan 1 moeten zijn. Want de brekingsindex van lucht is ongeveer 1 en die van water is ongeveer 1,3. Dus als het nlucht->water = nlucht/nwater zou zijn dan zou er 1/1,3 = 0.8 uit komen. En dat is kleiner dan 1, dus klopt toch niet? Daarom hoort het toch nlucht->water = nwater/nlucht te zijn?quote:Op dinsdag 3 mei 2011 18:06 schreef M.rak het volgende:
[..]
Bedoel je met nlucht de geluids- of lichtsnelheid in lucht? In dat geval lijkt mij dat het gewoon klopt wat in het boek staat, als je van medium 1 naar medium 2 gaat, geldt n=c1/c2 (met c de geluidssnelheid in het betreffende medium).
[..]
Staat er niets in de vraag welke straling er vrijkomt? Ik dacht dat dat er bij ons altijd bij stond namelijk, als het er niet bij staat zou ik het zo ook niet direct weten.
[..]
Nee het gaat zeg maar over een bepaalde isotoop (bijvoorbeeld O-19 of Ba-140) en dan moet je in je BINAS (informatieboek met onder andere gegevens van stoffen) opzoeken via welke straling het vervalt en daar moet je bijvoorbeeld de vervalreactie van opschrijven.
[ Bericht 6% gewijzigd door #ANONIEM op 04-05-2011 18:55:50 ]
Ja maar wat nou als je een isotoop krijgt, bijvoorbeeld Po-216. Die vervalt via alfa- en bètastraling. Die hebben allebei massa en lading, dus hoe zit het dan?quote:Op dinsdag 3 mei 2011 21:48 schreef bert_van_dirkjan het volgende:
[..]
In je vervalreactie zet je alleen deeltjes met massa en/of lading, gamma straling heeft dit beide niet en hoef je dus nooit in de vergelijking te zetten. In dit geval krijg je dus 19/8 O -> 0/-1 e + 19/9 F
[ Bericht 0% gewijzigd door #ANONIEM op 04-05-2011 18:55:13 ]
De brekingsindex geeft de verhouding tussen de lichtsnelheid in een vacuüm en in een medium, er is dus niet zoiets als nlucht -> water. Wat jij bedoelt is denk ik gewoon de wet van Snellius, n1*sin(B1)=n2*sin(B2)?quote:Op woensdag 4 mei 2011 18:50 schreef Mark94 het volgende:
[..]
Oh lichtsnelheid. Maar als licht via lucht naar een andere stof gaat, breekt hij naar de normaal toe. Dan zou de brekingsindex groter dan 1 moeten zijn. Want de brekingsindex van lucht is ongeveer 1 en die van water is ongeveer 1,3. Dus als het nlucht->water = nlucht/nwater zou zijn dan zou er 1/1,3 = 0.77 uit komen. En dat is kleiner dan 1, dus klopt toch niet? Daarom hoort het toch nlucht->water = nwater/nlucht te zijn?
http://www.natuurkunde.nl/artikelen/view.do?supportId=73
Aah, ze hebben hier de verhouding van de brekingsindices ook weer brekingsindex genoemd. De definitie van brekingsindex (van één enkel medium, dus niet van het ene naar het andere medium) is, zoals ik net al zei, de verhouding tussen de lichtsnelheid in vacuüm en de lichtsnelheid in het medium. De wet van Snellius zegt nuquote:Op woensdag 4 mei 2011 19:05 schreef Mark94 het volgende:
Hier dit bedoel ik:
http://www.natuurkunde.nl/artikelen/view.do?supportId=73
dit kunnen we ook schrijven als
Die laatste term,
[ Bericht 4% gewijzigd door #ANONIEM op 04-05-2011 19:57:14 ]
Wat betekend de volgende zin precies:
The Earth is mean so I plot mad schemes
Gr.
Het alfa-huiswerktopic is gesloten, omdat daarvoor geen belangstelling was. Misschien is het een beter idee om het in TTK te proberen?quote:Op donderdag 5 mei 2011 00:33 schreef porsche1 het volgende:
Geen idee waar ik dit moet plaatsen. Maar het heeft met school te maken.
Wat betekend de volgende zin precies:
The Earth is mean so I plot mad schemes
Gr.
Dankje.quote:Op donderdag 5 mei 2011 00:56 schreef lyolyrc het volgende:
[..]
Het alfa-huiswerktopic is gesloten, omdat daarvoor geen belangstelling was. Misschien is het een beter idee om het in TTK te proberen?
bij de zuur-base constanten (Kz en Kb) staat de ene keer de linker kant van de reactievergelijking bovenaan, en de andere keer staat de rechterkant van de reactievergelijking bovenaan (wat normaal is imo) wat bepaalt wat noemer en wat teller is?
Mocht een dergelijk isotoop in de vraag staan, dan zal in de tekst wel duidelijk zijn om welk verval het gaat. Een enkel atoom kan in ieder geval niet tegelijk beta en alfa vervallen, dus er zijn twee verschillende verval reacties (1 voor alfa verval en 1 voor beta verval) en niet een of andere reactie met de twee gecombineerd.quote:Op woensdag 4 mei 2011 18:53 schreef Mark94 het volgende:
[..]
Ja maar wat nou als je een isotoop krijgt, bijvoorbeeld Po-216. Die vervalt via alfa- en bètastraling. Die hebben allebei massa en lading, dus hoe zit het dan?
Stel dat gevraagd wordt geef de vervalreactie(s) van Po-216 dan krijg je dus:
216/84 Po -> 212/82 Pb + 4/2 He voor alfa verval en 216/84 Po -> 216/85 At + 0/-1 e voor beta verval
Ga ze niet tegelijk gebruiken door zoiets te doen: 216/84 Po -> 4/2 He + 0/-1 e + 212/83 Bi
Ik snap je vraag niet helemaal, maar als je bedoelt wat ik denk..... De concentraties van H3O+ of OH- staan altijd bovenaan (teller) vermenigvuldigd met de concentratie(s) van wat nog meer aan die kant van de evenwichtsreactie staat.quote:Op donderdag 5 mei 2011 22:36 schreef kevintjuhh2 het volgende:
ik heb ook een vraagje:
bij de zuur-base constanten (Kz en Kb) staat de ene keer de linker kant van de reactievergelijking bovenaan, en de andere keer staat de rechterkant van de reactievergelijking bovenaan (wat normaal is imo) wat bepaalt wat noemer en wat teller is?
Bijvoorbeeld als je de Ph wil berekenen van een oplossing van 1 mol HCN in een liter water
De evenwichtsreactie: HCN + H2O <--> CN- + H3O+
Het gaat om een zuur dus zoek de Kz op : Kz=6,1 * 10^-10
Oftewel: [H3O+] x [CN-] / [HCN] = 6,1 * 10^-10
Je begint met 1 M HCN, maar een gedeelte x zal overgaan tot H3O+ + CN -, je hebt nu dus [H3O+]=x, [CN-]=x en [HCN]= 1-x (de 1 komt van de 1 M).
De vergelijking wordt dus: x^2/(1-x) = 6,1 * 10^-10, als je ziet dat x heel klein wordt mag je de -x weglaten en krijg je dus x^2= 6,1 * 10^-10 -> x = 2,5 * 10^-5 = [H3O+] --> pH = -log[x]
Volgens mij geldt in het algemeen dat wat rechts van de evenwichtsreactie staat is de teller en links de noemer
Bedankt! Dan doe ik dat tenminste niet fout.quote:Op zondag 8 mei 2011 02:24 schreef bert_van_dirkjan het volgende:
[..]
Mocht een dergelijk isotoop in de vraag staan, dan zal in de tekst wel duidelijk zijn om welk verval het gaat. Een enkel atoom kan in ieder geval niet tegelijk beta en alfa vervallen, dus er zijn twee verschillende verval reacties (1 voor alfa verval en 1 voor beta verval) en niet een of andere reactie met de twee gecombineerd.
Stel dat gevraagd wordt geef de vervalreactie(s) van Po-216 dan krijg je dus:
216/84 Po -> 212/82 Pb + 4/2 He voor alfa verval en 216/84 Po -> 216/85 At + 0/-1 e voor beta verval
Ga ze niet tegelijk gebruiken door zoiets te doen: 216/84 Po -> 4/2 He + 0/-1 e + 212/83 Bi
jah ik ben laatst een paar keer tegengekomen dat rechts onder en links boven stond, dat snapte ik niet ( en nog steeds niet) maar zullen wel fouten in antwoordmodellen zijn ofzo:Squote:Op zondag 8 mei 2011 03:00 schreef bert_van_dirkjan het volgende:
[..]
Ik snap je vraag niet helemaal, maar als je bedoelt wat ik denk..... De concentraties van H3O+ of OH- staan altijd bovenaan (teller) vermenigvuldigd met de concentratie(s) van wat nog meer aan die kant van de evenwichtsreactie staat.
Bijvoorbeeld als je de Ph wil berekenen van een oplossing van 1 mol HCN in een liter water
De evenwichtsreactie: HCN + H2O <--> CN- + H3O+
Het gaat om een zuur dus zoek de Kz op : Kz=6,1 * 10^-10
Oftewel: [H3O+] x [CN-] / [HCN] = 6,1 * 10^-10
Je begint met 1 M HCN, maar een gedeelte x zal overgaan tot H3O+ + CN -, je hebt nu dus [H3O+]=x, [CN-]=x en [HCN]= 1-x (de 1 komt van de 1 M).
De vergelijking wordt dus: x^2/(1-x) = 6,1 * 10^-10, als je ziet dat x heel klein wordt mag je de -x weglaten en krijg je dus x^2= 6,1 * 10^-10 -> x = 2,5 * 10^-5 = [H3O+] --> pH = -log[x]
Volgens mij geldt in het algemeen dat wat rechts van de evenwichtsreactie staat is de teller en links de noemer
Fouten kunnen natuurlijk altijd voorkomen. Hou er wel rekening mee dat teller en noemer op basis van rekenregels verwisseld kunnen worden wanneer je bezig bent met de uitdrukking voor pKz.quote:Op zondag 8 mei 2011 21:46 schreef kevintjuhh2 het volgende:
[..]
jah ik ben laatst een paar keer tegengekomen dat rechts onder en links boven stond, dat snapte ik niet ( en nog steeds niet) maar zullen wel fouten in antwoordmodellen zijn ofzo:S
Om even door te gaan op het voorbeeld van bert_van_dirkjan:
HCN +H2O <-> CN- + H3O+
Kz = [CN-][H3O+]/[HCN]
pKz = -log(Kz) = -log([CN-][H3O+]/[HCN]) = -log([H3O+]) - log([CN-]/[HCN]) = pH - log([CN-]/[HCN]) = pH + log([HCN]/[CN-])
In de laatste uitdrukking zijn teller en noemer verwisseld ten opzichte van de uitdrukking van Kz.
en klopt dit?
Assortiment groep Multimedia
Artikelgroep Foto s
Artikelsoort Canvas
Assortiment groep opname apparatuur
Artikelgroep Foto-apparatuur
Artikelsoort Digitale compact camera s
Ik moet de stof NaHCO3 (0,3M) titreren. Dan krijg je volgens mij:
HCO3 + H3O <-> CO3 + 2H2O
[HCO3] X [H3O]
_____________ = Kb
[CO3]
Volgens acibbaselabs zou ik nu erg veel moeten titreren, dus wil ik het verdunnen naar 0,1M.
Dan heb je ongeveer 25ml nodig. Nu moet ik het dus 3 keer verdunnen, maar ik ben eigenlijk helemaal vergeten hoe je moet verdunnen. Als ik 6ml water neem en hier 3ml NaHCO3 bijvoeg heb ik dan drie keer verdunt?
De juiste reactievergelijking luidt:
HCO3- + H3O+ <-> H2CO3 + H2O -> 2 H2O + CO2
Bicarbonaat (HCO3-) en het hydroniumion (H3O+) zijn dus in evenwicht met koolzuur (H2CO3) en het reactiewater (H2O). Koolzuur op zijn beurt kan splitsen in water en koolstofdioxide. Deze laatste reactie loopt af, omdat koolstofdioxide wegbubbelt uit het reactiemengsel.
Het heeft hier niet echt zin om een evenwichtsvoorwaarde op te gaan stellen, want je doet er hier verder niets mee.
De verdunning klopt en dat kun je ook narekenen:
3 ml 0,3 M NaHCO3-oplossing bevat:
0,3 M * 3,0 ml = 0,9 mmol NaHCO3
Na verdunnen met 6,0 ml water is de concentratie:
0,9 mmol/9,0 ml = 0,1 M NaHCO3.
Ok bedankt, de evenwichtsvoorwaarde heb ik later wel nodig, want ik moet ook de pH uitrekenen. Nog bedankt voor het corrigeren daarvanquote:Op woensdag 18 mei 2011 19:30 schreef lyolyrc het volgende:
De reactievergelijking die je hebt opgesteld klopt niet, want HCO3, H3O en CO3 bestaan niet. Vermeld altijd ladingen als daarvan sprake is!
De juiste reactievergelijking luidt:
HCO3- + H3O+ <-> H2CO3 + H2O -> 2 H2O + CO2
Bicarbonaat (HCO3-) en het hydroniumion (H3O+) zijn dus in evenwicht met koolzuur (H2CO3) en het reactiewater (H2O). Koolzuur op zijn beurt kan splitsen in water en koolstofdioxide. Deze laatste reactie loopt af, omdat koolstofdioxide wegbubbelt uit het reactiemengsel.
Het heeft hier niet echt zin om een evenwichtsvoorwaarde op te gaan stellen, want je doet er hier verder niets mee.
De verdunning klopt en dat kun je ook narekenen:
3 ml 0,3 M NaHCO3-oplossing bevat:
0,3 M * 3,0 ml = 0,9 mmol NaHCO3
Na verdunnen met 6,0 ml water is de concentratie:
0,9 mmol/9,0 ml = 0,1 M NaHCO3.
Je verdunt deze zure 10 keer, welke pH waarde krijg je dan?
Kan iemand de berekening erbij geven? Heb het dringend nodig
pH=-log([h3O+]), pH=4 komt dus overeen met [H3O+]=10-4. Tien keer verdunnen betekent (neem ik aan) dat de concentratie tien keer kleiner wordt, dus [H3O+] wordt 10-5, dit invullen in de formule van pH levert op pH=5.quote:Op donderdag 19 mei 2011 18:09 schreef FreakyStyley het volgende:
Vraag: Je hebt een zure met een waarde van pH 4.
Je verdunt deze zure 10 keer, welke pH waarde krijg je dan?
Kan iemand de berekening erbij geven? Heb het dringend nodig
Dat is trouwens niet toevallig, dat 10x verdunnen een stap van 1 geeft op de pH-schaal, iedere verandering met een factor tien zal de pH één stap verhogen danwel verlagen.
De arts beweerde echter dat H2O een PH van minder dan 3 heeft. Dat is bijna net zo zuur als cola. Hij heeft er allicht meer verstand van dan ik, maar ik kan het moeilijk geloven. Wie heeft er gelijk?
(Hij was niet aan het trollen trouwens, de voorafgaande reden was een flesje met (pure) H2O en ernaast een flesje met PH 7, toen vroeg ik welke vloeistof dat was omdat ik dacht dat H2O ook PH 7 is.)
Voor zover ik weet is de pH van water onder standaardsomstandigheden gewoon gelijk aan 7. Bij gedeutereerd water (D2O) is de pH (of eigenlijk pD) hoger, namelijk 7,4.quote:Op vrijdag 20 mei 2011 22:35 schreef 08gnoT. het volgende:
Gisteren had ik een gesprek met een medicus. Ik heb met scheikunde altijd geleerd dat water PH-neutraal is, dus 7. Aangezien de zure H+ de base OH- elkaar precies neutraliseren.
De arts beweerde echter dat H2O een PH van minder dan 3 heeft. Dat is bijna net zo zuur als cola. Hij heeft er allicht meer verstand van dan ik, maar ik kan het moeilijk geloven. Wie heeft er gelijk?
(Hij was niet aan het trollen trouwens, de voorafgaande reden was een flesje met (pure) H2O en ernaast een flesje met PH 7, toen vroeg ik welke vloeistof dat was omdat ik dacht dat H2O ook PH 7 is.)
Ik geloof dat jij toch echt gelijk hebt, dat is ook de strekking van deze wikipedia-pagina.quote:Op vrijdag 20 mei 2011 22:35 schreef 08gnoT. het volgende:
Gisteren had ik een gesprek met een medicus. Ik heb met scheikunde altijd geleerd dat water PH-neutraal is, dus 7. Aangezien de zure H+ de base OH- elkaar precies neutraliseren.
De arts beweerde echter dat H2O een PH van minder dan 3 heeft. Dat is bijna net zo zuur als cola. Hij heeft er allicht meer verstand van dan ik, maar ik kan het moeilijk geloven. Wie heeft er gelijk?
(Hij was niet aan het trollen trouwens, de voorafgaande reden was een flesje met (pure) H2O en ernaast een flesje met PH 7, toen vroeg ik welke vloeistof dat was omdat ik dacht dat H2O ook PH 7 is.)
http://en.wikipedia.org/wiki/PH
Pure water is said to be neutral, with a pH close to 7.0 at 25 °C
Nou ja raar, hij bracht me wel aan het twijfelen. Dan hoop ik maar dat zijn onderzoeken goed gaan
Edit: Ik herinner me net dat ik een paar PH-strips binnenkrijg volgende week, dan kan ik het mooi zelf testen
Misschien had hij het over spa rood of zo. Frisdrank met prik is behoorlijk zuur en daardoor erg slecht voor je tanden, aldus mijn tandarts.quote:Op zaterdag 21 mei 2011 01:08 schreef 08gnoT. het volgende:
Ja daarom, en hier staat het ook:
http://en.wikipedia.org/wiki/PH
Pure water is said to be neutral, with a pH close to 7.0 at 25 °C
Nou ja raar, hij bracht me wel aan het twijfelen. Dan hoop ik maar dat zijn onderzoeken goed gaan
Edit: Ik herinner me net dat ik een paar PH-strips binnenkrijg volgende week, dan kan ik het mooi zelf testen
Medici hebben doorgaans niet zo veel verstand van scheikunde. Het is inderdaad gewoon 7.quote:Op vrijdag 20 mei 2011 22:35 schreef 08gnoT. het volgende:
Gisteren had ik een gesprek met een medicus. Ik heb met scheikunde altijd geleerd dat water PH-neutraal is, dus 7. Aangezien de zure H+ de base OH- elkaar precies neutraliseren.
De arts beweerde echter dat H2O een PH van minder dan 3 heeft. Dat is bijna net zo zuur als cola. Hij heeft er allicht meer verstand van dan ik, maar ik kan het moeilijk geloven. Wie heeft er gelijk?
(Hij was niet aan het trollen trouwens, de voorafgaande reden was een flesje met (pure) H2O en ernaast een flesje met PH 7, toen vroeg ik welke vloeistof dat was omdat ik dacht dat H2O ook PH 7 is.)
De borstel moet ongeveer 1000 toeren draaien.
is 50-40 kilo zwaar en heeft de radius van ongveer 175mm en is ongveer 800 mm lang
Als je een spijker in het vuur houdt, gaat hij niet branden, hij gaat gloeien, en later smelt hij. (als de temperatuur hoog genoeg is.)
Maar waarom gaat ijzerpoeder dan vonken (verbrandt) als je het bij een vlam houdt?
En nog één: Zou ijzer geschikt zijn om warmte op te wekken? waarom (niet) ?
Graag antwoord!
Stel je hebt een beker 1 gevuld met water van 10 graden Celsius die 10 gram weegt en je hebt een beker 2 gevuld met water van -10 graden Celsius die 20 gram weegt. En je moet dan de eindtemperatuur berekenen, hoe ga je dan te werk?
Ik ging toen eerst de formule Q = c x m x ΔT hanteren bij beide bekers. Je krijgt dan Q(beker1) = 4,18 x 10^3 x 0,01 x 10 = 418 Joule. Q(beker2) = 4,18 x 10^3 x 0,02 x -10 = -836 Joule. Dan zou ik dit doen: Qtotaal = Q(beker2) - Q(beker1) = -836 - 418 = -1254 Joule. Dan Q = c x m x ΔT ombouwen tot ΔT = Q / c x m. Dan zou ik ΔT = -1254 / ((2 x 4,18 x 10^3) x 0,03) = -5 graden Celsius krijgen. Klopt dit?
Snel antwoord graag!
[ Bericht 4% gewijzigd door #ANONIEM op 25-05-2011 14:04:42 ]
[ Bericht 58% gewijzigd door #ANONIEM op 25-05-2011 14:22:31 ]
Nee, het antwoord klopt niet.quote:Op woensdag 25 mei 2011 13:46 schreef Mark94 het volgende:
Ik heb weer een vraag. Zo'n vraag als deze kwam ik een lange tijd geleden tegen op een toets:
Stel je hebt een beker 1 gevuld met water van 10 graden Celsius die 10 gram weegt en je hebt een beker 2 gevuld met water van -10 graden Celsius die 20 gram weegt. En je moet dan de eindtemperatuur berekenen, hoe ga je dan te werk?
Ik ging toen eerst de formule Q = c x m x ΔT hanteren bij beide bekers. Je krijgt dan Q(beker1) = 4,18 x 10^3 x 0,01 x 10 = 418 Joule. Q(beker2) = 4,18 x 10^3 x 0,02 x -10 = -836 Joule. Dan zou ik dit doen: Qtotaal = Q(beker2) - Q(beker1) = -836 - 418 = -1254 Joule. Dan Q = c x m x ΔT ombouwen tot ΔT = Q / c x m. Dan zou ik ΔT = -1254 / ((2 x 4,18 x 10^3) x 0,03) = -5 graden Celsius krijgen. Klopt dit?
Snel antwoord graag!
Er geldt: Q1 + Q2 = 0
Dus: c*m1*ΔT1 + c*m2*ΔT2 = 0
c*(m1*ΔT1 + m2*ΔT2) = 0
c*(m1*(T1e - T1b) + m2*(T2e - T2b)) = 0
m1*(T1e - T1b) + m2*(T2e - T2b) = 0
T1e = T2e = Te
m1*(Te - T1b) + m2*(Te - T2b) = 0
Te = (m1* T1b + m2*T2b)/(m1+m2)
Invullen geeft Te = -3,33 °C
Aha. Ziet er wel een stuk ingewikkelder uit.quote:Op woensdag 25 mei 2011 14:27 schreef lyolyrc het volgende:
[..]
Nee, het antwoord klopt niet.
Er geldt: Q1 + Q2 = 0
Dus: c*m1*ΔT1 + c*m2*ΔT2 = 0
c*(m1*ΔT1 + m2*ΔT2) = 0
c*(m1*(T1e - T1b) + m2*(T2e - T2b)) = 0
m1*(T1e - T1b) + m2*(T2e - T2b) = 0
T1e = T2e = Te
m1*(Te - T1b) + m2*(Te - T2b) = 0
Te = (m1* T1b + m2*T2b)/(m1+m2)
Invullen geeft Te = -3,33 °C
[ Bericht 1% gewijzigd door #ANONIEM op 25-05-2011 15:13:34 ]
[ Bericht 4% gewijzigd door #ANONIEM op 25-05-2011 15:15:54 ]
Wet van behoud van energie.quote:Op woensdag 25 mei 2011 15:15 schreef Mark94 het volgende:
Geldt dat Q1 + Q2 = 0 alleen omdat ze allebei dezelfde soortelijke warmte hebben en gelijke tegengestelde temperaturen? Want de gewichten zijn wel verschillend.
De temperaturen zijn overigens niet tegengesteld. Celsius heeft ooit gekozen om het nulpunt van zijn temperatuurschaal te leggen bij het vriespunt van water. Er bestaat echter ook de temperatuurschaal van Kelvin die geen negatieve waardes kent.
Oja, want 0 graden Celsius is gelijk aan 273 Kelvin. Dus -10 graden Celsius zou dan gelijk aan 263 Kelvin zijn, en is inderdaad niet tegengesteld.quote:Op woensdag 25 mei 2011 19:17 schreef lyolyrc het volgende:
Door te stellen Q1 + Q2 = 0 veronderstel je feitelijk dat er geen warmte verloren gaat. De energie van het warme water komt alleen ten goede van het koude water. Dat heet dan 'behoud van energie'.
De temperaturen zijn overigens niet tegengesteld. Celsius heeft ooit gekozen om het nulpunt van zijn temperatuurschaal te leggen bij het vriespunt van water. Er bestaat echter ook de temperatuurschaal van Kelvin die geen negatieve waardes kent.
[ Bericht 1% gewijzigd door #ANONIEM op 25-05-2011 23:05:25 ]
Inderdaad!quote:Op woensdag 25 mei 2011 22:50 schreef Mark94 het volgende:
[..]
Oja, want 0 graden Celsius is 273 Kelvin. Dus -10 graden Celsius zou dan 263 Kelvin zijn, en is inderdaad niet tegengesteld.
Een temperatuurmeting heeft een meetgebied van 0 tot 100 graden Celsius. Hoeveel bits moet een A/D omzetter minimaal hebben om een resolutie van 0.1 graden Celsius (±0.05 graden Celsius) te krijgen?
Je hebt (100 - 0)/0.1 + 1 = 1001 verschillende waardenquote:Op donderdag 26 mei 2011 13:41 schreef vault_tec het volgende:
iemand dit weet en uitleg erbij kan geven:
Een temperatuurmeting heeft een meetgebied van 0 tot 100 graden Celsius. Hoeveel bits moet een A/D omzetter minimaal hebben om een resolutie van 0.1 graden Celsius (±0.05 graden Celsius) te krijgen?
Dus heb je een 2 log (1001) = 9.967
[ Bericht 6% gewijzigd door Nelis89 op 27-05-2011 19:55:59 ]
Portfolio P bestaat uit diverse stocks + een risk free Treasury bill.
De risk free rate (Tbill rate) is 2%
Nu wil ik de expected return van Portfolio P berekenen. Voor de diverse stocks is een expected return + weight op gegeven. Maar voor de Tressuray bill is alleen de weight opgegeven.
Kun je nu voor deze treasury bill de risk free rate pakken om de expected return van de portfolio te berekenen?
Dus: weight * risk free rate + ........
Bij het berekenen van de standaarddeviatie van portfolio P hoef je pas moeilijk te doen aangezien er meestal een correlatie tussen de verschillende stocks is.
is die +1 voor de waarde tussen 0 en de eerste ''stap''?quote:Op vrijdag 27 mei 2011 19:49 schreef Nelis89 het volgende:
[..]
Je hebt (100 - 0)/0.1 + 1 = 1001 verschillende waarden
Dus heb je een 2 log (1001) = 9.967 [ afbeelding ]10 bits A/D converter nodig
Tel je alle waarden die de temperatuur in jouw situatie aan kan nemen, dan kom je op 1001 waarden.quote:Op donderdag 2 juni 2011 19:25 schreef jabbahabba het volgende:
[..]
is die +1 voor de waarde tussen 0 en de eerste ''stap''?
Simpeler voorbeeldje: stel dat de temperatuur in hele graden gemeten zou worden en zou kunnen variëren tussen 0 en 10 °C. Dan heb je 11 verschillende meetwaarden in plaats van 10, namelijk 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 en 10 °C. <- Tel ze maar na, het zijn er 11.
Na wat googlen ben ik er nog steeds niet uit. Dus als iemand mij kan helpen, graag!
Wat is precies je vraag? Hoe het komt dat je het beeld van een spiegel, terwijl dat beeld virtueel is, toch scherp kan zien? Dat ligt aan de positieve lens in je oog, die zorgt ervoor dat de lichtstralen weer convergeren.quote:Op zondag 12 juni 2011 16:06 schreef vault_tec het volgende:
Voor natuurkunde heb ik nu een paar hoofdstukken over licht en lenzen. Wat mij verwart is dat een virtueel beeld niet geprojecteerd kan worden maar een spiegel geeft een virtueel beeld.
Na wat googlen ben ik er nog steeds niet uit. Dus als iemand mij kan helpen, graag!
Als je iets anders bedoelt moet je het maar zeggen
Ik snap het verschil niet tussen een virtueel en een reeel beeld. Want je kan een virtueel beeld niet projecteren (?) maar een spiegel kan je duidelijk zien en is een virtueel beeld. Dus wanneer is dan iets virtueel en wanneer is iets reeel?quote:Op zondag 12 juni 2011 16:06 schreef vault_tec het volgende:
Voor natuurkunde heb ik nu een paar hoofdstukken over licht en lenzen. Wat mij verwart is dat een virtueel beeld niet geprojecteerd kan worden maar een spiegel geeft een virtueel beeld.
Na wat googlen ben ik er nog steeds niet uit. Dus als iemand mij kan helpen, graag!
Bij een reëel beeld komen de stralen die van het object af komen, ook allemaal in één punt samen. In het plaatje hieronder is dat heel duidelijk te zien:quote:Op maandag 13 juni 2011 11:49 schreef vault_tec het volgende:
[..]
Ik snap het verschil niet tussen een virtueel en een reeel beeld. Want je kan een virtueel beeld niet projecteren (?) maar een spiegel kan je duidelijk zien en is een virtueel beeld. Dus wanneer is dan iets virtueel en wanneer is iets reeel?
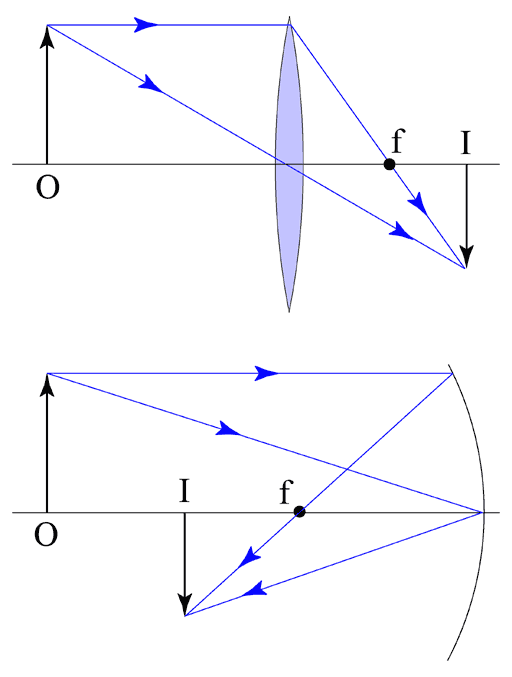
Er is duidelijk een punt aan te wijzen waar de stralen bij elkaar komen, daar is dus een echt beeld te zien. Verder is ook duidelijk te zien dat de stralen na de spiegel/lens convergeren.
Bij een virtueel beeld komen de stralen niet samen in één punt, maar lijken ze allemaal uit één punt te komen. Dat is duidelijk te zien op het volgende plaatje:
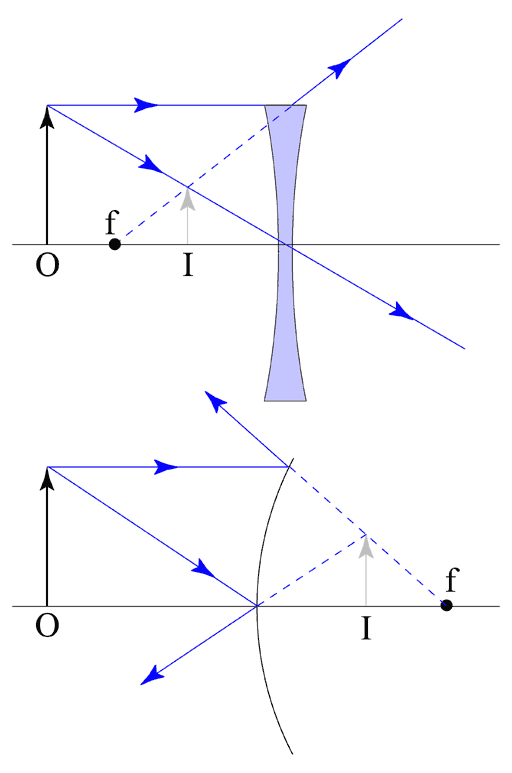
De stippellijnen zijn de lijnen die je krijgt wanneer je de gespiegelde/gebroken lichtstralen 'terugtekent'. Deze lijnen komen ook in één punt samen, maar als je in dit punt gaat kijken zie je niks. Dat is het makkelijkst te begrijpen bij de spiegel, als je aan de andere kant van de spiegel gaat kijken zie je niets, al lijkt het wel alsof het beeld wat je ziet (als je voor de spiegel staat) daar vandaan komt.
De reden dat je een virtueel beeld wel kan zien, hoewel je het niet kan projecteren, heeft te maken met de positieve lens in je oog. Een virtueel beeld kan je niet projecteren, omdat de stralen divergeren. Deze divergerende stralen kunnen echter met de lens in je oog weer convergerend gemaakt worden, waarna ze in op je oog geprojecteerd worden.
Ik hoop dat het een beetje duidelijker geworden is
Mevrouw Kraker blijkt een laag kaliumgehalte te hebben. Dit zal per infuus worden aangevuld. Aanwezig is een 8% KCl oplossing in infuuszakken met NaCl 0,7% (750 ml). De arts schrijft 900 mg KCl per infuuszak voor.
Hoeveel ml KCl oplossing moet aan de infuuszak worden toegevoegd?
Rond (zo nodig) af op 1 decimaal.
Als je hem weet, ben je echt een held!
Ik ga het proberen uit te leggen, maar het is al een jaartje geleden dat ik iets aan scheikunde heb gedaan. Er zijn al infuuszakken van 750 mL aanwezig met 8% KCl. Hoeveel mL KCl bevat een infuuszak? (Ik ga er even vanuit dat het hier om volumeprocenten gaat, en dat KCl niet reageren, wat ik niet zeker weet)quote:Op dinsdag 14 juni 2011 01:05 schreef glaba het volgende:
Hoi, ik heb hier een vraag waar ik niet uitkom.
Mevrouw Kraker blijkt een laag kaliumgehalte te hebben. Dit zal per infuus worden aangevuld. Aanwezig is een 8% KCl oplossing in infuuszakken met NaCl 0,7% (750 ml). De arts schrijft 900 mg KCl per infuuszak voor.
Hoeveel ml KCl oplossing moet aan de infuuszak worden toegevoegd?
Rond (zo nodig) af op 1 decimaal.
Als je hem weet, ben je echt een held!
Dit volume kan je met behulp van de dichtheid omrekenen naar het aantal milligram (de dichtheid van kaliumchloride is 1,987 g/cm³, dus het aantal milligram kan je berekenen door het aantal milliliter keer dit getal te doen, want één milliliter = één cm3)
Omdat je dit getal moet aanvullen tot 900 mg, moet je 900 min dit getal doen, en dat is je antwoord.
(Ik was nooit goed in scheikunde, maar ik hoop dat ik dit goed heb gedaan... Ik ben er nog steeds niet uit of KCl en NaCl zouden moeten reageren, als ze dat wel doen heb je niks aan deze post
Ik kom dan uit op 780,8 helaas zegt hij dat het niet klopt. Klopt het wel dat één mililiter = één cm3 is?
Dit is overigens de site waar ik de opgave vandaan heb gehaald en je het antwoord kan invullen.
http://wiskunde.stmichael(...)_medisch_rekenen.htm
8% KCl-oplossing betekent dat er 8 g KCl opgelost is per 100 ml oplossing. Percentages van zulk soort oplossingen luiden, tenzij anders vermeld, altijd in massa per volume-eenheid. De vraag die je dus moet oplossen is: hoeveel milliliter oplossing heb je nodig als je weet dat er 8 g KCl in 100 ml oplossing zit?
Antwoord: 0,9/8 * 100 = 11,3 ml.
ik, nee.quote:Op dinsdag 14 juni 2011 17:47 schreef Ouail222 het volgende:
Wie is goed in Engels en wil mijn vijf opdrachten voor mij nakijken?
tevens: [ bèta overig] huiswerk- en vragentopic.
Excuses in dat geval, in mijn herinnering ging het altijd om massapercentages of volumepercentages. Heb ik ook weer wat geleerdquote:Op dinsdag 14 juni 2011 10:14 schreef lyolyrc het volgende:
Het antwoord klopt niet, omdat de uitleg niet klopt.
8% KCl-oplossing betekent dat er 8 g KCl opgelost is per 100 ml oplossing. Percentages van zulk soort oplossingen luiden, tenzij anders vermeld, altijd in massa per volume-eenheid. De vraag die je dus moet oplossen is: hoeveel milliliter oplossing heb je nodig als je weet dat er 8 g KCl in 100 ml oplossing zit?
Antwoord: 0,9/8 * 100 = 11,3 ml.
Ik zie nu ook dat ik de vraag verkeerd gelezen heb, ik bakte er eigenlijk niks van
nog even naar kijken dan...
[ Bericht 5% gewijzigd door minibeer op 14-06-2011 20:26:47 ]
Er zijn nogal wat verschillende manieren om een concentratie uit te drukken. Het is dus ook een kwestie van bekend zijn met de gebruikelijke manier voor dit soort vraagstukken.quote:Op dinsdag 14 juni 2011 20:12 schreef minibeer het volgende:
[..]
Excuses in dat geval, in mijn herinnering ging het altijd om massapercentages of volumepercentages. Heb ik ook weer wat geleerd
Ik zie nu ook dat ik de vraag verkeerd gelezen heb, ik bakte er eigenlijk niks van
nog even naar kijken dan...
In jouw antwoord ging je werken met dichtheid, maar dat had hier geen zin. KCl valt bij oplossen in water namelijk uiteen in de ionen K+ en Cl-. Die ionen hoeven opgelost in water niet per se hetzelfde volume in te nemen als dat ze doen als vaste stof.
Het was jammer dat je antwoord niet klopte, maar het was natuurlijk wel goed dat je probeerde te helpen!
Niveau: Atheneum 3.
Opdracht 1)
Pieter makt een foto van de toren van Pisa (55 meter hoog).
De lenssterkte van zijn fotolens is +21dpt.
Als Pieter de foto maakt staat hij 63 meter van de toren af.
Bereken hoe groot de afbeelding van de toren is.
Mijn antwoord:
LL' = 55 Meter
V = 63 Meter
S = 21 dpt
f = 0,0476 Meter
b = 0,0476 Meter
N = 4,56*10^-4
BB' = 4,16 CM
Berekening:
LL' : Gegeven
v : Gegeven
s : Gegeven
f : s=1/f 21=1/f 1*1/21 = 0,0476 Meter
b :1/f =1/b+1/v, 1/f-1/v=1/b, 1/0,0467-1/63=b= 0,0476 Meter
N : b/v = 0,0476/63= 7,56*10^-4
BB' : N= BB'/LL' 7,56*10^-4 = BB'/55 meter BB' = 4,16 CM.
Zeg asjeblieft dat dit juist is.
1/f = 1/b + 1/v
1/f - 1/v = 1/b
1/0,0476 - 1/63 = 1/b
21 - 0,016 = 1/b
21 = 1/b
b = 0,0476
Wat doe ik fout dan:( ?
pA+qB
 rC+sD
rC+sD
Kan iemand uitleggen waarom die formule er zo uitziet en bijvoorbeeld niet zo:
pA+qB
 rC+sD
rC+sDK= (r[C]+s[D])/(p[A]+q[B])
sorry als dit een domme vraag is.
Ps. Weet niet zeker of het in dit topic thuishoort?
Twee monochromatische lichtstralen gaan via een slit en komen elkaar weer tegen op een scherm. De lichtstralen komen elkaar tegen bij n=8. Het weglengte verschil is 4,57 x 10^-6m. Wat is λ?
d sin θ = n x λ
Hoe kom ik nu aan λ?
d is volgens mij die 4,57x10^-6 m. Maar hoe bereken in nu die hoek?
Vraag
Bereken de molariteit van een geconcentreerde azijnzuuroplossing.
Gegeven: dichtheid geconc. azijnzuur = 1.044 g/cm3 concentratie ch3cooh 100 m/m %
571 nmquote:Op woensdag 31 augustus 2011 15:41 schreef bloodysunday het volgende:
Ik heb een vraag over een opgave over een Double-Slit experiment.
Twee monochromatische lichtstralen gaan via een slit en komen elkaar weer tegen op een scherm. De lichtstralen komen elkaar tegen bij n=8. Het weglengte verschil is 4,57 x 10^-6m. Wat is λ?
d sin θ = n x λ
Hoe kom ik nu aan λ?
d is volgens mij die 4,57x10^-6 m. Maar hoe bereken in nu die hoek?
Als de afstand tussen de twee spleten (d) veel kleiner is dan de afstand tot het scherm (L), m.a.w. d << L, dan kun je zeggen dat het weglengteverschil r1 - r2 = d sinθ.
De hoek tussen x (afstand tussen n=0 en in dit geval n=8) en L is dan weer θ
Het weglengteverschil is gegeven, dus r1 - r2 = d sinθ = 4,57E-6 m en daaruit volgt dat λ = 4,57E-6 / 8 = 571,25 nm.
Ligt het nou aan mij of klopt de eenheid hier niet of is het wel erg kort door de bocht geschreven? Meer dan meter/meter mol/mol kan ik er niet van makenquote:Op donderdag 1 september 2011 15:58 schreef jouwkeuze het volgende:
Wie kan deze vraag oplossen, en uitleggen hoe je dit doet want ik weet niet waar ik beginnen moet.
Vraag
Bereken de molariteit van een geconcentreerde azijnzuuroplossing.
Gegeven: dichtheid geconc. azijnzuur = 1.044 g/cm3 concentratie ch3cooh 100 m/m %
Kan zijn dat 'ie mol per milliliter bedoelde - percentageteken is dan nog wel een beetje vreemd.quote:Op donderdag 1 september 2011 16:35 schreef zoem het volgende:
[..]
Ligt het nou aan mij of klopt de eenheid hier niet of is het wel erg kort door de bocht geschreven? Meer dan meter/meter mol/mol kan ik er niet van maken
De massafractie wordt vaak als percentage weergegeven, en dan massa-percentage genoemd. De grootheid wordt aangeduid met %(m/m).
Je weet hoeveel gram er in 1 cm³ zit, dus kan je bepalen hoeveel er in 1 dm³/1 liter zit.
Dan met de molmassa en het aantal gram azijnzuur het aantal mol azijnzuur uitrekenen hoeveel er dus in 1 liter zit en dat is de molariteit.
Je kunt altijd het beste beginnen met het opschrijven wat je al weet. Je hebt de gegevens uit de vraag (1) en je hebt een stuk theorie gekregen (2) met formules. Wat heb je en waar moet je naartoe? Zoek de juiste formule(s) op en begin gewoon met opschrijven en rekenen. Een puzzle maak je tenslotte ook niet door alle stukjes afzonderlijk te bekijken. Je zult ze onderling moeten vergelijken en proberenquote:Op donderdag 1 september 2011 15:58 schreef jouwkeuze het volgende:
Wie kan deze vraag oplossen, en uitleggen hoe je dit doet want ik weet niet waar ik beginnen moet.
Vraag
Bereken de molariteit van een geconcentreerde azijnzuuroplossing.
Gegeven: dichtheid geconc. azijnzuur = 1.044 g/cm3 concentratie ch3cooh 100 m/m %
Bij een vraag als dit wéét je gewoon dat je de molmassa nodig hebt. De dichtheid zul je om moeten rekenen, want dat is nodig om de molariteit te berekenen (je moet dus wel je definities en bijbehorende eenheden kennen!).
Voor mij is dit weer al ruim 6 jaar geleden, dus fouten voorbehouden
De molmassa van azijnzuur:
Dichtheid omrekenen:
We weten dat:
Dus:
[ Bericht 12% gewijzigd door zoem op 02-09-2011 00:16:41 ]
ah thx, ik zat met de verkeerde weglengte. Zo is het duidelijk!quote:Op donderdag 1 september 2011 16:23 schreef zoem het volgende:
[..]
571 nm
Als de afstand tussen de twee spleten (d) veel kleiner is dan de afstand tot het scherm (L), m.a.w. d << L, dan kun je zeggen dat het weglengteverschil r1 - r2 = d sinθ.
[ afbeelding ]
De hoek tussen x (afstand tussen n=0 en in dit geval n=8) en L is dan weer θ
Het weglengteverschil is gegeven, dus r1 - r2 = d sinθ = 4,57E-6 m en daaruit volgt dat λ = 4,57E-6 / 8 = 571,25 nm.
Ik ben bezig met een marktonderzoek en ik heb een deelvraag 'Wie zijn de jongeren van 18 tot 24 jaar?'
En dit zijn mijn sub vragen
• Wat zijn de maandelijkse inkomsten en uitgaven?
• Hoeveel tijd besteden ze aan sport en welke sport?
Volgens mijn docent moeten mijn sub vragen uitgebreider zijn, maar mijn vraag is: hoe moeten ze uitgebreider zijn geformuleerd? Kan iemand me dat vertellen door mijn sub vragen uitgebreider te formuleren? Alvast bedankt voor uw antwoord!!
Mvg,
superky
Bedoelt je docent niet dat je méér subvragen moet formuleren? Het lijkt me namelijk vrij relevant om bijvoorbeeld geslacht, leeftijd en opleiding van de ondervraagde groep te kennen.quote:Op zaterdag 17 september 2011 21:28 schreef superky het volgende:
Hoi,
Ik ben bezig met een marktonderzoek en ik heb een deelvraag 'Wie zijn de jongeren van 18 tot 24 jaar?'
En dit zijn mijn sub vragen
• Wat zijn de maandelijkse inkomsten en uitgaven?
• Hoeveel tijd besteden ze aan sport en welke sport?
Volgens mijn docent moeten mijn sub vragen uitgebreider zijn, maar mijn vraag is: hoe moeten ze uitgebreider zijn geformuleerd? Kan iemand me dat vertellen door mijn sub vragen uitgebreider te formuleren? Alvast bedankt voor uw antwoord!!
Mvg,
superky
Nee dat bedoelt ze niet. En die subvragen die je had genoemd gaat iemand anders doen in mijn groepje. Het gaat echt om mijn sub vragen hier, wat ik totaal niet snap. Ik bedoel je hoe ik mijn sub vragen kan uitbreiden :S??quote:Op zaterdag 17 september 2011 23:29 schreef lyolyrc het volgende:
[..]
Bedoelt je docent niet dat je méér subvragen moet formuleren? Het lijkt me namelijk vrij relevant om bijvoorbeeld geslacht, leeftijd en opleiding van de ondervraagde groep te kennen.
Denk dat je docent dit bedoelt:quote:Op zaterdag 17 september 2011 21:28 schreef superky het volgende:
Hoi,
Ik ben bezig met een marktonderzoek en ik heb een deelvraag 'Wie zijn de jongeren van 18 tot 24 jaar?'
En dit zijn mijn sub vragen
• Wat zijn de maandelijkse inkomsten en uitgaven?
• Hoeveel tijd besteden ze aan sport en welke sport?
Volgens mijn docent moeten mijn sub vragen uitgebreider zijn, maar mijn vraag is: hoe moeten ze uitgebreider zijn geformuleerd? Kan iemand me dat vertellen door mijn sub vragen uitgebreider te formuleren? Alvast bedankt voor uw antwoord!!
Mvg,
superky
- Waaruit halen de jongeren hun maandelijkse inkomsten en hoe groot zijn deze?
- Waaraan besteden de jongeren hun maandelijkse inkomsten en hoe groot zijn deze?
- Hoeveel tijd besteden jongeren per week/maand aan sport (en andere vrije tijdsbesteding)?
Het gaat hier bijvoorbeeld niet over een naam zoals Avans Hogeschool, maar gewoon over een willekeurige hogeschool/uni
Thanksquote:Op maandag 19 september 2011 20:35 schreef zoem het volgende:
Als los woord hoef je geen hoofdletter te gebruiken. Dat is alleen als je het over de naam van de school hebt zoals Avans Hogeschool, Technische Universiteit Delft, etc
Er staat "maak een oplossing van 50ml van 50mg/ml citroenzuur (houdt rekening met de aanwezigheid van een watermolecuul in het kristal)."
Als ik een oplossing van 50ml moet hebben, en ik moet een concentratie aanhouden van 50mg per milliliter, dan kan ik toch niet anders dan 50*50 doen? Dan snap ik de relevantie van dat watermolecuul niet. Maar ik zal vast ergens een denkfout maken. Of is het een foutje in de tekst, en vragen ze gewoon 50mg/ml citroenzuuroplossing, zonder een totale hoeveelheid aan te geven?
Nee ik heb geen chemie gehad op de middelbare idd
Edit: ok ik ben nu zo ver dat de berekening idd gewoon zo simpel is, maar ik snap nog steeds niet wat ik aan dat verhaal over het watermolecuul heb. Iemand zei me zojuist via facebook dat dat iets uitmaakt voor als je molwaarden gaat berekenen ofzo, maar waarom dan?
[ Bericht 15% gewijzigd door lateralize op 20-09-2011 15:05:59 ]
Bedank voor jouw antwoord! Maar ik heb nog een vraagje over: 'Waaraan besteden de jongeren van 18 tot 24 jaar hun maandelijkse inkomsten en hoe groot zijn deze?''quote:Op zondag 18 september 2011 22:05 schreef Nelis89 het volgende:
[..]
Denk dat je docent dit bedoelt:
- Waaruit halen de jongeren hun maandelijkse inkomsten en hoe groot zijn deze?
- Waaraan besteden de jongeren hun maandelijkse inkomsten en hoe groot zijn deze?
- Hoeveel tijd besteden jongeren per week/maand aan sport (en andere vrije tijdsbesteding)?
Ik had al gezocht naar het antwoord op het internet, maar ik kon er nog niks over vinden. Ik had al op google, cbs en op lexis nexus newsportal gekeken. Maar nog steeds niks
Alvast bedankt voor uw antwoord!
Alvast bedankt voor uw antwoord!
Groet,
superky
[beta] huiswerk- en vragentopicquote:Op donderdag 22 september 2011 16:19 schreef superky het volgende:
Iemand nog?? De rest van mijn sub vragen had ik al bronnen gevonden. Behalve van deze sub vraag 1.3 Waaraan besteden de jongeren van 18 tot 24 jaar hun maandelijkse inkomsten en hoe groot zijn deze?
Alvast bedankt voor uw antwoord!
Groet,
superky
Vraag:
0.33x^2 - 0.125 = 0.25
mijn antwoord was (Wortel)1.25
maar hun hebben 0.5(wortel)5
(sorry dat ik het zo typ maar ik kon die tekens niet vinden)
Je kan je antwoord op de volgende manier omschrijven:quote:Op vrijdag 23 september 2011 19:33 schreef jouwkeuze het volgende:
Ik moet vergelijkingen oplossen, ik weet het heel makkelijk alleen weet ik niet hoe hun het andtwoordt op die manier geschreven krijgen
Vraag:
0.33x^2 - 0.125 = 0.25
mijn antwoord was (Wortel)1.25
maar hun hebben 0.5(wortel)5
(sorry dat ik het zo typ maar ik kon die tekens niet vinden)
Het antwoord is echter niet goed, er komt uit
[ Bericht 100% gewijzigd door Anoonumos op 26-09-2011 18:11:41 (opgelost) ]
[ Bericht 47% gewijzigd door KingRoland op 25-09-2011 19:07:38 ]
Ik heb een vraagje
Wat bedoelen ze eigenlijk met: in viervoud inleveren?
Bedoelen ze misschien in 4 kopietjes inleveren? Alvast bedankt voor je antwoord
groet,
Je mag niet meer radenquote:Op maandag 26 september 2011 18:01 schreef superky het volgende:
Hoi,
Ik heb een vraagje
Wat bedoelen ze eigenlijk met: in viervoud inleveren?
Bedoelen ze misschien in 4 kopietjes inleveren? Alvast bedankt voor je antwoord
groet,
Viervoud betekent niets anders dan 4 (identieke) exemplaren van een document.
eend.
Nu is de vraag:
Leid zelf een berekenigsformule af voor het berekenen van het mierenzuurgehalte% (m/m) in Wc-eend. Bereken hoeveel gram wc-eend moet worden afgewogen voor een natronloogverbruik van ca. 30 ml. (concentratie NaOH = ca. 0,1 mol/l).
reactievergelijking: HCOOH + OH ------> Hcoo + H2O
Ik snap de hele vraag niet, en heb geen idee wat ik moet doen. Wie kan me op weg helpen?
Alvast bedankt
De bedoeling van een titratie is dat je de concentratie van een stof gaat bepalen met een oplossing van een andere stof waarvan je de concentratie precies kent.(Het klopt daarom ook niet dat de concentratie van natronloog zo onnauwkeurig wordt gegeven!) Doordat je die concentratie van die andere stof precies kent en je ook nauwkeurig bepaalt hoeveel je ervan toevoegt, kun je berekenen hoeveel er van de ene stof aanwezig was.quote:Op maandag 26 september 2011 21:43 schreef daantje1044 het volgende:
Ik heb een vraag over een titratie die ik moet doen. Ik moet het mierenzuurgehalte bepalen in wc-
eend.
Nu is de vraag:
Leid zelf een berekenigsformule af voor het berekenen van het mierenzuurgehalte% (m/m) in Wc-eend. Bereken hoeveel gram wc-eend moet worden afgewogen voor een natronloogverbruik van ca. 30 ml. (concentratie NaOH = ca. 0,1 mol/l).
reactievergelijking: HCOOH + OH ------> Hcoo + H2O
Ik snap de hele vraag niet, en heb geen idee wat ik moet doen. Wie kan me op weg helpen?
Alvast bedankt
In dit geval ga je dus mierezuur met natronloog titreren. Dat geeft de reactievergelijking:
HCOOH + OH- ------> HCOO- + H2O
Je had zelf niet de ladingen van het hydroxy- en methanoaat-ion opgeschreven. Let daarop, want die moeten er wel staan!
De formule voor het gehalte mierezuur in WC-eend kun je afleiden:
• Tijdens de titratie meet je het aantal ml natronloog dat je toevoegt: Vnatronloog
• Als je dit vermenigvuldigt met de concentratie van natronloog [OH-], krijg je het aantal mol OH- dat je hebt toegevoegd.
• Natronloog reageert 1:1 met mierezuur, dus er reageert evenveel mol mierezuur weg als je mol OH- toevoegt.
• Vermenigvuldigen van het aantal mol mierezuur met de molmassa van mierezuur MWHCOOH geeft de massa van het mierezuur in gram.
• Delen van de massa van mierezuur door de massa van WC-eend mWC-eend (in gram!) dat je titreert geeft de massaverhouding van mierezuur en WC-eend.
• Vermenigvuldigen met 100% geeft deze verhouding weer als percentage.
Probeer hier eens een formule van te maken (antwoord in de spoiler).
SPOILERVnatronloog*[OH-]*MWHCOOH/mWC-eend * 100%
Ik weet wel hoe het gaat, maar ik vergeet er steeds een paar, of de richting van de krachten staan verkeerd.
Heb je een voorbeeld voor mij, liefst eentje die je zelf niet zo goed begrijpt? Dan wil ik het best voor je uitleggenquote:Op vrijdag 7 oktober 2011 13:36 schreef snellehenk het volgende:
Kan iemand me uitleggen, hoe je een goede VLS maakt?
Ik weet wel hoe het gaat, maar ik vergeet er steeds een paar, of de richting van de krachten staan verkeerd.
Ik heb een vraagje, ik wil graag weten: Hoeveel uur per week uitwonend studerende mannen in Amsterdam van 18 t/m 21 jaar (die het hoger onderwijs volgen) besteden aan internet en het lezen van een tijdschrift.
Verder had ik al gezocht op os amsterdam, maar ik kon nog niks vinden. Kan iemand me misschien helpen
Groet,
superky
quote:Op vrijdag 7 oktober 2011 13:40 schreef zoem het volgende:
[..]
Heb je een voorbeeld voor mij, liefst eentje die je zelf niet zo goed begrijpt? Dan wil ik het best voor je uitleggen

sorry voor mijn late reactie, maar ik had wat problemen met mijn computer,
zou je er alsnog voor mij naar willen kijken?
Ja hoorquote:Op maandag 10 oktober 2011 14:16 schreef snellehenk het volgende:
[..]
[ afbeelding ]
sorry voor mijn late reactie, maar ik had wat problemen met mijn computer,
zou je er alsnog voor mij naar willen kijken?
Ik heb het uitgewerkt op papier en ingescand:
subscript h staat voor horizontale component en v voor verticale component

Uitleg
Als je naar de opdracht kijkt dan moeten al een paar dingen je opvallen:
- punt A is een scharnierpunt en kent dus geen moment
- punt C is eigenlijk ook een soort scharnierpunt en ook hier geen moment
- tussen B en C is een touw gespannen en kent dus alleen een trekkracht
De methode die ik nu gebruik werkt aan de hand van de krachtenevenwichten in elk punt (node). Je trekt de constructie uit elkaar, zodat je elk punt of lijnsegment afzonderlijk kunt gaan analyseren.
Het is het gemakkelijkst om te beginnen met punt C. Hier weet je dat er een touw aan trekt met kracht FBC. Omdat het touw alleen trekkracht kent, weet je dat in het touwsegment de richting van de kracht "naar buiten toe" is. Dus de kracht die op punt C werkt is dan precies het tegenovergestelde zoals je in de tekening ziet (er wordt als het ware getrokken aan punt C). Punt C zit vast aan de muur die weerstand biedt in horizontale en verticale richting. Aangezien FBC naar rechts en naar beneden werkt, zullen de krachten in de muur naar links en naar boven moeten zijn om een evenwicht te creëren in horizontale en verticale richting (FBC kun je namelijk ook weer opdelen in een hor+vert component).
Vervolgens ga je naar punt B. Ook daar trekt het touw aan en net zoals bij punt C krijg je een kracht FBC die een tegenovergestelde richting heeft van het touw. Daarnaast werkt er een (gegeven) kracht F2 op punt B. Punt B zit ook nog eens vast aan staaf ABD en zal er een kracht bestaan tussen B en D: FBD. Kracht FBC wijst naar links+boven en kracht F2 naar beneden. Een staaf kent alleen trek- of compressiekrachten in de lengterichting, dus om een evenwicht te krijgen zal FBD wel naar rechtsboven moeten wijzen. De andere optie was linksonder, maar dan heb je geen evenwicht!
Punt D kent de tegenovergestelde kracht die vanuit B op D werkt. FBD wijst de tegenovergestelde kant op in D. Er is een gegeven verticale kracht F1 in D en er werkt een kracht tussen A en D: FAD. Wederom horizontale+verticale krachtenevenwichten in het punt: FBD en F1 wijzen naar beneden, dus dan blijft voor FAD alleen de richting rechtsboven over.
Punt A kent de tegenovergestelde kracht die vanuit D op A werkt (zelfde verhaal als in punt D). Punt A zit vast aan de muur en zal een kracht naar boven en een kracht naar rechts moeten hebben om een evenwicht te creëren met FAD.
Uiteindelijk zie je dat in het bovenste plaatje de krachten zowel horizontaal als verticaal in evenwicht zijn. De kracht in FBD kun je het makkelijkst uitrekenen door een moment om punt A te doen en het touw te vervangen door de kracht FBD. Opdelen van deze kracht in een horizontale+verticale component maakt het uitrekenen makkelijker.
Uitleg werd langer dan gedacht. Het kan maar duidelijk zijn
Een neutron beweegt met snelheid v = 0.3c van een melkwegstelsel af. Als het neutron zich op 1 lichtjaar afstand van het centrum bevindt, zendt hij een elektron met snelheid u = 0.5c t.o.v. het neutron de andere kant op (naar het centrum).
Hoe lang duurt het voordat het elektron het centrum bereikt, gemeten door een waarnemer in het melkwegstesell?
Ik heb de relatieve snelheid van het elektron t.o.v. het melkwegstelsel berekend: w = -0.24 c.
Mag ik nu zeggen, omdat het melkwegstelsel in rust is, t melkweg = lichtjaar/ 0,24c = 4.17 jaar, of moet ik met lorentztransformaties werken?
Niet echt bèta eigenlijk. Maar wat zoek je precies? Dit is nogal algemeen...quote:Op maandag 10 oktober 2011 20:32 schreef bjanaan het volgende:
Kan hier iemand wat vinden over oud premier Dries van Agt ik heb alleen iets op Wiki gevonden. Maar dat is ook niet veel..
Biografie.quote:Op maandag 10 oktober 2011 20:36 schreef zoem het volgende:
[..]
Niet echt bèta eigenlijk. Maar wat zoek je precies? Dit is nogal algemeen...
sorry voor de opmaak: link in de op werkt niet
De vraag is: leid zelf een berekeningsformule af voor het berekenen van de massa die er aan calciumcarbonaat moet worden ingewogen voor een natronloogverbruik van 25 ml ( concentratie NaOH = 0,1 mol/l)
nu heb ik dus als berekenings formule: Vnatronloog * [OH-] * MWCaCO3.
Is deze formule juist?
Het is sowieso van belang om eerst uit te schrijven welke reactie er gaat plaatsvinden. Het is mij niet duidelijk wat calciumcarbonaat met natronloog moet gaan doen. Volgens mij reageren die twee namelijk niet met elkaar. Weet je zeker dat je stofnamen correct hebt overgenomen?quote:Op donderdag 13 oktober 2011 13:29 schreef daantje1044 het volgende:
ff een vraag ter controle of ik het nu goed doe met die berekeningsformule.
sorry voor de opmaak: link in de op werkt niet
De vraag is: leid zelf een berekeningsformule af voor het berekenen van de massa die er aan calciumcarbonaat moet worden ingewogen voor een natronloogverbruik van 25 ml ( concentratie NaOH = 0,1 mol/l)
nu heb ik dus als berekenings formule: Vnatronloog * [OH-] * MWCaCO3.
Is deze formule juist?
Je formule is correct voor een reactie met molverhouding 1:1, maar geeft de massa van CaCO3 in mg. Wil je dit in grammen hebben, dan moet je nog delen door 1000.
CaCo3 + 2H+ -------> Ca + H2CO3
H2CO3 ---------> H2O + CO2
daarna wordt het CO2 uitgekookt. Omdat er meer zuur wordt toegevoegd dan nodig is, kan het restant H+ teruggetriteerd worden met een natriumhydroxide- oplossing.
Dat verklaart een hoop! Dit betekent dat ook bekend moet zijn hoeveel zuur je toevoegt, anders kun je niet bepalen hoeveel CaCO3 je moet toevoegen.quote:Op donderdag 13 oktober 2011 14:26 schreef daantje1044 het volgende:
het gaat om een terugtritatie met natronloog sorry. CaCo3 wordt eerst opgelost in een overmaat zuur :
CaCo3 + 2H+ -------> Ca + H2CO3
H2CO3 ---------> H2O + CO2
daarna wordt het CO2 uitgekookt. Omdat er meer zuur wordt toegevoegd dan nodig is, kan het restant H+ teruggetriteerd worden met een natriumhydroxide- oplossing.
Uit de eerste formule (CaCO3 + 2H+ -------> Ca2+ + H2CO3) blijkt dat het calciumcarbonaat en zuur in een verhouding 1:2 reageren. Natronloog en zuur reageren in een verhouding 1:1.
Je moet dan de volgende stappen zetten om de formule te krijgen:
• bepaal hoeveel mol zuur wordt toegevoegd aan de hand van het toegevoegde volume zuur en de concentratie van het zuur
• daar trek je het aantal mol zuur vanaf dat wegreageert met natronloog; berekenen aan de hand van het toegevoegde volume natronloog en de concentratie ervan
• dat geeft het aantal mol zuur dat reageert met calciumcarbonaat
• vermenigvuldigen met 0,5 (of delen door 2) geeft het aantal mol CaCO3 dat heeft gereageerd
• vermenigvuldigd met de molmassa geeft de massa van het weggereageerde CaCO3
SPOILER: antwoord in deze spoiler(Vzuur*[H+] - Vnatronloog*[OH-])*0,5*MWCaCO3
Nog 1 vraag uit nieuwsgierigheid. Waarom kook je de CO2 uit? Gaat de titratie anders niet werken?
CO2 kan reageren met OH-, dat geeft HCO3-. Zonder uitkoken zou de titratie daarom niet meer kloppen.quote:Op donderdag 13 oktober 2011 17:32 schreef daantje1044 het volgende:
ok dank je wel! weer wat wijzer geworden!
Nog 1 vraag uit nieuwsgierigheid. Waarom kook je de CO2 uit? Gaat de titratie anders niet werken?
Moet een practicum voorbereiden voor het opnemen van titratiecurven, berekenen van de equivalentiepunten en het bepalen van de omslaggebieden van een aantal zuur-base indicatoren.
Het practicum voer ik uit met natriumhydroxide oplossing en de volgende stoffen: zoutzuur, azijnzuur en fosforzuur.
Nu moet ik berekenen hoeveel ml NaOH (aq) er theoretisch nodig is om de eindpunten te bereiken. Ik heb dus geen idee hoe ik dat moet berekenen.
De gegevens die ik heb. ( ik ga uit van de reactie met zoutzuur):
Ik moet 25 ml zoutzuuroplossing gebruiken. concentratie NaOH is 0,1 mol/l.
En de pH meter wordt gekalibreerd met buffer pH= 7,00 en pH = 4,00.
reactievergelijking:
NaOH + HCL -----> NaCl + H2O
Kan iemand me uitleggen hoe ik het aantal ml NaOH moet berekenen? Zit er al uren naar te staren, maar kom er echt niet uit.
Weet je niet (ongeveer) de concentratie van de zoutzuuroplossing? Je moet namelijk weten hoeveel mol zoutzuur er is, waaruit je kunt beredeneren hoeveel mol NaOH er nodig is om HCl totaal te neutraliseren.quote:Op maandag 17 oktober 2011 15:33 schreef daantje1044 het volgende:
Sorry, alweer een vraag, begrijp het gewoon echt niet:
Moet een practicum voorbereiden voor het opnemen van titratiecurven, berekenen van de equivalentiepunten en het bepalen van de omslaggebieden van een aantal zuur-base indicatoren.
Het practicum voer ik uit met natriumhydroxide oplossing en de volgende stoffen: zoutzuur, azijnzuur en fosforzuur.
Nu moet ik berekenen hoeveel ml NaOH (aq) er theoretisch nodig is om de eindpunten te bereiken. Ik heb dus geen idee hoe ik dat moet berekenen.
De gegevens die ik heb. ( ik ga uit van de reactie met zoutzuur):
Ik moet 25 ml zoutzuuroplossing gebruiken. concentratie NaOH is 0,1 mol/l.
En de pH meter wordt gekalibreerd met buffer pH= 7,00 en pH = 4,00.
reactievergelijking:
NaOH + HCL -----> NaCl + H2O
Kan iemand me uitleggen hoe ik het aantal ml NaOH moet berekenen? Zit er al uren naar te staren, maar kom er echt niet uit.
Als je dan 25 ml van die oplossing pakt, hoeveel mol HCl heb je dan?quote:Op maandag 17 oktober 2011 23:51 schreef daantje1044 het volgende:
concentratie zoutzuur is 0,1 mol/l
En als je weet dat HCl volledig dissocieert in water, dat wil zeggen het splitst zich in H+ en Cl-, hoeveel mol H+ heb je dan in oplossing?SPOILER: antwoord25*0,1 = 2,5 mmol = 0,0025 mol HCl
Hoeveel mol OH- heb je dan nodig om het zuur te neutraliseren?SPOILER: antwoordAlle HCl splitst zich dus ook 2,5 mmol H+
En hoeveel ml 0,1 M natronloog heb je dan nodig?SPOILER: antwoordH+ en OH- reageren 1:1, dus 2,5 mmol OH- nodig
SPOILER: antwoord2,5 mmol zit in 2,5/0,1 = 25 ml natronloog.
Ik heb een vraag over een portfolio. Nou is het zo dat ik er nog nooit één gemaakt had. Maar mijn moeder maakt wel een portfolio tijdens haar inburgingscursus voor school.
Bij haar portfolio zie ik een blz. met persoonlijke gegevens. Dus naam, adres, woonplaats, hobby's en etc. In mijn ogen lijkt die blz. op een C.V.
Nu maak ik een portfolio van een vak voor school. De opdrachten die ik heb gemaakt zitten in mijn portfolio, maar er wordt niet gevraagd dat ik zo'n blz. maak met persoonlijke gegevens als een soort van C.V.
Mijn vraag is: Moet ik die persoonlijke gegevens na de inhoudsopgave er niet in zetten, omdat het niet wordt gevraagd.
Of moet ik mijn persoonlijke gegevens er wel in zetten zelfs als dat niet wordt gevraagd, omdat het standaard in een portfolio hoort. Alvast bedankt voor uw antwoord!
Groet,
superky
Aspirin (acetylsalicylic acid, C9H8O4 ) is a weak monoprotic acid. To determine its acid-dissociation constant, a student dissolved 2.00 of aspirin in 0.600 L of water and measured thePH . What was the Ka value calculated by the student if the PH of the solution was 2.61?
bij voorbaat dank.
De kapitaalrekening had een overschot van 18.4 miljard.
'Zal in de toekomst het saldo van de inkomensrekening van dit land daardoor positief of negatief worden beinvloed? Verklaar het antwoord.'
Het antwoord is: Negatief. De toevloed van kapitaal via de kapitaalrekening leidt in de toekomst tot rentebetalingen en dividendafdrachten aan het buitenland.
Maar dit klopt toch niet? Een verbetering van het saldo van de kapitaalrekening betekent toch juist dat deze overheid haar overschot op de kapitaalrekening van 18.4 miljard juist nog hoger wil maken? Waardoor er nog meer geld naar het buitenland gaat, waar WIJ juist winst en rente over ontvangen?
Je moet altijd eerst beginnen met het opstellen van de reactievergelijking:quote:Op zaterdag 22 oktober 2011 18:16 schreef jouwkeuze het volgende:
wie kan deze vraag oplossen, en uitleggen?
Aspirin (acetylsalicylic acid, C9H8O4 ) is a weak monoprotic acid. To determine its acid-dissociation constant, a student dissolved 2.00 of aspirin in 0.600 L of water and measured thePH . What was the Ka value calculated by the student if the PH of the solution was 2.61?
bij voorbaat dank.
HA + H2O <=> H3O+ + A-
Hierin is aspirine weergegeven als HA en zijn geconjugeerde base als A-.
Vervolgens stel je de bijbehorende evenwichtsvoorwaarde op:
Ka = [H3O+][A-]/[HA]
Om Ka te kunnen berekenen, moet je alle concentraties die genoemd worden in de evenwichtsvoorwaarde kennen.
De pH is bepaald op 2,61, waaruit we kunnen afleiden dat [H3O+] = 10pH = 10-2,61 = 0,00245 mol/l
[A-] = [H3O+] = 0,00245 mol/l, want beide ionen worden in een 1:1-verhouding gevormd.
Dan hoeven we alleen nog de concentratie van het ongedissocieerde zuur te bepalen: [HA].
Dat kun je doen door eerst te bepalen hoeveel mol aspirine er is opgelost en die te verminderen met [A-].
De opgave geeft geen eenheid van de opgeloste massa aspirine, maar ik ga even uit van 2,00 g. 2,00 g aspirine komt overeen met 2,00/180,16 = 0,0111 mol. Dat is opgelost in 0,600 l water, wat betekent dat de initiële concentratie van aspirine gelijk was aan 0,0111/0,600 = 0,0185 mol/l. Verminder deze met [A-], dat geeft 0,0185 - 0,00245 = 0,01605 mol/l
Invullen van de concentraties in de evenwichtsvoorwaarde geeft Ka = (0,00245)2/0,01605 = 3,75 * 10-4 mol/l
Als hij het niet verklapt zou ik het er wel bij doen maar niet te uitgebreid.
De opdracht met vragen:

Mijn poging op vraag 1 (weet niet of het klopt) (en heb v niet kunnen uitrekenen) (p.s. niets met integralen a.u.b. ):
Mijn poging op vraag 2:

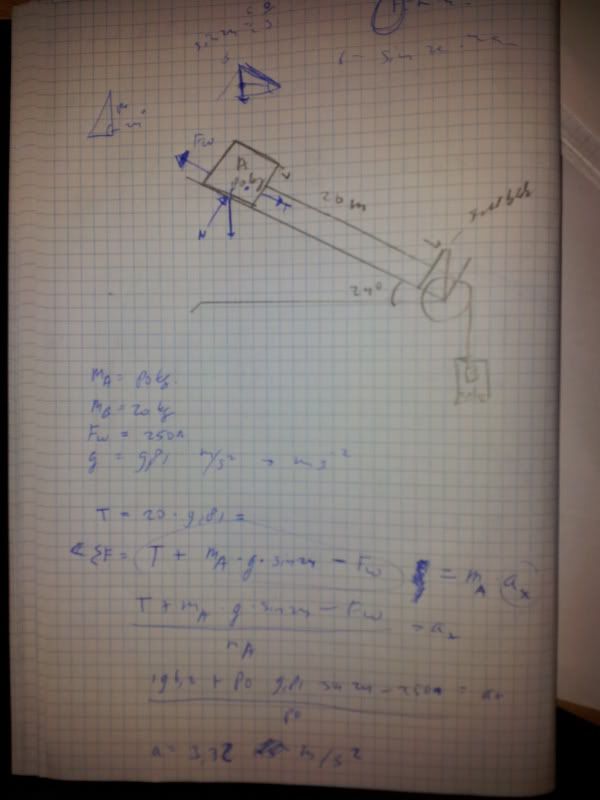
voor jouw eerste opdracht heb je T = m*g (20*9.8), dit is alleen waar als blok b stil zou staan(als de kabel massaloos is), en dat is niet zoquote:Op zondag 30 oktober 2011 20:08 schreef alicarpali het volgende:
Heren , une question, gelieve mij te helpen, ik kom er zelf niet uit (al veel geprobeerd).
De opdracht met vragen:
[ afbeelding ]
Mijn poging op vraag 1 (weet niet of het klopt) (en heb v niet kunnen uitrekenen) (p.s. niets met integralen a.u.b. ):
[ afbeelding ]
Mijn poging op vraag 2:
[ afbeelding ]
denk ik
http://i.imgur.com/GveY7.jpg zo moet ie denk ikquote:Op zondag 30 oktober 2011 20:08 schreef alicarpali het volgende:
Heren , une question, gelieve mij te helpen, ik kom er zelf niet uit (al veel geprobeerd).
De opdracht met vragen:
[ afbeelding ]
Mijn poging op vraag 1 (weet niet of het klopt) (en heb v niet kunnen uitrekenen) (p.s. niets met integralen a.u.b. ):
[ afbeelding ]
Mijn poging op vraag 2:
[ afbeelding ]
Zou iemand mij nadere uitleg wilen geven over de volgende functie's bij kansberekening?
De NCR funtctie
Fakkeltijd
BIj wat voor soort vraag moet ik welke functie gebruiken, ik haal het telkens door elkaar heen en in het boek staat het niet precies beschreven.
Het is faculteit; fakkeltijd is heel wat andersquote:Op zondag 6 november 2011 12:28 schreef Mierenneuker. het volgende:
Hallo,
Zou iemand mij nadere uitleg wilen geven over de volgende functie's bij kansberekening?
De NCR funtctie
Fakkeltijd
BIj wat voor soort vraag moet ik welke functie gebruiken, ik haal het telkens door elkaar heen en in het boek staat het niet precies beschreven.
De nCr-functie gebruik je voor het berekenen van combinaties (volgorde níet van belang).
Stel dat je uit een groep van 5 mensen er 2 mag kiezen; hoeveel verschillende keuzes (combinaties) kun je maken? Het maakt hier niet uit of je eerst A en dan B kiest, uiteindelijk kies je beide personen. Je maakt hier gebruik van nCr (combinaties). De oplossing is hier 5 nCr 2 oftewel 10 keuzes.
De nPr-functie gebruik je voor permutaties (volgorde wél van belang).
Stel dat je uit een groep van 5 mensen een voorzitter en een notulist moet kiezen; hoeveel verschillende keuzes (permutaties) kun je maken? De volgorde is van belang, want als je A als voorzitter kiest dan is hij geen notulist (want dat is B). Je maakt hier gebruik van nPr (permutaties). De oplossing is hier 5 nPr 2 oftewel 20 mogelijkheden.
Faculteit gebruik je voor het berekenen ervan:
waarin k het aantal elementen uit de verzamling n is.
Bedankt voor je reactie, nu ga ik al met een aardig beter gevoel mijn tentamen wisk. tegemoet.quote:Op zondag 6 november 2011 13:25 schreef zoem het volgende:
[..]
Het is faculteit; fakkeltijd is heel wat anders
De nCr-functie gebruik je voor het berekenen van combinaties (volgorde níet van belang).
Stel dat je uit een groep van 5 mensen er 2 mag kiezen; hoeveel verschillende keuzes (combinaties) kun je maken? Het maakt hier niet uit of je eerst A en dan B kiest, uiteindelijk kies je beide personen. Je maakt hier gebruik van nCr (combinaties). De oplossing is hier 5 nCr 2 oftewel 10 keuzes.
De nPr-functie gebruik je voor permutaties (volgorde wél van belang).
Stel dat je uit een groep van 5 mensen een voorzitter en een notulist moet kiezen; hoeveel verschillende keuzes (permutaties) kun je maken? De volgorde is van belang, want als je A als voorzitter kiest dan is hij geen notulist (want dat is B). Je maakt hier gebruik van nPr (permutaties). De oplossing is hier 5 nPr 2 oftewel 20 mogelijkheden.
Faculteit gebruik je voor het berekenen ervan:
waarin k het aantal elementen uit de verzamling n is.
Het antwoord is trouwens 1,293 kgm^-3 maar hoe kom je hieraan? :S
[ Bericht 24% gewijzigd door #ANONIEM op 07-11-2011 16:55:54 ]
Als de dichtheid van lucht niet gegeven is dan kun je uitgaan van ISA condities (International Standard Atmosphere). Dan is de luchtdichtheid:quote:Op maandag 7 november 2011 16:54 schreef magneetstrip het volgende:
Ik moet voor natuurkunde een formule invullen waarin de dichtheid van lucht voorkomt. Hoe moet ik deze dichtheid weten?
Het antwoord is trouwens 1,293 kgm^-3 maar hoe kom je hieraan? :S
Dit is bij 0 graden Celsius. Is dit niet makkelijk te vinden in een BINAS?quote:Op maandag 7 november 2011 16:54 schreef magneetstrip het volgende:
Ik moet voor natuurkunde een formule invullen waarin de dichtheid van lucht voorkomt. Hoe moet ik deze dichtheid weten?
Het antwoord is trouwens 1,293 kgm^-3 maar hoe kom je hieraan? :S
Hoe pak ik dat aan? Ik ben bekend met molverhoudingen en omrekenen naar gram in reactievergelijkingen.
Is het goed als ik:
- Eerst de molmassa glucose uitreken
- 100 gram deel door de molmassa = aantal mol
- aantal mol delen door (6+12+6) en daarna vermenigvuldig met 6? (want je hebt 6 koolstofatomen)?
- Ten slotte aantal mol vermenigvuldig met de molmassa van koolstof?
Zo'n vraag zat in de sk toets maar dan een stuk ingewikkelder. Het deel wat ik niet begreep was dit hierboven. Ik denk dat punt 3 niet goed is.
[ Bericht 12% gewijzigd door BeyondTheGreen op 10-11-2011 14:32:16 ]
H = 1g/mol
O = 16g/mol
molmassa C6H12O6 = 6*12+12*1+6*16 = 180 g/mol
Je hebt 100 gram C6H12O6, dus 100/180 = 0.555 mol.
Er is 6*12 = 72g/mol aan koolstofatomen aanwezig.
Dus 0.555 mol * 72 g/mol = 40g.
Lijkt me vrij rechttoe rechtaan
Danku.quote:Op donderdag 10 november 2011 14:43 schreef zoem het volgende:
C = 12g/mol
H = 1g/mol
O = 16g/mol
molmassa C6H12O6 = 6*12+12*1+6*16 = 180 g/mol
Je hebt 100 gram C6H12O6, dus 100/180 = 0.555 mol.
Er is 6*12 = 72g/mol aan koolstofatomen aanwezig.
Dus 0.555 mol * 72 g/mol = 40g.
Lijkt me vrij rechttoe rechtaan
Het is ook niet zo moeilijk, maar als je Sprinthavo doet en nooit eerder scheikunde hebt gehad gaat het wel allemaal erg snel.
Een halve glazen bol is bedekt met een spiegelende zilverlaag aan de gekromde kant van het
oppervlak. Binnenin de bol, op de centrale as, bevindt zich een kleine luchtbel op 50.0 mm afstand
van het platte oppervlak. De kromtestraal R van de halve bol is gelijk aan 75.0 mm en het glas van
de bol heeft een brekingsindex n = 1.60. (zie figuur). We kijken langs de as in het vlakke oppervlak
en we zien twee afbeeldingen van de luchtbel.
http://imageshack.us/photo/my-images/141/optica.png/ (copy/paste deze link)
a) Verklaar hoe de twee afbeeldingen van de luchtbel tot stand komen
OPGELOST
[ Bericht 11% gewijzigd door Anoonumos op 12-11-2011 23:26:46 ]
Mijn vorige vragen zijn al beantwoord en opgelost, dus nogmaals bedankt
Op welke tijden kijken kinderen van 9 t/m 12 jaar naar de televisie?
Ik had al op CBS Statline en SKO gekeken, maar dan kon ik niks vinden. Alvast bedankt voor uw antwoord!
Groet,
superky
Ik ben eigenlijk wel benieuwd naar het antwoord. Nav jouw vraag heb ik het proberen op te lossen, maar ik kwam er ook niet uit. Optica is één van de weinige natuurkunde-onderdelen die ik niet in mijn opleiding gehad heb.quote:
[ Bericht 48% gewijzigd door NonameNogame op 20-11-2011 14:26:12 ]
Past hier wel, maar je zult iets specifieker moeten zijn.quote:Op zondag 4 december 2011 14:02 schreef dynamiet het volgende:
Kan ik in dit topic ook een vraag stellen hoe ik een Bode plot (phase,amp/freq) naar een transfer functie moet omzetten? Of kan ik daar beter voor bij een ander topic zijn?
"Based on the measurement data in the lab exercise 2, estimate the dynamical model of the systemsto-be-controlled, which consists of the amplifier, motor, conveyor mechanism and the
tachogenerator."
Nu heb ik voor verschillende frequenties de vesterkingsfactor en fase-verschuiving gemeten. De volgende resultaten heb ik hier bij gekregen
Freq = [0.628318531,1.256637061,3.141592654,6.283185307,12.56637061,31.41592654,62.83185307]
Amp = [2.6719,2.6415,2.6611,2.8076,1.1931,0.4647,0.1142]
Phase = [-1.186022636,-2.319637234,-5.723848373,-11.63104324,-60.61320515,-87.11739091,-91.23122788]
Freq = rad/s, amp(versterking)= factor, Phase= fase verschuiving in graden.
Hier heb ik de volgende bode plot uit gecreëerd:

Mijn vraag is hoe ik hier nu een transfer functie uit kan creëren?
Tevens is het voor mij ook lastig te begrijpen wat de spintoestand nu precies inhoud en hoe je dit bepaald en aangeeft. Wij gebruiken het boek "Chemistry'' van McMurry & Fay en dat is dus in het (Harvard) Engels. Soms een beetje lastig. De stof zelf is niet zo moeilijk, maar deze dingen kom ik niet helemaal uit. Alvast heel erg bedankt.
Het is voor mij diep graven. Ik gebruik dit spul wel voor optische transfer functies, maar daar werken we niet met bodeplotten.quote:
Wat ik me van die materie herinner, is dat je een delta functie (pulse input, oneindig kort en oneindig hoog met een oppervlak van 1) nodig hebt om de transferfunctie van het systeem te bepalen. De reactie van het systeem op die functie is namelijk de transfer functie, en daarmee kun je berekenen hoe een andere input (bijvoorbeeld een sinus met een bepaalde frequentie) versterkt zal worden.
In jouw geval heb je metingen waarbij je de versterking en fase als een functie van de frequentie hebt.
Het lijkt me dat je daarmee ook wel een transferfunctie op kunt stellen, maar dan op een andere manier dan ik eerder beschreef. Je roll-off, 3dB punt en zo zijn vrij klassiek en lijkt daarmee op een klassieke versterker. In dat geval kun je eens googlen op een transferfunctie voor een versterker. Je weet waar je 3dB punt ligt, en je weet hoe veel je roll-off (~10dB/decade?) is. Ik hoop dat ik je hiermee niet het bos instuur.
Ik ben zelf geen natuurkundige, daarom kan ik je geen diepgaande uitleg hierover geven. Wat ik wel weet, is dat de quantumgetallen bedoeld zijn om de toestand waarin een elektron zich bevindt te beschrijven. Het hoofdquantumgetal n beschrijft het energieniveau (ofwel de schil) waarbinnen het elektron zich bevindt. Het nevenquantumgetal l beschrijft in wat voor type orbitaal het elektron zich bevindt (s, p, d, f). Het magnetisch quantumgetal m geeft weer binnen welke orbitaal zich het elektron zich bevindt (er zijn bijvoorbeeld 3 p-orbitalen). Het spinquantumgetal s beschrijft ten slotte de spin van het elektron (spin up of spin down).quote:Op dinsdag 6 december 2011 14:35 schreef WhatsTheSecret het volgende:
Zou iemand mij in het kort uit kunnen leggen wat de quantumgetallen (n,l,m) inhouden? En dan bijvoorbeeld bij een 4p-toestand.
Tevens is het voor mij ook lastig te begrijpen wat de spintoestand nu precies inhoud en hoe je dit bepaald en aangeeft. Wij gebruiken het boek "Chemistry'' van McMurry & Fay en dat is dus in het (Harvard) Engels. Soms een beetje lastig. De stof zelf is niet zo moeilijk, maar deze dingen kom ik niet helemaal uit. Alvast heel erg bedankt.
Voor jouw voorbeeld 4p geldt in ieder geval dat n = 4 (vierde energieniveau/schil en l = 1 (p-orbitalen). Er zijn dan nog 6 combinaties van m (-1, 0, 1) en s (-1/2, 1/2) mogelijk. Dat komt precies overeen met het aantal elektronen dat zich in de 4p-orbitalen kan bevinden. Met andere woorden elk elektron heeft zijn unieke combinatie van quantumgetallen!
Hopelijk helpt dit je een beetje op weg!
De waarde voor s is arbitrair. Er kunnen maximaal 2 elektronen in een orbitaal zitten. Als je aan de ene de waarde -1/2 toekent, dan heeft de andere automatisch de waarde 1/2.quote:Op dinsdag 6 december 2011 18:08 schreef WhatsTheSecret het volgende:
Ah thanx, dan had ik het toch wel redelijk begrepen.Alleen snap ik die 's' nog niet, hoe bepaal je die? -1/2 en 1/2.
Stel dat er zich 2 elektronen in de 2px-orbitaal bevinden. Dan heeft het ene elektron bijvoorbeeld als quantumgetallen n=2, l=1, m=-1, s=-1/2, de ander heeft dan n=2, l=1, m=-1, s=1/2. In dit geval staan n en l vast, maar ik had voor m ook 0 of 1 kunnen kiezen. De waarde die je kiest voor m is dus ook arbitrair, zolang je (even doorgaand op mijn voorbeeld) voor py en pz maar de andere mogelijke waarden kiest.
[ Bericht 0% gewijzigd door lyolyrc op 06-12-2011 19:34:14 ]
Daarbij werd een plaatje getoond waarin ik iets niet snap. Dat plaatje kon ik niet op internet vinden maar onderstaand is goed genoeg voor mn vraag

Het gaat om NAD+ en NADH
Als NAD+ een elektron opneemt om te vervoeren, wordt het toch NAD (met lading nul)?
En als er dan een H+ (lading plus 1) bijkomt, wordt het toch weer NADH+ (lading plus 1)?
Waarom staat er in de plaatjes (ook in die van mijn college) dat NAD+ verandert in NADH?

Edit: Binaire getal + (binaire getal + 'n 0 toevoegen als laatste bit) = vermenigvuldiging met drie binair
[ Bericht 4% gewijzigd door Diabox op 08-12-2011 18:30:38 ]
Onderzoek : 46 studenten, 23 controle groep, 23 experimentele groep.
Veronderstel dat in de populatie van alle studenten de test scores voor de controlegroep variëren volgens de N(56,9)-verdeling. Voor de experimentele groep is dit volgens de N(49,8) verdeling.
Vraag a: wat is de steekproef verdeling van de gemiddelde score x voor studenten die aan de controle groep worden toegewezen bij vele herhalingen van het experiment.
Ik begrijp niet helemaal wat ik nu moet doen. Als ik het goed begrijp, moet ik dus een betrouwbaarheidsinterval uitvoeren voor de mogelijke steekproeven? We hebben wel eens geoefend met het berekenen van een steekproef naar de populatie, maar niet vanuit een populatie naar een steekproef..
Heb t nu als volgt gedaan, maar weet bijna wel zeker dat dit niet klopt:
SE berekenen: wortel 56.9^2/ 23 = 11.86
Ga voor 95% zekerheid, dus Z = 1,96
Statistic +/- Z * SE, dus
56.9 + 1. 96 * 11. 86 = 80.15
56.9 - 1. 96 * 11.86 =33.65
x gemiddeld ligt met 95 % zekerheid tussen 33.65 en 80.15
Wie kan mij helpen en kan uitleggen hoe ik dit moet aanpakken??? Kom er niet meer uit!
Alvast bedankt
[ Bericht 51% gewijzigd door GeertJan88 op 12-12-2011 23:52:18 (Verkeerde tp[oc) ]
Chromatografie is een methode om stoffen van elkaar te scheiden en deze gescheiden van elkaar op te vangen of te meten.quote:Op zondag 18 december 2011 19:17 schreef vault_tec het volgende:
Iemand die mij simpel kan uitleggen wat chromatografie is en wat gas-vloeistof chromatografie is.
Meestal maakt men hierbij gebruik van een stationaire fase en een mobiele fase die zich baseren op polariteit van de stof. De stationaire fase is altijd de kolom en de mobiele fase is het gas of vloeistof.
In het geval van HPLC (high performance liquid chromatografie) wordt een vloeistof onder druk door een kolom gespoeld. Wanneer men een vreemde stof in de chromatograaf spuit zal deze een interactie hebben met het vloeistof (de mobiele fase) en oplossen.
De binnenkant van de kolom is gecoat met een laag die een bepaalde affiniteit geeft met moleculen, afhankelijk van de polariteit. Ieder molecuul zal dus graag interactie aangaan met de binnenkant van het kolom (de stationaire fase). Hoe meer affiniteit een molecuul heeft met jouw stationaire fase, hoe langer hij er over zal doen om door de kolom heen te komen.
Misschien snap je dan wel dat je vreemde monster/stof in de kolom dus helemaal uit elkaar wordt getrokken en afhankelijk van zijn polariteit in tig van verschillende stoffen wordt gesplitst.
Aan het einde van je chromatograaf zit een detector die de deeltjes zal meten en dit uitschrijft in een chromatogram doormiddel van piekjes.
Tot slot kun je dan aan de hand van het verschil van afstand tussen de piekjes uitrekenen wat het verschil in polariteit van de stoffen in je monster was.
Vergeet hierbij nooit om een bekende controle aan je monster toe te voegen (dus waar je de polariteit van kent) van dan kun je die stof in je chromatogram terugzoeken en vervolgens aan de hand daarvan berekenen welke stoffen allemaal vertegenwoordigd moeten zijn door de andere gemeten (onbekende) piekjes.
Gas-chromatografie is een vrijwel identieke methode, welke zich echter baseert op gas in plaats van vloeistof. Er zal hierbij een ander (meestal veel langer) kolom worden gebruikt en er wordt gebruik gemaakt van anderen vormen van affiniteit.
Ik heb een practicum gedaan waarbij ik het gehalte vanille in Baukje moest bepalen. Eerst heb ik de vanille geextraheerd met chloroform. Daarna het chloroformextract behandeld met NaOH-oplossing.
Daarna de absorptie gemeten met een spectrofotometer.
Nu moet ik de extinctie uitzetten tegen de concentratie, en dan de concentratie van de gemeten monsteroplossing met interpolatie bepalen.
Nu heb ik geen idee hoe ik dat moet doen. Is er iemand die me op weg kan helpen?
Er is heel veel wetenschappelijk onderzoek gedaan, naar hoe je het beste kunt leren.
Dus als je tentamens/examens hebt, zijn er allerlei trucjes die je kunt toepassen. Als je ze toepast, haal je veel hogere cijfers!
De trucjes zijn:
- Op tijd pauze houden (en weer beginnen)
Een Duitse wetenschapper (Ebbinghaus) heeft onderzoek gedaan naar de precieze tijden waarop je concentratie hoog is en wanneer je dingen vergeet. Het beste kan je 50 min leren, dan 10 min pauze nemen en dan weer 10 min herhalen wat je net hebt geleerd. Dan onthoud je het het beste en blijft je concentratie het best.
- Begrijpend lezen voor je begint
Voor je tekst begint te lezen, moet je eerst even nadenken: wat ga ik lezen? Waarom hoort dit bij het hoofdstuk? Dan heb je meteen een soort "kapstok" waaraan je de kennis ophangt! Dan onthoud je het daarna veel beter.
-Gebruik allebei de helften van je hersenen
Normaal gebruik je bij het leren alleen de linkerhelft van je hersenen (dit is de rationele kant, de feitelijke kant). Maar als je alle capaciteit van je hersenen wilt gebruiken moet je ook de rechterhelft (de creatieve, fantasievolle kant) van je hersenen gebruiken. Hoe doe je dit? Door bijvoorbeeld een mind map te maken van de stof! Mindmap is een kleurrijke weergave van de stof, in de vorm van een boom met takken.
-Samenvatting maken
Door een samenvatting te maken, onderscheid je de hoofd en bijzaken in de tekst.
- Aantekeningen delen met je vrienden
Je vrienden zien weer dingen die jij niet wist en andersom! Zo leer je dubbel zoveel.
- Ken jezelf!
Iedereen heeft een eigen manier van leren. Er zijn verschillende testen om je leerstijl te testen. Als je je leerstijl kent en deze toepast, ga je veel effectiever leren. Doe bijvoorbeeld de leerstijl van Kolb test op internet.
- Gebruik de inhoudsopgaven
Kijk goed naar de inhoudsopgaven, want dat is de structuur van je boek! Als je de structuur van je boek goed begrijpt, snap je ook veel beter waarom bepaalde dingen in het boek staan. Je hebt het " grote plaatje" van het boek door!
[ Bericht 7% gewijzigd door GlowMouse op 03-01-2012 14:11:48 ]
Waarschijnlijk heb je eerst van een aantal oplossingen met bekende concentratie de absorptie gemeten (of zijn de meetwaarden hiervan al gegeven). Als je deze meetwaarden dan zou uitzetten tegen de concentratie, dan kun je door de punten een lijn tekenen. Als je dan de absorptie meet van jouw onbekende oplossing, kun je uit de grafiek aflezen welke concentratie daarbij hoort.quote:Op dinsdag 3 januari 2012 13:32 schreef daantje1044 het volgende:
Ik heb een vraag:
Ik heb een practicum gedaan waarbij ik het gehalte vanille in Baukje moest bepalen. Eerst heb ik de vanille geextraheerd met chloroform. Daarna het chloroformextract behandeld met NaOH-oplossing.
Daarna de absorptie gemeten met een spectrofotometer.
Nu moet ik de extinctie uitzetten tegen de concentratie, en dan de concentratie van de gemeten monsteroplossing met interpolatie bepalen.
Nu heb ik geen idee hoe ik dat moet doen. Is er iemand die me op weg kan helpen?
Maar: je zult zien dat deze grafiek niet een rechte lijn is, waardoor je grote fouten zou maken bij de interpolatie. De truc om dit te omzeilen is de extinctie uitzetten tegen de concentratie. Daarvoor zul je eerst de gemeten absorptie moeten omrekenen naar transmissie en deze vervolgens omrekenen naar extinctie. De extinctie is wel lineair met de concentratie.
Hoe doe je dat:
• transmissie berekenen: transmissie = 1 - absorptie (in formulevorm: T = 1 - A)
• extinctie berekenen: E = - log(T)
• je kunt ook in 1 stap van absorptie naar extinctie: E = - log(1 - A)
• berekende extincties in een grafiek uitzetten tegen de concentratie
• absorptie van jouw monster omrekenen naar extinctie en met de grafiek de bijbehorende concentratie aflezen.
Ok dank je wel. Ja ik heb met bekende concentratie de absorptie gemeten.quote:Op dinsdag 3 januari 2012 17:44 schreef lyolyrc het volgende:
[..]
Waarschijnlijk heb je eerst van een aantal oplossingen met bekende concentratie de absorptie gemeten (of zijn de meetwaarden hiervan al gegeven). Als je deze meetwaarden dan zou uitzetten tegen de concentratie, dan kun je door de punten een lijn tekenen. Als je dan de absorptie meet van jouw onbekende oplossing, kun je uit de grafiek aflezen welke concentratie daarbij hoort.
Maar: je zult zien dat deze grafiek niet een rechte lijn is, waardoor je grote fouten zou maken bij de interpolatie. De truc om dit te omzeilen is de extinctie uitzetten tegen de concentratie. Daarvoor zul je eerst de gemeten absorptie moeten omrekenen naar transmissie en deze vervolgens omrekenen naar extinctie. De extinctie is wel lineair met de concentratie.
Hoe doe je dat:
• transmissie berekenen: transmissie = 1 - absorptie (in formulevorm: T = 1 - A)
• extinctie berekenen: E = - log(T)
• je kunt ook in 1 stap van absorptie naar extinctie: E = - log(1 - A)
• berekende extincties in een grafiek uitzetten tegen de concentratie
• absorptie van jouw monster omrekenen naar extinctie en met de grafiek de bijbehorende concentratie aflezen.
Ik denk dat ik er hiermee wel uit kom!
Bedankt!
Ik ga een potentiometrische titratie doen om het ijzergehalte in ijzertabletten te bepalen.
Nu is de vraag: Geef alle reactievergelijkingen die tijdens dit experiment plaatsvinden.
Maar het enige wat in de begeleidende tekst staat is dit:
Het gehalte ijzer in ijzertabletten kan bepaald worden door middel van een titratie met kaliumdichromaat, waarbij Fe2+ wordt geoxideerd door het dichromaat-ion volgens:
Fe2+ --> Fe3+ + e
Cr2O72- + 14 H+ +6e --> 2 Cr3+ + 7 H2O
Ik neem aan dat dat niet alle reactievergelijkingen zijn, maar heb ook geen idee welke er dan nog meer zouden moeten zijn?
Bij benodigheden staat wel dat ik ook nog fosforzuuroplossing moet gebruiken en zwavelzuuroplossing.
Ik ben volledig de kluts kwijt.
Kan iemand me helpen?
Zonder de reactievergelijkingen kan ik mijn berekeningen niet doen.
De reacties die je hier geeft zijn alleen de halfreacties. Om te bepalen hoe ijzer en dichromaat samen gaan reageren, moet je de halfreacties nog samennemen. Dit kun je doen door het aantal elektronen dat de reductor (Fe2+) opneemt en de oxidator (Cr2O72-) te balanceren.quote:Op maandag 9 januari 2012 15:09 schreef daantje1044 het volgende:
Ik heb weer een vraag,
Ik ga een potentiometrische titratie doen om het ijzergehalte in ijzertabletten te bepalen.
Nu is de vraag: Geef alle reactievergelijkingen die tijdens dit experiment plaatsvinden.
Maar het enige wat in de begeleidende tekst staat is dit:
Het gehalte ijzer in ijzertabletten kan bepaald worden door middel van een titratie met kaliumdichromaat, waarbij Fe2+ wordt geoxideerd door het dichromaat-ion volgens:
Fe2+ --> Fe3+ + e
Cr2O72- + 14 H+ +6e --> 2 Cr3+ + 7 H2O
Ik neem aan dat dat niet alle reactievergelijkingen zijn, maar heb ook geen idee welke er dan nog meer zouden moeten zijn?
Bij benodigheden staat wel dat ik ook nog fosforzuuroplossing moet gebruiken en zwavelzuuroplossing.
Ik ben volledig de kluts kwijt.
Kan iemand me helpen?
Zonder de reactievergelijkingen kan ik mijn berekeningen niet doen.
Hoe doe je dat? Fe2+ staat 1 elektron af, terwijl Cr2O72- er 6 opneemt. Met andere woorden als de halfreactie van ijzer 6x nemen en die van dichromaat 1x dan is er balans, waarbij je de elektronen na optellen van de halfreacties kan wegstrepen.
Fe2+ --> Fe3+ + e |6x|
Cr2O72- + 14 H+ +6e --> 2 Cr3+ + 7 H2O |1x|
============================================================= +
6 Fe2+ + Cr2O72- + 14 H+ + 6 e- --> 6 Fe3+ + 2 Cr3+ + 7 H2O + 6 e-
Het toevoegen van zuur is nodig om de reactie te laten verlopen. Je kunt dit ook zien in de halfreactie van dichromaat. Op elke mol dichromaat moet er 14 mol H+ aanwezig zijn.
Dus wat zou er verschillend moeten zijn bij serie en parallel? Ik heb hier de gegevens liggen maar hou die even voor mij zodat ik mensen niet laat twijfelen
Alvast bedankt!
Sowieso veel oefenen natuurlijk. Kunnen 'goochelen' met formules en dimensies is wel een vereiste. Weten wanneer je iets toepast, wanneer niet en wat uitzonderingsregels zijn. Dat kun je allemaal uit je hoofd leren. Maak samenvattingen. Welke onderdelen van de stof snap je wel, welke niet en waarom? Pas dan kan iemand je concreet verder helpen, hetzij via bijles of hier op FOK!
Wat mij altijd heeft geholpen is om stappenplannen te maken voor de meest voorkomende vragen. Op den duur leer je de stappen uit je hoofd en hoef je op het examen niet moeilijk te gaan lopen nadenken.
Door gedachte-experimenten.quote:Op vrijdag 13 januari 2012 21:27 schreef zoem het volgende:
Hoe kun je natuurkunde beter begrijpen? Lastige vraag hoor
Sowieso veel oefenen natuurlijk. Kunnen 'goochelen' met formules en dimensies is wel een vereiste. Weten wanneer je iets toepast, wanneer niet en wat uitzonderingsregels zijn. Dat kun je allemaal uit je hoofd leren. Maak samenvattingen. Welke onderdelen van de stof snap je wel, welke niet en waarom? Pas dan kan iemand je concreet verder helpen, hetzij via bijles of hier op FOK!
Wat mij altijd heeft geholpen is om stappenplannen te maken voor de meest voorkomende vragen. Op den duur leer je de stappen uit je hoofd en hoef je op het examen niet moeilijk te gaan lopen nadenken.
Dusquote:
Zoals hierboven al is aangegeven, is een stappenplan opzetten voor de meest voorkomende vraagstukken een goede oplossing. Amerikanen doen het zo ook (GRE test), en dat blijkt enorm effectief. Zelfs pre-med students, die het vak alleen maar gekozen hebben om zo medicijnen te kunnen studeren, maken zo'n standaard test zonder problemen.quote:Op vrijdag 13 januari 2012 21:07 schreef withloveproductions_ het volgende:
Haihai, ik zit nu in het examenjaar van havo 5 met het ng-profiel en heb nogal veel moeite met natuurkunde. Ik begrijp het vak weliswaar niet. Voor mijn gevoel is het een miljoen keer moeilijker dan wiskunde en scheikunde bijvoorbeeld (die vakken begrijp ik veel beter). Ik kan wel bijles krijgen enzo en die krijg ik ook, maar wat kan ik nou doen om natuurkunde beter te begrijpen? Ik heb het totaal niet nodig voor me vervolgopleiding, maar wil het vak het liefst wel even last-minute met een voldoende of minimaal een 5 aflsluiten.
Alvast bedankt!
Ik heb op het VWO heel erg met het vak geworsteld, omdat ik dacht dat ik de stof snapte, maar dat bleek vaak niet het geval te zijn. Mijn ervaring is dat als je de stof aan iemand anders uit kunt leggen, dat je het dan pas snapt.
Veel vraagstukken maken, en veel voorbeeldvraagstukken met antwoorden napluizen, om te zien of je de manier van oplossen helemaal snapt, helpt.
Natuurkunde is een vak waarbij zelfvertrouwen erg belangrijk is. Als je denkt, dit kan ik niet, dan gaat het ook echt niet lukken. Maar als je veel vraagstukken gemaakt hebt, en als je weet dat je het kunt, dan is het vak een makkie.
Het antwoord moet a zijn. Vind iemand dat deze vraag een beetje vreemd gesteld is?quote:De lichaamscellen van één individu bezitten niet alle hetzelfde pakket eiwitten. De variatie in eiwitvorming is het gevolg
van:
A verschillende concentraties aan mRNA in de ribosomen;
B verschillende DNA-strengen in verschillende lichaamscellen.
a A is juist, B is onjuist;
b B is juist, A is onjuist;
c A en B zijn beide juist;
d A en B zijn beide onjuist.
Elke cel kan alle eiwitten produceren, maar niet in elke cel worden alle eiwitten geproduceerd. Dat komt omdat niet van elk stukje DNA, mRNA wordt gemaakt. Om dit te formuleren als concentratie vind ik een beetje vreemd.
Het antwoord impliceert namelijk, alsof alle mRNA in meer of mindere mate aanwezig is in de ribosomen. Dat is toch niet waar?
Naar mijn mening moet het d zijn.
Het dikgedrukte is niet waar, want in elke cel behalve totipotente stamcellen zijn er delen van het DNA geblokkeerd. Dat is de reden dat verschillende celtypen een verschillend pakket aan eiwitten produceren. Je kunt dan stellen dat dit tot verschillende mRNA-concentraties leidt, maar ik vind dat net als jij nogal vaag.quote:Op maandag 23 januari 2012 16:39 schreef Warren het volgende:
[..]
Het antwoord moet a zijn. Vind iemand dat deze vraag een beetje vreemd gesteld is?
Elke cel kan alle eiwitten produceren, maar niet in elke cel worden alle eiwitten geproduceerd. Dat komt omdat niet van elk stukje DNA, mRNA wordt gemaakt. Om dit te formuleren als concentratie vind ik een beetje vreemd.
Het antwoord impliceert namelijk, alsof alle mRNA in meer of mindere mate aanwezig is in de ribosomen. Dat is toch niet waar?
Naar mijn mening moet het d zijn.
Naar mijn mening zouden zij dat in één van de alternatieven moeten zetten, en niet de mRNA-concentraties.quote:Op maandag 23 januari 2012 16:47 schreef lyolyrc het volgende:
[..]
Het dikgedrukte is niet waar, want in elke cel behalve totipotente stamcellen zijn er delen van het DNA geblokkeerd. [b]Dat is de reden dat verschillende celtypen een verschillend pakket aan eiwitten produceren.[/b] Je kunt dan stellen dat dit tot verschillende mRNA-concentraties leidt, maar ik vind dat net als jij nogal vaag.
Nog een vraagje. Vind iemand ook dat deze vraag slecht geformuleerd is? Als je de celkern weghaald, dan wordt er geen mRNA meer gemaakt. Dat leidt er toe dat er geen eiwitten worden gemaakt. Echter, door het weghalen van de celkern, haal je niet de ribosomen weg, dus in theorie kunnen er nog eiwitten ontstaan als er nog mRNA werd afgelezen.quote:Indien experimenteel uit een cel de kern wordt weggenomen, is de cel niet meer in staat:
A eiwitmoleculen te vormen;
B mRNA te vormen.
a A is juist, B is onjuist;
b B is juist, A is onjuist;
c A en B zijn beide juist;
d A en B zijn beide onjuist.
Kortom, naar mijn mening is deze vraag niet éénduidig te bentwoorden. Iemand mee eens?
Ben het helemaal met je eens. Juist vanwege dit soort vragen ben ik niet zo'n fan van biologie. Je kunt nuance moeilijk in een meerkeuzevraag vangen.quote:Op maandag 23 januari 2012 17:18 schreef Warren het volgende:
[..]
Nog een vraagje. Vind iemand ook dat deze vraag slecht geformuleerd is? Als je de celkern weghaald, dan wordt er geen mRNA meer gemaakt. Dat leidt er toe dat er geen eiwitten worden gemaakt. Echter, door het weghalen van de celkern, haal je niet de ribosomen weg, dus in theorie kunnen er nog eiwitten ontstaan als er nog mRNA werd afgelezen.
Kortom, naar mijn mening is deze vraag niet éénduidig te bentwoorden. Iemand mee eens?
quote:Op maandag 23 januari 2012 17:23 schreef lyolyrc het volgende:
[..]
Ben het helemaal met je eens. Juist vanwege dit soort vragen ben ik niet zo'n fan van biologie. Je kunt nuance moeilijk in een meerkeuzevraag vangen.
Ik moet wel zeggen dat dit wel een van de slechtere meerkeuzevragen zijn die ik ooit ben tegengekomen, ook al ben ik in het algemeen geen fan van meerkeuzevragen.
Kan iemand mij uitleggen hoe je de POWER moet berekenen [statistiek] met onderstaande gegevens:
H0 μ = 100, σ = 10, n = 50
en Ha μ = 105
Ik dacht dus zelf 105-100 / [10/wortel 50] dan z waarde opzoeken met bijbehorende kans
Ik kom maar niet op het juiste antwoord:: wat doe ik verkeerd???
Deze vraag kun je het best stellen in het [Bèta wiskunde] Huiswerk- en vragentopicquote:Op donderdag 26 januari 2012 14:26 schreef RedroseSK het volgende:
Hallo!
Kan iemand mij uitleggen hoe je de POWER moet berekenen [statistiek] met onderstaande gegevens:
H0 μ = 100, σ = 10, n = 50
en Ha μ = 105
Ik dacht dus zelf 105-100 / [10/wortel 50] dan z waarde opzoeken met bijbehorende kans
Ik kom maar niet op het juiste antwoord:: wat doe ik verkeerd???
Wanneer het zuur een pH bereikt van minimaal 8,2, wordt de oplossing paars/roze. Echter, hierdoor kunnen we niets zeggen over het equivalentiepunt van de stof, omdat de pH van de oplossing tussen de 8,2 en 10 ligt. Dit terwijl je, om iets nuttigs te kunnen zeggen over bijvoorbeeld de molariteit van het zuur, uiteindelijk een pH van 7 nodig hebt, om iets over het aantal opgeloste mol te kunnen zeggen.
Kortom, wat kun je wel concluderen als je weet dat de pH tussen de 8,2 en 10 ligt?
Ik heb even een correctie in je tekst doorgevoerd. Een oplossing heeft namelijk een pH, maar een zure stof op zich niet. We gebruiken de term pKa om weer te geven hoe zuur een stof is. Bij pH = pKa is 50% van het zuur in de geassocieerde vorm (HA) en 50% in de gedissocieerde vorm (A-) aanwezig.quote:Op dinsdag 31 januari 2012 23:03 schreef Manu. het volgende:
Morgen moet ik voor een praktisch handelingsdeel een titratie uitvoeren (ik zit nu in 6vwo). We gebruiken als indicator standaard fenolftaleine, een indicator met een omslagpunt van 8,2-10.
Wanneer het zuur de oplossing een pH bereikt van minimaal 8,2, wordt de oplossing paars/roze. Echter, hierdoor kunnen we niets zeggen over het equivalentiepunt van de stof, omdat de pH van de oplossing tussen de 8,2 en 10 ligt. Dit terwijl je, om iets nuttigs te kunnen zeggen over bijvoorbeeld de molariteit van het zuur, uiteindelijk een pH van 7 nodig hebt, om iets over het aantal opgeloste mol te kunnen zeggen.
Kortom, wat kun je wel concluderen als je weet dat de pH tussen de 8,2 en 10 ligt?
Je moet je niet blindstaren op het omslagpunt van fenolftaleïne. Het omslagpunt ligt weliswaar hoger dan pH 7, maar bij het titreren overbrug je het gebied van pH 6 naar pH 8 met enkele druppels base.
Een soortgelijk verhaal gaat voor als je NH3-oplossing (NH4OH, ammonia) met HCl gaat titreren; een oplossing van een zwakke base titreren met een sterk zuur zal bij het equivalentiepunt alleen een zwak zuur opleveren, dus dien je een indicator te kiezen waarbij het kleuromslagpunt rond de pH 6 ligt.
Maar net wat Lyolyrc zegt, dan praten we over concentraties van 10-6 M, oftewel in de praktijk 1 of 2 druppeltjes titer-oplossing meer.
http://www.scribd.com/doc/80471940/Literatuur-Nederlands
Alvast bedankt.
Als men zegt: "Je leidt 0.5 Mol waterstofchloride gas in 550 mL zuiver water." en je moet de nieuwe pH berekenen van die nieuwe oplossing, hoeveel mL / gr is 0.5 Mol waterstofchloride gas?
En dan wordt hetquote:Op dinsdag 14 februari 2012 17:50 schreef VanishedEntity het volgende:
De molaire massa van HCl is 36.46 g/mol en je leidt 0.5 mol door 550 ml water; in totaal wordt er dus 18.23 gram HCl opgelost. Vervolgens moet je dit omrekenen naar een hoeveelheid g/L. Deel dus die 18.23 gram HCL door 550ml en vermenigvuldig met 1000ml. Dat levert 18.23gr * 1000ml / 550ml = 33.15 gr/L op.
pH = -log(33.15 / 36.46) = 0.04
Thx!
Een schijf met 1 stip wordt rondgedraaid rondgedraaid met een toerental van 20 Hz.
Als je dit belicht met een stroboscoop met een flitsfreq. van 60 Hz, klopt dan dat je nog steeds 1 stip blijft zien?
En wat gebeurt er als je de flitsfreq. ook op 20 Hz zet?
Een toerental van 20 Hz betekent dat de stip iedere 0.05 seconde (1/20) op het zelfde punt staat. Als je de flitsfrequentie dan op 60 Hz zet, kijk je dus iedere 0.0167 seconde waar de stip zich bevindt. Je zal dan dus de stip op drie plekken zien, allemaal even ver van elkaar af. Als je de flitsfrequentie op 20 Hz zet kijk je precies iedere 0.05 seconde waar de stip zich bevindt, dat is dus iedere keer op de zelfde plek.quote:Op zaterdag 18 februari 2012 17:47 schreef Lagente het volgende:
Heel basic waarschijnlijk, maar ik ben begin weer helemaal vanaf 0.
Een schijf met 1 stip wordt rondgedraaid rondgedraaid met een toerental van 20 Hz.
Als je dit belicht met een stroboscoop met een flitsfreq. van 60 Hz, klopt dan dat je nog steeds 1 stip blijft zien?
En wat gebeurt er als je de flitsfreq. ook op 20 Hz zet?
Geweldig! Ik snap hem! 21 Hz is dan 0.0476 seconde wat dus inhoudt dat je 2 x een stip ziet? Nagenoeg er naast?quote:Op zaterdag 18 februari 2012 17:59 schreef M.rak het volgende:
[..]
Een toerental van 20 Hz betekent dat de stip iedere 0.05 seconde (1/20) op het zelfde punt staat. Als je de flitsfrequentie dan op 60 Hz zet, kijk je dus iedere 0.0167 seconde waar de stip zich bevindt. Je zal dan dus de stip op drie plekken zien, allemaal even ver van elkaar af. Als je de flitsfrequentie op 20 Hz zet kijk je precies iedere 0.05 seconde waar de stip zich bevindt, dat is dus iedere keer op de zelfde plek.
Nee, bij 40 Hz zou je twee stippen zien. Je moet de flitsfrequentie zien als de frequentie waarmee je een foto maakt. Bij 40 Hz maak je iedere 0.025 seconde een foto. In die 0.025 seconde heeft de stip precies een half rondje afgelegd (hij doet immers 0.05 seconde over een heel rondje). Je maakt dus eerst de eerste foto, dan zie je de stip op een bepaald punt, bij de volgende foto zie je hem een half rondje verder, bij de derde foto weer op het beginpunt, bij de vierde weer op het andere punt, enzovoorts... Je ziet dan dus twee stippen verschijnen.quote:Op zaterdag 18 februari 2012 21:13 schreef Lagente het volgende:
[..]
Geweldig! Ik snap hem! 21 Hz is dan 0.0476 seconde wat dus inhoudt dat je 2 x een stip ziet? Nagenoeg er naast?
Bij 21 Hz is het wat lastiger, je maakt dan iedere 0.0476 een foto, terwijl de stip er 0.05 seconde over doet om een heel rondje te maken. Als je de foto maakt heeft de stip dus nog net geen heel rondje gemaakt. Bij de eerste foto zien we de stip dus in z'n beginpunt, bij de tweede foto een beetje daaronder (aangenomen dat de schijf tegen de klok in roteert), bij de derde foto weer een beetje daaronder, enzovoorts. De stip lijkt dus tegen de draairichting van de schijf in te bewegen.
Bedankt voor de heldere, duidelijke en verklarende uitlegquote:Op zaterdag 18 februari 2012 21:26 schreef M.rak het volgende:
[..]
Nee, bij 40 Hz zou je twee stippen zien. Je moet de flitsfrequentie zien als de frequentie waarmee je een foto maakt. Bij 40 Hz maak je iedere 0.025 seconde een foto. In die 0.025 seconde heeft de stip precies een half rondje afgelegd (hij doet immers 0.05 seconde over een heel rondje). Je maakt dus eerst de eerste foto, dan zie je de stip op een bepaald punt, bij de volgende foto zie je hem een half rondje verder, bij de derde foto weer op het beginpunt, bij de vierde weer op het andere punt, enzovoorts... Je ziet dan dus twee stippen verschijnen.
Bij 21 Hz is het wat lastiger, je maakt dan iedere 0.0476 een foto, terwijl de stip er 0.05 seconde over doet om een heel rondje te maken. Als je de foto maakt heeft de stip dus nog net geen heel rondje gemaakt. Bij de eerste foto zien we de stip dus in z'n beginpunt, bij de tweede foto een beetje daaronder (aangenomen dat de schijf tegen de klok in roteert), bij de derde foto weer een beetje daaronder, enzovoorts. De stip lijkt dus tegen de draairichting van de schijf in te bewegen.
[ Bericht 97% gewijzigd door kutkloon7 op 01-03-2012 17:52:51 ]
Om een afstand, snelheid of tijd uit te rekenen, heb je dus formules. Maar welke eenheden moet ik dan gebruiken om ze toe ta passen?
Bijv: S=V x T. Als ik nou de gegevens heb, 10km en 25 minuten, welke eenheden moet ik dan gebruiken om de formule toe te passen? De minuten omrekenen naar uren?
Als je de afstand wil berekenen, moet je zorgen dat de tijdseenheid (bv. seconden) gelijk is aan de tijdseenheid in de snelheid (meter per seconde). Als je de tijd in uren vermenigvuldigt met de snelheid in meter per seconden gaat het fout. Als je de tijd in seconden vermenigvuldigt met de snelheid in meter per seconden krijg je de afstand in meters. Als je de tijd in seconden vermenigvuldigt met de snelheid in kilometers per seconden krijg je de afstand in kilometers.quote:Op woensdag 29 februari 2012 20:53 schreef datisstom het volgende:
Ik heb een hele simpele vraag die nú beantwoord moet worden.
Om een afstand, snelheid of tijd uit te rekenen, heb je dus formules. Maar welke eenheden moet ik dan gebruiken om ze toe ta passen?
Bijv: S=V x T. Als ik nou de gegevens heb, 10km en 25 minuten, welke eenheden moet ik dan gebruiken om de formule toe te passen? De minuten omrekenen naar uren?
In jouw geval, 10 km en 25 minuten, kan je de formule zo gebruiken. Je antwoord heeft dan als eenheid kilometer per minuut. Als je een andere eenheid van snelheid wil moet je de afstand en de tijd even omrekenen
Dat haal je uit de eenheid van de snelheid. De formule voor de tijd is t=s/v, als je de afstand in meters (m) hebt en de snelheid in meters per seconde (m/s), krijg je de tijd in seconden. Dat kan je zelf ook nagaan, vul de eenheden maar in in de formule: [t]=[s]/[v]=m/(m/s)=s. In deze notatie staat [t] voor de eenheid van tijd (in dit geval dus seconden).quote:Op woensdag 29 februari 2012 22:13 schreef datisstom het volgende:
En als je nou tijd berekent, hoe weet je dan welke eenheid je hebt berekend?
Bedankt, het is allemaal een stuk duidelijker nu ik wat slaap heb gehad.quote:Op woensdag 29 februari 2012 22:23 schreef M.rak het volgende:
[..]
Dat haal je uit de eenheid van de snelheid. De formule voor de tijd is t=s/v, als je de afstand in meters (m) hebt en de snelheid in meters per seconde (m/s), krijg je de tijd in seconden. Dat kan je zelf ook nagaan, vul de eenheden maar in in de formule: [t]=[s]/[v]=m/(m/s)=s. In deze notatie staat [t] voor de eenheid van tijd (in dit geval dus seconden).
Edit: bij nader inzien; 25 km / 10 m per seconde is 2,5 seconden.
[ Bericht 12% gewijzigd door datisstom op 01-03-2012 16:03:49 ]
Dat kan natuurlijk sowieso nooit, als je iedere seconde 10 meter aflegt, heb je in 2.5 seconden geen 10 km afgelegdquote:Op donderdag 1 maart 2012 15:54 schreef datisstom het volgende:
[..]
Bedankt, het is allemaal een stuk duidelijker nu ik wat slaap heb gehad.
Edit: bij nader inzien; 25 km / 10 m per seconde is 2,5 seconden.

snelheid: eenheid van afstand (L) / eenheid van tijd (T)
afstand: eenheid van afstand (L)
tijd: eenheid van tijd (T)
Nu moet je ervoor zorgen dat je voor de eenheid van afstand en voor de eenheid van tijd overal hetzelfde kiest. Kwestie van dimensieanalyse toepassen.
Als je zeker van je zaak wilt zijn reken je alles gewoon om naar SI-eenheden. Voor afstand is dat meters, voor tijd is dat seconden. Voor snelheid is het dan logischerwijs meter per seconde in SI.
Jouw voorbeeld:
25km -> 25.000 meter (SI)
10 m/s -> 10 m/s (SI)
Formule toepassen:
Achteraf kun je nog altijd omrekenen naar een andere eenheid indien dat gevraagd/nodig is.
Ik heb deze twee proeven gekregen:
Proef 1:
http://www.natuurkunde.nl(...)d=3&supportId=588151
^Het lijkt hierop.
De stippellijn is bij ons een statief, de hoek is niet gegeven, lengte van het touw was bij ons ook niet gegeven, het zwarte blokje waren bij ons 3 gewichtjes en de kracht naar rechts hebben we gemeten met een veerunster.
Nu moet ik voor mijn PO een hoofdstuke maken met meetfouten et cetera.
Maar ik weet niet precies wat voor onnauwkeurigheden ik hier gemaakt zou kunnen hebben.
Ik dacht zelf aan:
- Fout bij het meten van de hoek
- Fout bij het aflezen van de veerunster
- De veerunster niet helemaal horizontaal houden
Zijn er nog andere 'fouten' die bij deze proef veel voorkomend zijn?
-----
En dan nu proef 2 nog.
Deze leek een beetje hierop:
De driehoek bestaat uit een statief en een soort van 'rails' waar je een karretje op kan zetten. (hier afgebeeld als een rondje) bij ons ging het touwtje echter via de katrol omhoog en zat daar vast aan een veerunster. En dan moesten we verschillende hellingshoeken uitproberen en verschillend extra gewicht (aan het karretje vast), om te kijken hoeveel kracht er nodig was om het karretje op z'n plaats te houden.
Hierbij dacht ik aan deze mogelijke fouten:
- Onnauwkeurig aflezen van de veerunster
- De hellingshoek niet op de graad perfect afgemeten
Zijn er hier ook nog andere veel voorkomende 'fouten'?
Alvast bedankt voor jullie hulp.
Je verwaarloost de weerstand van de katrol, dat is ook een onnauwkeurigheid.quote:Op donderdag 8 maart 2012 16:34 schreef Miraculously het volgende:
Vraag je voor mijn PO Natuurkunde,
Ik heb deze twee proeven gekregen:
-----
En dan nu proef 2 nog.
Deze leek een beetje hierop:
[ afbeelding ]
De driehoek bestaat uit een statief en een soort van 'rails' waar je een karretje op kan zetten. (hier afgebeeld als een rondje) bij ons ging het touwtje echter via de katrol omhoog en zat daar vast aan een veerunster. En dan moesten we verschillende hellingshoeken uitproberen en verschillend extra gewicht (aan het karretje vast), om te kijken hoeveel kracht er nodig was om het karretje op z'n plaats te houden.
Hierbij dacht ik aan deze mogelijke fouten:
- Onnauwkeurig aflezen van de veerunster
- De hellingshoek niet op de graad perfect afgemeten
Zijn er hier ook nog andere veel voorkomende 'fouten'?
Alvast bedankt voor jullie hulp.
Oké, bedankt.quote:Op donderdag 8 maart 2012 16:38 schreef Jochemz het volgende:
[..]
Je verwaarloost de weerstand van de katrol, dat is ook een onnauwkeurigheid.
Dan zal ik dat er ook bij verwerken.
Zelf hadden we al het karretje iets omlaag getrokken en losgelaten om de weerstand te verminderen.
Zijn hier nog andere opties voor?
En dan heb ik nog een klein vraagje, in mijn opdracht staat dit:
'Bereken met behulp van de hellingshoek en het gewicht van het karretje de component van de zwaartekracht op het karretje langs het vlak en vergelijk deze met de gementen kracht'
Dat is dan toch m * g * sin(hoek)
Of heb ik het nu fout?
[ Bericht 32% gewijzigd door Miraculously op 08-03-2012 17:32:16 ]
Is mij en mijn ook assonantie?
Tuurlijk, er zit allebei een ij in, maar dit lijkt me niet helemaal het juist topicquote:Op donderdag 8 maart 2012 21:41 schreef TheOnion het volgende:
Waar is de alfa huiswerk vragen topic? Dan maar hier
Is mij en mijn ook assonantie?
Ontopic: als je een deelruimte van R3 hebt, bijvoorbeeld:
{(1, a, b)t : a,b uit R}
Mag je deze dan beschrijven als: de deelruimte van R3 die wordt opgespannen door (0, 1, 0)t en (0, 0, 1)t en (1, 0, 0)t bevat?
Daarvoor kan je beter in het wiskunde huiswerk- en vragentopic zijn denk ikquote:Op vrijdag 9 maart 2012 23:44 schreef kutkloon7 het volgende:
[..]
Tuurlijk, er zit allebei een ij in, maar dit lijkt me niet helemaal het juist topic.
Ontopic: als je een deelruimte van R3 hebt, bijvoorbeeld:
{(1, a, b)t : a,b uit R}
Mag je deze dan beschrijven als: de deelruimte van R3 die wordt opgespannen door (0, 1, 0)t en (0, 0, 1)t en (1, 0, 0)t bevat?
Dat is helemaal geen deelruimte!quote:Op vrijdag 9 maart 2012 23:44 schreef kutkloon7 het volgende:
[..]
Tuurlijk, er zit allebei een ij in, maar dit lijkt me niet helemaal het juist topic.
Ontopic: als je een deelruimte van R3 hebt, bijvoorbeeld:
{(1, a, b)t : a,b uit R}
Mag je deze dan beschrijven als: de deelruimte van R3 die wordt opgespannen door (0, 1, 0)t en (0, 0, 1)t en (1, 0, 0)t bevat?
Zit ik een beetje stoer te doen, met mijn ontopic... Haha, ik dacht dat dit het wiskundetopic was, sorryquote:Op vrijdag 9 maart 2012 23:49 schreef M.rak het volgende:
[..]
Daarvoor kan je beter in het wiskunde huiswerk- en vragentopic zijn denk ik. Maar als antwoord op je vraag, dat lijkt me niet, het opspansel wat jij geeft is namelijk de hele R3. Je kan het wel schrijven als (1,0,0)t plus het opspansel van (0, 1, 0)t en (0, 0, 1)t. Maar er zijn misschien handigere manieren om dat op te schrijven.
Verder bedoelde ik (ik had het iets duidelijker moeten verwoorden denk ik):
de deelruimte van R3 die wordt opgespannen door (0, 1, 0)t en (0, 0, 1)t,
en het punt (1, 0, 0) bevat. Maar dit mag dus niet, omdat de deelruimte die wordt opgespannen door (0, 1, 0) en (0, 0, 1) al per definitie (1, 0, 0) niet bevat?
Dit heb ik geïmplementeerd, maar volgens het automatische inleverprogramma geeft mijn programma nog het foute antwoord op sommige testinvoeren. Er is verder slechts een kleine voorbeeld in- en output beschikbaar, waar mijn programma wel gewoon de goede output voor levert. Ook op elke testinvoer die ik zelf bedenk levert mijn programma de goede output. Heeft iemand een idee wat ik nu kan doen? Ik heb het programma al een paar keer opnieuw geschreven, met hetzelfde resultaat.
Het programma hier posten en hopen dat iemand zin heeft om ernaar te kijken.quote:Op maandag 2 april 2012 18:34 schreef kutkloon7 het volgende:
Ik moet voor mijn studie een programma schrijven dat, gegeven een ongerichte gewogen graaf, een verzameling kanten geeft die, als je deze verwijdert, de graaf in twee componenten split. Er worden twee knopen gegeven die in een verschillend component moeten zitten. Dit heet een min-cut vinden (en is gerelateerd aan een max-flow vinden), en kan met de Ford-Fulkerson-methode.
Dit heb ik geïmplementeerd, maar volgens het automatische inleverprogramma geeft mijn programma nog het foute antwoord op sommige testinvoeren. Er is verder slechts een kleine voorbeeld in- en output beschikbaar, waar mijn programma wel gewoon de goede output voor levert. Ook op elke testinvoer die ik zelf bedenk levert mijn programma de goede output. Heeft iemand een idee wat ik nu kan doen? Ik heb het programma al een paar keer opnieuw geschreven, met hetzelfde resultaat.
Dus dan zou het of een fout in het automatisch nakijken van het practicum moeten zijn, een fout bij het gedeelte na het berekenen van de maxflow, of een fout die alleen voorkomt in een randgeval. Ik ga het gewoon aan de practicumleider vragen, die kan hopelijk wel bij de in- en output van mijn programma, want ik geloof niet dat er zo iets anders op zit.
Ik zou natuurlijk mijn code kunnen posten, maar er wordt automatisch gecontroleerd op fraude (ook op internet, zo is me verteld), en eerlijk gezegd denk ik niet dat het veel gaat helpen, aangezien mijn programma in alle testcases die ik gebruikt heb gewoon het goede antwoord geeft. Bovendien is het een behoorlijke lap tekst die niet al te elegant en begrijpelijk is geschreven (het was de 6e keer dat ik het programma overnieuw schreef, dan heb je een beetje schijt aan variabelennamen enzo).
Update:
Het is inmiddels gelukt, er was een waarde < 231. Ik dacht dat ik deze in een int kon opslaan, wat ook zo was, maar door de manier waarop ik de waarden opsloeg werd deze groter. Ik gebruik nu een uint en dat werkt
[ Bericht 7% gewijzigd door kutkloon7 op 04-04-2012 11:29:25 ]
Voor biologie moet ik een artikel schrijven over een proefje met groenten. Ik heb gekozen om het volgende te doen:
Ik heb 5 porties van 25 gram tuinbonen, die ik 5 minuten kook. Ik heb 5 oplossingen, een van 0 gram NaCl per liter, een van 5 g/L, 10 g/L, 15 g/L en 20 g/L. In elk van de oplossingen kook ik dus één portie tuinbonen. Na het koken, meet ik met een spectrometer de kleur van het gekookte water. De kleur van het water verandert omdat er chlorofyl vrijkomt. Mijn hypothese was dat elke oplossing dezelfde pieken en dalen zou hebben, omdat chlorofyl te groot is om door osmose in het water te komen, en omdat alles even lang kookt, zou er gewoon even veel chlorofyl uit de kapotte cellen moeten komen. Maar nu blijkt dat er echt verschil zit tussen de oplossingen, en ik kan geen verklaring vinden waarom het zout er effect op heeft.
Alvast heel erg bedankt voor de hulp!
Het zout zorgt vooral voor een andere osmotische waarde.
0,9 massa% NaCl is de standaard voor een isotone oplossing. Dat zou zijn 9 gram in 1 liter water. Voor planten weet ik niet zeker of dit dezelfde waarde is.
5 g/L is dan in ieder geval hypotoon
10 g/L is dan ongeveer isotoon
15 en 20 g/L zijn dan hypertoon
Omdat er een andere turgordruk is, zou je ook kunnen verwachten dat de celwanden op een ander moment kapot gaan.
Maar bedoel je met een verschil in pieken en dalen dat de pieken op een andere plaats zitten? Of dat de hoogte van deze pieken/dalen anders is?
Over het algemeen zijn chlorofyl a en chlorofyl b de meest voorkomende soorten, dat wist ik al, maar ik dacht dat als ik steeds dezelfde soort, en dezelfde portie bonen gebruik, dat dan dezelfde grafiek zou ontstaan. Over die pieken en dalen, ze zitten vooral op een andere hoogte, zie het plaatje
(0 g/L = rood; 5 g/L = blauw; 10 g/L = paars; 15 g/L = oranje; 20 g/L = groen; en er is geen rode lijn te zien omdat hij precies samenvalt met de blauwe)
http://www.filedropper.com/scheikundeallegrafieken
ik vond zelf dat de groene lijn erg lijkt op het absorptiespectrum van chlorofyl a en chlorofyl b
http://commons.wikimedia.org/wiki/File:Chlorophyll_ab_spectra.png
Ik vind je theorie eigenlijk wel heel logisch klinken, maar als je verder nog iets vindt/bedenkt hoor ik het natuurlijk graag
Heb je ook eiklijnen gemaakt? (Dus een keer door de spectroscoop met alleen het water en de verschillende schone zoutoplossingen)
Maar weet je zeker dat oranje de 15 g/L is, en rood de 0 g/L?
De rode lijn is bij mij trouwens een zwarte lijn...
Nu wordt in mijn boek gezegd dat het d moet zijn, omdat:quote:Under control conditions, flow through a blood vessel is 100 ml/min with a pressure gradient of 50 mm Hg. What would be the approximate flow through the vessel after increasing the vessel diameter by 50%, assuming the pressure gradient is maintained at 100 mm Hg?
a. 100 ml/min
b. 150 ml/min
c. 300 ml/min
d. 500 ml/min
e. 700 ml/min
Nou ben ik het hier mee eens, maar de druk stijgt toch ook van 50 mm Hg naar 100 mm Hg, en volgens de wet van Poiseuille stijgt de flow als je de drukgradient toe laat nemen. In het antwoord is daar geen rekening mee gehouden. Weet iemand waarom?quote:Blood flow in a vessel is directly proportional to the fourth power of the vessel radius. Increasing vessel diameter by 50% (1.5 times control) would increase blood flow 1.5 to the fourth power x normal blood flow (100 ml/min). Thus blood flow would increase to 100 ml/min * 5,06, or approximately 500 ml/min.
http://www.filedropper.com/allegrafieken
0 g/L = rood; 5 g/L = geel; 10 g/L = roze; 15 g/L = blauw; 20 g/L = lichtgroen
Het resultaat is er alleen niet veel logischer op geworden, vind ik, de pieken zitten nu wel op dezelfde plek, maar ik geloof niet dat hier conclusies uit getrokken kunnen worden...
Een paar mogelijke opties:
De celwanden zijn geen perfecte membramen, en laten dus ook chlorofyl door.
Bij een hypertone oplossing (0 en 5 g/L) zal er veel water, en dus ook veel chlorofyl door het membraam heen gaan.
Bij een isotone oplossing zal er vrijwel niets door het membraam heen gaan.
Maar wat die lichtgroen (20 g/L) nu zo relatief hoog doet...
Weet je zeker dat dit een scheikunde-practicum is? Ergens heb ik het gevoel dat er nog wat biologische factoren mee lijken te spelen (beschadiging van celwanden in te zoute omgeving etc.)
Eigenlijk vind ik alle lijnen wel logisch er uit zien ten opzichte van elkaar, want hoe meer chlorofyl er in het water zit, des te minder wordt er in het groen gedeelte licht geabsorbeerd, want er wordt meer groen licht weerkaatst. Dus dan zou er bij de hypertone oplossingen toch juist geen chlorofyl in het water komen? Of in ieder geval minder dan bij de sterkere oplosingen, want de hypertone oplossingen absorberen meer groen licht, dus bevat het water minder chlorofyl, toch?
Als wat ik zeg klopt, dan betekent het dat er bij de 5e oplossing om de een of andere reden er MINDER chlorofyl in het water is gekomen, dan bij de 4e lijn... En dat is het vreemdst, want door meer zout zou de celwand "meer kapot" moeten gaan, en zou er dus juist meer chlorofyl in het water moeten komen...
tijdens het oefenen van rekenopgaven scheikunde kwam ik bij deze vraag niet uit:
Gegeven butaanzuur / 20,00 mmol en dichtheid p= 0,9577 * 10-3 kg/m3
Bereken hoeveel microliter je nodig hebt ?
Eerst bereken ik de deeltjesmassa van butaanzuur:
C= 4 x 12,01 u
O= 2 x 16,00 u
H= 8 x 1,008 u
-------------------- +
88,104 u => Dus 88,104 g/mol
20,00 mmol = 0,02 mol => 0,02 mol x 88,104 g/mol = 1,76208 gram
Dichtheid: 0,95577 x 10-3 kg/m3
= 0,95577 x 10-3 g/L
0,9577 x 10-3 x 1,76208 g = 0,001687544 L
= 1687,544 microliter
Maar het antwoord klopt niet, dus kan iemand mijn denkwijze/rekenfout opsporen ?
Alvast bedankt
massa * dichtheid ?quote:Op zondag 8 april 2012 18:57 schreef Nutkicker22 het volgende:
Hey iedereen,
tijdens het oefenen van rekenopgaven scheikunde kwam ik bij deze vraag niet uit:
Gegeven butaanzuur / 20,00 mmol en dichtheid p= 0,9577 * 10-3 kg/m3
Bereken hoeveel microliter je nodig hebt ?
Eerst bereken ik de deeltjesmassa van butaanzuur:
C= 4 x 12,01 u
O= 2 x 16,00 u
H= 8 x 1,008 u
-------------------- +
88,104 u => Dus 88,104 g/mol
20,00 mmol = 0,02 mol => 0,02 mol x 88,104 g/mol = 1,76208 gram
Dichtheid: 0,95577 x 10-3 kg/m3
= 0,95577 x 10-3 g/L
0,9577 x 10-3 x 1,76208 g = 0,001687544 L
= 1687,544 microliter
Maar het antwoord klopt niet, dus kan iemand mijn denkwijze/rekenfout opsporen ?
Alvast bedankt
kg * kg/m^3 = kg^2/m^3
dus dat klopt hier niet
massa/dichtheid = volume

Het onderzoek bestaat hoofdzakelijk uit het meten van 3 variabelen, welke aan de hand van regressieanalyse zal worden uitgevoerd (spss). 1 van de variabelen (Var. X (sorry dubbel gedaan)) heeft een modererend effect
Ik had eerst dit: βx*βy=0 (of ongelijk aan 0). Maar dit is natuurlijk het interactie effect.
Wat is dan wel de juiste? (beta's zijn hier noodzakelijk btw)

Hieruit blijkt dat naarmate de interstitial fluid pressure positiever wordt, je meer lymph flow hebt. Dat vind ik echter onlogisch. Eerder staat in Guyton & Hall namelijk:quote:Figure 16-9 Relation between interstitial fluid pressure and lymph flow in the leg of a dog. Note that lymph flow reaches a maximum when the interstitial pressure, PT, rises slightly above atmospheric pressure (0 mm Hg). (Courtesy Drs. Harry Gibson and Aubrey Taylor.)
Dus bij een positieve waarde wordt de vloeistof juist in het bloedvat "geforceerd". Wie weet hoe dit zit?quote:The interstitial fluid pressure (Pif), which tends to force fluid inward through the capillary membrane when Pif is positive but outward when Pif is negative.
Nu moet ik ook andersom kunnen rekenen, dus vanuit de pH het aantal gram van een stof weten. En daar heb ik nogal moeite mee.
De opdracht is dit:
3 Liter Ca(OH)2 met een pH van 12,0, bereken het aantal gram.
Hoe bereken ik dit?
Met de pH waarde kun je de concentratie OH- bepalen, vervolgens kan je dan berekenen hoeveel mol Ca(OH)2 je hebt. Vermenigvuldigen met de molaire massa geeft het aantal gram Ca(OH)2quote:Op zaterdag 14 april 2012 11:10 schreef toetsenbordridder het volgende:
Hee, volgende week een scheikunde toets met 1 van de onderwerpen pH berekenen.
Nu moet ik ook andersom kunnen rekenen, dus vanuit de pH het aantal gram van een stof weten. En daar heb ik nogal moeite mee.
De opdracht is dit:
3 Liter Ca(OH)2 met een pH van 12,0, bereken het aantal gram.
Hoe bereken ik dit?
Dus 10^-2,0 (14-12=2). Dan je mol Ca(OH)2 bepalen? Kun je dat 1x voor doen? De molmassa van Ca(OH)2 = 74 g/molquote:Op zaterdag 14 april 2012 11:28 schreef Nelis89 het volgende:
[..]
Met de pH waarde kun je de concentratie OH- bepalen, vervolgens kan je dan berekenen hoeveel mol Ca(OH)2 je hebt. Vermenigvuldigen met de molaire massa geeft het aantal gram Ca(OH)2
[ Bericht 1% gewijzigd door toetsenbordridder op 14-04-2012 12:43:57 ]
pOH = 14 - pH = 14 - 12 = 2quote:Op zaterdag 14 april 2012 12:23 schreef toetsenbordridder het volgende:
[..]
Dus 10^-2,0 (14-12=2). Dan je mol Ca(OH)2 bepalen? Kun je dat 1x voor doen? De molmassa van Ca(OH)2 = 74 g/mol
COH- = 10-pOH = 10-2 mol/liter
CCa(OH)2 = 10-2 / 2 = 5 * 10-3 mol/liter
mCa(OH)2 = CCa(OH)2 * V * uCa(OH)2
mCa(OH)2 = 5 * 10-3 * 3 * 74 = 1.11 g
http://www.4beta.nl/wiki/index.php?title=Zuur-base_reacties
En dan vooral de eerste twee filmpjes.
Kijk dit is ook weer hartstikke goedquote:Op zaterdag 14 april 2012 16:19 schreef 4Beta het volgende:
Misschien iets te laat gereageerd, maar misschien heb je hier ook nog wat aan:
http://www.4beta.nl/wiki/index.php?title=Zuur-base_reacties
En dan vooral de eerste twee filmpjes.
Bereken de molariteit van 11 mg zuurstof in 1,0m3 slootwater
Molaire massa O : 16,00 g mol-1
11 mg : 11*10^-3 g
mol : (11*10^-3) / (16,00) : 6,875*10^-4 mol O
Opgelost in 1,0 m3 : 1,0*10^3 L
[O] : (6,875*10^-4) / (1,0*10^3) : 6,9*10^-7 M
O moet natuurlijk O2 zijn, dus mijn antwoord /2.
[ Bericht 8% gewijzigd door Miraculously op 17-04-2012 16:24:44 ]
Klopt helemaal. Alleen het ziet er wat onoverzichtelijk uit omdat je : gebruikt in plaats van =
ja sorry. de : was makkelijker via mijn telefoon. lBedankt voor je antwoord.quote:Op dinsdag 17 april 2012 17:24 schreef 4Beta het volgende:
@Miraculously
Klopt helemaal. Alleen het ziet er wat onoverzichtelijk uit omdat je : gebruikt in plaats van =
Curie hoofdstuk 6, 4 vwo scheikunde. Opdracht 19bquote:Op dinsdag 17 april 2012 15:25 schreef Miraculously het volgende:
Kan iemand mij vertellen of ik deze opdracht goed gemaakt heb?
Bereken de molariteit van 11 mg zuurstof in 1,0m3 slootwater
Molaire massa O : 16,00 g mol-1
11 mg : 11*10^-3 g
mol : (11*10^-3) / (16,00) : 6,875*10^-4 mol O
Opgelost in 1,0 m3 : 1,0*10^3 L
[O] : (6,875*10^-4) / (1,0*10^3) : 6,9*10^-7 M
O moet natuurlijk O2 zijn, dus mijn antwoord /2.
Ik snap dat sommetje niet echt. (p1 * V1) : (n1 * T1) = (p2 * V2) : (n2 * T2)
p is druk
V is volume
n is aantal mol gas
T is temperatuur
Voorbeeld som:
Magnesium reageert met verdund zwavelzuur. Hierbij ontstaat waterstofgas in de molverhouding 1 : 1. Je wilt 100,0 cm^3 waterstof maken. Een lengte van 1,00 magnesiumband heeft een massa van 0,0108 gram.
a) Bereken het molaire gasvolume bij 20 graden C
b) Bereken hoeveel cm magnesiumband je moet nemen.
Wieowie kan mij helpen?!
Als je die formule wilt toepassen, heb je toch echt de druk nodig...
Bij de tweede formule is ook weer de ideale gaswet niet echt handig van toepassing...
Dit is gewoon basis chemisch rekenen.
Omdat ik niet zomaar iemand zijn huiswerk ga maken, hier een variant op de opgave (laatste stuk is eruit, zoutzuur ipv zwavelzuur, maar je moet het idee denk ik wel kunnen begrijpen zo.
Molair volume is overigens gewoon het aantal liters per mol. Bij de meeste gassen ongeveer 22 liter per mol bij 273K.
[ Bericht 27% gewijzigd door 4Beta op 22-04-2012 16:58:02 ]
Vm is dan 2.45 *10^-2 m3 / mol * 293/298 = 24,1 dm3 / mol
Hoeveel gram bevat de volgende oplossing:
5 ml H2SO4 met een dichtheid van 1,8 g/ml, zuiverheid 55 m/m%
molmassa H2SO4 = 98 g
Dit is wat ik doe:
V*dichtheid=Massa
5*1,8=9
Massa/100(procent)*55(procent zuiverheid)
=4,95 gram
Klopt dit?
Ja, prima!quote:Op maandag 23 april 2012 19:23 schreef toetsenbordridder het volgende:
Hoe reken ik deze uit? (jaha daar ben ik weer)
Hoeveel gram bevat de volgende oplossing:
5 ml H2SO4 met een dichtheid van 1,8 g/ml, zuiverheid 55 m/m%
molmassa H2SO4 = 98 g
Dit is wat ik doe:
V*dichtheid=Massa
5*1,8=9
Massa/100(procent)*55(procent zuiverheid)
=4,95 gram
Klopt dit?
bereken αHA voor het zuur HA met een pKA = 5 bij de volgende ph-waarden:3.0; 3.5.
Alvast heel erg bedankt.
Vraagstuk:
Hierbij wat extra gegevens.quote:Een van den grootste onzekerheden waar Uit Den Bogt me geconfronteerd wordt bij het beslissen over de aanschaf van de bussen betreft de brandstofkosten. De complementaire kosten van een bus bestaan voor een groot gedeelte uit brandstofkosten.
Bepaal bij welke hoogte van de complementaire kosten de NCW van één bus precies nul is (in Excel).
Ik weet dat ik hiervoor de functie "goal seek" kan gebruiken maar weet niet hoe.quote:*Cashflows zijn de contante ontvangsten en uitgaven.
*Contante waarde van de cashflows zijn de huidige waarde (tijdstip 0) van de toekomstige cashflows.
*Netto contante waarde is het verschil tussen het contante bedrag van de verwachte opbrengsten (cashflows) van een investeringsproject en het opgerente bedrag van de investeringen. (NCW= CW cashflows - investeringsbedrag)
Screenshots van sheets:
SPOILER[ afbeelding ]
SPOILER[ afbeelding ]
SPOILER[ afbeelding ]
Maar als ik een X bedrag complementaire kosten zoek, kan ik de IRR niet berekenen omdat ik de cashflow niet weet toch?quote:Met de interne rentevoet wordt het percentage bepaald waarmee we de cashflows contant moeten maken om een netto contante waarde van nul te krijgen.
Als ik de IRR toepas op de volgende cashflows:
Kom ik uit op een percentage van 73%.quote:-400000 (aanschafprijs)
¤ 348.458 (ontvangsten bus)
¤ 348.458
¤ 348.458
¤ 150.000 (restwaarde)
Kan ik de complementaire kosten (cashflow) contant maken met die 73% en daarvan de investeringsbedrag (400k) aftrekken, om op NCW=0 uit te komen?. Maar ik kan dit toch niet contant maken omdat ik niet weet op welk tijdstip ik zit op dat moment?
Hoe hoog moeten de complementaire kosten moeten zijn voor ncw=0?
SPOILERAls geldt: ncw=cw cashflows - investeringbedrag
Zijn de contante waarde complementaire kosten dan niet gewoon 400k?
[ Bericht 4% gewijzigd door #ANONIEM op 25-04-2012 14:30:11 ]
CH3CH=CHCH(CH3)2
Is bovenstaande 2-methylbutaan?
is die dubbele binding niet voor de methylgroep?quote:Op vrijdag 27 april 2012 12:50 schreef Anoonumos het volgende:
Er staat een dubbele binding, dus de naam is iets met buteen i.p.v. butaan.
Je kunt voor de juiste naamgeving het best beginnen met de langste koolstofketen. In dit geval bevat de langste keten vijf aaneengeschakelde koolstofatomen en bovendien nog een dubbele binding. Dat betekent dat de stofnaam eindigt op penteen. De dubbele binding bevindt zich tussen het 2e en 3e koolstofatoom. Dat geven we in de stofnaam weer door het laagste cijfer van de koolstofatomen waartussen de dubbele binding zich bevindt voor de stofnaam te zetten: 2-penteen. Ten slotte is er nog een methylgroep die geen deel uitmaakt van de langste koolstofketen. Deze benoemen we apart samen met het cijfer van het koolstofatoom waarmee deze groep verbonden is: 4-methyl-2-penteen.quote:Op vrijdag 27 april 2012 13:29 schreef daantje1044 het volgende:
[..]
is die dubbele binding niet voor de methylgroep?
Hiermee volgt men in Nederland overigens de Duitse naamgeving. In Engelstalige literatuur zul je zien dat de locatie van de dubbele binding anders wordt geplaatst: 4-methylpent-2-ene.
[ Bericht 4% gewijzigd door lyolyrc op 27-04-2012 14:20:30 ]
Dank je wel voor de duidelijke uitleg! Blijf het lastig vinden de naamgeving.quote:Op vrijdag 27 april 2012 14:11 schreef lyolyrc het volgende:
[..]
Je kunt voor de juiste naamgeving het best beginnen met de langste koolstofketen. In dit geval bevat de langste keten vijf aaneengeschakelde koolstofatomen en bovendien nog een dubbele binding. Dat betekent dat de stofnaam eindigt op penteen. De dubbele binding bevindt zich tussen het 2e en 3e koolstofatoom. Dat geven we in de stofnaam weer door het laagste cijfer van de koolstofatomen waartussen de dubbele binding zich bevindt voor de stofnaam te zetten: 2-penteen. Ten slotte is er nog een methylgroep die geen deel uitmaakt van de langste koolstofketen. Deze benoemen we apart samen met het cijfer van het koolstofatoom waarmee deze groep verbonden is: 4-methyl-2-penteen.
Hiermee volgt men in Nederland overigens de Duitse naamgeving. In Engelstalige literatuur zul je zien dat de locatie van de dubbele binding anders wordt geplaatst: 4-methylpent-2-ene.
Veel oefenen helpt (al is dat natuurlijk gemakkelijker gezegd dan gedaan). Verder zou ik je aanraden om bij dit soort opgaven de structuur eerst uit te tekenen. Dan kun je gemakkelijker bepalen wat de langste koolstofketen is en wat de substituenten (zijgroepen) zijn en aan welk koolstofatoom ze zich bevinden.quote:Op vrijdag 27 april 2012 14:45 schreef daantje1044 het volgende:
[..]
Dank je wel voor de duidelijke uitleg! Blijf het lastig vinden de naamgeving.
En als je er niet uitkomt of je wil graag even controle van je antwoord, dan gewoon hier posten.
Als ik nog meer vragen heb, zal ik ze zeker stellen.
Uit het chemisch evenwicht KA = [H+]*[A- ] / [HA]quote:Op woensdag 25 april 2012 13:47 schreef jouwkeuze het volgende:
Hoe kan ik het volgende berekenen?
bereken αHA voor het zuur HA met een pKA = 5 bij de volgende ph-waarden:3.0; 3.5.
Alvast heel erg bedankt.
is direct de Henderson-Hasselbalch vgl. voor pH-buffers af te leiden door aan beide zijden de -10Log te nemen. Je krijgt dan pKA = pH - 10Log([A- ] / [HA]). Aangezien pH en pKa al gegeven zijn en [H+] in het geval van een monoprotisch zuur gelijk moet zijn aan [A- ], kan je direct de concentratiebreuk en daarmee de verhouding ts [H+] en [A- ] berekenen en met de al bekende [A- ] ook meteen [HA] berekenen. Vervolgens bereken je de dissociätie alpha door [H+] op de formele concentratie [HA], oftewel de som van [A- ] + [H+], te delen.
Volgens mij geldt hier datquote:Op zaterdag 28 april 2012 04:59 schreef VanishedEntity het volgende:
[..]
Uit het chemisch evenwicht KA = [H+]*[A- ] / [HA]
is direct de Henderson-Hasselbalch vgl. voor pH-buffers af te leiden door aan beide zijden de -10Log te nemen. Je krijgt dan pKA = pH - 10Log([A- ] / [HA]). Aangezien pH en pKa al gegeven zijn en [H+] in het geval van een monoprotisch zuur gelijk moet zijn aan [A- ], kan je direct de concentratiebreuk en daarmee de verhouding ts [H+] en [A- ] berekenen en met de al bekende [A- ] ook meteen [HA] berekenen. Vervolgens bereken je de dissociätie alpha door [H+] op de formele concentratie [HA], oftewel de som van [A- ] + [H+], te delen.
Verder weten we dat
En uit de evenwichtsvoorwaarde
Substitueren van de vergelijkingen voor [HA] en [A-] geeft:
[ Bericht 0% gewijzigd door lyolyrc op 30-04-2012 11:51:11 (typo) ]
inclusief de afronding klopt de berekening wel in ieder gevalquote:Op dinsdag 17 april 2012 15:25 schreef Miraculously het volgende:
Kan iemand mij vertellen of ik deze opdracht goed gemaakt heb?
Bereken de molariteit van 11 mg zuurstof in 1,0m3 slootwater
Molaire massa O : 16,00 g mol-1
11 mg : 11*10^-3 g
mol : (11*10^-3) / (16,00) : 6,875*10^-4 mol O
Opgelost in 1,0 m3 : 1,0*10^3 L
[O] : (6,875*10^-4) / (1,0*10^3) : 6,9*10^-7 M
O moet natuurlijk O2 zijn, dus mijn antwoord /2.
maar overzichtelijk is anders
hexeenquote:Op vrijdag 27 april 2012 12:42 schreef daantje1044 het volgende:
Ik heb een vraag over naamgeving. Weet niet zeker of ik deze goed heb.
CH3CH=CHCH(CH3)2
Is bovenstaande 2-methylbutaan?
4-Methylpent-2-ene
quote:
Voor hexeen moet de langste keten 1 dubbele binding en 6 koolstofatomen bevatten en dat is hier niet het geval. Er is hier sprake van een keten van 5 koolstofatomen en 1 dubbele binding met een methyl substituent.
quote:Op dinsdag 1 mei 2012 20:04 schreef boyv het volgende:
en als je specifieker wilt zijn
4-Methylpent-2-ene
Zoals ik hier ook al beredeneerde.
Wat zijn de frequentie en trillingstijd van een zuiver C?
Ik zou bij god niet weten hoe ik dit moet uitrekenen, het staat onder het kopje internetvragen maar een hoop gegoogel levert alleen een octavering met een heleboel verschillende frequenties op. Kan iemand me verder helpen?
Hoezo zou je dat dan moeten uitrekenen? Volgens mij moet je de frequentie gewoon opzoeken en de reciproke waarde daarvan nemen geeft de trillingstijd.quote:Op zondag 13 mei 2012 13:53 schreef datisstom het volgende:
Ik voel me nu heel stom in dit topic met bovenstaande vragen, maargoed. Ik moet een verslag schrijven voor natuurkunde, en nu zit de volgende vraag erin:
Wat zijn de frequentie en trillingstijd van een zuiver C?
Ik zou bij god niet weten hoe ik dit moet uitrekenen, het staat onder het kopje internetvragen maar een hoop gegoogel levert alleen een octavering met een heleboel verschillende frequenties op. Kan iemand me verder helpen?
Nu moet ik alle reactievergelijkingen die bij deze synthese voorkomen geven.
Ik heb deze:Fe + H2SO4 ---> FeSO4 +H2
Maar zouden er dan meer moeten zijn?
Het is fe2? Toch?quote:Op vrijdag 25 mei 2012 16:28 schreef daantje1044 het volgende:
Ik heb weer een vraag, ik moet een synthese van ijzersulfaat voorbereiden. Ijzer uit spijkers moet ik met behulp van zwavelzuur omzetten in ijzersulfaat.
Nu moet ik alle reactievergelijkingen die bij deze synthese voorkomen geven.
Ik heb deze:Fe + H2SO4 ---> FeSO4 +H2
Maar zouden er dan meer moeten zijn?
Mijn vraag, hieronder spreekt eigenlijk voor zich, kom niet uit de volgende vragen en ben er eigenlijk al de hele dag mee bezig, wellicht voor velen gesneden koek...
http://www.mijnbestand.nl/Bestand-3VP486ELFN6L.jpg
http://www.mijnbestand.nl/Bestand-BJNTMOA7HHOQ.jpg
Kan iemand mij op weg helpen richting de antwoorden? Ik weet niet wat ik moet vermenigvuldigen/delen etc...
mijn dank is groot!
Je antwoord is goed. Wellicht bedoelen ze dat je de halfreacties ook moet geven en dan samenvoegen tot de formule die je nu al hebt opgeschreven.quote:Op vrijdag 25 mei 2012 16:28 schreef daantje1044 het volgende:
Ik heb weer een vraag, ik moet een synthese van ijzersulfaat voorbereiden. Ijzer uit spijkers moet ik met behulp van zwavelzuur omzetten in ijzersulfaat.
Nu moet ik alle reactievergelijkingen die bij deze synthese voorkomen geven.
Ik heb deze:Fe + H2SO4 ---> FeSO4 +H2
Maar zouden er dan meer moeten zijn?
de ene keer moet ik deze echt uitrekenen, en met een 2e set moet ik dit grafisch doen.
Diegene die ik moet uitrekenen gaat als volgt :
{
{
Je moet die oplossen met de "plus" methode ofzo. Maar ik snap niet hoe die werkt
De 2e die je grafisch moet oplossen ziet er zo uit:
Een beetje een grote vraag maar ik hoop dat iemand het uit wil leggen
Beter hanteer je simpele elementaire algebraïsche technieken voor 2 vergelijkingen met 2 onbekenden. Het principe berust op het feit dat je 1 variabele als functie van de ander schijft en die functie dan in de andere vergelijking voor de eerste variabele inplugt. Met de eerste opgave als voorbeeld krijgen we:
2x - y = 8 ^ 3x + 2y =5
^ Staat nu niet voor machtsverheffen maar voor de logische EN
We kunnen dus ook direct schrijven 2x - 8 = y ^ 3x + 2y =5
en dus kunnen we direct 2x - 8 voor y inpluggen in 3x + 2y = 5
wat ons 3x + 4x - 16 = 5 oplevert
verder oplossen geeft:
7x - 16 = 5
7x - 21 = 0
7x = 21
x=3
plug nu in de eerste vgl 2x - y = 8 de waarde 3 die je zojuist hebt gevonden voor x:
2*3 - y = 8
6 -y = 8
-y = 2
y = -2
Voor de tweede opgave die grafisch (hoe verzinnen ze het
x+y = 9 => x + y - 9 = 0 => x - 9 = -y => 9 - x = y
2y - 4x = -6 => 2y = -6 + 4x => 2y = 4x - 6 => y = 2x - 3
Als je deze lineaire vgl's in een cartestisch coördinatenstelsel tekent is direct het snijpunt (en géén, ik herhaal, géén kruispunt) zichbaar. Maar een beetje maths geek prefereert altijd een analytische oplossing.
x+y=9 => y = 9-x
2y-4x = -6 ^ y = 9-x => 2*(9-x) - 4x = -6 => 18-2x-4x = -6 => 18-6x = -6 => 3-x=1 => 4-x=0 => x=4
x+y=9 ^ x=4 => 4+y=9 => y=5
Het snijpunt is dus (4,5)
EDIT: fout verbeterd.
[ Bericht 14% gewijzigd door VanishedEntity op 28-05-2012 21:48:40 ]
ok, ik begin even bij de 2e omdat die me het makkelijkste lijkt. Echter, weet je zeker dat dat goed zit?quote:Op maandag 28 mei 2012 21:19 schreef VanishedEntity het volgende:
Meh, oplossen met de plus-methode... klinkt als de zoveelste pikkepoelie-onzin rechtstreeks uit de koker van de PABO-mutsjes die zich door kinders van groep 8 eruit laten staartdelen
Beter hanteer je simpele elementaire algebraïsche technieken voor 2 vergelijkingen met 2 onbekenden. Het principe berust op het feit dat je 1 variabele als functie van de ander schijft en die functie dan in de andere vergelijking voor de eerste variabele inplugt. Met de eerste opgave als voorbeeld krijgen we:
2x - y = 8 ^ 3x + 2y =5
^ Staat nu niet voor machtsverheffen maar voor de logische EN
We kunnen dus ook direct schrijven 2x - 8 = y ^ 3x + 2y =5
en dus kunnen we direct 2x - 8 voor y inpluggen in 3x + 2y = 5
wat ons 3x + 4x - 16 = 5 oplevert
verder oplossen geeft:
7x - 16 = 5
7x - 21 = 0
7x = 21
x=3
plug nu in de eerste vgl 2x - y = 8 de waarde 3 die je zojuist hebt gevonden voor x:
2*3 - y = 8
6 -y = 8
-y = 2
y = -2
Voor de tweede opgave die grafisch (hoe verzinnen ze het
) opgelost dient te worden moet je beide leden van het stelsel van vergelijkingen omschrijven naar de algemene versie v/d lineaire vergelijking ax + b = y . Here goes.
x+y = 9 => x + y - 9 = 0 => x - 9 = -y => 9 - x = y
2y - 4x = -6 => 2y = -6 + 4x => 2y = 4x - 6 => y = 2x - 3
Als je deze lineaire vgl's in een cartestisch coördinatenstelsel tekent is direct het snijpunt (en géén, ik herhaal, géén kruispunt) zichbaar. Maar een beetje maths geek prefereert altijd een analytische oplossing.
x+y=9 => y = 9-x
2y-4x = -6 ^ y = 9-x => 2*(9-x) - 4x = -6 => 18-2x-4x = -6 => 18-6x = -6 => 3-x=1 => 2-x=0 => x=2
x+y=9 ^ x=2 => 2+y=9 => y=7
Het snijpunt is dus (2,7)
Kan je die eerste niet omschrijven van
x+y=9 naar y= -x+9 ? wat je dus een lijn geeft die bij y= +9 de y kruist?
Wat je dus een kruisingspunt van x = 4 en Y = 5 geeft?
Kan het mis hebben hoor. Ik snap het nog maar half.
Ik zit zelf ook al te kijken waar de fout zit, maargoed, de gehanteerde techniek en principes blijven staan. ff wachten, pak pen en papier erbij.quote:Op maandag 28 mei 2012 21:36 schreef gogosweden het volgende:
[..]
ok, ik begin even bij de 2e omdat die me het makkelijkste lijkt. Echter, weet je zeker dat dat goed zit?
Kan je die eerste niet omschrijven van
x+y=9 naar y= -x+9 ? wat je dus een lijn geeft die bij y= +9 de y kruist?
Wat je dus een kruisingspunt van x = 4 en Y = 5 geeft?
Kan het mis hebben hoor. Ik snap het nog maar half.
EDIT: fout gevonden; het moet zijn 18-6x = -6 => 3-x = -1 => 4-x = 0 => 4=x
wat dus daarna x+y=9 ^ x=4 => 4+y=9 => y=5 oplevert. Je had eerder dan mij de correcte coördinaten van het snijpunt (engels: point of intersection) gevonden dus je bent al goed op weg om het te snappen. En idd, y = 9-x is idd hetzelfde als y = -x + 9.
[ Bericht 0% gewijzigd door VanishedEntity op 28-05-2012 21:53:13 ]
ja is goedquote:Op maandag 28 mei 2012 22:06 schreef VanishedEntity het volgende:
Just throw us another one als je iets nog niet snapt.
Enorm bedankt voor je hulp!
Frequentie van zuivere noten staan in de Binas, tabel 15 geloof ik. Met 'frequentie = 1/trillingstijd' kun je dan de trillingstijd bepalen. (staat ook in B-35)quote:Op zondag 13 mei 2012 13:53 schreef datisstom het volgende:
Ik voel me nu heel stom in dit topic met bovenstaande vragen, maargoed. Ik moet een verslag schrijven voor natuurkunde, en nu zit de volgende vraag erin:
Wat zijn de frequentie en trillingstijd van een zuiver C?
Ik zou bij god niet weten hoe ik dit moet uitrekenen, het staat onder het kopje internetvragen maar een hoop gegoogel levert alleen een octavering met een heleboel verschillende frequenties op. Kan iemand me verder helpen?
De plusmethode is zeker dat je ze bij elkaar optelt en dat er dan wat tegen elkaar weg valt. Je kan het stelsel schrijven alsquote:Op maandag 28 mei 2012 21:06 schreef gogosweden het volgende:
Ok, ik heb morgen een mondeling examen over 2 vragen waar ik de ballen niet van snap. Dus ik hoop dat jullie het wat beter kunnen uitleggen. Ik moet een systeem met 2 lijnen "oplossen" (dus uitrekenen waar die 2 lijnen kruizen)
de ene keer moet ik deze echt uitrekenen, en met een 2e set moet ik dit grafisch doen.
Diegene die ik moet uitrekenen gaat als volgt :
{
{
Je moet die oplossen met de "plus" methode ofzo. Maar ik snap niet hoe die werkt
De 2e die je grafisch moet oplossen ziet er zo uit:
Een beetje een grote vraag maar ik hoop dat iemand het uit wil leggen
4x - 2y = 16
3x + 2y = 5
De linker en rechterkanten bij elkaar optellen geeft
7x = 21
x = 3
Vervolgens kan je x=3 invullen in (1) of in (2) om y te berekenen.
Gaat een stuk sneller.
Voor de tweede, schrijf het stelsel als:
4x + 4y = 36
-4x + 2y = -6
---------------------+
6y=30
Dus y=5. En dan weer invullen om x te berekenen.
Gegeven een goal (voetbal). Kracht van 1000 N precies op het midden naar beneden (-1000N dus). Doel is 7,32 m breed en 2,44 m hoog. De goal staat dus vast aan de grond.

Gevraagd: Reactiekrachten en moment om Z in A.
Fy = 500N (logisch)
Nu geeft ANSYS aan voor Fx = -481 N en Mz = 391.78 Nm.
Nu kom ik zelf op een veel groter moment uit, mijn FBD methode mist nog iets.
Weet een van jullie dat hier?
Vroeger op de basisschool had je weleens vragen als:
Nu krijg ik de vraag:quote:Een gevuld bad loopt leeg in 8 minuten. De linker kraan vult het bad in 12 minuten en de rechter kraan vult het bad in 6 minuten. Als de stop eruit is hoelang duurt het als beide kranen open staan om het bad te vullen?
Antwoord: in 8 minuten
Kan iemand mij dit uitleggen? (En dan vooral waarom ik er bij bovenstaande vraag vanuit mag gaan dat de hoogte constant blijft, zoals in het antwoord wordt aangenomen.)quote:Een rechthoekige badkuip heeft een constante doorsnede over de hoogte. Als de kraan wijd open staat en de afvoer gesloten is, stroomt het bad in 20 minuten vol. De waterhoogte is dan 50 cm. Het tot deze hoogte gevulde bad loopt bij gesloten kraan leeg in 32 min, via afvoer in de bodem. Hoe hoog zal het water in het bad staan als zowel kraan als afvoer open staan?
Antwoord: 32 cm
Correctie, dat stroom in = stroom uit.
[ Bericht 2% gewijzigd door Ofresca op 30-05-2012 14:55:18 ]
Omdat, als niet geldt stroom in = stroom uit, het waterpeil nog 'aan het veranderen' is (en dus niet constant). Als er meer water bijkomt dan er uitstroomt, zal het waterpeil stijgen en omgekeerd.quote:Op woensdag 30 mei 2012 14:41 schreef Ofresca het volgende:
Hellllppp, mijn wereld staat op de kop.
Vroeger op de basisschool had je weleens vragen als:
[..]
Nu krijg ik de vraag:
[..]
Kan iemand mij dit uitleggen? (En dan vooral waarom ik er bij bovenstaande vraag vanuit mag gaan dat de hoogte constant blijft, zoals in het antwoord wordt aangenomen.)
Correctie, dat stroom in = stroom uit.
Ze hebben het in de vraag inderdaad niet genoemd, maar ze willen dus eigenlijk de hoogte weten waar het water 'naar toe gaat'. De evenwichtstoestand, als het ware (God wat ben ik slecht in dit soort dingen formuleren
Maar waarom mag ik er vanuit gaan dat die er is? Stel nou dat het bad wel zou overstromen, dan zou hoogte zeker (er valt een kwartje) > 50 cm zijn?quote:Op woensdag 30 mei 2012 15:23 schreef kutkloon7 het volgende:
[..]
Omdat, als niet geldt stroom in = stroom uit, het waterpeil nog 'aan het veranderen' is (en dus niet constant). Als er meer water bijkomt dan er uitstroomt, zal het waterpeil stijgen en omgekeerd.
Ze hebben het in de vraag inderdaad niet genoemd, maar ze willen dus eigenlijk de hoogte weten waar het water 'naar toe gaat'. De evenwichtstoestand, als het ware (God wat ben ik slecht in dit soort dingen formuleren)
Ja, en als ie leeg zou lopen zou er een negatieve hoogte uit komen.quote:Op woensdag 30 mei 2012 15:29 schreef Ofresca het volgende:
[..]
Maar waarom mag ik er vanuit gaan dat die er is? Stel nou dat het bad wel zou overstromen, dan zou hoogte zeker (er valt een kwartje) > 50 cm zijn?
Volgens mij moet je er trouwens van uitgaan dat de uitstroomsnelheid evenredig is met de hoeveelheid water, dan kan je een differentiaalvergelijking opstellen.
Het water stijgt niet meer als de uitstroom via de afvoer gelijk is aan de instroom vanuit de kraan. Kennelijk is het de bedoeling dat je aanneemt dat de uitstroomsnelheid evenredig is met de hoogte van het water in het bad, zodat de uitstroomsnelheid dus toeneemt naarmate het bad zich vult. Maar dan nog is de opgave niet op te lossen met de gegevens die je hebt gekregen.quote:Op woensdag 30 mei 2012 15:29 schreef Ofresca het volgende:
[..]
Maar waarom mag ik er vanuit gaan dat die er is? Stel nou dat het bad wel zou overstromen, dan zou hoogte zeker (er valt een kwartje) > 50 cm zijn?
Stel t drukt de tijd uit in minuten, en h(t) is de hoogte van de waterstand in het bad in cm op tijdstip t. De instroom vanuit de kraan is constant, en aangezien in 20 minuten het bad is gevuld en de hoogte van de waterstand dan 50 cm bedraagt, komt er 2,5 cm water per minuut bij, zodat voor het vullen van het bad met gesloten afvoer dus geldt h(t) = 2,5∙t, en dus h'(t) = 2,5. Voor het laten leeglopen van het bad (kraan dicht) geldt dat h'(t) negatief is, en evenredig met h(t), dus h'(t) = -c∙h(t). Aangezien we beginnen met een leeg bad, dus h(0) = 0, krijgen we dan voor de combinatie van het laten vullen van het bad en het laten wegstromen van het water via de afvoer de volgende differentiaalvergelijking:
h'(t) = 2.5 - c∙h(t), h(0) = 0
De oplossing van deze DV is:
h(t) = (2,5 - 2,5∙e-ct)/c
Het badwater kan dus niet hoger stijgen dan tot een hoogte 2,5/c. Alleen zie ik niet hoe je met de gegevens uit de opgave c zou moeten bepalen.
[ Bericht 0% gewijzigd door Riparius op 30-05-2012 17:07:32 ]
Met behulp van de Bernoulli-vergelijking voor stroomlijnen bereken je dat v = sqrt(29 * h), ervan uitgaande dat de druk over een meter ongeveer gelijk is.
Dan stel je een massa-balans op: dM/dt = phi_M,in - phi_M,uit
Wanneer de afvoer dicht is, is de stroom phi_v,in = (A * H) / t_0
Dit volgt van dM/dt = phi_v,in * rho
<=> d/dt (A*h) = phi_v,in
<=> A * h = phi_v,in * t + c
t = 0 => h = 0 <=> c = 0
t = t_0 => h = H <=> phi_v = A*H / t_0
Wanneer de afvoer open is, is de stroom phi_v,uit = - rho * v * A_1
Dus:
d/dt rho * A * h (= M) = - rho * v * A_1
<=>
2 h^(1/2) = sqrt(29) A_1 / A * t + c
Op t = 0, h = H => c = 2 * H^(1/2)
Op t = t_1, h = 0 => A_1 = 2*H^(1/2) * A / (sqrt(29) * t_1)
Wanneer beide open zijn wordt phi_v,in = phi_v,uit
A * H/t_0 = sqrt(29*h) * A_1
Voordat je slapeloze nachten krijgt.SPOILERA = Oppervlakte van het bad
A_1 = Doorsnede van de afvoerbuis
h = Hoogte
H = 0,50 meter
t_0 = 20
t_1 = 32
rho = Dichtheid van water
v = Stroomsnelheid door de afvoer
[ Bericht 0% gewijzigd door Ofresca op 30-05-2012 18:57:53 ]

