SES School, Studie en Onderwijs
Wiskunde in de brugklas, Frans voor het examen of een studie Personeel en Arbeid? Moeilijke formulieren van DUO? Iets weten over studiefinanciering of studentenverenigingen? Dit is het forum voor leerkrachten, scholieren en studenten, van brugklas tot uni



Hoi,
Ik heb een vraagje
Wat bedoelen ze eigenlijk met: in viervoud inleveren?
Bedoelen ze misschien in 4 kopietjes inleveren? Alvast bedankt voor je antwoord
groet,
Ik heb een vraagje
Wat bedoelen ze eigenlijk met: in viervoud inleveren?
Bedoelen ze misschien in 4 kopietjes inleveren? Alvast bedankt voor je antwoord
groet,


Je mag niet meer radenquote:Op maandag 26 september 2011 18:01 schreef superky het volgende:
Hoi,
Ik heb een vraagje
Wat bedoelen ze eigenlijk met: in viervoud inleveren?
Bedoelen ze misschien in 4 kopietjes inleveren? Alvast bedankt voor je antwoord
groet,
Viervoud betekent niets anders dan 4 (identieke) exemplaren van een document.


Ik heb een vraag over een titratie die ik moet doen. Ik moet het mierenzuurgehalte bepalen in wc-
eend.
Nu is de vraag:
Leid zelf een berekenigsformule af voor het berekenen van het mierenzuurgehalte% (m/m) in Wc-eend. Bereken hoeveel gram wc-eend moet worden afgewogen voor een natronloogverbruik van ca. 30 ml. (concentratie NaOH = ca. 0,1 mol/l).
reactievergelijking: HCOOH + OH ------> Hcoo + H2O
Ik snap de hele vraag niet, en heb geen idee wat ik moet doen. Wie kan me op weg helpen?
Alvast bedankt
eend.
Nu is de vraag:
Leid zelf een berekenigsformule af voor het berekenen van het mierenzuurgehalte% (m/m) in Wc-eend. Bereken hoeveel gram wc-eend moet worden afgewogen voor een natronloogverbruik van ca. 30 ml. (concentratie NaOH = ca. 0,1 mol/l).
reactievergelijking: HCOOH + OH ------> Hcoo + H2O
Ik snap de hele vraag niet, en heb geen idee wat ik moet doen. Wie kan me op weg helpen?
Alvast bedankt


De bedoeling van een titratie is dat je de concentratie van een stof gaat bepalen met een oplossing van een andere stof waarvan je de concentratie precies kent.(Het klopt daarom ook niet dat de concentratie van natronloog zo onnauwkeurig wordt gegeven!) Doordat je die concentratie van die andere stof precies kent en je ook nauwkeurig bepaalt hoeveel je ervan toevoegt, kun je berekenen hoeveel er van de ene stof aanwezig was.quote:Op maandag 26 september 2011 21:43 schreef daantje1044 het volgende:
Ik heb een vraag over een titratie die ik moet doen. Ik moet het mierenzuurgehalte bepalen in wc-
eend.
Nu is de vraag:
Leid zelf een berekenigsformule af voor het berekenen van het mierenzuurgehalte% (m/m) in Wc-eend. Bereken hoeveel gram wc-eend moet worden afgewogen voor een natronloogverbruik van ca. 30 ml. (concentratie NaOH = ca. 0,1 mol/l).
reactievergelijking: HCOOH + OH ------> Hcoo + H2O
Ik snap de hele vraag niet, en heb geen idee wat ik moet doen. Wie kan me op weg helpen?
Alvast bedankt
In dit geval ga je dus mierezuur met natronloog titreren. Dat geeft de reactievergelijking:
HCOOH + OH- ------> HCOO- + H2O
Je had zelf niet de ladingen van het hydroxy- en methanoaat-ion opgeschreven. Let daarop, want die moeten er wel staan!
De formule voor het gehalte mierezuur in WC-eend kun je afleiden:
• Tijdens de titratie meet je het aantal ml natronloog dat je toevoegt: Vnatronloog
• Als je dit vermenigvuldigt met de concentratie van natronloog [OH-], krijg je het aantal mol OH- dat je hebt toegevoegd.
• Natronloog reageert 1:1 met mierezuur, dus er reageert evenveel mol mierezuur weg als je mol OH- toevoegt.
• Vermenigvuldigen van het aantal mol mierezuur met de molmassa van mierezuur MWHCOOH geeft de massa van het mierezuur in gram.
• Delen van de massa van mierezuur door de massa van WC-eend mWC-eend (in gram!) dat je titreert geeft de massaverhouding van mierezuur en WC-eend.
• Vermenigvuldigen met 100% geeft deze verhouding weer als percentage.
Probeer hier eens een formule van te maken (antwoord in de spoiler).
SPOILEROm spoilers te kunnen lezen moet je zijn ingelogd. Je moet je daarvoor eerst gratis Registreren. Ook kun je spoilers niet lezen als je een ban hebt.


Kan iemand me uitleggen, hoe je een goede VLS maakt?
Ik weet wel hoe het gaat, maar ik vergeet er steeds een paar, of de richting van de krachten staan verkeerd.
Ik weet wel hoe het gaat, maar ik vergeet er steeds een paar, of de richting van de krachten staan verkeerd.


Heb je een voorbeeld voor mij, liefst eentje die je zelf niet zo goed begrijpt? Dan wil ik het best voor je uitleggenquote:Op vrijdag 7 oktober 2011 13:36 schreef snellehenk het volgende:
Kan iemand me uitleggen, hoe je een goede VLS maakt?
Ik weet wel hoe het gaat, maar ik vergeet er steeds een paar, of de richting van de krachten staan verkeerd.


Hoi,
Ik heb een vraagje, ik wil graag weten: Hoeveel uur per week uitwonend studerende mannen in Amsterdam van 18 t/m 21 jaar (die het hoger onderwijs volgen) besteden aan internet en het lezen van een tijdschrift.
Verder had ik al gezocht op os amsterdam, maar ik kon nog niks vinden. Kan iemand me misschien helpen ? Alvast bedankt voor jouw hulp!
? Alvast bedankt voor jouw hulp!
Groet,
superky
Ik heb een vraagje, ik wil graag weten: Hoeveel uur per week uitwonend studerende mannen in Amsterdam van 18 t/m 21 jaar (die het hoger onderwijs volgen) besteden aan internet en het lezen van een tijdschrift.
Verder had ik al gezocht op os amsterdam, maar ik kon nog niks vinden. Kan iemand me misschien helpen
Groet,
superky


quote:Op vrijdag 7 oktober 2011 13:40 schreef zoem het volgende:
[..]
Heb je een voorbeeld voor mij, liefst eentje die je zelf niet zo goed begrijpt? Dan wil ik het best voor je uitleggen
sorry voor mijn late reactie, maar ik had wat problemen met mijn computer,
zou je er alsnog voor mij naar willen kijken?


Ja hoorquote:Op maandag 10 oktober 2011 14:16 schreef snellehenk het volgende:
[..]
[ afbeelding ]
sorry voor mijn late reactie, maar ik had wat problemen met mijn computer,
zou je er alsnog voor mij naar willen kijken?
Ik heb het uitgewerkt op papier en ingescand:
subscript h staat voor horizontale component en v voor verticale component
Uitleg
Als je naar de opdracht kijkt dan moeten al een paar dingen je opvallen:
- punt A is een scharnierpunt en kent dus geen moment
- punt C is eigenlijk ook een soort scharnierpunt en ook hier geen moment
- tussen B en C is een touw gespannen en kent dus alleen een trekkracht
De methode die ik nu gebruik werkt aan de hand van de krachtenevenwichten in elk punt (node). Je trekt de constructie uit elkaar, zodat je elk punt of lijnsegment afzonderlijk kunt gaan analyseren.
Het is het gemakkelijkst om te beginnen met punt C. Hier weet je dat er een touw aan trekt met kracht FBC. Omdat het touw alleen trekkracht kent, weet je dat in het touwsegment de richting van de kracht "naar buiten toe" is. Dus de kracht die op punt C werkt is dan precies het tegenovergestelde zoals je in de tekening ziet (er wordt als het ware getrokken aan punt C). Punt C zit vast aan de muur die weerstand biedt in horizontale en verticale richting. Aangezien FBC naar rechts en naar beneden werkt, zullen de krachten in de muur naar links en naar boven moeten zijn om een evenwicht te creëren in horizontale en verticale richting (FBC kun je namelijk ook weer opdelen in een hor+vert component).
Vervolgens ga je naar punt B. Ook daar trekt het touw aan en net zoals bij punt C krijg je een kracht FBC die een tegenovergestelde richting heeft van het touw. Daarnaast werkt er een (gegeven) kracht F2 op punt B. Punt B zit ook nog eens vast aan staaf ABD en zal er een kracht bestaan tussen B en D: FBD. Kracht FBC wijst naar links+boven en kracht F2 naar beneden. Een staaf kent alleen trek- of compressiekrachten in de lengterichting, dus om een evenwicht te krijgen zal FBD wel naar rechtsboven moeten wijzen. De andere optie was linksonder, maar dan heb je geen evenwicht!
Punt D kent de tegenovergestelde kracht die vanuit B op D werkt. FBD wijst de tegenovergestelde kant op in D. Er is een gegeven verticale kracht F1 in D en er werkt een kracht tussen A en D: FAD. Wederom horizontale+verticale krachtenevenwichten in het punt: FBD en F1 wijzen naar beneden, dus dan blijft voor FAD alleen de richting rechtsboven over.
Punt A kent de tegenovergestelde kracht die vanuit D op A werkt (zelfde verhaal als in punt D). Punt A zit vast aan de muur en zal een kracht naar boven en een kracht naar rechts moeten hebben om een evenwicht te creëren met FAD.
Uiteindelijk zie je dat in het bovenste plaatje de krachten zowel horizontaal als verticaal in evenwicht zijn. De kracht in FBD kun je het makkelijkst uitrekenen door een moment om punt A te doen en het touw te vervangen door de kracht FBD. Opdelen van deze kracht in een horizontale+verticale component maakt het uitrekenen makkelijker.
Uitleg werd langer dan gedacht. Het kan maar duidelijk zijn


Speciale relativiteitstheorie:
Een neutron beweegt met snelheid v = 0.3c van een melkwegstelsel af. Als het neutron zich op 1 lichtjaar afstand van het centrum bevindt, zendt hij een elektron met snelheid u = 0.5c t.o.v. het neutron de andere kant op (naar het centrum).
Hoe lang duurt het voordat het elektron het centrum bereikt, gemeten door een waarnemer in het melkwegstesell?
Ik heb de relatieve snelheid van het elektron t.o.v. het melkwegstelsel berekend: w = -0.24 c.
Mag ik nu zeggen, omdat het melkwegstelsel in rust is, t melkweg = lichtjaar/ 0,24c = 4.17 jaar, of moet ik met lorentztransformaties werken?
Een neutron beweegt met snelheid v = 0.3c van een melkwegstelsel af. Als het neutron zich op 1 lichtjaar afstand van het centrum bevindt, zendt hij een elektron met snelheid u = 0.5c t.o.v. het neutron de andere kant op (naar het centrum).
Hoe lang duurt het voordat het elektron het centrum bereikt, gemeten door een waarnemer in het melkwegstesell?
Ik heb de relatieve snelheid van het elektron t.o.v. het melkwegstelsel berekend: w = -0.24 c.
Mag ik nu zeggen, omdat het melkwegstelsel in rust is, t melkweg = lichtjaar/ 0,24c = 4.17 jaar, of moet ik met lorentztransformaties werken?


Kan hier iemand wat vinden over oud premier Dries van Agt ik heb alleen iets op Wiki gevonden. Maar dat is ook niet veel..


Niet echt bèta eigenlijk. Maar wat zoek je precies? Dit is nogal algemeen...quote:Op maandag 10 oktober 2011 20:32 schreef bjanaan het volgende:
Kan hier iemand wat vinden over oud premier Dries van Agt ik heb alleen iets op Wiki gevonden. Maar dat is ook niet veel..


Biografie.quote:Op maandag 10 oktober 2011 20:36 schreef zoem het volgende:
[..]
Niet echt bèta eigenlijk. Maar wat zoek je precies? Dit is nogal algemeen...


ff een vraag ter controle of ik het nu goed doe met die berekeningsformule.
sorry voor de opmaak: link in de op werkt niet
De vraag is: leid zelf een berekeningsformule af voor het berekenen van de massa die er aan calciumcarbonaat moet worden ingewogen voor een natronloogverbruik van 25 ml ( concentratie NaOH = 0,1 mol/l)
nu heb ik dus als berekenings formule: Vnatronloog * [OH-] * MWCaCO3.
Is deze formule juist?
sorry voor de opmaak: link in de op werkt niet
De vraag is: leid zelf een berekeningsformule af voor het berekenen van de massa die er aan calciumcarbonaat moet worden ingewogen voor een natronloogverbruik van 25 ml ( concentratie NaOH = 0,1 mol/l)
nu heb ik dus als berekenings formule: Vnatronloog * [OH-] * MWCaCO3.
Is deze formule juist?


Het is sowieso van belang om eerst uit te schrijven welke reactie er gaat plaatsvinden. Het is mij niet duidelijk wat calciumcarbonaat met natronloog moet gaan doen. Volgens mij reageren die twee namelijk niet met elkaar. Weet je zeker dat je stofnamen correct hebt overgenomen?quote:Op donderdag 13 oktober 2011 13:29 schreef daantje1044 het volgende:
ff een vraag ter controle of ik het nu goed doe met die berekeningsformule.
sorry voor de opmaak: link in de op werkt niet
De vraag is: leid zelf een berekeningsformule af voor het berekenen van de massa die er aan calciumcarbonaat moet worden ingewogen voor een natronloogverbruik van 25 ml ( concentratie NaOH = 0,1 mol/l)
nu heb ik dus als berekenings formule: Vnatronloog * [OH-] * MWCaCO3.
Is deze formule juist?
Je formule is correct voor een reactie met molverhouding 1:1, maar geeft de massa van CaCO3 in mg. Wil je dit in grammen hebben, dan moet je nog delen door 1000.


het gaat om een terugtritatie met natronloog sorry. CaCo3 wordt eerst opgelost in een overmaat zuur :
CaCo3 + 2H+ -------> Ca + H2CO3
H2CO3 ---------> H2O + CO2
daarna wordt het CO2 uitgekookt. Omdat er meer zuur wordt toegevoegd dan nodig is, kan het restant H+ teruggetriteerd worden met een natriumhydroxide- oplossing.
CaCo3 + 2H+ -------> Ca + H2CO3
H2CO3 ---------> H2O + CO2
daarna wordt het CO2 uitgekookt. Omdat er meer zuur wordt toegevoegd dan nodig is, kan het restant H+ teruggetriteerd worden met een natriumhydroxide- oplossing.


Dat verklaart een hoop! Dit betekent dat ook bekend moet zijn hoeveel zuur je toevoegt, anders kun je niet bepalen hoeveel CaCO3 je moet toevoegen.quote:Op donderdag 13 oktober 2011 14:26 schreef daantje1044 het volgende:
het gaat om een terugtritatie met natronloog sorry. CaCo3 wordt eerst opgelost in een overmaat zuur :
CaCo3 + 2H+ -------> Ca + H2CO3
H2CO3 ---------> H2O + CO2
daarna wordt het CO2 uitgekookt. Omdat er meer zuur wordt toegevoegd dan nodig is, kan het restant H+ teruggetriteerd worden met een natriumhydroxide- oplossing.
Uit de eerste formule (CaCO3 + 2H+ -------> Ca2+ + H2CO3) blijkt dat het calciumcarbonaat en zuur in een verhouding 1:2 reageren. Natronloog en zuur reageren in een verhouding 1:1.
Je moet dan de volgende stappen zetten om de formule te krijgen:
• bepaal hoeveel mol zuur wordt toegevoegd aan de hand van het toegevoegde volume zuur en de concentratie van het zuur
• daar trek je het aantal mol zuur vanaf dat wegreageert met natronloog; berekenen aan de hand van het toegevoegde volume natronloog en de concentratie ervan
• dat geeft het aantal mol zuur dat reageert met calciumcarbonaat
• vermenigvuldigen met 0,5 (of delen door 2) geeft het aantal mol CaCO3 dat heeft gereageerd
• vermenigvuldigd met de molmassa geeft de massa van het weggereageerde CaCO3
SPOILER: antwoord in deze spoilerOm spoilers te kunnen lezen moet je zijn ingelogd. Je moet je daarvoor eerst gratis Registreren. Ook kun je spoilers niet lezen als je een ban hebt.


ok dank je wel! weer wat wijzer geworden!
Nog 1 vraag uit nieuwsgierigheid. Waarom kook je de CO2 uit? Gaat de titratie anders niet werken?
Nog 1 vraag uit nieuwsgierigheid. Waarom kook je de CO2 uit? Gaat de titratie anders niet werken?


CO2 kan reageren met OH-, dat geeft HCO3-. Zonder uitkoken zou de titratie daarom niet meer kloppen.quote:Op donderdag 13 oktober 2011 17:32 schreef daantje1044 het volgende:
ok dank je wel! weer wat wijzer geworden!
Nog 1 vraag uit nieuwsgierigheid. Waarom kook je de CO2 uit? Gaat de titratie anders niet werken?


Sorry, alweer een vraag, begrijp het gewoon echt niet:
Moet een practicum voorbereiden voor het opnemen van titratiecurven, berekenen van de equivalentiepunten en het bepalen van de omslaggebieden van een aantal zuur-base indicatoren.
Het practicum voer ik uit met natriumhydroxide oplossing en de volgende stoffen: zoutzuur, azijnzuur en fosforzuur.
Nu moet ik berekenen hoeveel ml NaOH (aq) er theoretisch nodig is om de eindpunten te bereiken. Ik heb dus geen idee hoe ik dat moet berekenen.
De gegevens die ik heb. ( ik ga uit van de reactie met zoutzuur):
Ik moet 25 ml zoutzuuroplossing gebruiken. concentratie NaOH is 0,1 mol/l.
En de pH meter wordt gekalibreerd met buffer pH= 7,00 en pH = 4,00.
reactievergelijking:
NaOH + HCL -----> NaCl + H2O
Kan iemand me uitleggen hoe ik het aantal ml NaOH moet berekenen? Zit er al uren naar te staren, maar kom er echt niet uit.
Moet een practicum voorbereiden voor het opnemen van titratiecurven, berekenen van de equivalentiepunten en het bepalen van de omslaggebieden van een aantal zuur-base indicatoren.
Het practicum voer ik uit met natriumhydroxide oplossing en de volgende stoffen: zoutzuur, azijnzuur en fosforzuur.
Nu moet ik berekenen hoeveel ml NaOH (aq) er theoretisch nodig is om de eindpunten te bereiken. Ik heb dus geen idee hoe ik dat moet berekenen.
De gegevens die ik heb. ( ik ga uit van de reactie met zoutzuur):
Ik moet 25 ml zoutzuuroplossing gebruiken. concentratie NaOH is 0,1 mol/l.
En de pH meter wordt gekalibreerd met buffer pH= 7,00 en pH = 4,00.
reactievergelijking:
NaOH + HCL -----> NaCl + H2O
Kan iemand me uitleggen hoe ik het aantal ml NaOH moet berekenen? Zit er al uren naar te staren, maar kom er echt niet uit.


Weet je niet (ongeveer) de concentratie van de zoutzuuroplossing? Je moet namelijk weten hoeveel mol zoutzuur er is, waaruit je kunt beredeneren hoeveel mol NaOH er nodig is om HCl totaal te neutraliseren.quote:Op maandag 17 oktober 2011 15:33 schreef daantje1044 het volgende:
Sorry, alweer een vraag, begrijp het gewoon echt niet:
Moet een practicum voorbereiden voor het opnemen van titratiecurven, berekenen van de equivalentiepunten en het bepalen van de omslaggebieden van een aantal zuur-base indicatoren.
Het practicum voer ik uit met natriumhydroxide oplossing en de volgende stoffen: zoutzuur, azijnzuur en fosforzuur.
Nu moet ik berekenen hoeveel ml NaOH (aq) er theoretisch nodig is om de eindpunten te bereiken. Ik heb dus geen idee hoe ik dat moet berekenen.
De gegevens die ik heb. ( ik ga uit van de reactie met zoutzuur):
Ik moet 25 ml zoutzuuroplossing gebruiken. concentratie NaOH is 0,1 mol/l.
En de pH meter wordt gekalibreerd met buffer pH= 7,00 en pH = 4,00.
reactievergelijking:
NaOH + HCL -----> NaCl + H2O
Kan iemand me uitleggen hoe ik het aantal ml NaOH moet berekenen? Zit er al uren naar te staren, maar kom er echt niet uit.


Als je dan 25 ml van die oplossing pakt, hoeveel mol HCl heb je dan?quote:Op maandag 17 oktober 2011 23:51 schreef daantje1044 het volgende:
concentratie zoutzuur is 0,1 mol/l
SPOILER: antwoordOm spoilers te kunnen lezen moet je zijn ingelogd. Je moet je daarvoor eerst gratis Registreren. Ook kun je spoilers niet lezen als je een ban hebt.En als je weet dat HCl volledig dissocieert in water, dat wil zeggen het splitst zich in H+ en Cl-, hoeveel mol H+ heb je dan in oplossing?SPOILER: antwoordOm spoilers te kunnen lezen moet je zijn ingelogd. Je moet je daarvoor eerst gratis Registreren. Ook kun je spoilers niet lezen als je een ban hebt.Hoeveel mol OH- heb je dan nodig om het zuur te neutraliseren?SPOILER: antwoordOm spoilers te kunnen lezen moet je zijn ingelogd. Je moet je daarvoor eerst gratis Registreren. Ook kun je spoilers niet lezen als je een ban hebt.En hoeveel ml 0,1 M natronloog heb je dan nodig?SPOILER: antwoordOm spoilers te kunnen lezen moet je zijn ingelogd. Je moet je daarvoor eerst gratis Registreren. Ook kun je spoilers niet lezen als je een ban hebt.
 Hoi,
Hoi,
Ik heb een vraag over een portfolio. Nou is het zo dat ik er nog nooit één gemaakt had. Maar mijn moeder maakt wel een portfolio tijdens haar inburgingscursus voor school.
Bij haar portfolio zie ik een blz. met persoonlijke gegevens. Dus naam, adres, woonplaats, hobby's en etc. In mijn ogen lijkt die blz. op een C.V.
Nu maak ik een portfolio van een vak voor school. De opdrachten die ik heb gemaakt zitten in mijn portfolio, maar er wordt niet gevraagd dat ik zo'n blz. maak met persoonlijke gegevens als een soort van C.V.
Mijn vraag is: Moet ik die persoonlijke gegevens na de inhoudsopgave er niet in zetten, omdat het niet wordt gevraagd.
Of moet ik mijn persoonlijke gegevens er wel in zetten zelfs als dat niet wordt gevraagd, omdat het standaard in een portfolio hoort. Alvast bedankt voor uw antwoord!
Groet,
superky
 wie kan deze vraag oplossen, en uitleggen?
wie kan deze vraag oplossen, en uitleggen?
Aspirin (acetylsalicylic acid, C9H8O4 ) is a weak monoprotic acid. To determine its acid-dissociation constant, a student dissolved 2.00 of aspirin in 0.600 L of water and measured thePH . What was the Ka value calculated by the student if the PH of the solution was 2.61?
bij voorbaat dank.
 'Voor de jaren na 2007 verwacht de regering van dit land een verbetering van het saldo van de kapitaalrekening.'
'Voor de jaren na 2007 verwacht de regering van dit land een verbetering van het saldo van de kapitaalrekening.'
De kapitaalrekening had een overschot van 18.4 miljard.
'Zal in de toekomst het saldo van de inkomensrekening van dit land daardoor positief of negatief worden beinvloed? Verklaar het antwoord.'
Het antwoord is: Negatief. De toevloed van kapitaal via de kapitaalrekening leidt in de toekomst tot rentebetalingen en dividendafdrachten aan het buitenland.
Maar dit klopt toch niet? Een verbetering van het saldo van de kapitaalrekening betekent toch juist dat deze overheid haar overschot op de kapitaalrekening van 18.4 miljard juist nog hoger wil maken? Waardoor er nog meer geld naar het buitenland gaat, waar WIJ juist winst en rente over ontvangen?
 Je moet altijd eerst beginnen met het opstellen van de reactievergelijking:quote:
Je moet altijd eerst beginnen met het opstellen van de reactievergelijking:quote:Op zaterdag 22 oktober 2011 18:16 schreef jouwkeuze het volgende:
wie kan deze vraag oplossen, en uitleggen?
Aspirin (acetylsalicylic acid, C9H8O4 ) is a weak monoprotic acid. To determine its acid-dissociation constant, a student dissolved 2.00 of aspirin in 0.600 L of water and measured thePH . What was the Ka value calculated by the student if the PH of the solution was 2.61?
bij voorbaat dank.
HA + H2O <=> H3O+ + A-
Hierin is aspirine weergegeven als HA en zijn geconjugeerde base als A-.
Vervolgens stel je de bijbehorende evenwichtsvoorwaarde op:
Ka = [H3O+][A-]/[HA]
Om Ka te kunnen berekenen, moet je alle concentraties die genoemd worden in de evenwichtsvoorwaarde kennen.
De pH is bepaald op 2,61, waaruit we kunnen afleiden dat [H3O+] = 10pH = 10-2,61 = 0,00245 mol/l
[A-] = [H3O+] = 0,00245 mol/l, want beide ionen worden in een 1:1-verhouding gevormd.
Dan hoeven we alleen nog de concentratie van het ongedissocieerde zuur te bepalen: [HA].
Dat kun je doen door eerst te bepalen hoeveel mol aspirine er is opgelost en die te verminderen met [A-].
De opgave geeft geen eenheid van de opgeloste massa aspirine, maar ik ga even uit van 2,00 g. 2,00 g aspirine komt overeen met 2,00/180,16 = 0,0111 mol. Dat is opgelost in 0,600 l water, wat betekent dat de initiële concentratie van aspirine gelijk was aan 0,0111/0,600 = 0,0185 mol/l. Verminder deze met [A-], dat geeft 0,0185 - 0,00245 = 0,01605 mol/l
Invullen van de concentraties in de evenwichtsvoorwaarde geeft Ka = (0,00245)2/0,01605 = 3,75 * 10-4 mol/l
 @ supersky: vraag het eens na bij je leraar. Die waardeert het waarschijnlijk dat je het zo graag goed wil doen, dus wellicht vertelt hij het wel.
@ supersky: vraag het eens na bij je leraar. Die waardeert het waarschijnlijk dat je het zo graag goed wil doen, dus wellicht vertelt hij het wel.
Als hij het niet verklapt zou ik het er wel bij doen maar niet te uitgebreid.
 Heren , une question, gelieve mij te helpen, ik kom er zelf niet uit (al veel geprobeerd).
Heren , une question, gelieve mij te helpen, ik kom er zelf niet uit (al veel geprobeerd).
De opdracht met vragen:
Mijn poging op vraag 1 (weet niet of het klopt) (en heb v niet kunnen uitrekenen) (p.s. niets met integralen a.u.b. ):
Mijn poging op vraag 2:

 voor jouw eerste opdracht heb je T = m*g (20*9.8), dit is alleen waar als blok b stil zou staan(als de kabel massaloos is), en dat is niet zoquote:
voor jouw eerste opdracht heb je T = m*g (20*9.8), dit is alleen waar als blok b stil zou staan(als de kabel massaloos is), en dat is niet zoquote:Op zondag 30 oktober 2011 20:08 schreef alicarpali het volgende:
Heren , une question, gelieve mij te helpen, ik kom er zelf niet uit (al veel geprobeerd).
De opdracht met vragen:
[ afbeelding ]
Mijn poging op vraag 1 (weet niet of het klopt) (en heb v niet kunnen uitrekenen) (p.s. niets met integralen a.u.b. ):
[ afbeelding ]
Mijn poging op vraag 2:
[ afbeelding ]
denk ik

 http://i.imgur.com/GveY7.jpg zo moet ie denk ikquote:
http://i.imgur.com/GveY7.jpg zo moet ie denk ikquote:Op zondag 30 oktober 2011 20:08 schreef alicarpali het volgende:
Heren , une question, gelieve mij te helpen, ik kom er zelf niet uit (al veel geprobeerd).
De opdracht met vragen:
[ afbeelding ]
Mijn poging op vraag 1 (weet niet of het klopt) (en heb v niet kunnen uitrekenen) (p.s. niets met integralen a.u.b. ):
[ afbeelding ]
Mijn poging op vraag 2:
[ afbeelding ]
 Hallo,
Hallo,
Zou iemand mij nadere uitleg wilen geven over de volgende functie's bij kansberekening?
De NCR funtctie
Fakkeltijd
BIj wat voor soort vraag moet ik welke functie gebruiken, ik haal het telkens door elkaar heen en in het boek staat het niet precies beschreven.''Ja die meneer heeft kaal haar.''
 Het is faculteit; fakkeltijd is heel wat andersquote:
Het is faculteit; fakkeltijd is heel wat andersquote:Op zondag 6 november 2011 12:28 schreef Mierenneuker. het volgende:
Hallo,
Zou iemand mij nadere uitleg wilen geven over de volgende functie's bij kansberekening?
De NCR funtctie
Fakkeltijd
BIj wat voor soort vraag moet ik welke functie gebruiken, ik haal het telkens door elkaar heen en in het boek staat het niet precies beschreven.
De nCr-functie gebruik je voor het berekenen van combinaties (volgorde níet van belang).
Stel dat je uit een groep van 5 mensen er 2 mag kiezen; hoeveel verschillende keuzes (combinaties) kun je maken? Het maakt hier niet uit of je eerst A en dan B kiest, uiteindelijk kies je beide personen. Je maakt hier gebruik van nCr (combinaties). De oplossing is hier 5 nCr 2 oftewel 10 keuzes.
De nPr-functie gebruik je voor permutaties (volgorde wél van belang).
Stel dat je uit een groep van 5 mensen een voorzitter en een notulist moet kiezen; hoeveel verschillende keuzes (permutaties) kun je maken? De volgorde is van belang, want als je A als voorzitter kiest dan is hij geen notulist (want dat is B). Je maakt hier gebruik van nPr (permutaties). De oplossing is hier 5 nPr 2 oftewel 20 mogelijkheden.
Faculteit gebruik je voor het berekenen ervan:
waarin k het aantal elementen uit de verzamling n is.
 Bedankt voor je reactie, nu ga ik al met een aardig beter gevoel mijn tentamen wisk. tegemoet.quote:
Bedankt voor je reactie, nu ga ik al met een aardig beter gevoel mijn tentamen wisk. tegemoet.quote:Op zondag 6 november 2011 13:25 schreef zoem het volgende:
[..]
Het is faculteit; fakkeltijd is heel wat anders
De nCr-functie gebruik je voor het berekenen van combinaties (volgorde níet van belang).
Stel dat je uit een groep van 5 mensen er 2 mag kiezen; hoeveel verschillende keuzes (combinaties) kun je maken? Het maakt hier niet uit of je eerst A en dan B kiest, uiteindelijk kies je beide personen. Je maakt hier gebruik van nCr (combinaties). De oplossing is hier 5 nCr 2 oftewel 10 keuzes.
De nPr-functie gebruik je voor permutaties (volgorde wél van belang).
Stel dat je uit een groep van 5 mensen een voorzitter en een notulist moet kiezen; hoeveel verschillende keuzes (permutaties) kun je maken? De volgorde is van belang, want als je A als voorzitter kiest dan is hij geen notulist (want dat is B). Je maakt hier gebruik van nPr (permutaties). De oplossing is hier 5 nPr 2 oftewel 20 mogelijkheden.
Faculteit gebruik je voor het berekenen ervan:
waarin k het aantal elementen uit de verzamling n is.''Ja die meneer heeft kaal haar.''
 Ik moet voor natuurkunde een formule invullen waarin de dichtheid van lucht voorkomt. Hoe moet ik deze dichtheid weten?
Ik moet voor natuurkunde een formule invullen waarin de dichtheid van lucht voorkomt. Hoe moet ik deze dichtheid weten?
Het antwoord is trouwens 1,293 kgm^-3 maar hoe kom je hieraan? :S
[ Bericht 24% gewijzigd door #ANONIEM op 07-11-2011 16:55:54 ]
 Als de dichtheid van lucht niet gegeven is dan kun je uitgaan van ISA condities (International Standard Atmosphere). Dan is de luchtdichtheid:quote:
Als de dichtheid van lucht niet gegeven is dan kun je uitgaan van ISA condities (International Standard Atmosphere). Dan is de luchtdichtheid:quote:Op maandag 7 november 2011 16:54 schreef magneetstrip het volgende:
Ik moet voor natuurkunde een formule invullen waarin de dichtheid van lucht voorkomt. Hoe moet ik deze dichtheid weten?
Het antwoord is trouwens 1,293 kgm^-3 maar hoe kom je hieraan? :S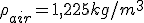

 Dit is bij 0 graden Celsius. Is dit niet makkelijk te vinden in een BINAS?quote:
Dit is bij 0 graden Celsius. Is dit niet makkelijk te vinden in een BINAS?quote:Op maandag 7 november 2011 16:54 schreef magneetstrip het volgende:
Ik moet voor natuurkunde een formule invullen waarin de dichtheid van lucht voorkomt. Hoe moet ik deze dichtheid weten?
Het antwoord is trouwens 1,293 kgm^-3 maar hoe kom je hieraan? :S
 Jongens, als er wordt gevraagd hoeveel gram koolstofatomen er zitten in 100 gram C6H12O6 (glucose)
Jongens, als er wordt gevraagd hoeveel gram koolstofatomen er zitten in 100 gram C6H12O6 (glucose)
Hoe pak ik dat aan? Ik ben bekend met molverhoudingen en omrekenen naar gram in reactievergelijkingen.
Is het goed als ik:
- Eerst de molmassa glucose uitreken
- 100 gram deel door de molmassa = aantal mol
- aantal mol delen door (6+12+6) en daarna vermenigvuldig met 6? (want je hebt 6 koolstofatomen)?
- Ten slotte aantal mol vermenigvuldig met de molmassa van koolstof?
Zo'n vraag zat in de sk toets maar dan een stuk ingewikkelder. Het deel wat ik niet begreep was dit hierboven. Ik denk dat punt 3 niet goed is.
[ Bericht 12% gewijzigd door BeyondTheGreen op 10-11-2011 14:32:16 ]Unbowed, Unbent, Unbroken.
 C = 12g/mol
C = 12g/mol
H = 1g/mol
O = 16g/mol
molmassa C6H12O6 = 6*12+12*1+6*16 = 180 g/mol
Je hebt 100 gram C6H12O6, dus 100/180 = 0.555 mol.
Er is 6*12 = 72g/mol aan koolstofatomen aanwezig.
Dus 0.555 mol * 72 g/mol = 40g.
Lijkt me vrij rechttoe rechtaan

 Danku.quote:
Danku.quote:Op donderdag 10 november 2011 14:43 schreef zoem het volgende:
C = 12g/mol
H = 1g/mol
O = 16g/mol
molmassa C6H12O6 = 6*12+12*1+6*16 = 180 g/mol
Je hebt 100 gram C6H12O6, dus 100/180 = 0.555 mol.
Er is 6*12 = 72g/mol aan koolstofatomen aanwezig.
Dus 0.555 mol * 72 g/mol = 40g.
Lijkt me vrij rechttoe rechtaan
Het is ook niet zo moeilijk, maar als je Sprinthavo doet en nooit eerder scheikunde hebt gehad gaat het wel allemaal erg snel.Unbowed, Unbent, Unbroken.
 OPGELOST
OPGELOST
Een halve glazen bol is bedekt met een spiegelende zilverlaag aan de gekromde kant van het
oppervlak. Binnenin de bol, op de centrale as, bevindt zich een kleine luchtbel op 50.0 mm afstand
van het platte oppervlak. De kromtestraal R van de halve bol is gelijk aan 75.0 mm en het glas van
de bol heeft een brekingsindex n = 1.60. (zie figuur). We kijken langs de as in het vlakke oppervlak
en we zien twee afbeeldingen van de luchtbel.
http://imageshack.us/photo/my-images/141/optica.png/ (copy/paste deze link)
a) Verklaar hoe de twee afbeeldingen van de luchtbel tot stand komen
OPGELOST
[ Bericht 11% gewijzigd door Anoonumos op 12-11-2011 23:26:46 ]
 Hoi,
Hoi,
Mijn vorige vragen zijn al beantwoord en opgelost, dus nogmaals bedankt. Maar ik heb nog een vraagje:
Op welke tijden kijken kinderen van 9 t/m 12 jaar naar de televisie?
Ik had al op CBS Statline en SKO gekeken, maar dan kon ik niks vinden. Alvast bedankt voor uw antwoord!
Groet,
superky
 Ik ben eigenlijk wel benieuwd naar het antwoord. Nav jouw vraag heb ik het proberen op te lossen, maar ik kwam er ook niet uit. Optica is één van de weinige natuurkunde-onderdelen die ik niet in mijn opleiding gehad heb.quote:
Ik ben eigenlijk wel benieuwd naar het antwoord. Nav jouw vraag heb ik het proberen op te lossen, maar ik kwam er ook niet uit. Optica is één van de weinige natuurkunde-onderdelen die ik niet in mijn opleiding gehad heb.quote:
 Uitwerking komt komende week online, dus die zal ik hier wel posten. Het idee was dat het voorwerp dichterbij lijkt dan hij daadwerkelijk is, net zoals een zwembad minder diep lijkt als je van boven kijkt. Het andere beeld ontstaat door de spiegel.
Uitwerking komt komende week online, dus die zal ik hier wel posten. Het idee was dat het voorwerp dichterbij lijkt dan hij daadwerkelijk is, net zoals een zwembad minder diep lijkt als je van boven kijkt. Het andere beeld ontstaat door de spiegel.
 Ik was wel al zo ver dat ik de beeldafstand had uitgerekend, en die lag inderdaad net iets vóór het voorwerp zelf. Ik kwam uit op 16.67mm voor het object, of 41.67mm vanaf de lens/bol. Maar ja dat is met middelbare-schooloptica
Ik was wel al zo ver dat ik de beeldafstand had uitgerekend, en die lag inderdaad net iets vóór het voorwerp zelf. Ik kwam uit op 16.67mm voor het object, of 41.67mm vanaf de lens/bol. Maar ja dat is met middelbare-schooloptica

 -- crosspost (Admins: verwijder deze post aub. Ik had 'm perongeluk in verkeerde topic geplaatst. Mijn excuses)
-- crosspost (Admins: verwijder deze post aub. Ik had 'm perongeluk in verkeerde topic geplaatst. Mijn excuses)
[ Bericht 48% gewijzigd door NonameNogame op 20-11-2011 14:26:12 ]
 Kan ik in dit topic ook een vraag stellen hoe ik een Bode plot (phase,amp/freq) naar een transfer functie moet omzetten? Of kan ik daar beter voor bij een ander topic zijn?
Kan ik in dit topic ook een vraag stellen hoe ik een Bode plot (phase,amp/freq) naar een transfer functie moet omzetten? Of kan ik daar beter voor bij een ander topic zijn?
 Past hier wel, maar je zult iets specifieker moeten zijn.quote:
Past hier wel, maar je zult iets specifieker moeten zijn.quote:Op zondag 4 december 2011 14:02 schreef dynamiet het volgende:
Kan ik in dit topic ook een vraag stellen hoe ik een Bode plot (phase,amp/freq) naar een transfer functie moet omzetten? Of kan ik daar beter voor bij een ander topic zijn?Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson
 Ik heb de volgende opdracht gekregen:
Ik heb de volgende opdracht gekregen:
"Based on the measurement data in the lab exercise 2, estimate the dynamical model of the systemsto-be-controlled, which consists of the amplifier, motor, conveyor mechanism and the
tachogenerator."
Nu heb ik voor verschillende frequenties de vesterkingsfactor en fase-verschuiving gemeten. De volgende resultaten heb ik hier bij gekregen
Freq = [0.628318531,1.256637061,3.141592654,6.283185307,12.56637061,31.41592654,62.83185307]
Amp = [2.6719,2.6415,2.6611,2.8076,1.1931,0.4647,0.1142]
Phase = [-1.186022636,-2.319637234,-5.723848373,-11.63104324,-60.61320515,-87.11739091,-91.23122788]
Freq = rad/s, amp(versterking)= factor, Phase= fase verschuiving in graden.
Hier heb ik de volgende bode plot uit gecreëerd:
Mijn vraag is hoe ik hier nu een transfer functie uit kan creëren?
 Zou iemand mij in het kort uit kunnen leggen wat de quantumgetallen (n,l,m) inhouden? En dan bijvoorbeeld bij een 4p-toestand.
Zou iemand mij in het kort uit kunnen leggen wat de quantumgetallen (n,l,m) inhouden? En dan bijvoorbeeld bij een 4p-toestand.
Tevens is het voor mij ook lastig te begrijpen wat de spintoestand nu precies inhoud en hoe je dit bepaald en aangeeft. Wij gebruiken het boek "Chemistry'' van McMurry & Fay en dat is dus in het (Harvard) Engels. Soms een beetje lastig. De stof zelf is niet zo moeilijk, maar deze dingen kom ik niet helemaal uit. Alvast heel erg bedankt.Waarom?
 Het is voor mij diep graven. Ik gebruik dit spul wel voor optische transfer functies, maar daar werken we niet met bodeplotten.quote:
Het is voor mij diep graven. Ik gebruik dit spul wel voor optische transfer functies, maar daar werken we niet met bodeplotten.quote:
Wat ik me van die materie herinner, is dat je een delta functie (pulse input, oneindig kort en oneindig hoog met een oppervlak van 1) nodig hebt om de transferfunctie van het systeem te bepalen. De reactie van het systeem op die functie is namelijk de transfer functie, en daarmee kun je berekenen hoe een andere input (bijvoorbeeld een sinus met een bepaalde frequentie) versterkt zal worden.
In jouw geval heb je metingen waarbij je de versterking en fase als een functie van de frequentie hebt.
Het lijkt me dat je daarmee ook wel een transferfunctie op kunt stellen, maar dan op een andere manier dan ik eerder beschreef. Je roll-off, 3dB punt en zo zijn vrij klassiek en lijkt daarmee op een klassieke versterker. In dat geval kun je eens googlen op een transferfunctie voor een versterker. Je weet waar je 3dB punt ligt, en je weet hoe veel je roll-off (~10dB/decade?) is. Ik hoop dat ik je hiermee niet het bos instuur. Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson
 Ik ben zelf geen natuurkundige, daarom kan ik je geen diepgaande uitleg hierover geven. Wat ik wel weet, is dat de quantumgetallen bedoeld zijn om de toestand waarin een elektron zich bevindt te beschrijven. Het hoofdquantumgetal n beschrijft het energieniveau (ofwel de schil) waarbinnen het elektron zich bevindt. Het nevenquantumgetal l beschrijft in wat voor type orbitaal het elektron zich bevindt (s, p, d, f). Het magnetisch quantumgetal m geeft weer binnen welke orbitaal zich het elektron zich bevindt (er zijn bijvoorbeeld 3 p-orbitalen). Het spinquantumgetal s beschrijft ten slotte de spin van het elektron (spin up of spin down).quote:
Ik ben zelf geen natuurkundige, daarom kan ik je geen diepgaande uitleg hierover geven. Wat ik wel weet, is dat de quantumgetallen bedoeld zijn om de toestand waarin een elektron zich bevindt te beschrijven. Het hoofdquantumgetal n beschrijft het energieniveau (ofwel de schil) waarbinnen het elektron zich bevindt. Het nevenquantumgetal l beschrijft in wat voor type orbitaal het elektron zich bevindt (s, p, d, f). Het magnetisch quantumgetal m geeft weer binnen welke orbitaal zich het elektron zich bevindt (er zijn bijvoorbeeld 3 p-orbitalen). Het spinquantumgetal s beschrijft ten slotte de spin van het elektron (spin up of spin down).quote:Op dinsdag 6 december 2011 14:35 schreef WhatsTheSecret het volgende:
Zou iemand mij in het kort uit kunnen leggen wat de quantumgetallen (n,l,m) inhouden? En dan bijvoorbeeld bij een 4p-toestand.
Tevens is het voor mij ook lastig te begrijpen wat de spintoestand nu precies inhoud en hoe je dit bepaald en aangeeft. Wij gebruiken het boek "Chemistry'' van McMurry & Fay en dat is dus in het (Harvard) Engels. Soms een beetje lastig. De stof zelf is niet zo moeilijk, maar deze dingen kom ik niet helemaal uit. Alvast heel erg bedankt.
Voor jouw voorbeeld 4p geldt in ieder geval dat n = 4 (vierde energieniveau/schil en l = 1 (p-orbitalen). Er zijn dan nog 6 combinaties van m (-1, 0, 1) en s (-1/2, 1/2) mogelijk. Dat komt precies overeen met het aantal elektronen dat zich in de 4p-orbitalen kan bevinden. Met andere woorden elk elektron heeft zijn unieke combinatie van quantumgetallen!
Hopelijk helpt dit je een beetje op weg!
 Ah thanx, dan had ik het toch wel redelijk begrepen.
Ah thanx, dan had ik het toch wel redelijk begrepen.Alleen snap ik die 's' nog niet, hoe bepaal je die? -1/2 en 1/2.
Waarom?
 De waarde voor s is arbitrair. Er kunnen maximaal 2 elektronen in een orbitaal zitten. Als je aan de ene de waarde -1/2 toekent, dan heeft de andere automatisch de waarde 1/2.quote:
De waarde voor s is arbitrair. Er kunnen maximaal 2 elektronen in een orbitaal zitten. Als je aan de ene de waarde -1/2 toekent, dan heeft de andere automatisch de waarde 1/2.quote:Op dinsdag 6 december 2011 18:08 schreef WhatsTheSecret het volgende:
Ah thanx, dan had ik het toch wel redelijk begrepen.Alleen snap ik die 's' nog niet, hoe bepaal je die? -1/2 en 1/2.
Stel dat er zich 2 elektronen in de 2px-orbitaal bevinden. Dan heeft het ene elektron bijvoorbeeld als quantumgetallen n=2, l=1, m=-1, s=-1/2, de ander heeft dan n=2, l=1, m=-1, s=1/2. In dit geval staan n en l vast, maar ik had voor m ook 0 of 1 kunnen kiezen. De waarde die je kiest voor m is dus ook arbitrair, zolang je (even doorgaand op mijn voorbeeld) voor py en pz maar de andere mogelijke waarden kiest.
[ Bericht 0% gewijzigd door lyolyrc op 06-12-2011 19:34:14 ]
 vandaag een college gehad over de glycolyse:
vandaag een college gehad over de glycolyse:
Daarbij werd een plaatje getoond waarin ik iets niet snap. Dat plaatje kon ik niet op internet vinden maar onderstaand is goed genoeg voor mn vraag
Het gaat om NAD+ en NADH
Als NAD+ een elektron opneemt om te vervoeren, wordt het toch NAD (met lading nul)?
En als er dan een H+ (lading plus 1) bijkomt, wordt het toch weer NADH+ (lading plus 1)?
Waarom staat er in de plaatjes (ook in die van mijn college) dat NAD+ verandert in NADH?
 Ik heb m al, de beschrijving is niet helemaal compleet op de plaatjes en dat bracht mij in verwarring.
Ik heb m al, de beschrijving is niet helemaal compleet op de plaatjes en dat bracht mij in verwarring.

 Hoe schrijf ik een Turing Machine die een binair getal kan vermenigvuldigen met drie? Dus de input is een binair getal (zeg 11) en de uitkomst is aan het einde van de rit 1001. Hoe doe ik dit, welke toestanden heb ik nodig? Ik zie geen eenduidig patroon hierin om correcte toestanden te maken. Wie helpt me op weg?
Hoe schrijf ik een Turing Machine die een binair getal kan vermenigvuldigen met drie? Dus de input is een binair getal (zeg 11) en de uitkomst is aan het einde van de rit 1001. Hoe doe ik dit, welke toestanden heb ik nodig? Ik zie geen eenduidig patroon hierin om correcte toestanden te maken. Wie helpt me op weg?
Edit: Binaire getal + (binaire getal + 'n 0 toevoegen als laatste bit) = vermenigvuldiging met drie binair
[ Bericht 4% gewijzigd door Diabox op 08-12-2011 18:30:38 ]
 Ik ben een paar proeftoetsen aan het maken voor statistiek, nu kom ik de volgende vraag tegen: zou even kort omschrijven
Ik ben een paar proeftoetsen aan het maken voor statistiek, nu kom ik de volgende vraag tegen: zou even kort omschrijven
Onderzoek : 46 studenten, 23 controle groep, 23 experimentele groep.
Veronderstel dat in de populatie van alle studenten de test scores voor de controlegroep variëren volgens de N(56,9)-verdeling. Voor de experimentele groep is dit volgens de N(49,8) verdeling.
Vraag a: wat is de steekproef verdeling van de gemiddelde score x voor studenten die aan de controle groep worden toegewezen bij vele herhalingen van het experiment.
Ik begrijp niet helemaal wat ik nu moet doen. Als ik het goed begrijp, moet ik dus een betrouwbaarheidsinterval uitvoeren voor de mogelijke steekproeven? We hebben wel eens geoefend met het berekenen van een steekproef naar de populatie, maar niet vanuit een populatie naar een steekproef..
Heb t nu als volgt gedaan, maar weet bijna wel zeker dat dit niet klopt:
SE berekenen: wortel 56.9^2/ 23 = 11.86
Ga voor 95% zekerheid, dus Z = 1,96
Statistic +/- Z * SE, dus
56.9 + 1. 96 * 11. 86 = 80.15
56.9 - 1. 96 * 11.86 =33.65
x gemiddeld ligt met 95 % zekerheid tussen 33.65 en 80.15
Wie kan mij helpen en kan uitleggen hoe ik dit moet aanpakken??? Kom er niet meer uit!
Alvast bedankt
 Als je me vertelt wat je met de N-verdeling bedoelt kom ik misschien verder. De normale verdeling met midden mu en standaarddev sigma zien jullie als N(mu,sigma), is dat zo?Maar laten we wel wezen, dat was natuurlijk al lang duidelijk.
Als je me vertelt wat je met de N-verdeling bedoelt kom ik misschien verder. De normale verdeling met midden mu en standaarddev sigma zien jullie als N(mu,sigma), is dat zo?Maar laten we wel wezen, dat was natuurlijk al lang duidelijk.
 Chromatografie is een methode om stoffen van elkaar te scheiden en deze gescheiden van elkaar op te vangen of te meten.quote:
Chromatografie is een methode om stoffen van elkaar te scheiden en deze gescheiden van elkaar op te vangen of te meten.quote:Op zondag 18 december 2011 19:17 schreef vault_tec het volgende:
Iemand die mij simpel kan uitleggen wat chromatografie is en wat gas-vloeistof chromatografie is.
Meestal maakt men hierbij gebruik van een stationaire fase en een mobiele fase die zich baseren op polariteit van de stof. De stationaire fase is altijd de kolom en de mobiele fase is het gas of vloeistof.
In het geval van HPLC (high performance liquid chromatografie) wordt een vloeistof onder druk door een kolom gespoeld. Wanneer men een vreemde stof in de chromatograaf spuit zal deze een interactie hebben met het vloeistof (de mobiele fase) en oplossen.
De binnenkant van de kolom is gecoat met een laag die een bepaalde affiniteit geeft met moleculen, afhankelijk van de polariteit. Ieder molecuul zal dus graag interactie aangaan met de binnenkant van het kolom (de stationaire fase). Hoe meer affiniteit een molecuul heeft met jouw stationaire fase, hoe langer hij er over zal doen om door de kolom heen te komen.
Misschien snap je dan wel dat je vreemde monster/stof in de kolom dus helemaal uit elkaar wordt getrokken en afhankelijk van zijn polariteit in tig van verschillende stoffen wordt gesplitst.
Aan het einde van je chromatograaf zit een detector die de deeltjes zal meten en dit uitschrijft in een chromatogram doormiddel van piekjes.
Tot slot kun je dan aan de hand van het verschil van afstand tussen de piekjes uitrekenen wat het verschil in polariteit van de stoffen in je monster was.
Vergeet hierbij nooit om een bekende controle aan je monster toe te voegen (dus waar je de polariteit van kent) van dan kun je die stof in je chromatogram terugzoeken en vervolgens aan de hand daarvan berekenen welke stoffen allemaal vertegenwoordigd moeten zijn door de andere gemeten (onbekende) piekjes.
Gas-chromatografie is een vrijwel identieke methode, welke zich echter baseert op gas in plaats van vloeistof. Er zal hierbij een ander (meestal veel langer) kolom worden gebruikt en er wordt gebruik gemaakt van anderen vormen van affiniteit.

 Ik heb een vraag:
Ik heb een vraag:
Ik heb een practicum gedaan waarbij ik het gehalte vanille in Baukje moest bepalen. Eerst heb ik de vanille geextraheerd met chloroform. Daarna het chloroformextract behandeld met NaOH-oplossing.
Daarna de absorptie gemeten met een spectrofotometer.
Nu moet ik de extinctie uitzetten tegen de concentratie, en dan de concentratie van de gemeten monsteroplossing met interpolatie bepalen.
Nu heb ik geen idee hoe ik dat moet doen. Is er iemand die me op weg kan helpen?
 Hi iedereen,
Hi iedereen,
Er is heel veel wetenschappelijk onderzoek gedaan, naar hoe je het beste kunt leren.
Dus als je tentamens/examens hebt, zijn er allerlei trucjes die je kunt toepassen. Als je ze toepast, haal je veel hogere cijfers!
De trucjes zijn:
- Op tijd pauze houden (en weer beginnen)
Een Duitse wetenschapper (Ebbinghaus) heeft onderzoek gedaan naar de precieze tijden waarop je concentratie hoog is en wanneer je dingen vergeet. Het beste kan je 50 min leren, dan 10 min pauze nemen en dan weer 10 min herhalen wat je net hebt geleerd. Dan onthoud je het het beste en blijft je concentratie het best.
- Begrijpend lezen voor je begint
Voor je tekst begint te lezen, moet je eerst even nadenken: wat ga ik lezen? Waarom hoort dit bij het hoofdstuk? Dan heb je meteen een soort "kapstok" waaraan je de kennis ophangt! Dan onthoud je het daarna veel beter.
-Gebruik allebei de helften van je hersenen
Normaal gebruik je bij het leren alleen de linkerhelft van je hersenen (dit is de rationele kant, de feitelijke kant). Maar als je alle capaciteit van je hersenen wilt gebruiken moet je ook de rechterhelft (de creatieve, fantasievolle kant) van je hersenen gebruiken. Hoe doe je dit? Door bijvoorbeeld een mind map te maken van de stof! Mindmap is een kleurrijke weergave van de stof, in de vorm van een boom met takken.
-Samenvatting maken
Door een samenvatting te maken, onderscheid je de hoofd en bijzaken in de tekst.
- Aantekeningen delen met je vrienden
Je vrienden zien weer dingen die jij niet wist en andersom! Zo leer je dubbel zoveel.
- Ken jezelf!
Iedereen heeft een eigen manier van leren. Er zijn verschillende testen om je leerstijl te testen. Als je je leerstijl kent en deze toepast, ga je veel effectiever leren. Doe bijvoorbeeld de leerstijl van Kolb test op internet.
- Gebruik de inhoudsopgaven
Kijk goed naar de inhoudsopgaven, want dat is de structuur van je boek! Als je de structuur van je boek goed begrijpt, snap je ook veel beter waarom bepaalde dingen in het boek staan. Je hebt het " grote plaatje" van het boek door!
[ Bericht 7% gewijzigd door GlowMouse op 03-01-2012 14:11:48 ]kijk op www.efaqt.com !
 Waarschijnlijk heb je eerst van een aantal oplossingen met bekende concentratie de absorptie gemeten (of zijn de meetwaarden hiervan al gegeven). Als je deze meetwaarden dan zou uitzetten tegen de concentratie, dan kun je door de punten een lijn tekenen. Als je dan de absorptie meet van jouw onbekende oplossing, kun je uit de grafiek aflezen welke concentratie daarbij hoort.quote:
Waarschijnlijk heb je eerst van een aantal oplossingen met bekende concentratie de absorptie gemeten (of zijn de meetwaarden hiervan al gegeven). Als je deze meetwaarden dan zou uitzetten tegen de concentratie, dan kun je door de punten een lijn tekenen. Als je dan de absorptie meet van jouw onbekende oplossing, kun je uit de grafiek aflezen welke concentratie daarbij hoort.quote:Op dinsdag 3 januari 2012 13:32 schreef daantje1044 het volgende:
Ik heb een vraag:
Ik heb een practicum gedaan waarbij ik het gehalte vanille in Baukje moest bepalen. Eerst heb ik de vanille geextraheerd met chloroform. Daarna het chloroformextract behandeld met NaOH-oplossing.
Daarna de absorptie gemeten met een spectrofotometer.
Nu moet ik de extinctie uitzetten tegen de concentratie, en dan de concentratie van de gemeten monsteroplossing met interpolatie bepalen.
Nu heb ik geen idee hoe ik dat moet doen. Is er iemand die me op weg kan helpen?
Maar: je zult zien dat deze grafiek niet een rechte lijn is, waardoor je grote fouten zou maken bij de interpolatie. De truc om dit te omzeilen is de extinctie uitzetten tegen de concentratie. Daarvoor zul je eerst de gemeten absorptie moeten omrekenen naar transmissie en deze vervolgens omrekenen naar extinctie. De extinctie is wel lineair met de concentratie.
Hoe doe je dat:
• transmissie berekenen: transmissie = 1 - absorptie (in formulevorm: T = 1 - A)
• extinctie berekenen: E = - log(T)
• je kunt ook in 1 stap van absorptie naar extinctie: E = - log(1 - A)
• berekende extincties in een grafiek uitzetten tegen de concentratie
• absorptie van jouw monster omrekenen naar extinctie en met de grafiek de bijbehorende concentratie aflezen.
 Ok dank je wel. Ja ik heb met bekende concentratie de absorptie gemeten.quote:
Ok dank je wel. Ja ik heb met bekende concentratie de absorptie gemeten.quote:Op dinsdag 3 januari 2012 17:44 schreef lyolyrc het volgende:
[..]
Waarschijnlijk heb je eerst van een aantal oplossingen met bekende concentratie de absorptie gemeten (of zijn de meetwaarden hiervan al gegeven). Als je deze meetwaarden dan zou uitzetten tegen de concentratie, dan kun je door de punten een lijn tekenen. Als je dan de absorptie meet van jouw onbekende oplossing, kun je uit de grafiek aflezen welke concentratie daarbij hoort.
Maar: je zult zien dat deze grafiek niet een rechte lijn is, waardoor je grote fouten zou maken bij de interpolatie. De truc om dit te omzeilen is de extinctie uitzetten tegen de concentratie. Daarvoor zul je eerst de gemeten absorptie moeten omrekenen naar transmissie en deze vervolgens omrekenen naar extinctie. De extinctie is wel lineair met de concentratie.
Hoe doe je dat:
• transmissie berekenen: transmissie = 1 - absorptie (in formulevorm: T = 1 - A)
• extinctie berekenen: E = - log(T)
• je kunt ook in 1 stap van absorptie naar extinctie: E = - log(1 - A)
• berekende extincties in een grafiek uitzetten tegen de concentratie
• absorptie van jouw monster omrekenen naar extinctie en met de grafiek de bijbehorende concentratie aflezen.
Ik denk dat ik er hiermee wel uit kom!
Bedankt!

 Ik heb weer een vraag,
Ik heb weer een vraag,
Ik ga een potentiometrische titratie doen om het ijzergehalte in ijzertabletten te bepalen.
Nu is de vraag: Geef alle reactievergelijkingen die tijdens dit experiment plaatsvinden.
Maar het enige wat in de begeleidende tekst staat is dit:
Het gehalte ijzer in ijzertabletten kan bepaald worden door middel van een titratie met kaliumdichromaat, waarbij Fe2+ wordt geoxideerd door het dichromaat-ion volgens:
Fe2+ --> Fe3+ + e
Cr2O72- + 14 H+ +6e --> 2 Cr3+ + 7 H2O
Ik neem aan dat dat niet alle reactievergelijkingen zijn, maar heb ook geen idee welke er dan nog meer zouden moeten zijn?
Bij benodigheden staat wel dat ik ook nog fosforzuuroplossing moet gebruiken en zwavelzuuroplossing.
Ik ben volledig de kluts kwijt.
Kan iemand me helpen?
Zonder de reactievergelijkingen kan ik mijn berekeningen niet doen.
 De reacties die je hier geeft zijn alleen de halfreacties. Om te bepalen hoe ijzer en dichromaat samen gaan reageren, moet je de halfreacties nog samennemen. Dit kun je doen door het aantal elektronen dat de reductor (Fe2+) opneemt en de oxidator (Cr2O72-) te balanceren.quote:
De reacties die je hier geeft zijn alleen de halfreacties. Om te bepalen hoe ijzer en dichromaat samen gaan reageren, moet je de halfreacties nog samennemen. Dit kun je doen door het aantal elektronen dat de reductor (Fe2+) opneemt en de oxidator (Cr2O72-) te balanceren.quote:Op maandag 9 januari 2012 15:09 schreef daantje1044 het volgende:
Ik heb weer een vraag,
Ik ga een potentiometrische titratie doen om het ijzergehalte in ijzertabletten te bepalen.
Nu is de vraag: Geef alle reactievergelijkingen die tijdens dit experiment plaatsvinden.
Maar het enige wat in de begeleidende tekst staat is dit:
Het gehalte ijzer in ijzertabletten kan bepaald worden door middel van een titratie met kaliumdichromaat, waarbij Fe2+ wordt geoxideerd door het dichromaat-ion volgens:
Fe2+ --> Fe3+ + e
Cr2O72- + 14 H+ +6e --> 2 Cr3+ + 7 H2O
Ik neem aan dat dat niet alle reactievergelijkingen zijn, maar heb ook geen idee welke er dan nog meer zouden moeten zijn?
Bij benodigheden staat wel dat ik ook nog fosforzuuroplossing moet gebruiken en zwavelzuuroplossing.
Ik ben volledig de kluts kwijt.
Kan iemand me helpen?
Zonder de reactievergelijkingen kan ik mijn berekeningen niet doen.
Hoe doe je dat? Fe2+ staat 1 elektron af, terwijl Cr2O72- er 6 opneemt. Met andere woorden als de halfreactie van ijzer 6x nemen en die van dichromaat 1x dan is er balans, waarbij je de elektronen na optellen van de halfreacties kan wegstrepen.
Fe2+ --> Fe3+ + e |6x|
Cr2O72- + 14 H+ +6e --> 2 Cr3+ + 7 H2O |1x|
============================================================= +
6 Fe2+ + Cr2O72- + 14 H+ + 6 e- --> 6 Fe3+ + 2 Cr3+ + 7 H2O + 6 e-
Het toevoegen van zuur is nodig om de reactie te laten verlopen. Je kunt dit ook zien in de halfreactie van dichromaat. Op elke mol dichromaat moet er 14 mol H+ aanwezig zijn.
 Heb met een klasgenoot een projectje. Moeten een citroen batterij maken. Nu is dit best simpel alleen het probleem is dat hij de batterij heeft gemaakt en ik maak het verslag. Volgens mij heeft hij de waardes van serie bij parallel op geschreven en andersom.
Heb met een klasgenoot een projectje. Moeten een citroen batterij maken. Nu is dit best simpel alleen het probleem is dat hij de batterij heeft gemaakt en ik maak het verslag. Volgens mij heeft hij de waardes van serie bij parallel op geschreven en andersom.
Dus wat zou er verschillend moeten zijn bij serie en parallel? Ik heb hier de gegevens liggen maar hou die even voor mij zodat ik mensen niet laat twijfelen

 Dat ligt er aan wat je gemeten hebt. Als je verschillende weerstanden in serie schakelt, is de stroom door iedere weerstand gelijk, maar het voltage wat over de weerstand niet (of de weerstanden moeten allemaal dezelfde weerstand hebben). Als je ze parallel schakelt is het voltage over alle weerstanden even groot, maar de stroom die er door heen loopt niet (of, net als bij de serieschakeling, de weerstanden moeten allemaal dezelfde weerstand hebben).The biggest argument against democracy is a five minute discussion with the average voter.
Dat ligt er aan wat je gemeten hebt. Als je verschillende weerstanden in serie schakelt, is de stroom door iedere weerstand gelijk, maar het voltage wat over de weerstand niet (of de weerstanden moeten allemaal dezelfde weerstand hebben). Als je ze parallel schakelt is het voltage over alle weerstanden even groot, maar de stroom die er door heen loopt niet (of, net als bij de serieschakeling, de weerstanden moeten allemaal dezelfde weerstand hebben).The biggest argument against democracy is a five minute discussion with the average voter.
 Haihai, ik zit nu in het examenjaar van havo 5 met het ng-profiel en heb nogal veel moeite met natuurkunde. Ik begrijp het vak weliswaar niet. Voor mijn gevoel is het een miljoen keer moeilijker dan wiskunde en scheikunde bijvoorbeeld (die vakken begrijp ik veel beter). Ik kan wel bijles krijgen enzo en die krijg ik ook, maar wat kan ik nou doen om natuurkunde beter te begrijpen? Ik heb het totaal niet nodig voor me vervolgopleiding, maar wil het vak het liefst wel even last-minute met een voldoende of minimaal een 5 aflsluiten.
Haihai, ik zit nu in het examenjaar van havo 5 met het ng-profiel en heb nogal veel moeite met natuurkunde. Ik begrijp het vak weliswaar niet. Voor mijn gevoel is het een miljoen keer moeilijker dan wiskunde en scheikunde bijvoorbeeld (die vakken begrijp ik veel beter). Ik kan wel bijles krijgen enzo en die krijg ik ook, maar wat kan ik nou doen om natuurkunde beter te begrijpen? Ik heb het totaal niet nodig voor me vervolgopleiding, maar wil het vak het liefst wel even last-minute met een voldoende of minimaal een 5 aflsluiten.
Alvast bedankt!with love..♥
 Hoe kun je natuurkunde beter begrijpen? Lastige vraag hoor
Hoe kun je natuurkunde beter begrijpen? Lastige vraag hoor
Sowieso veel oefenen natuurlijk. Kunnen 'goochelen' met formules en dimensies is wel een vereiste. Weten wanneer je iets toepast, wanneer niet en wat uitzonderingsregels zijn. Dat kun je allemaal uit je hoofd leren. Maak samenvattingen. Welke onderdelen van de stof snap je wel, welke niet en waarom? Pas dan kan iemand je concreet verder helpen, hetzij via bijles of hier op FOK!
Wat mij altijd heeft geholpen is om stappenplannen te maken voor de meest voorkomende vragen. Op den duur leer je de stappen uit je hoofd en hoef je op het examen niet moeilijk te gaan lopen nadenken.
 Door gedachte-experimenten.quote:
Door gedachte-experimenten.quote:Op vrijdag 13 januari 2012 21:27 schreef zoem het volgende:
Hoe kun je natuurkunde beter begrijpen? Lastige vraag hoor
Sowieso veel oefenen natuurlijk. Kunnen 'goochelen' met formules en dimensies is wel een vereiste. Weten wanneer je iets toepast, wanneer niet en wat uitzonderingsregels zijn. Dat kun je allemaal uit je hoofd leren. Maak samenvattingen. Welke onderdelen van de stof snap je wel, welke niet en waarom? Pas dan kan iemand je concreet verder helpen, hetzij via bijles of hier op FOK!
Wat mij altijd heeft geholpen is om stappenplannen te maken voor de meest voorkomende vragen. Op den duur leer je de stappen uit je hoofd en hoef je op het examen niet moeilijk te gaan lopen nadenken.Croce e delizia cor. Misterioso, Misterioso altero, croce e delizia al cor.
 Zoals hierboven al is aangegeven, is een stappenplan opzetten voor de meest voorkomende vraagstukken een goede oplossing. Amerikanen doen het zo ook (GRE test), en dat blijkt enorm effectief. Zelfs pre-med students, die het vak alleen maar gekozen hebben om zo medicijnen te kunnen studeren, maken zo'n standaard test zonder problemen.quote:
Zoals hierboven al is aangegeven, is een stappenplan opzetten voor de meest voorkomende vraagstukken een goede oplossing. Amerikanen doen het zo ook (GRE test), en dat blijkt enorm effectief. Zelfs pre-med students, die het vak alleen maar gekozen hebben om zo medicijnen te kunnen studeren, maken zo'n standaard test zonder problemen.quote:Op vrijdag 13 januari 2012 21:07 schreef withloveproductions_ het volgende:
Haihai, ik zit nu in het examenjaar van havo 5 met het ng-profiel en heb nogal veel moeite met natuurkunde. Ik begrijp het vak weliswaar niet. Voor mijn gevoel is het een miljoen keer moeilijker dan wiskunde en scheikunde bijvoorbeeld (die vakken begrijp ik veel beter). Ik kan wel bijles krijgen enzo en die krijg ik ook, maar wat kan ik nou doen om natuurkunde beter te begrijpen? Ik heb het totaal niet nodig voor me vervolgopleiding, maar wil het vak het liefst wel even last-minute met een voldoende of minimaal een 5 aflsluiten.
Alvast bedankt!
Ik heb op het VWO heel erg met het vak geworsteld, omdat ik dacht dat ik de stof snapte, maar dat bleek vaak niet het geval te zijn. Mijn ervaring is dat als je de stof aan iemand anders uit kunt leggen, dat je het dan pas snapt.
Veel vraagstukken maken, en veel voorbeeldvraagstukken met antwoorden napluizen, om te zien of je de manier van oplossen helemaal snapt, helpt.
Natuurkunde is een vak waarbij zelfvertrouwen erg belangrijk is. Als je denkt, dit kan ik niet, dan gaat het ook echt niet lukken. Maar als je veel vraagstukken gemaakt hebt, en als je weet dat je het kunt, dan is het vak een makkie.Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson
 Natuurkunde is juist het vak waar de abstractie en reallife elkaar goed tegenkomen. Ik vond het heerlijk omdat het zo lekker logisch was.Wie dit leest is een lezer van dit.
Natuurkunde is juist het vak waar de abstractie en reallife elkaar goed tegenkomen. Ik vond het heerlijk omdat het zo lekker logisch was.Wie dit leest is een lezer van dit.
 Ok. Bedankt! Dat met het stappenplan heb ik ook geprobeerd. Maar ik ga het nu nog veel meer doen. Ook oude examens oefenen etc. Hopelijk haal ik minimaal een 5,5 dit keer..with love..♥
Ok. Bedankt! Dat met het stappenplan heb ik ook geprobeerd. Maar ik ga het nu nog veel meer doen. Ook oude examens oefenen etc. Hopelijk haal ik minimaal een 5,5 dit keer..with love..♥
 Het antwoord moet a zijn. Vind iemand dat deze vraag een beetje vreemd gesteld is?quote:De lichaamscellen van één individu bezitten niet alle hetzelfde pakket eiwitten. De variatie in eiwitvorming is het gevolg
Het antwoord moet a zijn. Vind iemand dat deze vraag een beetje vreemd gesteld is?quote:De lichaamscellen van één individu bezitten niet alle hetzelfde pakket eiwitten. De variatie in eiwitvorming is het gevolg
van:
A verschillende concentraties aan mRNA in de ribosomen;
B verschillende DNA-strengen in verschillende lichaamscellen.
a A is juist, B is onjuist;
b B is juist, A is onjuist;
c A en B zijn beide juist;
d A en B zijn beide onjuist.
Elke cel kan alle eiwitten produceren, maar niet in elke cel worden alle eiwitten geproduceerd. Dat komt omdat niet van elk stukje DNA, mRNA wordt gemaakt. Om dit te formuleren als concentratie vind ik een beetje vreemd.
Het antwoord impliceert namelijk, alsof alle mRNA in meer of mindere mate aanwezig is in de ribosomen. Dat is toch niet waar?
Naar mijn mening moet het d zijn.
 Het dikgedrukte is niet waar, want in elke cel behalve totipotente stamcellen zijn er delen van het DNA geblokkeerd. Dat is de reden dat verschillende celtypen een verschillend pakket aan eiwitten produceren. Je kunt dan stellen dat dit tot verschillende mRNA-concentraties leidt, maar ik vind dat net als jij nogal vaag.quote:
Het dikgedrukte is niet waar, want in elke cel behalve totipotente stamcellen zijn er delen van het DNA geblokkeerd. Dat is de reden dat verschillende celtypen een verschillend pakket aan eiwitten produceren. Je kunt dan stellen dat dit tot verschillende mRNA-concentraties leidt, maar ik vind dat net als jij nogal vaag.quote:Op maandag 23 januari 2012 16:39 schreef Warren het volgende:
[..]
Het antwoord moet a zijn. Vind iemand dat deze vraag een beetje vreemd gesteld is?
Elke cel kan alle eiwitten produceren, maar niet in elke cel worden alle eiwitten geproduceerd. Dat komt omdat niet van elk stukje DNA, mRNA wordt gemaakt. Om dit te formuleren als concentratie vind ik een beetje vreemd.
Het antwoord impliceert namelijk, alsof alle mRNA in meer of mindere mate aanwezig is in de ribosomen. Dat is toch niet waar?
Naar mijn mening moet het d zijn.
 Bedankt. Wat er eigenlijk had moeten staan in het vetgedrukte is dat iedere cel in het menselijk lichaam in zijn celkern de volledige genetische informatie bevat.Naar mijn mening zouden zij dat in één van de alternatieven moeten zetten, en niet de mRNA-concentraties.quote:
Bedankt. Wat er eigenlijk had moeten staan in het vetgedrukte is dat iedere cel in het menselijk lichaam in zijn celkern de volledige genetische informatie bevat.Naar mijn mening zouden zij dat in één van de alternatieven moeten zetten, en niet de mRNA-concentraties.quote:Op maandag 23 januari 2012 16:47 schreef lyolyrc het volgende:
[..]
Het dikgedrukte is niet waar, want in elke cel behalve totipotente stamcellen zijn er delen van het DNA geblokkeerd. [b]Dat is de reden dat verschillende celtypen een verschillend pakket aan eiwitten produceren.[/b] Je kunt dan stellen dat dit tot verschillende mRNA-concentraties leidt, maar ik vind dat net als jij nogal vaag.
 Nog een vraagje. Vind iemand ook dat deze vraag slecht geformuleerd is? Als je de celkern weghaald, dan wordt er geen mRNA meer gemaakt. Dat leidt er toe dat er geen eiwitten worden gemaakt. Echter, door het weghalen van de celkern, haal je niet de ribosomen weg, dus in theorie kunnen er nog eiwitten ontstaan als er nog mRNA werd afgelezen.quote:Indien experimenteel uit een cel de kern wordt weggenomen, is de cel niet meer in staat:
Nog een vraagje. Vind iemand ook dat deze vraag slecht geformuleerd is? Als je de celkern weghaald, dan wordt er geen mRNA meer gemaakt. Dat leidt er toe dat er geen eiwitten worden gemaakt. Echter, door het weghalen van de celkern, haal je niet de ribosomen weg, dus in theorie kunnen er nog eiwitten ontstaan als er nog mRNA werd afgelezen.quote:Indien experimenteel uit een cel de kern wordt weggenomen, is de cel niet meer in staat:
A eiwitmoleculen te vormen;
B mRNA te vormen.
a A is juist, B is onjuist;
b B is juist, A is onjuist;
c A en B zijn beide juist;
d A en B zijn beide onjuist.
Kortom, naar mijn mening is deze vraag niet éénduidig te bentwoorden. Iemand mee eens?
 Ben het helemaal met je eens. Juist vanwege dit soort vragen ben ik niet zo'n fan van biologie. Je kunt nuance moeilijk in een meerkeuzevraag vangen.quote:
Ben het helemaal met je eens. Juist vanwege dit soort vragen ben ik niet zo'n fan van biologie. Je kunt nuance moeilijk in een meerkeuzevraag vangen.quote:Op maandag 23 januari 2012 17:18 schreef Warren het volgende:
[..]
Nog een vraagje. Vind iemand ook dat deze vraag slecht geformuleerd is? Als je de celkern weghaald, dan wordt er geen mRNA meer gemaakt. Dat leidt er toe dat er geen eiwitten worden gemaakt. Echter, door het weghalen van de celkern, haal je niet de ribosomen weg, dus in theorie kunnen er nog eiwitten ontstaan als er nog mRNA werd afgelezen.
Kortom, naar mijn mening is deze vraag niet éénduidig te bentwoorden. Iemand mee eens?
 quote:
quote:Op maandag 23 januari 2012 17:23 schreef lyolyrc het volgende:
[..]
Ben het helemaal met je eens. Juist vanwege dit soort vragen ben ik niet zo'n fan van biologie. Je kunt nuance moeilijk in een meerkeuzevraag vangen.Ok, bedankt. Deze twee vragen zijn afkomstig uit één van de eerste hoofdstukken uit een fysiologieboek. Ik schrok een beetje van het feit dat ik de helft van de vragen fout had, maar het lijkt er op dat het toch komt omdat het veelal dit soort ambigue vragen zijn, waarop je eigenlijk geen exact antwoord kan geven. Het verbaast mij ook dat zij zulke vragen er in hebben verwerkt, waar je als je heel nauwkeurig bent, meerdere kanten op kan redeneren.
Ik moet wel zeggen dat dit wel een van de slechtere meerkeuzevragen zijn die ik ooit ben tegengekomen, ook al ben ik in het algemeen geen fan van meerkeuzevragen.
 Hallo!
Hallo!
Kan iemand mij uitleggen hoe je de POWER moet berekenen [statistiek] met onderstaande gegevens:
H0 μ = 100, σ = 10, n = 50
en Ha μ = 105
Ik dacht dus zelf 105-100 / [10/wortel 50] dan z waarde opzoeken met bijbehorende kans
Ik kom maar niet op het juiste antwoord:: wat doe ik verkeerd???
 Deze vraag kun je het best stellen in het [Bèta wiskunde] Huiswerk- en vragentopicquote:
Deze vraag kun je het best stellen in het [Bèta wiskunde] Huiswerk- en vragentopicquote:Op donderdag 26 januari 2012 14:26 schreef RedroseSK het volgende:
Hallo!
Kan iemand mij uitleggen hoe je de POWER moet berekenen [statistiek] met onderstaande gegevens:
H0 μ = 100, σ = 10, n = 50
en Ha μ = 105
Ik dacht dus zelf 105-100 / [10/wortel 50] dan z waarde opzoeken met bijbehorende kans
Ik kom maar niet op het juiste antwoord:: wat doe ik verkeerd???
 Morgen moet ik voor een praktisch handelingsdeel een titratie uitvoeren (ik zit nu in 6vwo). We gebruiken als indicator standaard fenolftaleine, een indicator met een omslagpunt van 8,2-10.
Morgen moet ik voor een praktisch handelingsdeel een titratie uitvoeren (ik zit nu in 6vwo). We gebruiken als indicator standaard fenolftaleine, een indicator met een omslagpunt van 8,2-10.
Wanneer het zuur een pH bereikt van minimaal 8,2, wordt de oplossing paars/roze. Echter, hierdoor kunnen we niets zeggen over het equivalentiepunt van de stof, omdat de pH van de oplossing tussen de 8,2 en 10 ligt. Dit terwijl je, om iets nuttigs te kunnen zeggen over bijvoorbeeld de molariteit van het zuur, uiteindelijk een pH van 7 nodig hebt, om iets over het aantal opgeloste mol te kunnen zeggen.
Kortom, wat kun je wel concluderen als je weet dat de pH tussen de 8,2 en 10 ligt?Not everything that counts can be counted, and not everything that can be counted counts
 Ik heb even een correctie in je tekst doorgevoerd. Een oplossing heeft namelijk een pH, maar een zure stof op zich niet. We gebruiken de term pKa om weer te geven hoe zuur een stof is. Bij pH = pKa is 50% van het zuur in de geassocieerde vorm (HA) en 50% in de gedissocieerde vorm (A-) aanwezig.quote:
Ik heb even een correctie in je tekst doorgevoerd. Een oplossing heeft namelijk een pH, maar een zure stof op zich niet. We gebruiken de term pKa om weer te geven hoe zuur een stof is. Bij pH = pKa is 50% van het zuur in de geassocieerde vorm (HA) en 50% in de gedissocieerde vorm (A-) aanwezig.quote:Op dinsdag 31 januari 2012 23:03 schreef Manu. het volgende:
Morgen moet ik voor een praktisch handelingsdeel een titratie uitvoeren (ik zit nu in 6vwo). We gebruiken als indicator standaard fenolftaleine, een indicator met een omslagpunt van 8,2-10.
Wanneer het zuur de oplossing een pH bereikt van minimaal 8,2, wordt de oplossing paars/roze. Echter, hierdoor kunnen we niets zeggen over het equivalentiepunt van de stof, omdat de pH van de oplossing tussen de 8,2 en 10 ligt. Dit terwijl je, om iets nuttigs te kunnen zeggen over bijvoorbeeld de molariteit van het zuur, uiteindelijk een pH van 7 nodig hebt, om iets over het aantal opgeloste mol te kunnen zeggen.
Kortom, wat kun je wel concluderen als je weet dat de pH tussen de 8,2 en 10 ligt?
Je moet je niet blindstaren op het omslagpunt van fenolftaleïne. Het omslagpunt ligt weliswaar hoger dan pH 7, maar bij het titreren overbrug je het gebied van pH 6 naar pH 8 met enkele druppels base.
 Om even aan te vullen; de specifieke pH-indicator die je dient te gebruiken hangt af van welke titratie je precies uitvoert. Concreter gezegd, het hangt af van de sterkte van het zuur en de base die je gebruikt. Een zwak zuur is via zn pH-reactie gekoppeld aan zn geconjungeerde base; schoolvoorbeeld in dezen is CH3COOH ⇌ CH3COO- + H+, oftewel de dissociatie van azijnzuur tot het proton en het acetaat-ion. Máár... het acetaat-ion is zèlf ook een zwakke base middels de pH-reactie CH3COO- + H2O ⇌ CH3COOH + OH-. Als je dus Azijnzuur gaat titreren met NaOH en je bereikt het equivalentiepunt, heb je alle Azijnzuur omgezet tot Acetaat, en omdat Acetaat basische activiteit vertoont zal je uiteindelijke oplossing geen pH 7 zijn, maar iets hoger (ong. pH 8). Op dit gegeven dien je in te spelen met je indicatorkeuze, en fenolftaleïne is idd degene die zn kleuromslag rond de pH 8 heeft zitten.
Om even aan te vullen; de specifieke pH-indicator die je dient te gebruiken hangt af van welke titratie je precies uitvoert. Concreter gezegd, het hangt af van de sterkte van het zuur en de base die je gebruikt. Een zwak zuur is via zn pH-reactie gekoppeld aan zn geconjungeerde base; schoolvoorbeeld in dezen is CH3COOH ⇌ CH3COO- + H+, oftewel de dissociatie van azijnzuur tot het proton en het acetaat-ion. Máár... het acetaat-ion is zèlf ook een zwakke base middels de pH-reactie CH3COO- + H2O ⇌ CH3COOH + OH-. Als je dus Azijnzuur gaat titreren met NaOH en je bereikt het equivalentiepunt, heb je alle Azijnzuur omgezet tot Acetaat, en omdat Acetaat basische activiteit vertoont zal je uiteindelijke oplossing geen pH 7 zijn, maar iets hoger (ong. pH 8). Op dit gegeven dien je in te spelen met je indicatorkeuze, en fenolftaleïne is idd degene die zn kleuromslag rond de pH 8 heeft zitten.
Een soortgelijk verhaal gaat voor als je NH3-oplossing (NH4OH, ammonia) met HCl gaat titreren; een oplossing van een zwakke base titreren met een sterk zuur zal bij het equivalentiepunt alleen een zwak zuur opleveren, dus dien je een indicator te kiezen waarbij het kleuromslagpunt rond de pH 6 ligt.
Maar net wat Lyolyrc zegt, dan praten we over concentraties van 10-6 M, oftewel in de praktijk 1 of 2 druppeltjes titer-oplossing meer.
 Wie kan dit voor me beantwoorden?
Wie kan dit voor me beantwoorden?
http://www.scribd.com/doc/80471940/Literatuur-Nederlands
Alvast bedankt.ss
 Ik heb een klein vraagje.
Ik heb een klein vraagje.
Als men zegt: "Je leidt 0.5 Mol waterstofchloride gas in 550 mL zuiver water." en je moet de nieuwe pH berekenen van die nieuwe oplossing, hoeveel mL / gr is 0.5 Mol waterstofchloride gas?
 Door het aantal mol HCl te vermenigvuldigen met de molmassa van HCl krijg je de massa van het gas. Het aantal ml HCl kun je vinden door het aantal mol te vermenigvuldigen met het molair volume.
Door het aantal mol HCl te vermenigvuldigen met de molmassa van HCl krijg je de massa van het gas. Het aantal ml HCl kun je vinden door het aantal mol te vermenigvuldigen met het molair volume.
Forum Opties Forumhop: Hop naar: