W&T Wetenschap & Technologie
Een plek om te discussiŰren over wetenschappelijke onderwerpen, wetenschappelijke problemen, technologische projecten en grootse uitvindingen.



Vroegah toen je nog WFL had was er een topic over het inbouwen van 1 onnatuurlijk aminozuur. (nouja onnatuurlijk voor eiwitten)
[schokkend] ÚÚnentwintig aminozuren in een eiwit !
Gisteren viel mijn oog op een artikel in nature dat het veld niet stil heeft gestaan. Men kan tegenwoordig met hoge efficientie aminuzuren inbouwen dmv tRNA die ipv een triplet codon een quadruplet codon kan lezen. Dit zorgt er voor dat er ipv 1 onnatuurlijk amminozuur per eiwit ingebouwd kan worden (want er is maar 1 codon over de rest is in gebruik) er nu tot ongeveer 200 verschillende amminozuren ingebouwd kunnen worden. De auteurs laten ook zien dat het werkt door 2 verschillende aminozuren op verschillende plekken in te bouwen. Deze 2 amminozuren gebruiken active groepen die veel in click chemistry gebruikt worden en het lukt de auteurs om deze aan elkaar te koppelen.
Kortom veel mogenlijkheden! Dit was een gerichte evolutie naar quadruplet codon gebruik en laat zo maar weer zien dat de natuur tot veel in staat is mits er maar selectie criterea voor zijn.
bronnen nature
http://www.nature.com/nat(...)summ/e100318-16.html
http://www.nature.com/nat(...)ull/nature08817.html
[schokkend] ÚÚnentwintig aminozuren in een eiwit !
Gisteren viel mijn oog op een artikel in nature dat het veld niet stil heeft gestaan. Men kan tegenwoordig met hoge efficientie aminuzuren inbouwen dmv tRNA die ipv een triplet codon een quadruplet codon kan lezen. Dit zorgt er voor dat er ipv 1 onnatuurlijk amminozuur per eiwit ingebouwd kan worden (want er is maar 1 codon over de rest is in gebruik) er nu tot ongeveer 200 verschillende amminozuren ingebouwd kunnen worden. De auteurs laten ook zien dat het werkt door 2 verschillende aminozuren op verschillende plekken in te bouwen. Deze 2 amminozuren gebruiken active groepen die veel in click chemistry gebruikt worden en het lukt de auteurs om deze aan elkaar te koppelen.
Kortom veel mogenlijkheden! Dit was een gerichte evolutie naar quadruplet codon gebruik en laat zo maar weer zien dat de natuur tot veel in staat is mits er maar selectie criterea voor zijn.
bronnen nature
http://www.nature.com/nat(...)summ/e100318-16.html
http://www.nature.com/nat(...)ull/nature08817.html
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Wat vinden jullie hiervan?
(waarom reageert niemand iets waar het vroegere topic ook al last van had)
(waarom reageert niemand iets waar het vroegere topic ook al last van had)
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Het is nogal geavanceerde materie. Ik denk dat velen het niet zo goed kunnen volgen. Wat het toevoegen van meer aminozuren toevoegd is mij nog onduidelijk. De 20tal die er al zijn, zijn al verantwoordelijk voor miljoenen verschillende eiwitstructuren.quote:Op vrijdag 19 maart 2010 15:47 schreef Bosbeetle het volgende:
Wat vinden jullie hiervan?
(waarom reageert niemand iets waar het vroegere topic ook al last van had)
Geld maakt meer kapot dan je lief is.
Het zijn sterke ruggen die vrijheid en weelde kunnen dragen
Het zijn sterke ruggen die vrijheid en weelde kunnen dragen


nou zoals in de OP gezegd het toevoegen van actieve groepen, denk aan een gekoppeld medicijn op een specifieke plek aan een drager eiwit. Die groep kan dan zo gemaakt worden dat hij alleen in specifieke condities losgelaten wordt, bijvoorbeeld de lage pH van een lysozoom, of de reducerende condities in een cel. Je zou het bijvoorbeeld kunnen koppelen aan een groeifactor die opgereguleerd is in een kanker en dan zo die specifieke cellen targetten. Volgensmij zijn de mogelijkheden legio.quote:Op vrijdag 19 maart 2010 16:01 schreef Digi2 het volgende:
[..]
Het is nogal geavanceerde materie. Ik denk dat velen het niet zo goed kunnen volgen. Wat het toevoegen van meer aminozuren toevoegd is mij nog onduidelijk. De 20tal die er al zijn, zijn al verantwoordelijk voor miljoenen verschillende eiwitstructuren.
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Volgens mij kan dat ook al met de bestaande eiwitten of niet?quote:Op vrijdag 19 maart 2010 16:03 schreef Bosbeetle het volgende:
[..]
nou zoals in de OP gezegd het toevoegen van actieve groepen, denk aan een gekoppeld medicijn op een specifieke plek aan een drager eiwit. Die groep kan dan zo gemaakt worden dat hij alleen in specifieke condities losgelaten wordt, bijvoorbeeld de lage pH van een lysozoom, of de reducerende condities in een cel. Volgensmij zijn de mogelijkheden legio.
Geld maakt meer kapot dan je lief is.
Het zijn sterke ruggen die vrijheid en weelde kunnen dragen
Het zijn sterke ruggen die vrijheid en weelde kunnen dragen


Niet zo specifiek dan koppel je aan een lysine die in het eiwit voorkomt maar vaak zitten er meerdere lysines in het eiwit dus weet je nooit waar je precies aan koppelt. Ook de daadwerkelijke chemische koppeling is beperkt bij lysines.quote:Op vrijdag 19 maart 2010 16:05 schreef Digi2 het volgende:
[..]
Volgens mij kan dat ook al met de bestaande eiwitten of niet?
In dit geval kan het zelfs zo dat je het medicijn maakt met een aminozuur groep en dat hij dan direct ingebouwd wordt. Denk in dat geval ook aan het creeren van een grote poly-medicijn structuur gewoon door een sequentie te maken (zo kun je dus een medicijn maken met heel veel active groepen, die ruimtelijk op specifieke plaatsen zit)
Naast deze toepassingen zijn natuurlijk de experimentele tools die je hier mee kunt maken onbegrensd.
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


De reactieve zones zitten vaak ingebed in een 3 dimensionale eiwitstructuur en alleen eiwitten met een specifieke structuur kunnen dan reageren. Met meerdere aminozuren is het misschien eenvoudiger maar dan nog. Menselijk DNA van een 3 naar 4 codon systeem brengen heeft nogal wat voeten in de aarde. Voorlopig zie ik nog geen mensen met een 4 codon verschijnen.quote:Op vrijdag 19 maart 2010 16:10 schreef Bosbeetle het volgende:
Niet zo specifiek dan koppel je aan een lysine die in het eiwit voorkomt maar vaak zitten er meerdere lysines in het eiwit dus weet je nooit waar je precies aan koppelt. Ook de daadwerkelijke chemische koppeling is beperkt bij lysines.
In dit geval kan het zelfs zo dat je het medicijn maakt met een aminozuur groep en dat hij dan direct ingebouwd wordt. Denk in dat geval ook aan het creeren van een grote poly-medicijn structuur gewoon door een sequentie te maken (zo kun je dus een medicijn maken met heel veel active groepen, die ruimtelijk op specifieke plaatsen zit)
Naast deze toepassingen zijn natuurlijk de experimentele tools die je hier mee kunt maken onbegrensd.
Geld maakt meer kapot dan je lief is.
Het zijn sterke ruggen die vrijheid en weelde kunnen dragen
Het zijn sterke ruggen die vrijheid en weelde kunnen dragen


Nee dat is ook helemaal niet de bedoeling. Zie het gewoon als een uitbereiding op de eiwitproductie zoals die nu gedaan wordt in bacteriŰn.quote:Op vrijdag 19 maart 2010 16:27 schreef Digi2 het volgende:
[..]
De reactieve zones zitten vaak ingebed in een 3 dimensionale eiwitstructuur en alleen eiwitten met een specifieke structuur kunnen dan reageren. Met meerdere aminozuren is het misschien eenvoudiger maar dan nog. Menselijk DNA van een 3 naar 4 codon systeem brengen heeft nogal wat voeten in de aarde. Voorlopig zie ik nog geen mensen met een 4 codon verschijnen.
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Het cyclisch maken van eiwitten bijvoorbeeld een goede toepassing (wat de auteurs van het artikel ook hebben gedaan en dus mogelijk is). Je hebt eiwitten die door een conformatie verandering actief zijn. Voor die conformatie verandering is vaak een ander eiwit nodig. Als je nou door 2 groepen van niet natuurlijk amminozuren aan elkaar kunt koppelen de conformatie verandert en zo een constitutief actief eiwit kunt maken en zuiveren.
Zoals je hierboven ziet, De rode en de blauwe groep komen normaal niet in eiwitten voor. Door het toepassen van click chemistry kunnen door het toevoegen van koper die 2 groepen aan elkaar gekoppeld worden. In het gelletje zie je dat de aan elkaar gekoppelde vorm iets sneller loopt.
[ Bericht 8% gewijzigd door Bosbeetle op 19-03-2010 16:41:27 ]
Zoals je hierboven ziet, De rode en de blauwe groep komen normaal niet in eiwitten voor. Door het toepassen van click chemistry kunnen door het toevoegen van koper die 2 groepen aan elkaar gekoppeld worden. In het gelletje zie je dat de aan elkaar gekoppelde vorm iets sneller loopt.
[ Bericht 8% gewijzigd door Bosbeetle op 19-03-2010 16:41:27 ]
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Dat gaan leken dus niet snappen hequote:Op vrijdag 19 maart 2010 16:31 schreef Bosbeetle het volgende:
Het cyclisch maken van eiwitten bijvoorbeeld een goede toepassing (wat de auteurs van het artikel ook hebben gedaan en dus mogelijk is). Je hebt eiwitten die door een conformatie verandering actief zijn. Voor die conformatie verandering is vaak een ander eiwit nodig. Als je nou door 2 groepen van niet natuurlijk amminozuren aan elkaar kunt koppelen de conformatie verandert en zo een constitutief actief eiwit kunt maken en zuiveren.
[ afbeelding ]
Zoals je hierboven ziet, De rode en de blauwe groep komen normaal niet in eiwitten voor. Door het toepassen van click chemistry kunnen door het toevoegen van koper die 2 groepen aan elkaar gekoppeld worden. In het gelletje zie je dat de aan elkaar gekoppelde vorm iets sneller loopt.
"De wetende is karig met zijn woorden; de woordenrijke is onwetend."
Lao-Tse
PSN(ps3): Appelknaller
Lao-Tse
PSN(ps3): Appelknaller


Sorry je ziet een 2de bandje ontstaan die 2de is iets anders dan die eerste. Dat is een manier om eiwit te laten zien.quote:Op vrijdag 19 maart 2010 17:56 schreef Appelknaller het volgende:
[..]
Dat gaan leken dus niet snappen he
Wees trouwens blij dat ik de MS spectra er niet bij heb gezet
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Dat andere eiwit gaat dus sneller door de gel omdat die aminozuren aan elkaar gekoppeld zijn, dus minder weerstand van de polyacryl? (Ik neem aan dat het een polyacrylgel is)quote:Op vrijdag 19 maart 2010 18:10 schreef Bosbeetle het volgende:
[..]
Sorry je ziet een 2de bandje ontstaan die 2de is iets anders dan die eerste. Dat is een manier om eiwit te laten zien.
Wees trouwens blij dat ik de MS spectra er niet bij heb gezet
"De wetende is karig met zijn woorden; de woordenrijke is onwetend."
Lao-Tse
PSN(ps3): Appelknaller
Lao-Tse
PSN(ps3): Appelknaller


ja die gekoppelde versie is iets globulairder dus kan hij er wat sneller doorquote:Op vrijdag 19 maart 2010 18:57 schreef Appelknaller het volgende:
[..]
Dat andere eiwit gaat dus sneller door de gel omdat die aminozuren aan elkaar gekoppeld zijn, dus minder weerstand van de polyacryl? (Ik neem aan dat het een polyacrylgel is)
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Interessant topic trouwens 
"De wetende is karig met zijn woorden; de woordenrijke is onwetend."
Lao-Tse
PSN(ps3): Appelknaller
Lao-Tse
PSN(ps3): Appelknaller


Doe is. Ik ben gek op dingen die ik niet snap.quote:Op vrijdag 19 maart 2010 18:10 schreef Bosbeetle het volgende:
Wees trouwens blij dat ik de MS spectra er niet bij heb gezet


dus in feite worrd het gewoon makkelijker voor ons om eiwitten te manipuleren en voor bepaalde doeleinden te specificeren, bijvoorbeeld voor mediyijnen. geld dan niet hetzelfde voor de iets minder gunstige ontwikkelingen? (ik noem maar een dwarsstraat, biologische wapens)


Tja er is natuurlijk altijd een schaduwzijde maar die is er bij alles. Einstein dacht heus niet aan een atoombom toen hij bezig wat met zijn relativiteits theorie maar ook niet aan het GPS systeem dat dankzij zijn theorie ook werkt.quote:Op woensdag 24 maart 2010 09:42 schreef ptb het volgende:
dus in feite worrd het gewoon makkelijker voor ons om eiwitten te manipuleren en voor bepaalde doeleinden te specificeren, bijvoorbeeld voor mediyijnen. geld dan niet hetzelfde voor de iets minder gunstige ontwikkelingen? (ik noem maar een dwarsstraat, biologische wapens)
Maak anders een centraal onderwerp over dit onderwerp opzich is de ethiek achter de wetenschap interesant genoeg
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Ik herinner me dat er wel meer dan 21 aminozuren zijn. Maar die zijn net als alle andere eiwitten 100% natuurlijk hoor. Ze komen alleen niet zoveel voor en zijn veel later ontdekt dan die eerste 20 stuks.


Klinkt interessant. En de mogelijkheden lijken legio. Zeker in bestrijding van ziektes. Alleen is het de vraag hoe de nieuwe structuur wordt opgenomen in een lichaam. Reageert het wel zoals verwacht? Of denkt het lichaam, je bekijkt het maar en plegen cellen massaal apoptose?
Ook kan je je afvragen hoe effectief het zal zijn. de 3 codon had 4*4*4 = 64 mogelijkheden. Toch zijn er 20 aminizuren. De laatste plek in de codon is dus al van minder invloed aangezien in veel gevallen er eenzelfde aminozuur uitrolt. Wat is de reden daarvan? Dat kan misschien zo wel worden verklaard.
Ik ben wel benieuwd hoe het zit met de kans op fouten. Hoe groter een codon des te groter wordt de kans op een fout in aminozuur/eiwit. Komen er veel mer fouten en wat heeft dit voor invloed zijn wel belangrijke vragen dan.
Ik vind het een mooie doorbraak, die je zeker op bacterieel niveau moet zien. Uitkomsten van testen hiermee kunnen vele inzichten geven in de natuur en hoe die reageert op bepaalde verandering, of in de manier waarop wij ziektes beter kunnen bestrijden etc.
Ook kan je je afvragen hoe effectief het zal zijn. de 3 codon had 4*4*4 = 64 mogelijkheden. Toch zijn er 20 aminizuren. De laatste plek in de codon is dus al van minder invloed aangezien in veel gevallen er eenzelfde aminozuur uitrolt. Wat is de reden daarvan? Dat kan misschien zo wel worden verklaard.
Ik ben wel benieuwd hoe het zit met de kans op fouten. Hoe groter een codon des te groter wordt de kans op een fout in aminozuur/eiwit. Komen er veel mer fouten en wat heeft dit voor invloed zijn wel belangrijke vragen dan.
Ik vind het een mooie doorbraak, die je zeker op bacterieel niveau moet zien. Uitkomsten van testen hiermee kunnen vele inzichten geven in de natuur en hoe die reageert op bepaalde verandering, of in de manier waarop wij ziektes beter kunnen bestrijden etc.
Kein gewalt! Wir sind das volk!
Steps taken forwards but sleepwalking back again.
''And the Germans kill the Jews, And the Jews kill the Arabs, And the Arabs kill the hostages
And that is the news.''
Steps taken forwards but sleepwalking back again.
''And the Germans kill the Jews, And the Jews kill the Arabs, And the Arabs kill the hostages
And that is the news.''


Ja er zijn honderden aminozuren er worden er alleen maar 21 ingebouwd in eiwitten. In mijn eerste post heb ik ook staan 'natuurlijk voorkomen in eiwitten'. Er is 1 aminozuur dat wel buiten het normale reeksje valt en die recent is ontdekt en dat is een bacterie die een selanolysine kan inbouwen.quote:Op donderdag 25 maart 2010 14:37 schreef Gray het volgende:
Ik herinner me dat er wel meer dan 21 aminozuren zijn. Maar die zijn net als alle andere eiwitten 100% natuurlijk hoor. Ze komen alleen niet zoveel voor en zijn veel later ontdekt dan die eerste 20 stuks.
[ Bericht 0% gewijzigd door Bosbeetle op 25-03-2010 17:18:23 ]
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


technisch gezien is dat vrij makkelijk, dat heet wobble pairing het tRNA herkent de codon maar er zijn ook tRNA's met op de derde plek een inositol die bind niet specifiek aan A,T,C of G maar is dus flexibel. Waarom dat zo is, dat is zo geevolueerd maar de selectie erachter is mij niet bekendquote:Op donderdag 25 maart 2010 16:16 schreef One_of_the_few het volgende:
Klinkt interessant. En de mogelijkheden lijken legio. Zeker in bestrijding van ziektes. Alleen is het de vraag hoe de nieuwe structuur wordt opgenomen in een lichaam. Reageert het wel zoals verwacht? Of denkt het lichaam, je bekijkt het maar en plegen cellen massaal apoptose?
Ook kan je je afvragen hoe effectief het zal zijn. de 3 codon had 4*4*4 = 64 mogelijkheden. Toch zijn er 20 aminizuren. De laatste plek in de codon is dus al van minder invloed aangezien in veel gevallen er eenzelfde aminozuur uitrolt. Wat is de reden daarvan? Dat kan misschien zo wel worden verklaard.
In het artikel boven besproken hebben ze ook de foute incorporatie gemeten en die is net zo laag als bij een triplet codon, tussen 10 -2 tot 10 -4 fouten per codon.quote:Ik ben wel benieuwd hoe het zit met de kans op fouten. Hoe groter een codon des te groter wordt de kans op een fout in aminozuur/eiwit. Komen er veel mer fouten en wat heeft dit voor invloed zijn wel belangrijke vragen dan.
Ik vind het een mooie doorbraak, die je zeker op bacterieel niveau moet zien. Uitkomsten van testen hiermee kunnen vele inzichten geven in de natuur en hoe die reageert op bepaalde verandering, of in de manier waarop wij ziektes beter kunnen bestrijden etc.
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Welke bacterie??quote:Op donderdag 25 maart 2010 17:11 schreef Bosbeetle het volgende:
[..]
Ja er zijn honderden aminozuren er worden er alleen maar 21 ingebouwd in eiwitten. In mijn eerste post heb ik ook staan 'natuurlijk voorkomen in eiwitten'. Er is 1 aminozuur dat wel buiten het normale reeksje valt en die recent is ontdekt en dat is een bacterie die een selanolysine kan inbouwen.
"De wetende is karig met zijn woorden; de woordenrijke is onwetend."
Lao-Tse
PSN(ps3): Appelknaller
Lao-Tse
PSN(ps3): Appelknaller


het is een selenocysteine ipv lysin en dat is al ontdekt in 1986quote:
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Zoals je zelf al aangeeft is de reden dat er van de mogelijkheden vele hetzelfde opleveren fout tolerantie (meestal 3 codons voor hetzelfde aminozuur). Daar blijkt maar weer eens uit wat voor een krachtig systeem dit is. Enerzijds flexibel en anderzijds robuust.quote:Op donderdag 25 maart 2010 16:16 schreef One_of_the_few het volgende:
Klinkt interessant. En de mogelijkheden lijken legio. Zeker in bestrijding van ziektes. Alleen is het de vraag hoe de nieuwe structuur wordt opgenomen in een lichaam. Reageert het wel zoals verwacht? Of denkt het lichaam, je bekijkt het maar en plegen cellen massaal apoptose?
Ook kan je je afvragen hoe effectief het zal zijn. de 3 codon had 4*4*4 = 64 mogelijkheden. Toch zijn er 20 aminizuren. De laatste plek in de codon is dus al van minder invloed aangezien in veel gevallen er eenzelfde aminozuur uitrolt. Wat is de reden daarvan? Dat kan misschien zo wel worden verklaard.


Er zijn natuurlijk ook prefere codons er zijn organismen die codons anders gebruiken. Dieren hebben een ander codon gebruik dan bacteriŰn. Ook kan codon gebruik (bijvoorbeeld aminozuren die langzamer worden ingebouwd) zorgen dat een bepaalde vouwing in het eiwit (beter) verloopt. Als het ware een soort vouwstop. Soms hebben namelijk mutaties die wel voor de zelfde amminozuur volgorde zorgen toch een effect op eiwit niveau.
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Kan dat serieus? Met welke codons van welke aminozuren worden zijn er dan van die 'grote' tijdsverschillen (okÚ okÚ, nanoseconden)? Is dat dan zo'n verschil in tijd (okÚ okÚ, nanoseconden) dat de tertiare/quarternaire structuur anders kan worden als er ÚÚn ander codon gebruikt wordt (van hetzelfde aminozuur) ?quote:Op zondag 28 maart 2010 12:12 schreef Bosbeetle het volgende:
Ook kan codon gebruik (bijvoorbeeld aminozuren die langzamer worden ingebouwd) zorgen dat een bepaalde vouwing in het eiwit (beter) verloopt. Als het ware een soort vouwstop. Soms hebben namelijk mutaties die wel voor de zelfde amminozuur volgorde zorgen toch een effect op eiwit niveau.


Nou kijk maar eens als je een eiwit wilt produceren in bacteriŰn dan kun je DH5alpha strain gebruiken en soms werkt het daar niet in en wel in bl10 codon+ (die is zo gemaakt dat hij beter met mamalian codons om kan springen) daar zie je dus duidelijk een expressie effect door verschil in codon gebruik.quote:Op dinsdag 30 maart 2010 16:31 schreef tactician het volgende:
[..]
Kan dat serieus? Met welke codons van welke aminozuren worden zijn er dan van die 'grote' tijdsverschillen (okÚ okÚ, nanoseconden)? Is dat dan zo'n verschil in tijd (okÚ okÚ, nanoseconden) dat de tertiare/quarternaire structuur anders kan worden als er ÚÚn ander codon gebruikt wordt (van hetzelfde aminozuur) ?
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Hoe kunnen ze dan een DNA/RNA code verzinnen voor het eiwit? Alle tripletten coderen toch al voor een aminozuur, dus hoe kan men ervoor zorgen dat een RNA-triplet ineens voor een ander aminozuur gaat coderen?
Kunnen we zo misschien later nog meer nieuwe aminozuren ontdekken waardoor we allerlei nieuwe eiwitten e.d. kunnen bouwen? Als we bijv. zijgroepen kunnen maken met bepaalde eigenschappen, kunnen we nieuwe vormen van eiwitten met speciale eigenschappen maken, of niet? Bijv. extra veel zwavelgroepen om een superstevig eiwit te maken?
Kunnen we zo misschien later nog meer nieuwe aminozuren ontdekken waardoor we allerlei nieuwe eiwitten e.d. kunnen bouwen? Als we bijv. zijgroepen kunnen maken met bepaalde eigenschappen, kunnen we nieuwe vormen van eiwitten met speciale eigenschappen maken, of niet? Bijv. extra veel zwavelgroepen om een superstevig eiwit te maken?


Aan het triplet zit een aminozuur. Als je een ander aminozuur koppelt aan een ander codon en dan de mRNA laat aflezen.quote:Op dinsdag 30 maart 2010 17:43 schreef lol_nl het volgende:
Hoe kunnen ze dan een DNA/RNA code verzinnen voor het eiwit? Alle tripletten coderen toch al voor een aminozuur, dus hoe kan men ervoor zorgen dat een RNA-triplet ineens voor een ander aminozuur gaat coderen?
Kunnen we zo misschien later nog meer nieuwe aminozuren ontdekken waardoor we allerlei nieuwe eiwitten e.d. kunnen bouwen? Als we bijv. zijgroepen kunnen maken met bepaalde eigenschappen, kunnen we nieuwe vormen van eiwitten met speciale eigenschappen maken, of niet? Bijv. extra veel zwavelgroepen om een superstevig eiwit te maken?
Kein gewalt! Wir sind das volk!
Steps taken forwards but sleepwalking back again.
''And the Germans kill the Jews, And the Jews kill the Arabs, And the Arabs kill the hostages
And that is the news.''
Steps taken forwards but sleepwalking back again.
''And the Germans kill the Jews, And the Jews kill the Arabs, And the Arabs kill the hostages
And that is the news.''


Waarom gebruiken jullie allemaal van die moeilijke woorden. 
[b]Op dinsdag 28 februari 2012 10:19 schreef TheGeneral:[/b]Eindelijk eens wat zinnige posts van Federer-fan O+ .
[b]Op maandag 24 mei 2010 16:33 schreef tarantism:[/b]dit is het slechtste topic dat ik ooit heb gezien
[b]Op maandag 24 mei 2010 16:33 schreef tarantism:[/b]dit is het slechtste topic dat ik ooit heb gezien


Als scheikundeleek is dit iets wat je niet moet proberen te begrijpen. Een standaardboek over biochemie bevat meestal al ruim 1000 pagina's en dat is dan vaak nog maar een samenvatting van de basiskennis.quote:Op dinsdag 6 april 2010 21:52 schreef Federer-fan het volgende:
Waarom gebruiken jullie allemaal van die moeilijke woorden.
OT: Ik vind het een interessante ontwikkeling waar ik een paar jaar geleden al van had gehoord tijdens een college. Dit maakt echt de weg vrij voor de vorming van hybridematerialen die bestaan uit stoffen die verkregen zijn via conventionele organische synthese en eiwitten die gesynthetiseerd zijn door bacteriŰn.
Ik zie weinig nut in de vorming van extra stevige eiwitten. Macro-organisch onderzoek heeft de laatste jaren uitgewezen dat subtiliteit van secundaire interacties veel belangrijker is dan maximalisatie. Subtiliteit geeft namelijk voldoende stevigheid, maar wat veel belangrijker is, de mogelijkheid van reversibiliteit van interacties. Dit is waarschijnlijk het belangrijkste aspect van dynamiek in eiwitten.quote:Op dinsdag 30 maart 2010 17:43 schreef lol_nl het volgende:
Hoe kunnen ze dan een DNA/RNA code verzinnen voor het eiwit? Alle tripletten coderen toch al voor een aminozuur, dus hoe kan men ervoor zorgen dat een RNA-triplet ineens voor een ander aminozuur gaat coderen?
Kunnen we zo misschien later nog meer nieuwe aminozuren ontdekken waardoor we allerlei nieuwe eiwitten e.d. kunnen bouwen? Als we bijv. zijgroepen kunnen maken met bepaalde eigenschappen, kunnen we nieuwe vormen van eiwitten met speciale eigenschappen maken, of niet? Bijv. extra veel zwavelgroepen om een superstevig eiwit te maken?


Oke, jammer.quote:Op dinsdag 6 april 2010 23:33 schreef lyolyrc het volgende:
[..]
Als scheikundeleek is dit iets wat je niet moet proberen te begrijpen. Een standaardboek over biochemie bevat meestal al ruim 1000 pagina's en dat is dan vaak nog maar een samenvatting van de basiskennis.
quote:[..]
Ik zie weinig nut in de vorming van extra stevige eiwitten. Macro-organisch onderzoek heeft de laatste jaren uitgewezen dat subtiliteit van secundaire interacties veel belangrijker is dan maximalisatie. Subtiliteit geeft namelijk voldoende stevigheid, maar wat veel belangrijker is, de mogelijkheid van reversibiliteit van interacties. Dit is waarschijnlijk het belangrijkste aspect van dynamiek in eiwitten.
[b]Op dinsdag 28 februari 2012 10:19 schreef TheGeneral:[/b]Eindelijk eens wat zinnige posts van Federer-fan O+ .
[b]Op maandag 24 mei 2010 16:33 schreef tarantism:[/b]dit is het slechtste topic dat ik ooit heb gezien
[b]Op maandag 24 mei 2010 16:33 schreef tarantism:[/b]dit is het slechtste topic dat ik ooit heb gezien


Maar vragen mag altijd. Ik vind het raar dat er nog niet meer van deze theorie in het vak biologie op de middelbare school zit. Ik heb echt het idee dat biologie niet als exact vak behandeld wordt maar meer als een cursus begrijpend lezen.quote:Op dinsdag 6 april 2010 23:33 schreef lyolyrc het volgende:
[..]
Als scheikundeleek is dit iets wat je niet moet proberen te begrijpen.
Dus mensen vraag maar raak 'we' zullen proberen zo min mogelijk moeilijke worden te gebruiken en leggen de moeilijke woorden die niet begrepen worden ook graag uit.
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Op de middelbare school hoeft dit ook niet imo. Biologie VWO behandeld wel DNA en RNA geloof ik. Of ze de processen met tRNA etc behandelen weet ik niet zo, geloof het niet.Daarnaast is het een gebied die nog relatief jong is en waar veel ontdekkingen gedaan worden. Dat is niet echt makkelijk in een algemene lesvorm te gieten.quote:Op woensdag 7 april 2010 10:02 schreef Bosbeetle het volgende:
[..]
Maar vragen mag altijd. Ik vind het raar dat er nog niet meer van deze theorie in het vak biologie op de middelbare school zit. Ik heb echt het idee dat biologie niet als exact vak behandeld wordt maar meer als een cursus begrijpend lezen.
Dus mensen vraag maar raak 'we' zullen proberen zo min mogelijk moeilijke worden te gebruiken en leggen de moeilijke woorden die niet begrepen worden ook graag uit.
Kein gewalt! Wir sind das volk!
Steps taken forwards but sleepwalking back again.
''And the Germans kill the Jews, And the Jews kill the Arabs, And the Arabs kill the hostages
And that is the news.''
Steps taken forwards but sleepwalking back again.
''And the Germans kill the Jews, And the Jews kill the Arabs, And the Arabs kill the hostages
And that is the news.''


Nouja als je soms ziet wat mensen over evolutie en genetica denken dan mag dat best zonder flauwekul onderwezen wordenquote:Op woensdag 7 april 2010 11:04 schreef One_of_the_few het volgende:
[..]
Op de middelbare school hoeft dit ook niet imo. Biologie VWO behandeld wel DNA en RNA geloof ik. Of ze de processen met tRNA etc behandelen weet ik niet zo, geloof het niet.Daarnaast is het een gebied die nog relatief jong is en waar veel ontdekkingen gedaan worden. Dat is niet echt makkelijk in een algemene lesvorm te gieten.
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


evolutie en genetica worden ook best uitgebreid behandeld. Dat kan ik nog uit mijn eigen tijd naar voren halen. Genetica werd als erg moeilijk gezien. Evolutie blijft altijd een heikel onderwerp aangezien mensen daar ook andere geluiden over te horen krijgenquote:Op woensdag 7 april 2010 11:10 schreef Bosbeetle het volgende:
[..]
Nouja als je soms ziet wat mensen over evolutie en genetica denken dan mag dat best zonder flauwekul onderwezen worden
Kein gewalt! Wir sind das volk!
Steps taken forwards but sleepwalking back again.
''And the Germans kill the Jews, And the Jews kill the Arabs, And the Arabs kill the hostages
And that is the news.''
Steps taken forwards but sleepwalking back again.
''And the Germans kill the Jews, And the Jews kill the Arabs, And the Arabs kill the hostages
And that is the news.''


OkÚ, graag. Kun je uitleggen wat een eiwit nu precies is? Is het iets tastbaars/materie? En hoe verhoudt een eiwit zich ten opzichte van aminozuren?quote:Op woensdag 7 april 2010 10:02 schreef Bosbeetle het volgende:
[..]
Maar vragen mag altijd. Ik vind het raar dat er nog niet meer van deze theorie in het vak biologie op de middelbare school zit. Ik heb echt het idee dat biologie niet als exact vak behandeld wordt maar meer als een cursus begrijpend lezen.
Dus mensen vraag maar raak 'we' zullen proberen zo min mogelijk moeilijke worden te gebruiken en leggen de moeilijke woorden die niet begrepen worden ook graag uit.
Graag uitleggen op het niveau van een ingezonden brief in Donald Duck.
[b]Op dinsdag 28 februari 2012 10:19 schreef TheGeneral:[/b]Eindelijk eens wat zinnige posts van Federer-fan O+ .
[b]Op maandag 24 mei 2010 16:33 schreef tarantism:[/b]dit is het slechtste topic dat ik ooit heb gezien
[b]Op maandag 24 mei 2010 16:33 schreef tarantism:[/b]dit is het slechtste topic dat ik ooit heb gezien


Een eiwit is opgebouwd uit verschillende aminozuren. 20 welteverstaan, al zegt BB nu dat het er 21 zijn?quote:Op woensdag 7 april 2010 12:14 schreef Federer-fan het volgende:
[..]
OkÚ, graag. Kun je uitleggen wat een eiwit nu precies is? Is het iets tastbaars/materie? En hoe verhoudt een eiwit zich ten opzichte van aminozuren?
Graag uitleggen op het niveau van een ingezonden brief in Donald Duck.
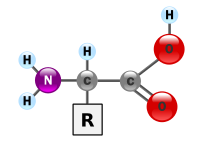
De volgorde van aminozuren bepaalt het karakter van het eiwit. Dus andere 'sequence' is een ander eiwit. Een aminozuur (dus de bouwstenen van het eitwit) is een verbinding met een NH2-groep en een COOH-groep.
Veel meer moet je mij ook niet vragen want ik had maar een 6 op biochemie.


OkÚ, ik probeer het toch; misschien dat iemand anders ze dan kan beantwoorden:quote:Op woensdag 7 april 2010 12:20 schreef Zwansen het volgende:
[..]
Een eiwit is opgebouwd uit verschillende aminozuren. 20 welteverstaan, al zegt BB nu dat het er 21 zijn?
De volgorde van aminozuren bepaalt het karakter van het eiwit. Dus andere 'sequence' is een ander eiwit. Een aminozuur (dus de bouwstenen van het eitwit) is een verbinding met een NH2-groep en een COOH-groep.
Veel meer moet je mij ook niet vragen want ik had maar een 6 op biochemie.
- Zijn amonizuren vloeistof?
- Op welke manier is er een volgorde? IOs dat net als bij een DNA-streng?
- Op welke niveau zitten eiwitten en aminozuren; zijn het moleculen, atomen?
[b]Op dinsdag 28 februari 2012 10:19 schreef TheGeneral:[/b]Eindelijk eens wat zinnige posts van Federer-fan O+ .
[b]Op maandag 24 mei 2010 16:33 schreef tarantism:[/b]dit is het slechtste topic dat ik ooit heb gezien
[b]Op maandag 24 mei 2010 16:33 schreef tarantism:[/b]dit is het slechtste topic dat ik ooit heb gezien


Aminozuren zijn simpele moleculen.
Ze zien er allemaal ongeveer zo uit als het bovenstaande plaatje, alleen de R verschilt onderling.
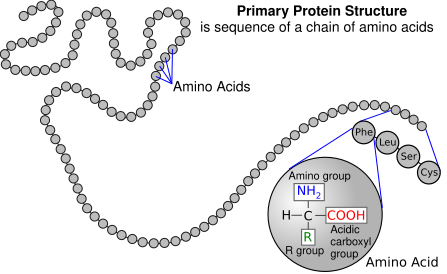
zoals Zwansen zei de NH2 kan aan de COOH gekoppeld worden door afsplitsing van water. Je krijgt dan een soort ketting van aminozuren en een heel groot molecuul (er zijn eiwitten die bestaan uit 1000 aminozuren op een specifieke volgorde) de volgorde van de aminozuren bepaalt de vorm en eigenschappen van het eiwit.
Je kunt dus met 20 bestandsdelen duizenden verschillende stoffen maken.
Aminozuren zijn vaste stoffen maar meestal vind je ze in opgeloste vorm. Eiwitten kunnen ook opgelost worden en in die staat zitten ze ook in cellen.
eiwitten zijn gestructureerd op verschillende niveaus net zei ik al de volgorde waarin ze zitten dat is de primaire structuur, dan heeft die streng ook weer een bepaalde vorm ( een alpha-helix dus een soort wenteltrap of een beta-sheet de eens soort vlakke vorm of random coil gewoon een slappe sliert spagetti)
zo laten wij dat zien in een plaatje bij a zie je helixen bij b sheets en de gele lus is een random coil. En dat allemaal is dus weer een sliert aminozuren.
Dan heb je nog de tertiare structuur en dat is de daadwerkelijke vorm van een eiwit dus het complete plaatje zeg maar dat is een combinatie van de secondaire structuren
tertiare structuur van het eiwit ubiquitine
Maar sommige eiwiten werken samen en vormen dan samen de actieve structuur of in groepjes van 2 of meer. Hier een voorbeeld voor ubiquitine die in strengen aan elkaar zit op verschillende manieren en zo dus andere functies heeft. Dit noemen we quartenare structuur.
In dit plaatje zie je eiwitten zoals je ze zou 'zien' als je hele goede ogen hebt. een soort blob met overal kleine bultjes. Die helixen en sheets zitten er wel in maar zien er dus niet zo uit als in de cartoon (deze groene blobs zijn 4 keer hetzelfde eiwitje dat hierboven ook staat in cartoon vorm)
daarnaast kunnen eiwitten ook nog bewegen door bepaalde veranderingen aan te brengen nadat het eiwit al is gemaakt kunnen hele domijnen op het eiwit buigen, bepaalde stukken blootgeven, en zo activeren of deactiveren etc.
[ Bericht 8% gewijzigd door Bosbeetle op 07-04-2010 13:54:48 ]
Ze zien er allemaal ongeveer zo uit als het bovenstaande plaatje, alleen de R verschilt onderling.
zoals Zwansen zei de NH2 kan aan de COOH gekoppeld worden door afsplitsing van water. Je krijgt dan een soort ketting van aminozuren en een heel groot molecuul (er zijn eiwitten die bestaan uit 1000 aminozuren op een specifieke volgorde) de volgorde van de aminozuren bepaalt de vorm en eigenschappen van het eiwit.
Je kunt dus met 20 bestandsdelen duizenden verschillende stoffen maken.
Aminozuren zijn vaste stoffen maar meestal vind je ze in opgeloste vorm. Eiwitten kunnen ook opgelost worden en in die staat zitten ze ook in cellen.
eiwitten zijn gestructureerd op verschillende niveaus net zei ik al de volgorde waarin ze zitten dat is de primaire structuur, dan heeft die streng ook weer een bepaalde vorm ( een alpha-helix dus een soort wenteltrap of een beta-sheet de eens soort vlakke vorm of random coil gewoon een slappe sliert spagetti)
zo laten wij dat zien in een plaatje bij a zie je helixen bij b sheets en de gele lus is een random coil. En dat allemaal is dus weer een sliert aminozuren.
Dan heb je nog de tertiare structuur en dat is de daadwerkelijke vorm van een eiwit dus het complete plaatje zeg maar dat is een combinatie van de secondaire structuren
tertiare structuur van het eiwit ubiquitine
Maar sommige eiwiten werken samen en vormen dan samen de actieve structuur of in groepjes van 2 of meer. Hier een voorbeeld voor ubiquitine die in strengen aan elkaar zit op verschillende manieren en zo dus andere functies heeft. Dit noemen we quartenare structuur.
In dit plaatje zie je eiwitten zoals je ze zou 'zien' als je hele goede ogen hebt. een soort blob met overal kleine bultjes. Die helixen en sheets zitten er wel in maar zien er dus niet zo uit als in de cartoon (deze groene blobs zijn 4 keer hetzelfde eiwitje dat hierboven ook staat in cartoon vorm)
daarnaast kunnen eiwitten ook nog bewegen door bepaalde veranderingen aan te brengen nadat het eiwit al is gemaakt kunnen hele domijnen op het eiwit buigen, bepaalde stukken blootgeven, en zo activeren of deactiveren etc.
[ Bericht 8% gewijzigd door Bosbeetle op 07-04-2010 13:54:48 ]
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Misschien als je mijn stukje in jouw topic over scheikunde combineert met het stuk van Bosbeetle, dat je dan wat wijzer wordt.quote:Op woensdag 7 april 2010 12:36 schreef Federer-fan het volgende:
OkÚ, ik probeer het toch; misschien dat iemand anders ze dan kan beantwoorden:
- Zijn amonizuren vloeistof?
- Op welke manier is er een volgorde? IOs dat net als bij een DNA-streng?
- Op welke niveau zitten eiwitten en aminozuren; zijn het moleculen, atomen?
Ik bedoelde overigens dat het onderwerp waarmee dit topic begon wel een brug te ver is om biochemie te leren begrijpen, de basis van biochemie is dat uiteraard niet. Wij zijn immers ook ooit ergens begonnen.quote:
En vooral blijven vragen, ik denk dat alle deskundigen in dit topic graag dingen uitleggen!
[ Bericht 26% gewijzigd door lyolyrc op 07-04-2010 14:07:18 (Reactie op Federerfan toegevoegd) ]


Er zijn heel veel verschillende vormen eiwitten even wat voorbeeltjes om de diversiteit aan te geven
snares
een wd40 repeat domain ook wel beta propellor
een antilichaam
Best mooi eigenlijk
snares
een wd40 repeat domain ook wel beta propellor
een antilichaam
Best mooi eigenlijk
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Ik durf wel te beweren dat eiwitten het verschil zijn tussen leven en levenloos. De veelzijdigheid, dynamiek in eiwitstructuur, de complexiteit die toch leidt tot eenduidigheid van functie. Inderdaad erg mooi!quote:Op woensdag 7 april 2010 14:00 schreef Bosbeetle het volgende:
Er zijn heel veel verschillende vormen eiwitten even wat voorbeeltjes om de diversiteit aan te geven
[ afbeelding ]
snares
[ afbeelding ]
een wd40 repeat domain ook wel beta propellor
[ afbeelding ]
een antilichaam
Best mooi eigenlijk
Als ik nog mooie plaatjes vind, zal ik ze ook posten.


in dit topic --> Het Ribosoom :) heb ik een plaatje gepost van een ribosoom echt geweldig om die complexiteit te zien en dat is niet alleen eiwit maar ook DNA dat zelf dus meer kan dan alleen informatie bevatten maar ook een active stof kan zijn net als eiwit. RNA is nog mooier eigenlijk die kan een enzym zijn en ook nog tegelijkertijd data bevatten. Ik denk dat leven is begonnen bij RNAquote:Op woensdag 7 april 2010 14:19 schreef lyolyrc het volgende:
[..]
Ik durf wel te beweren dat eiwitten het verschil zijn tussen leven en levenloos. De veelzijdigheid, dynamiek in eiwitstructuur, de complexiteit die toch leidt tot eenduidigheid van functie. Inderdaad erg mooi!
Als ik nog mooie plaatjes vind, zal ik ze ook posten.
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Bedankt voor de uitgebreide uitleg! Ziet er mooi uit met al die plaatjes. Een OP waardig.quote:Op woensdag 7 april 2010 13:33 schreef Bosbeetle het volgende:
Aminozuren zijn simpele moleculen.
[ afbeelding ]
Ze zien er allemaal ongeveer zo uit als het bovenstaande plaatje, alleen de R verschilt onderling.
zoals Zwansen zei de NH2 kan aan de COOH gekoppeld worden door afsplitsing van water. Je krijgt dan een soort ketting van aminozuren en een heel groot molecuul (er zijn eiwitten die bestaan uit 1000 aminozuren op een specifieke volgorde) de volgorde van de aminozuren bepaalt de vorm en eigenschappen van het eiwit.
[ afbeelding ]
Je kunt dus met 20 bestandsdelen duizenden verschillende stoffen maken.
Aminozuren zijn vaste stoffen maar meestal vind je ze in opgeloste vorm. Eiwitten kunnen ook opgelost worden en in die staat zitten ze ook in cellen.
eiwitten zijn gestructureerd op verschillende niveaus net zei ik al de volgorde waarin ze zitten dat is de primaire structuur, dan heeft die streng ook weer een bepaalde vorm ( een alpha-helix dus een soort wenteltrap of een beta-sheet de eens soort vlakke vorm of random coil gewoon een slappe sliert spagetti)
[ afbeelding ]
zo laten wij dat zien in een plaatje bij a zie je helixen bij b sheets en de gele lus is een random coil. En dat allemaal is dus weer een sliert aminozuren.
Dan heb je nog de tertiare structuur en dat is de daadwerkelijke vorm van een eiwit dus het complete plaatje zeg maar dat is een combinatie van de secondaire structuren
[ afbeelding ]
tertiare structuur van het eiwit ubiquitine
Maar sommige eiwiten werken samen en vormen dan samen de actieve structuur of in groepjes van 2 of meer. Hier een voorbeeld voor ubiquitine die in strengen aan elkaar zit op verschillende manieren en zo dus andere functies heeft. Dit noemen we quartenare structuur.
[ afbeelding ]
In dit plaatje zie je eiwitten zoals je ze zou 'zien' als je hele goede ogen hebt. een soort blob met overal kleine bultjes. Die helixen en sheets zitten er wel in maar zien er dus niet zo uit als in de cartoon (deze groene blobs zijn 4 keer hetzelfde eiwitje dat hierboven ook staat in cartoon vorm)
daarnaast kunnen eiwitten ook nog bewegen door bepaalde veranderingen aan te brengen nadat het eiwit al is gemaakt kunnen hele domijnen op het eiwit buigen, bepaalde stukken blootgeven, en zo activeren of deactiveren etc.
Maar wat me nog niet duidelijk is, is of het tastbaar is. Als je heel erg klein zou zijn, zou je het dan kunnen vastpakken of is het meer een soort energie?
En wat dˇÚt een eiwit precies? En waarom heet het eiwit?
[b]Op dinsdag 28 februari 2012 10:19 schreef TheGeneral:[/b]Eindelijk eens wat zinnige posts van Federer-fan O+ .
[b]Op maandag 24 mei 2010 16:33 schreef tarantism:[/b]dit is het slechtste topic dat ik ooit heb gezien
[b]Op maandag 24 mei 2010 16:33 schreef tarantism:[/b]dit is het slechtste topic dat ik ooit heb gezien


Ja het is gewoon tastbaar (het is voornamelijk lucht maar dat is meer een scheikundig iets wat in een ander topic beter uitgelegd kan worden). Het is een stof. Hier zie je een beetje in een potje. (tegenwoordig kunnen we elk gewenst eiwit door bacteriŰn laten maken en het dan zuiveren)
En wat doet een eiwit precies is een vraag dat niet te antwoorden is omdat er namelijk ongeveer 19599 verschillende eiwitten zijn en die doen allemaal wat anders. Maar functies gaan van het geven van structuur (het skelet van de cel) tot het vervoeren van stoffen (motor proteins) het doen van celdeling, kopieren van DNA, signaleren om andere eiwitten te maken het aan en uitzetten van eiwit productie etc etc
Het meeste zijn eiwitten nog bezig om zichzelf en andere eiwitten te reguleren. Het mooie is ook nog dat er geen eiwit bekent is met maar 1 functie het doet altijd meer dan in het begin verwacht was. We zijn er dus ook nog niet uit wat alle eiwiten precies doen. Eigenlijk is dat wat alle mensen doen die onderzoek doen in de biochemie uitzoeken wat welke eiwitten nou precies doen.
[ Bericht 6% gewijzigd door Bosbeetle op 07-04-2010 14:46:21 ]
En wat doet een eiwit precies is een vraag dat niet te antwoorden is omdat er namelijk ongeveer 19599 verschillende eiwitten zijn en die doen allemaal wat anders. Maar functies gaan van het geven van structuur (het skelet van de cel) tot het vervoeren van stoffen (motor proteins) het doen van celdeling, kopieren van DNA, signaleren om andere eiwitten te maken het aan en uitzetten van eiwit productie etc etc
Het meeste zijn eiwitten nog bezig om zichzelf en andere eiwitten te reguleren. Het mooie is ook nog dat er geen eiwit bekent is met maar 1 functie het doet altijd meer dan in het begin verwacht was. We zijn er dus ook nog niet uit wat alle eiwiten precies doen. Eigenlijk is dat wat alle mensen doen die onderzoek doen in de biochemie uitzoeken wat welke eiwitten nou precies doen.
[ Bericht 6% gewijzigd door Bosbeetle op 07-04-2010 14:46:21 ]
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Ik denk dat eiwit eiwit heet omdat het hoofd bestandsdeel van eiwit (uit een ei) een eiwit (ovalbumine e.a.) is. Prote´ne is een andere benaming ervoor.
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Heb hier wel een stukje geprobeerdquote:Op woensdag 7 april 2010 14:47 schreef Zwansen het volgende:
Misschien kan BB gelijk een stukje over DNA/RNA/transcriptie schrijven.
Dat is ook zo prachtig.
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


Waarschijnlijk zijn eiwitten (prote´nes) het eerst ge´soleerd uit het wit van een ei. Dat lijkt me wel een logische verklaring.quote:Op woensdag 7 april 2010 14:42 schreef Bosbeetle het volgende:
Ik denk dat eiwit eiwit heet omdat het hoofd bestandsdeel van eiwit (uit een ei) een eiwit (ovalbumine e.a.) is. Prote´ne is een andere benaming ervoor.
Overigens vergeet je de naam polypeptide.
|
|