Post hier weer al je vragen, passies, trauma's en andere dingen die je uit je slaap houden met betrekking tot de vakken:
Van MBO tot WO, hier is het topic waar je een antwoord kunt krijgen op je vragen.
Opmaak: http://betahw.mine.nu/index.php: site van GlowMouse om formules te kunnen gebruiken in je posts (op basis van Latexcode wordt een plaatje gegenereerd dat je vervolgens via het aangegeven linkje kunt opnemen).
quote:Echt niemand ?Op dinsdag 16 maart 2010 13:00 schreef horned_reaper het volgende:
Even en snelle vraag...
Hoe kan ik zien dat een Alpha-Helix rechtsdraaiend is en een collageen triple helix linksdraaiend.....
En dan ze dan samengevoegd weer rechtsdraaiend zijn?
Alvast bedankt
Als ik Schrodinger oplos dan weet ik dat Psi een functie van A*sin(kx) + B*cos(kx) is.Maar hoe verder?
Ik zie in een iets ander voorbeeld dat ze Psi(0) en Psi(L) in gaan vullen en op Psi(L)=0=Asin(kL) uitkomen.
Kan iemand uitleggen waarom we bij 0 en L gaan kijken? Omdat dat de grenzen zijn waar het deeltje zich bevindt?

Bij vraag 23 wordt gevraagd hoe de elektronen gaan lopen, volgens mij gebeurt dit altijd van - naar + en stroom van + naar -, nu ga ik kijken naar het antwoord van dit examen, maar die beweert feitelijk het tegengestelde namelijk:
Door influentie (condensator werking) wordt het alluminium folie negatief: er lopen elektroenen van de aarde naar het folie, de stroom gaat in de andere richting, van het folie naar de aarde.
Link antwoorden: http://havovwo.nl/vwo/vna/bestanden/vna1209iiopl5.pdf
Weet iemand hoe dit werkt?
Ik moet de L = µ.N2.A / l [H] Henry
te weten komen. Maar ik heb niet de gegevens van de formule, wel heb ik:
U voeding
I
Pp
Pq
Ps
UTL
UL
cos phi
RTL
Hoe kan ik L te weten komen?
[ Bericht 1% gewijzigd door GoodGawd op 28-03-2010 14:36:09 ]
quote:Nee, ze beweren hetzelfde. Aan de buitenkant worden negatieve elektronen aangetrokken door de positieve elektronen aan de binnenkant. Die elektronen komen van de aarde.Op woensdag 24 maart 2010 18:23 schreef Superlam het volgende:
Morgen heb ik een tentamen natuurkunde, daarvoor ben ik wat oude examens aan het oefenen, nu stuitte ik op het volgende examen: http://havovwo.nl/vwo/vna/bestanden/vna1209iiopg5.pdf
Bij vraag 23 wordt gevraagd hoe de elektronen gaan lopen, volgens mij gebeurt dit altijd van - naar + en stroom van + naar -, nu ga ik kijken naar het antwoord van dit examen, maar die beweert feitelijk het tegengestelde namelijk:
Door influentie (condensator werking) wordt het alluminium folie negatief: er lopen elektroenen van de aarde naar het folie, de stroom gaat in de andere richting, van het folie naar de aarde.
Link antwoorden: http://havovwo.nl/vwo/vna/bestanden/vna1209iiopl5.pdf
Weet iemand hoe dit werkt?
Ik kan het echt niet vinden...
Verklaar waarom proline niet voorkomt in een -helix en wel in een collageen triple helix.
ik morgene en SE over radioactiviteit.
Ik snap iets kleins niet, namelijk als er een verval reactie plaatstvindt, hoe ik dan de vrij gekomen of verdwenen energie moet berekenen.
De volgende reactie:
39-19K + 1-0n > 39-18Ar + 1-1p
Ik heb de massa van het 39 isotoop van Kalium genomen en die + de massa van een neutron ..?
en aan de andere kant de massa van een 39 Ar isotoop en die bij een proton opgeteld.
Maar antwoord is:
m(K-atoom) - 19xm(elektron) + m(neutron) > m(Ar-atoom) - 18xm(elektron) + m(H-atoom) - 1x m(elektron)
Ik snap dat je er de elektronen van af moet halen, maar ik snap die H-atoom en de massa van die elektron achter de pijl niet.
En waar is de massa van de proton gebleven?
Alvast bedankt.
De vraag is; "Je hebt 1 liter vruchtensap met een sterkte van 20%. Dit is te sterk en je verdunt het met 1 dl water. Wat is nu de sterkte van de vruchtensap in %?"
Het antwoord is 18,18% maar ik snap niet waarom
Je gooit er 1 dl bij, oftewel 0,1 L.
Sterkte = onverdund / totaal * 100%
0,2 / 1,1 *100% = 18,18%
quote:Bedankt!Op zondag 28 maart 2010 20:17 schreef MichielPH het volgende:
Het totaal is 1 liter, onverdund zou het dus 20% * 1 L = 0,2 L zijn.
Je gooit er 1 dl bij, oftewel 0,1 L.
Sterkte = onverdund / totaal * 100%
0,2 / 1,1 *100% = 18,18%

Hoe kan je hier aan zien dat de molecuulformule C10H20O is?
Alvast bedankt.
Edit: laat maar, ik zie het al
[ Bericht 26% gewijzigd door Warren op 29-03-2010 20:35:50 ]
f(t) = 2t3 . e4t
Dan moet je rekenregel gebruiken: f(t)e-at
En je kan niet dus:
tn
en
eat
nemen?
Voor een cirkel is dit: Fietswiel
Voor een boog is dit: Viaducht
Maar wat is het voor een driehoek?
quote:Eehm.... de driehoek structuren als in ... de spaken van je fietswiel misschien en de driehoekstructuren onder een brug misschienOp dinsdag 30 maart 2010 19:47 schreef caspergf1 het volgende:
Ik moet voor techniek een werkstukkie maken maar ik moet een voorbeeld geven in wat voor constructies driehoeken worden gebruikt.
Voor een cirkel is dit: Fietswiel
Voor een boog is dit: Viaducht
Maar wat is het voor een driehoek?
quote:De eiffeltoren?Op dinsdag 30 maart 2010 19:47 schreef caspergf1 het volgende:
Ik moet voor techniek een werkstukkie maken maar ik moet een voorbeeld geven in wat voor constructies driehoeken worden gebruikt.
Voor een cirkel is dit: Fietswiel
Voor een boog is dit: Viaducht
Maar wat is het voor een driehoek?
quote:Dat en ...Op dinsdag 30 maart 2010 19:56 schreef horned_reaper het volgende:
Eehm.... de driehoek structuren als in ... de spaken van je fietswiel misschien en de driehoekstructuren onder een brug misschien
quote:dat dus. Dit noemt vakwerkconstructies.
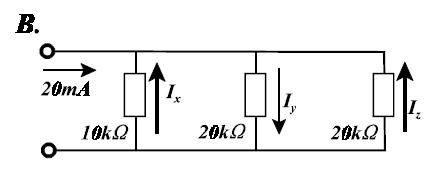
Ik zie met het blote oog zo wat de stroomsterktes worden. Maar hoe laat je dat zien met een berekening?
quote:Bereken eerst de vervangweerstand van de drie parallel geschakelde weerstanden. Die bedraagt 5 kΩ. Dan weet je ook de spanning tussen de klemmen en aangezien die spanning over elk van de drie weerstanden staat kun je dan de stroomsterkte door elke weerstand afzonderlijk berekenen. Je pijltjes bij Ix en Iz staan overigens in de verkeerde richting.Op zondag 4 april 2010 17:16 schreef GoodGawd het volgende:
[ afbeelding ]
Ik zie met het blote oog zo wat de stroomsterktes worden. Maar hoe laat je dat zien met een berekening?
quote:Als het zijn eigen tekening is, staan ze verkeerd; als het direct uit de opdracht komt, moet je dus opletten dat de 2 stromen negatief gedefinieert zijn.Op zondag 4 april 2010 18:27 schreef Riparius het volgende:
Je pijltjes bij Ix en Iz staan overigens in de verkeerde richting.
quote:Dat dus.Op zondag 4 april 2010 18:37 schreef MichielPH het volgende:
[..]
Als het zijn eigen tekening is, staan ze verkeerd; als het direct uit de opdracht komt, moet je dus opletten dat de 2 stromen negatief gedefinieert zijn.
Merci, ja logisch.
quote:In werkelijkheid kunnen de stromen door drie parallel geschakelde weerstanden waarover een spanningsbron is aangesloten nooit in verschillende richtingen vloeien.Op zondag 4 april 2010 18:37 schreef MichielPH het volgende:
[..]
Als het zijn eigen tekening is, staan ze verkeerd; als het direct uit de opdracht komt, moet je dus opletten dat de 2 stromen negatief gedefinieerd zijn.
quote:Ik gebruik dan ook niet voor niets 'gedefinieerd'.Op zondag 4 april 2010 21:25 schreef Riparius het volgende:
[..]
In werkelijkheid kunnen de stromen door drie parallel geschakelde weerstanden waarover een spanningsbron is aangesloten nooit in verschillende richtingen vloeien.
En wat een simplistische spelfout van mezelf..
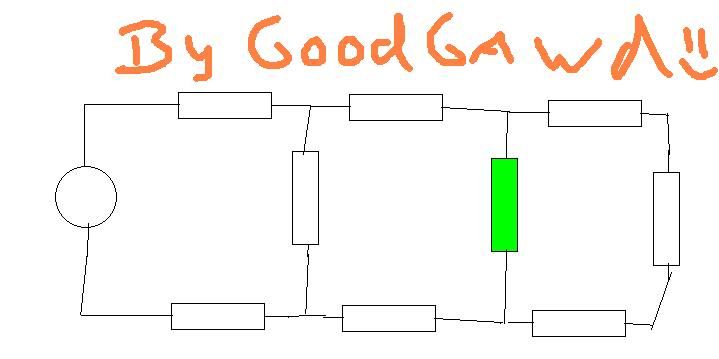
Ik vroeg me af met die schakelingen, hoe je bijvoorbeeld de stroomsterkte in de groene weerstand zou moeten berekenen als spanning en weerstanden gegeven zijn.
Maar de hoofdvraag is, hoe je dit benaderd. Normaal bereken ik de vervangings weerstand Rv. Maar hier zie ik het even niet. (al is dat wel simpel
De eerste R zie je als serie, maar dan komt die splitsing en dan raak ik in de war. Moet je die laatste twee blokken nou als parallel zien? en die eerste en laaste R als serie?
Het kan wat omslachtiger met vervangingsweerstanden:
Werk van rechts naar links. De 3 weerstanden in serie kan je optellen tot 1 weerstand. Deze vervangingsweerstand staat parallel met de verticale weerstand. De vervangingsweerstand van deze 2 parallel staat weer in serie met de 2 horizontale weerstanden.
Dit herhaal je tot je de spanningsbron, 2 weerstanden en een vervangingsweerstand van 7 weerstanden hebt. Hierna heb je de spanning over de vervaningsweerstand, en kan je weer terugrekenen naar de groene.
Duidelijk of te vaag uitgelegd nog?
Houd in gedachten dat je de schakeling ook zo kan zien:

De spanning over de vervanginsweerstand van de 7 is ongelijk aan de spanning over de groene weerstand.
Rv1 = R6 + R7 + R8
Rv2 = RGroen * Rv1 / ( RGroen + Rv1 )
Rv3 = R4 + Rv2 + R5
Rv4 = R2 * Rv3 / ( R2 + Rv3 )
Spanning over Rv4:
I1 = UBron / ( R1 + Rv4 + R2 )
Uv4 = R * I = Rv4 * UBron / ( R1 + Rv4 + R2 )
Uv4 = U2 = Uv3
Uv2 = UGroen = Uv1
I2 = Uv4 / Rv3
UGroen = R * I = Rv3 * UBron / ( R4 + Rv2 + R5 )
IGroen = UGroen / RGroen
Edit: wacht, nadat ik dit hele kutverhaal getypt heb, lijkt het dat je het wel bergepen had. Shit
[ Bericht 29% gewijzigd door MichielPH op 05-04-2010 16:31:01 ]
quote:Wanneer je K kleiner is dan 1 wil dat zeggen dat het evenwicht van je reactie naar links loopt.Op maandag 5 april 2010 15:38 schreef vault_tec het volgende:
Ik heb met scheikunde een evenwichtsconstante van 0.1258. Wat wil dit getal nou zeggen?
Wanneer de K groter is dan 1 is dit logischerwijs andersom.
Wanneer we kijken naar het molecuul D-Glucose, is te zien dat bij het 3de koolstof atoom (het 2de chirale C-atoom) de OH groep aan de linker kant staat en bij de rest van de chirale koolstof atomen staan deze OH groepen rechts van de C.
Ik ben ervan op de hoogte dat dit te maken heeft met de ruimtelijke indeling van het molecuul.... maar hoe kan ik zelf bepalen of bij een bepaald molecuul bij het 2de... het 3de of misschien wel het 4de chirale koolstofatoom de OH groep links ofwel rechs moet?
[ Bericht 11% gewijzigd door horned_reaper op 05-04-2010 20:08:14 ]

Vier in serie?
quote:Nee, want dan krijg je een spanning van 48 Volt, en dat is duidelijk niet de bedoeling.
quote:Nee, weer fout, want dan krijg je een spanning van 12 Volt.
deels
Ik wijzigde het te laat. Ik weet niet hoe je het goed in woorden moet zeggen. Maar je hebt er vier dus. En je maakt groepje van 2 in serie en dat groepje zet je parallel
quote:Leg beter uit hoe je de accu's wil schakelen.
deze totale meut parallel.
- 2 in serie

Welke integraal moet ik hier voor opstellen? En vooral waarom.
Het uitrekenen ervan is niet nodig, dat zou ik zelf moeten kunnen
Alvast bedankt
quote:Oh? Nou in dat geval kan het niet, misschien is het een strik vraag.Op maandag 5 april 2010 19:27 schreef MichielPH het volgende:
Mij is geleerd dat je accu's niet parallel mag schakelen, omdat er door kleine spanningsverschillen onbedoelde stromen rond gaan lopen.
quote:er is een wiskundetopic.Op maandag 5 april 2010 19:21 schreef Jesse_ het volgende:
Even een vraagje:
[ afbeelding ]
Welke integraal moet ik hier voor opstellen? En vooral waarom.
Het uitrekenen ervan is niet nodig, dat zou ik zelf moeten kunnen
Alvast bedankt
x loopt van 0 tot 1, y loopt voor een gegeven x van .. tot ...
quote:Op maandag 5 april 2010 19:21 schreef Jesse_ het volgende:
Even een vraagje:
[ afbeelding ]
Welke integraal moet ik hier voor opstellen? En vooral waarom.
Het uitrekenen ervan is niet nodig, dat zou ik zelf moeten kunnen
Alvast bedankt
Kan je zelf bedenken waarom?
quote:Noujaa, waarschijnlijk is je antwoord wel goed, maar toch heb ik liever dat het vliegtuig waar ik in zit netter is ontworpen.Op maandag 5 april 2010 19:28 schreef GoodGawd het volgende:
[..]
Oh? Nou in dat geval kan het niet, misschien is het een strik vraag.
quote:Nogmaals even ... nadat m'n vraag is ondergesneeuwd ....Op maandag 5 april 2010 16:19 schreef horned_reaper het volgende:
Als ik zo vrij mag zijn, zou ik graag zelf ook nog een vraag willen stellen m.b.t. chemie!
Wanneer we kijken naar het molecuul D-Glucose, is te zien dat bij het 3de koolstof atoom (het 2de chirale C-atoom) de OH groep aan de linker kant staat en bij de rest van de chirale koolstof atomen staan deze OH groepen rechts van de C.
Ik ben ervan op de hoogte dat dit te maken heeft met de ruimtelijke indeling van het molecuul.... maar hoe kan ik zelf bepalen of bij een bepaald molecuul bij het 2de... het 3de of misschien wel het 4de chirale koolstofatoom de OH groep links ofwel rechs moet?
quote:Ik snap waar je de bovengrens van y vandaan haalt, maar bereken zo niet juist het gearceerde gebied?Op maandag 5 april 2010 19:34 schreef BasementDweller het volgende:
[..]
[ afbeelding ]
Kan je zelf bedenken waarom?
quote:Kijk eens naar de structuur van glucose (in de ringvorm), en bekijk dan welke structuur (bootvorm of stoelvorm) het gunstigste is, en in welke posities de OH groepen het best staan ivm. sterische hindering.Op maandag 5 april 2010 20:08 schreef horned_reaper het volgende:
[..]
Nogmaals even ... nadat m'n vraag is ondergesneeuwd ....
Stel je wilt weten hoeveel gram natriumcarbonaat nodig is om al het zilver uit 10 gram zilvernitraat neer te slaan.
Je zou dan deze tabel moeten gebruiken:

De berekening is dan:
10/339,8 x 106,0 g = 3,119 g Na2Co3
Ik snap echter niet waarom de molcuulverhouding bij zilvernitraat en natriumnitraat 2 is. Kan iemand dat toelichten? Alvast bedankt.
Weet alleen geen reet van scheikunde
quote:Waarom niet?Op maandag 5 april 2010 20:20 schreef Jesse_ het volgende:
[..]
Ik snap waar je de bovengrens van y vandaan haalt, maar bereken zo niet juist het gearceerde gebied?
quote:Voor mijn gevoel bereken je dan een heel ander gebied, maar dat zal komen omdat ik het me niet zo goed kan visualiseren :p
quote:y zit altijd tussen 0 en (1-x)/2 in en x tussen 0 en 1. Als je de functie weglaat in de integraal, krijg je dit:Op maandag 5 april 2010 22:17 schreef Jesse_ het volgende:
[..]
Voor mijn gevoel bereken je dan een heel ander gebied, maar dat zal komen omdat ik het me niet zo goed kan visualiseren :p
Dat is dus het oppervlakte van het gebiedje (klopt, want het is een driehoek en basis × hoogte / 2 = 1/4). Maar "boven" dat gebied zit nog een functie. De inhoud tussen het oppervlak en de functie reken je hiermee uit.
Het is vergelijkbaar met het volgende:
Als je de functie weglaat, krijg je:
Dat is precies de afstand waarover je integreert (analoog aan het oppervlakte waarover je integreert van de eerstbesproken integraal). Bij de integraal van xdx integreer je over een lijn en krijg je een oppervlakte, en bij jouw integraal integreer je over een oppervlakte en krijg je een volume. Je doet in principe hetzelfde alleen krijg je er een dimensie bij .
Hoop dat het een beetje duidelijk is
[ Bericht 3% gewijzigd door BasementDweller op 05-04-2010 22:33:43 ]
Ik had zelf alleen x van 0 naar 1-2y laten lopen en y van 0 naar 1/2, omdat de integraal dan iets makkelijker wordt.
Je edit maakt het nog duidelijker, bedankt
quote:Ja mijn verhaaltje was nog niet helemaal af eigenlijkOp maandag 5 april 2010 22:33 schreef Jesse_ het volgende:
ah oke, volgens mij begrijp ik het. Heel erg bedankt
Ik had zelf alleen x van 0 naar 1-2y laten lopen en y van 0 naar 1/2, omdat de integraal dan iets makkelijker wordt.
Je edit maakt het nog duidelijker, bedankt
Wat jij doet met die andere grenzen is natuurlijk ook goed
Als je nog vragen hebt over wiskunde, kan je ze beter hier stellen:
[Bèta wiskunde] Huiswerk- en vragentopic
quote:Ik neem aan dat je vraag betrekking heeft op glucose in de lineaire in plaats van de cyclische vorm. In dit geval moet je de Fischerprojectie gebruiken om glucose te tekenen. Je kunt of de absolute configuratie (volgens regels van Cahn-Ingold-Prelog) van de chirale centra onthouden, of simpelweg onthouden in welke richting ze moeten wijzen in de Fischerprojectie.Op maandag 5 april 2010 20:08 schreef horned_reaper het volgende:
Nogmaals even ... nadat m'n vraag is ondergesneeuwd ....
quote:Dankje voor je uitleg!Op dinsdag 6 april 2010 00:03 schreef lyolyrc het volgende:
[..]
Ik neem aan dat je vraag betrekking heeft op glucose in de lineaire in plaats van de cyclische vorm. In dit geval moet je de Fischerprojectie gebruiken om glucose te tekenen. Je kunt of de absolute configuratie (volgens regels van Cahn-Ingold-Prelog) van de chirale centra onthouden, of simpelweg onthouden in welke richting ze moeten wijzen in de Fischerprojectie.
Maar ik zal je even een voorbeeld geven....

In bovenstaande afbeeldingen zijn alle mogelijk isomeren te vinden.....
Stel dat alle onderstaande namen willekeurig in een bak zouden liggen.... en ik zou ze onder de juiste structuur moeten plaatsen.
Zou hier dan enige logische kennis voor nodig zijn? Of is dat puur een kwestie van uit het hoofd leren?
quote:Dat is helaas een kwestie van stampen. Maar ik meen dat de rode OH-groepen aanduiden dat je met de D-enantiomeren te maken hebt, dus verschil tussen L en D is dan wel te maken.Op dinsdag 6 april 2010 00:32 schreef horned_reaper het volgende:
Dankje voor je uitleg!
Maar ik zal je even een voorbeeld geven....
[ afbeelding ]
In bovenstaande afbeeldingen zijn alle mogelijk isomeren te vinden.....
Stel dat alle onderstaande namen willekeurig in een bak zouden liggen.... en ik zou ze onder de juiste structuur moeten plaatsen.
Zou hier dan enige logische kennis voor nodig zijn? Of is dat puur een kwestie van uit het hoofd leren?
quote:D & L is gelukkig nooit een probleemOp dinsdag 6 april 2010 00:46 schreef lyolyrc het volgende:
[..]
Dat is helaas een kwestie van stampen. Maar ik meen dat de rode OH-groepen aanduiden dat je met de D-enantiomeren te maken hebt, dus verschil tussen L en D is dan wel te maken.
Maar dan wordt dit dus even een kwestie van stampen
Bedankt!
lyolyrc: Uw persoonlijke Fok!Chemie Docent!
quote:Bijvoorbeeld N2 + 3 H2 --> 2 NH3, 1 molecuul stikstof, reageert met 3 moleculen waterstof waaruit twee moleculen ammoniak ontstaan. Volgens het boek is de molecuulverhouding dan 1, 3 en 2.Op maandag 5 april 2010 22:08 schreef BasementDweller het volgende:
Molecuulverhouding van wat staat tot wat?

Dus als ik het goed begrijp zijn de molecuulverhoudingingen 2 bij AgNO3 en NaNO3 omdat
Na2CO3 + 2 Ag NO3 --> Ag2CO3 + 2 NaNo3?
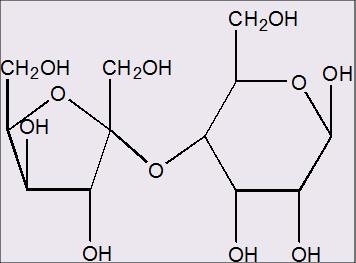
quote:het is in ieder geval een ,4 want de glycosidische binding zit duidelijk aan de 4de koolstof van de 6ring structuur vast.
Maar ik denk dat het een 2,4 Alpha binding is, aangezien de 5 ring structuur van de fructose een ketose is en er nog een eerste koolstof voor de koolstof zit die met de dubbelgebonden O heeft willen hechten!
Stel dat ik bijvoorbeeld, D-Glucose zou laten binden met D-Lactose.
D-Glucose is een 6 ringstructuur en D-Lactose een 5ring structuur.
Nu doet het er even niet toe of we de alpha of beta versie hebben van glucose... De eerste koolstof van D-Glucose gaat een binding aan met de 4de koolstof van D-Lactose.
Normaal gesproken zou bij een 6ring structuur aan het 4de koolstof een OH en een H groep hebben gezeten, en zou om de binding te vormen de 2 OH groepen van koolstof 1 van het eerste molecuul en koolstof 4 van het tweede molecuul met elkaar reageren tot een O-binding + H2O dat zou worden afgescheiden.
Alleen D-Lactose is een 5ring structuur en heeft aan zijn 4de koolstof een zijketen hangen plus een enkele H.
Dus heeft de OH groep van D-Glucose geen OH groep van D-Lactose om een binding mee te vormen.....
Is het dan misschien zo dat de O-binding wel wordt gevormd maar er geen water wordt uitgescheiden?
Ik weet dat de binding wel mogelijk is..... maar hoe?
quote:Weet je zeker dat je lactose bedoelt? Volgens mij is dat namelijk een disaccharide...Op woensdag 7 april 2010 15:45 schreef horned_reaper het volgende:
Dit is nog een vraag voor Lyolyrc.... of ieder ander die er verstand van heeft!
Stel dat ik bijvoorbeeld, D-Glucose zou laten binden met D-Lactose.
D-Glucose is een 6 ringstructuur en D-Lactose een 5ring structuur.
Nu doet het er even niet toe of we de alpha of beta versie hebben van glucose... De eerste koolstof van D-Glucose gaat een binding aan met de 4de koolstof van D-Lactose.
Normaal gesproken zou bij een 6ring structuur aan het 4de koolstof een OH en een H groep hebben gezeten, en zou om de binding te vormen de 2 OH groepen van koolstof 1 van het eerste molecuul en koolstof 4 van het tweede molecuul met elkaar reageren tot een O-binding + H2O dat zou worden afgescheiden.
Alleen D-Lactose is een 5ring structuur en heeft aan zijn 4de koolstof een zijketen hangen plus een enkele H.
Dus heeft de OH groep van D-Glucose geen OH groep van D-Lactose om een binding mee te vormen.....
Is het dan misschien zo dat de O-binding wel wordt gevormd maar er geen water wordt uitgescheiden?
Ik weet dat de binding wel mogelijk is..... maar hoe?
quote:Ah sorry, dat klopt... ik bedoel natuurlijk D-Fructose!Op woensdag 7 april 2010 16:04 schreef lyolyrc het volgende:
[..]
Weet je zeker dat je lactose bedoelt? Volgens mij is dat namelijk een disaccharide...
quote:Ik zit te twijfelen aan het reactiemechanisme. Energetisch lijkt me afsplitsing van een H+ op die plek van fructose allerminst gunstig. Je krijgt dan namelijk negatieve lading op de koolstof naast een vrij elektronenpaar op de zuurstof. Daarentegen gebeurt de vorming van disacchariden natuurlijk enzymatisch, maar het mechanisme daarvan ken ik niet.Op woensdag 7 april 2010 16:13 schreef horned_reaper het volgende:
Ah sorry, dat klopt... ik bedoel natuurlijk D-Fructose!
Edit: als er niet 2x H en 1x O afsplitst, dan kun je uiteraard geen condensatiereactie hebben, dus geen waterafsplitsing.
quote:Maar wat gebeurt er dan met de 2 overgebleven Htjes? Want wanneer de O binding is gevormd zullen die toch ergens heen moeten... ?Op woensdag 7 april 2010 16:42 schreef lyolyrc het volgende:
[..]
Ik zit te twijfelen aan het reactiemechanisme. Energetisch lijkt me afsplitsing van een H+ op die plek van fructose allerminst gunstig. Je krijgt dan namelijk negatieve lading op de koolstof naast een vrij elektronenpaar op de zuurstof. Daarentegen gebeurt de vorming van disacchariden natuurlijk enzymatisch, maar het mechanisme daarvan ken ik niet.
Edit: als er niet 2x H en 1x O afsplitst, dan kun je uiteraard geen condensatiereactie hebben, dus geen waterafsplitsing.
quote:Ze zouden zich als radicaal kunnen afsplitsen, waardoor er net H2 uitgaat. Ik weet niet of dat enzymatisch mogelijk is. Ook is het misschien mogelijk dat er een zuurstofatoom tussen de C-H-binding wordt gewurmd, waarna zich water afsplitst via de normale procedure. Dit zijn de enige dingen die ik zo kan bedenken.Op woensdag 7 april 2010 16:45 schreef horned_reaper het volgende:
Maar wat gebeurt er dan met de 2 overgebleven Htjes? Want wanneer de O binding is gevormd zullen die toch ergens heen moeten... ?
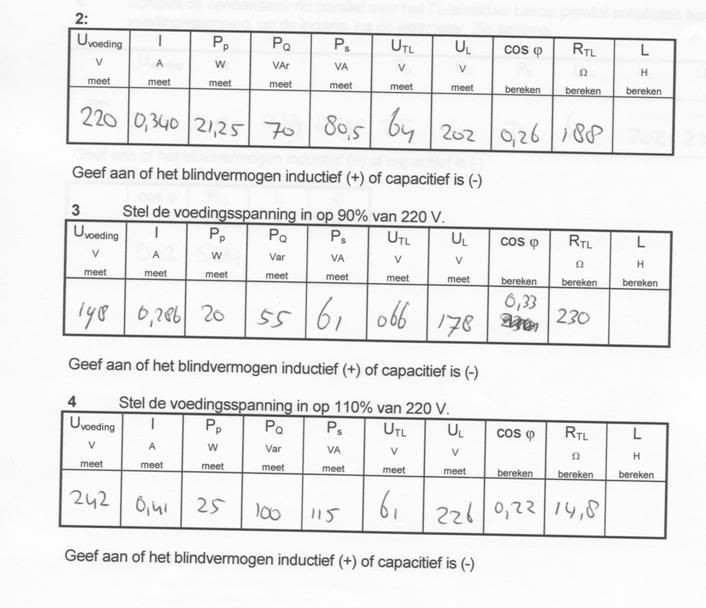

[ Bericht 20% gewijzigd door GoodGawd op 07-04-2010 22:36:49 ]
X = 2Pi* f * L
cos phi = R / Z
Dit zou je moeten kunnen herschrijven tot je L krijgt.
quote:Ik ben eruit, merciOp woensdag 7 april 2010 22:38 schreef MichielPH het volgende:
Z² = R² + X²
X = 2Pi* f * L
cos phi = R / Z
Dit zou je moeten kunnen herschrijven tot je L krijgt.
Kan je tussen Blind vermogen, werkelijk vermogen en schijnbaar vermogen onderling afleiden of het blind vermogen inductief is?
A → P + X
De reactie is tweede orde in A. Bereken de benodigde buislengte om 60% conversie te halen.
Gegevens:
k2 = 5.0 dm3/mol.s
CA,0 = 0.2 mol/dm3
v,0 = 1.0 dm3/s
Ac = 1.0 dm2
Nu had ik het volgende bedacht:
molbalans:
- Fa,0 * dX/dV = -k * Ca0^2(1-X)^2 omzetten naar:
dX/(1-X)^2 = k * Ca0^2 / Fa0 * dV differentiaal wegwerken:
X/1-X = k * Ca0^2 * V / Fa0 invullen geeft:
0.6/(1-0.6) = 1.5
1.5 = 5 * 0.2^2 * V / 0.2 en dit geeft aan dat 1.5 = 0.2 * V / 0.2 dus V = 1.5 dm^3
Maar hoe kom ik nou aan de lengte van de buis???
EDIT:
Nog een probleem:
De reversibele vloeistoffase reactie:
A ↔ P
Is eerste orde in zowel A als P. De reactie wordt isotherm uitgevoerd in een batch reactor met een volume van 2 m3. Op het tijdstip t = 0 geldt dat CA,0 = 2000 mol/m3 en CP,0 = 0 mol/m3.
Gegevens:
k1 = 1.4 x 10-3 s-1
k-1 = 0.7 x 10-3 s-1
Evenwichtsconversie = 67%
Bereken het tijdstip waarop de conversie van A 10% afwijkt van de evenwichtsconversie.
-ra = k1 * (Ca - Cp / Kc) vervangen Ca = Ca0*(1-X) en Cp = Ca0*X
molbalans en kinetiek combineren:
-k1 * (Ca0*(1-X) - Ca0 * X / Kc) = dCa0*(1-X) / dt tijd naar links brengen:
-k1*dt = dCa0*(1-X) / (Ca0*(1-X) - Ca0*X / Kc) hoe nu verder?
[ Bericht 34% gewijzigd door karelsmits87 op 09-04-2010 15:45:10 ]
Wanneer ik een evewichtsreactie heb.. en tijdens het evenwicht zijn de molaire verdelingen als volgt is: 0,02 <--> 0,04 + 0,04
En hier moet ik de K van uitrekenen.
Dan schrijf je de evenwichtsconstante op: K = [0,04] * [0,04] / [0,02] = 0,08
Maar dit klopt niet, want het antwoord zou 4 moeten zijn.....
PS: De reactie verloopt in een volume van 2 liter!
quote:Heb je niet meer info? Want hiermee kan ik je niet echt van advies dienen.Op vrijdag 9 april 2010 14:33 schreef horned_reaper het volgende:
Even een snelle en hele domme vraag van me.... want ik ben het echt even kwijt.
Wanneer ik een evewichtsreactie heb.. en tijdens het evenwicht zijn de molaire verdelingen als volgt is: 0,02 <--> 0,04 + 0,04
En hier moet ik de K van uitrekenen.
Dan schrijf je de evenwichtsconstante op: K = [0,04] * [0,04] / [0,02] = 0,08
Maar dit klopt niet, want het antwoord zou 4 moeten zijn.....
PS: De reactie verloopt in een volume van 2 liter!
2 HI (g) <--> H2 (g) + I2 (g) met ∆H > 0
In een afgesloten reactievat (volume = 2 liter) wordt op tijdstip t0 0,10 mol HI gebracht. Na instelling van het evenwicht op tew blijkt er 0,04 mol I2 te zijn ontstaan.
b. Bereken de evenwichtsconstante K.
Het probleem zit hem in je berekening van het evenwicht, dat moet namelijk zijn: K = [H2]*[I2]/[HI]2. Je vergeet het kwadraat! Uitrekenen van dit evenwicht geeft 0,042/0,022 = 4
quote:Ik zie het nuOp vrijdag 9 april 2010 14:53 schreef lyolyrc het volgende:
Op t0 heb je 0,10 mol HI, en 0 mol van zowel H2 als I2. Het eerste is gegeven, het andere weet je. Bij evenwichtsinstelling is er 0,04 mol I2 gevormd. Je had zelf al correct beredeneerd dat er dan ook 0,04 mol H2 gevormd moet zijn en dat 0,04 mol I2 en H2 gevormd wordt uit 0,08 mol HI, zodat er bij evenwicht nog maar 0,02 mol HI over is.
Het probleem zit hem in je berekening van het evenwicht, dat moet namelijk zijn: K = [H2]*[I2]/[HI]2. Je vergeet het kwadraat! Uitrekenen van dit evenwicht geeft 0,042/0,022 = 4
Dankjewel
Bereken hoeveel gram ijzerfosfaat, Fe3(PO4)2, je moet afwegen om 200 ml ijzerfosfaat-oplossing te maken die 150 mmol Fe2+-ionen per liter bevat.
Nou, de massa van Fe3(PO4)2 = 357,4 g/mol als je die waarden optelt uit het periodiek systeem...
Als er dus 357,4 gram in 1 mol zit... zou dit volgens mij ook moeten betekenen dat je 357,4 gram Fe3(PO)4 moet oplossen in 1 liter water om 1M te krijgen...
Waarna ik zeg, 357,4*0,15 = 53,61 g/150mmol
Maar blijkbaar ga ik hier al helemaal de mist in
quote:Ik zou zelf de andere kant op redeneren. Je hebt een 200 ml oplossing nodig met [Fe2+]=150 mM. Dit betekent dat de oplossing 0,150*0,200 = 0,030 mol Fe2+ moet bevatten. Aangezien het oplossen van 1 mol Fe3(PO4)2 leidt tot 3 mol Fe2+, betekent het dat je 30 mmol Fe2+ kunt halen uit 10 mmol Fe3(PO4)2. 10 mmol Fe3(PO4)2 komt overeen met 3,57 g.Op vrijdag 9 april 2010 15:26 schreef horned_reaper het volgende:
Dan nog even een snelle.... het blijkt maar weer dat ik echt een chemicus ben van de biochemie en de koolstofchemie
Bereken hoeveel gram ijzerfosfaat, Fe3(PO4)2, je moet afwegen om 200 ml ijzerfosfaat-oplossing te maken die 150 mmol Fe2+-ionen per liter bevat.
Nou, de massa van Fe3(PO4)2 = 357,4 g/mol als je die waarden optelt uit het periodiek systeem...
Als er dus 357,4 gram in 1 mol zit... zou dit volgens mij ook moeten betekenen dat je 357,4 gram Fe3(PO)4 moet oplossen in 1 liter water om 1M te krijgen...
Waarna ik zeg, 357,4*0,15 = 53,61 g/150mmol
Maar blijkbaar ga ik hier al helemaal de mist inomdat het uiteindelijk antwoord toch echt 3,57g hoort te zijn....
quote:Dankje voor je uitleg, maar ik snap de logica nog steeds niet helemaal....Op vrijdag 9 april 2010 16:41 schreef lyolyrc het volgende:
[..]
Ik zou zelf de andere kant op redeneren. Je hebt een 200 ml oplossing nodig met [Fe2+]=150 mM. Dit betekent dat de oplossing 0,150*0,200 = 0,030 mol Fe2+ moet bevatten. Aangezien het oplossen van 1 mol Fe3(PO4)2 leidt tot 3 mol Fe2+, betekent het dat je 30 mmol Fe2+ kunt halen uit 10 mmol Fe3(PO4)2. 10 mmol Fe3(PO4)2 komt overeen met 3,57 g.
Ik kan je stap, "Dit betekent dat de oplossing 0,150*0,200 = 0,030 mol Fe2+ moet bevatten", nog niet helemaal volgen.... waarom doe je 0,150mol * 0,200L ? ... ik zie niet in waarom ik die stap zou nemen wanneer ik de vraag volgende week in een andere context zou krijgen....
quote:Er is een gewenst volume gegeven (200 ml) en een gewenste concentratie van 150 mmol Fe2+/l = 150 mM. Als je het volume vermenigvuldigt met de concentratie, krijg je aantal mol Fe2+ dat de oplossing moet bevatten. Samengevat: liter*mol/liter = mol.Op vrijdag 9 april 2010 16:54 schreef horned_reaper het volgende:
Dankje voor je uitleg, maar ik snap de logica nog steeds niet helemaal....
Ik kan je stap, "Dit betekent dat de oplossing 0,150*0,200 = 0,030 mol Fe2+ moet bevatten", nog niet helemaal volgen.... waarom doe je 0,150mol * 0,200L ? ... ik zie niet in waarom ik die stap zou nemen wanneer ik de vraag volgende week in een andere context zou krijgen....
Vanuit het aantal mol dat die vermenigvuldiging oplevert, bereken ik eerst hoeveel mol ijzersulfaat je nodig hebt en dan hoeveel gram dat is.
quote:Ah, dus wanneer ik heb berekend hoeveel mol er in totaal in de oplossing moet, 0,150*0,200 = 0,030... is dat uitgedrukt in Fe2+ maar aangezien ik met een stof te maken heeft die Fe3 bevat, moet die 0,030 gedeeld door 3.... dat wordt 0,010 en wanneer ik mijn 357* 0,010 doe is dat = 3,57g ?Op vrijdag 9 april 2010 17:00 schreef lyolyrc het volgende:
[..]
Er is een gewenst volume gegeven (200 ml) en een gewenste concentratie van 150 mmol Fe2+/l = 150 mM. Als je het volume vermenigvuldigt met de concentratie, krijg je aantal mol Fe2+ dat de oplossing moet bevatten. Samengevat: liter*mol/liter = mol.
Vanuit het aantal mol dat die vermenigvuldiging oplevert, bereken ik eerst hoeveel mol ijzersulfaat je nodig hebt en dan hoeveel gram dat is.
quote:Je hebt hem door!Op vrijdag 9 april 2010 17:15 schreef horned_reaper het volgende:
Ah, dus wanneer ik heb berekend hoeveel mol er in totaal in de oplossing moet, 0,150*0,200 = 0,030... is dat uitgedrukt in Fe2+ maar aangezien ik met een stof te maken heeft die Fe3 bevat, moet die 0,030 gedeeld door 3.... dat wordt 0,010 en wanneer ik mijn 357* 0,010 doe is dat = 3,57g ?
Aangezien de concentratie 150 mmol Fe2+ per liter is, zal 200 ml van die oplossing maar een vijfde van 150 mmol = 30 mmol bevatten. Dan maak je de stap naar het zout: 3 ionen Fe2+ haal je uit 1 zoutmolecuul Fe3(PO4)2. Vandaar dat je de 30 mmol door 3 moet delen. De laatste stap spreekt voor zich: je gaat van mol naar gram door te vermenigvuldigen met de molmassa.
Sowieso moet je zulk soort sommetjes altijd in deze volgorde oplossen. De manier waarop je begonnen was, werkt wel, maar is omslachtig.
Als ik dan nog één aller laatste vraag aan je zou mogen stellen, zal ik je niet meer lastig vallen
De vraag gaat als volgt: "We maken 2 liter acetaatbuffer met pH 5,0 en een sterkte van 0,1 M (dus [CH3COOH] + [CH3COO-] = 0,1 M) door de juiste hoeveelheid vast natriumacetaat (CH3COONa) en het juiste volume azijnzuur op te nemen in 2 liter water. Hoeveel gram natriumacetaat weeg je af en hoeveel ml azijnzuur (werkoplossing in de zuurkast is 4 M) heb je nodig?"
Waarschijnlijk zal ik eerste de fracties ten opzichte van elkaar moeten uitrekenen... en als ik dat weet kan ik aan de hand daarvan vrij makkelijk het aantal gram van beide stoffen uitrekenen.
Maar hoe bereken ik die fracties?
Hieruit volgt: Ka/[H+] = [Ac-]/[HAc]
substitueer: Ka = 10^-4.75 en [H+] = 10^-5.0
dat geeft [Ac-]/[HAc] = 10^0.25 = 1.78
daaruit leid je af dat: [Ac-] = 1.78*[HAc]
gegeven is dat: [Ac-]+[HAc] = 1.0 M
substitueer daarin [Ac-] = 1.78*[HAc], dat geeft: 2.78*[HAc] = 1.0 M
dan is [HAc] = 1.0/2.78 = 0.36 M
en [Ac-] = 1.0 M - [HAc] = 0.64 M
Gebruik deze concentraties om uit te rekenen hoeveel van de werkoplossing je nodig hebt en hoeveel gram natriumacetaat.
quote:Hoe kom je in het begin aan de 4,75 ?Op vrijdag 9 april 2010 20:00 schreef lyolyrc het volgende:
We beginnen met de evenwichtsvergelijking (Ac- = CH3COO-): Ka = [H+]*[Ac-]/[HAc]
Hieruit volgt: Ka/[H+] = [Ac-]/[HAc]
substitueer: Ka = 10^-4.75 en [H+] = 10^-5.0
dat geeft [Ac-]/[HAc] = 10^0.25 = 1.78
daaruit leid je af dat: [Ac-] = 1.78*[HAc]
gegeven is dat: [Ac-]+[HAc] = 1.0 M
substitueer daarin [Ac-] = 1.78*[HAc], dat geeft: 2.78*[HAc] = 1.0 M
dan is [HAc] = 1.0/2.78 = 0.36 M
en [Ac-] = 1.0 M - [HAc] = 0.64 M
Gebruik deze concentraties om uit te rekenen hoeveel van de werkoplossing je nodig hebt en hoeveel gram natriumacetaat.
quote:Dat is de pKa van azijnzuur.Op vrijdag 9 april 2010 20:04 schreef horned_reaper het volgende:
Hoe kom je in het begin aan de 4,75 ?
[ Bericht 0% gewijzigd door lyolyrc op 09-04-2010 20:10:31 (pKa uiteraard) ]
quote:Kijk, daar liep ik dus vast
Maar hoe zou ik zo uit m'n hoofd moeten weten wat een pKa van een willekeurige stof is ?
quote:Lijkt me dat die op een tentamen gegeven wordt. Ik heb hem nu van wikipedia geplukt, maar het staat ook in Binas of meer professionele naslagwerken. Wellicht zelfs ergens in een scheikundeboek dat je hebt, aan de binnenkant van de kaft bijvoorbeeld.Op vrijdag 9 april 2010 20:13 schreef horned_reaper het volgende:
Kijk, daar liep ik dus vastwant de rest lukt me wel....
Maar hoe zou ik zo uit m'n hoofd moeten weten wat een pKa van een willekeurige stof is ?
quote:We mogen geen binas of naslagwerk gebruiken, en er is echt helemaal nergens een pKa gegeven, dus daarom vindt ik het nogal vreemd....Op vrijdag 9 april 2010 20:17 schreef lyolyrc het volgende:
[..]
Lijkt me dat die op een tentamen gegeven wordt. Ik heb hem nu van wikipedia geplukt, maar het staat ook in Binas of meer professionele naslagwerken. Wellicht zelfs ergens in een scheikundeboek dat je hebt, aan de binnenkant van de kaft bijvoorbeeld.
Het enige dat van tevoren gegeven is is dat acetaatbuffer (Ka azijnzuur = 1,8.10-5) en fosfaatbuffer (Ka H2PO4- = 6,2.10-8)... had ik het daar uit kunnen halen dan ?
quote:Ja, immers pKa = -log(Ka).Op vrijdag 9 april 2010 20:24 schreef horned_reaper het volgende:
We mogen geen binas of naslagwerk gebruiken, en er is echt helemaal nergens een pKa gegeven, dus daarom vindt ik het nogal vreemd....
Het enige dat van tevoren gegeven is is dat acetaatbuffer (Ka azijnzuur = 1,8.10-5) en fosfaatbuffer (Ka H2PO4- = 6,2.10-8)... had ik het daar uit kunnen halen dan ?
Voor azijnzuur geeft dat: -log(1.8*10^-5) = 4.74. Dat klopt dus wel ongeveer met de waarde van wikipedia. Mijn Binas geeft 4.77.
Overigens had je die Ka dan rechtstreeks kunnen invullen, i.p.v. te berekenen!
Stel je wilt A. B en C bereken als de helft van A heeft gereageerd. A is dan de helft, dus 0,050 M, maar volgens het antwoordenmodel is B dan 0,20 omdat die met 0,10 afneemt omdat A en B reageren in en molverhouding van 1:2.
Betekent dat dus dat als [A] afneemt met 0,050, dat B met het dubbele afneemt?
quote:Ja, inderdaad. Dat is precies wat er in de reactievergelijking staat. Om 1 mol C te vormen, heb je 1 mol A en 2 mol B nodig. A en B reageren dus in een verhouding van 1:2.Op vrijdag 9 april 2010 20:47 schreef Warren het volgende:
De reactie A + 2B --> C vindt in één stap plaats. Bij het begin van de reactie geldt [A] = 0,10 M, [B] = 0,30 M en s = 7,0 * 10^-5 mol/L.
Stel je wilt A. B en C bereken als de helft van A heeft gereageerd. A is dan de helft, dus 0,050 M, maar volgens het antwoordenmodel is B dan 0,20 omdat die met 0,10 afneemt omdat A en B reageren in en molverhouding van 1:2.
Betekent dat dus dat als [A] afneemt met 0,050, dat B met het dubbele afneemt?
quote:Is het ook logische om hierbij Hasselbalch te gebruiken ?Op vrijdag 9 april 2010 20:00 schreef lyolyrc het volgende:
We beginnen met de evenwichtsvergelijking (Ac- = CH3COO-): Ka = [H+]*[Ac-]/[HAc]
Hieruit volgt: Ka/[H+] = [Ac-]/[HAc]
substitueer: Ka = 10^-4.75 en [H+] = 10^-5.0
dat geeft [Ac-]/[HAc] = 10^0.25 = 1.78
daaruit leid je af dat: [Ac-] = 1.78*[HAc]
gegeven is dat: [Ac-]+[HAc] = 1.0 M
substitueer daarin [Ac-] = 1.78*[HAc], dat geeft: 2.78*[HAc] = 1.0 M
dan is [HAc] = 1.0/2.78 = 0.36 M
en [Ac-] = 1.0 M - [HAc] = 0.64 M
Gebruik deze concentraties om uit te rekenen hoeveel van de werkoplossing je nodig hebt en hoeveel gram natriumacetaat.
Dan zou de berekening als volgt worden:
pH = pKa +log b/z
pKa = 4,74
pH = 5,0
Dus, 5,0 = 4,74 + log b/z
Omgedraaid wordt dat, Log b/z = 5,0 - 4,74
= 0,26
10^0,26 = 1,82
[AC-] = 1,82 * [HAC]
Enz.......
Dit is namelijk de enige beredenatie hoe ik er kom.... of zal ik dan fouten maken de volgende keer ?
quote:Natuurlijk kan dat! Sterker nog, in eerste instantie had ik dat ook op die manier gedaan. Ik had tijdens het eten de oplossing op een papiertje gekrabbeld, maar toen ik het aan het typen was, kwam ik erachter dat het sneller kon. Beide methodes zijn goed.Op vrijdag 9 april 2010 22:37 schreef horned_reaper het volgende:
Is het ook logische om hierbij Hasselbalch te gebruiken ?
Dan zou de berekening als volgt worden:
pH = pKa +log b/z
pKa = 4,74
pH = 5,0
Dus, 5,0 = 4,74 + log b/z
Omgedraaid wordt dat, Log b/z = 5,0 - 4,74
= 0,26
10^0,26 = 1,82
[AC- = 1,82 * [HAC]
Enz.......
Dit is namelijk de enige beredenatie hoe ik er kom.... of zal ik dan fouten maken de volgende keer ?
Ik hoop wel dat je snapt hoe je jouw vergelijking kunt afleiden uit het zuur-base-evenwicht.
Heb 2 vragen die ik niet kan vinden.
Hoe luidt de wet van avogrado?
Kom steeds dingen op internet tegen die steeds weer iets verschillen...
Wat wordt onder het molaire volume van een gas verstaan?
quote:NA = (6,022 141 79 ± 0,000 000 30) × 1023 mol-1Op zaterdag 10 april 2010 14:01 schreef vault_tec het volgende:
Blaadjes kwijt raken met de antwoorden voor je verslagen...
Heb 2 vragen die ik niet kan vinden.
Hoe luidt de wet van avogrado?
Maar meestal gewoon NA = 6,022 × 1023
quote:Het molaire volume is het volume dat ingenomen wordt door één mol van een zuivere stof.Kom steeds dingen op internet tegen die steeds weer iets verschillen...
Wat wordt onder het molaire volume van een gas verstaan?
Het molair volume van één mol ideaal gas is onder dezelfde omstandigheden (druk en temperatuur) altijd hetzelfde en kan met de ideale gaswet worden berekend. Onder standaard omstandigheden met een ideaal gas is dit:
22,414 dm3/mol (L/mol) (T = 273,15 K en p = 1 atm = 101325 Pa).
Voor reële gassen ligt deze waarde bij bovenvermelde temperatuur en druk altijd in de buurt van 22 (± 0,5) dm3/mol (L/mol).
Men kan bij 25°C de volgende afgeronde waarde gebruiken:
24,5 dm3/mol (L/mol) (T = 298 K en p = 1 atm = 101325 Pa).
De volgende vraag werd gesteld:
quote:Nu is dit gewoon een kwestie van, H3O+ berekenen aan de hand van de verdunning en hier de -log van nemen.....Twee studenten bestuderen deze reactie door CaCO3 uit een voedingssupplement te laten reageren met H3O+ in een tweetal verschillende oplossingen: 1 zoutzuur (HCl) met pH = 2,50 en 2 azijnzuur (CH3COOH) met pH = 2,50.
Eén van de studenten wil aantonen dat door middel van verdunning van de zoutzuur oplossing 1 de pH verandert. Daartoe verdunt hij deze oplossing met een factor 106.
(c) Bepaal de pH-waarde van de verdunde oplossing en verklaar je antwoord.
Maar de uitwerking begint als volgt: Het wordt 106× verdund, dus [H3O+] wordt 3,2•10–-9 mol/L....
Hoe komen ze in vredesnaam opeens aan die 3,2 ?
[ Bericht 0% gewijzigd door horned_reaper op 10-04-2010 14:42:52 ]
quote:pH = -log([H+]), dus [H+] = 10-pHOp zaterdag 10 april 2010 14:19 schreef horned_reaper het volgende:
Ik had zelf ook nog even een korte vraag.
De volgende vraag werd gesteld:
[..]
Nu is dit gewoon een kwestie van, H3O+ berekenen aan de hand van de verdunning en hier de -log van nemen.....
Maar de uitwerking begint als volgt: Het wordt 106× verdund, dus [H3O+] wordt 3,2•10–-9 mol/L....
Hoe komen ze in vredesnaam opeens aan die 3,2 ?
In dit geval: 10-2.5 = 3.2•10-3
Vermenigvuldig dit met 10-6 en je krijgt 3.2•10-9
quote:Dankje, en nevermind!Op zaterdag 10 april 2010 14:51 schreef lyolyrc het volgende:
[..]
pH = -log([H+]), dus [H+] = 10-pH
In dit geval: 10-2.5 = 3.2•10-3
Vermenigvuldig dit met 10-6 en je krijgt 3.2•10-9
Als ik weer met zo'n stomme vraag kom, wijs me er dan maar op dat ik even m'n hersenen moet gebruiken
quote:Even een kleine opmerking hierbij, de wet van Avogadro is wat ik in jouw post vetgedrukt heb. NA = 6,022 × 1023 is het getal van Avogadro.Op zaterdag 10 april 2010 14:14 schreef horned_reaper het volgende:
NA = (6,022 141 79 ± 0,000 000 30) × 1023 mol-1
Maar meestal gewoon NA = 6,022 × 1023
[..]
Het molaire volume is het volume dat ingenomen wordt door één mol van een zuivere stof.
Het molair volume van één mol ideaal gas is onder dezelfde omstandigheden (druk en temperatuur) altijd hetzelfde en kan met de ideale gaswet worden berekend. Onder standaard omstandigheden met een ideaal gas is dit:
22,414 dm3/mol (L/mol) (T = 273,15 K en p = 1 atm = 101325 Pa).
Voor reële gassen ligt deze waarde bij bovenvermelde temperatuur en druk altijd in de buurt van 22 (± 0,5) dm3/mol (L/mol).
Men kan bij 25°C de volgende afgeronde waarde gebruiken:
24,5 dm3/mol (L/mol) (T = 298 K en p = 1 atm = 101325 Pa).
[ Bericht 0% gewijzigd door lyolyrc op 10-04-2010 15:06:35 (typo) ]
quote:Door te doen en fouten te maken leer je het meest! Ik ga er dus vanuit dat je dit niet meer vergeet!Op zaterdag 10 april 2010 14:51 schreef horned_reaper het volgende:
Dankje, en nevermind!
Als ik weer met zo'n stomme vraag kom, wijs me er dan maar op dat ik even m'n hersenen moet gebruiken
quote:Ik ben echt een leek op dit gebied.... Biochemie en Koolstofchemie vindt ik super, en ook relatief makkelijk.Op zaterdag 10 april 2010 15:00 schreef lyolyrc het volgende:
[..]
Door te doen en fouten te maken leer je het meest! Ik ga er dus vanuit dat je dit niet meer vergeet!
Maar al die molaire verhoudingen en formules gaan er bij mij maar niet in......
quote:Ik ben al lang blij dat er nog mensen interesse hebben in scheikunde, want zoveel zijn dat er niet!Op zaterdag 10 april 2010 15:06 schreef horned_reaper het volgende:
Ik ben echt een leek op dit gebied.... Biochemie en Koolstofchemie vindt ik super, en ook relatief makkelijk.
Maar al die molaire verhoudingen en formules gaan er bij mij maar niet in......
Het helpt als je inziet waar de formules vandaan komen. De Henderson-Hasselbalchvergelijking is bijvoorbeeld af te leiden uit de evenwichtsvergelijking voor een zuur-basereactie. Je leert deze afleidingen alleen door ze verschillende keren te doen en door inzicht in de wiskunde die erachter zit.
Overigens zat ik ook flink te stoeien met deze vergelijkingen toen ik pas op de universiteit zat.
quote:Nu heb ik daar natuurlijk de volgende formule bij nodig: Q = Ms * ΔTs * SHsVan een voedingsstof wordt 0,05 mol verbrand in een bomcalorimeter die 0,2 liter water bevat. De molmassa van de voedingsstof bedraagt 114 g/mol.
Bereken de voedingswaarde (in Cal/g) als de temperatuur van het water 6,52C stijgt.
Maar komt dat dan gewoon neer op: Q = 0,05 * 6,52 * 1,0Cal.... = 0,33 cal ?
Of raak ik nu weer eens kant nog wal ?
quote:Je moet berekenen hoeveel calorieën per gram de verbranding van de voedingsstof levert. Je antwoord kan dus sowieso niet juist zijn, aangezien jouw antwoord de eenheid cal heeft (wat volgens mij ook niet juist is!). En bovendien ben je niet zorgvuldig met het verschil tussen cal en Cal.Op zaterdag 10 april 2010 17:06 schreef horned_reaper het volgende:
Nou, ik zal er dan nog eentje plaatsen waar ik weer eens vastloop.... en daarna ga ik lekker uit eten
[..]
Nu heb ik daar natuurlijk de volgende formule bij nodig: Q = Ms * ΔTs * SHs
Maar komt dat dan gewoon neer op: Q = 0,05 * 6,52 * 1,0Cal.... = 0,33 cal ?
Of raak ik nu weer eens kant nog wal ?
Ik ga maar eens kijken of ik je in de vorm van tips kan helpen, in plaats van het antwoord voor te rekenen:
Je moet dit probleem in twee stukken hakken:
Gebruik hier de ΔT, de definitie van de calorie, het volume van het water en de dichtheid van water.
Reken de energie is om naar de hoeveelheid energie per mol en dan naar energie per gram voedingsstof.
quote:Dit zijn functionele antwoorden!Op maandag 12 april 2010 11:05 schreef lyolyrc het volgende:
[..]
Je moet berekenen hoeveel calorieën per gram de verbranding van de voedingsstof levert. Je antwoord kan dus sowieso niet juist zijn, aangezien jouw antwoord de eenheid cal heeft (wat volgens mij ook niet juist is!). En bovendien ben je niet zorgvuldig met het verschil tussen cal en Cal.
Ik ga maar eens kijken of ik je in de vorm van tips kan helpen, in plaats van het antwoord voor te rekenen:
Je moet dit probleem in twee stukken hakken:Bereken de energie die het water opneemt (het antwoord moet de eenheid Cal hebben)
Gebruik hier de ΔT, de definitie van de calorie, het volume van het water en de dichtheid van water.Reken dit antwoord om naar de hoeveelheid energie per gram voedingsstof.
Reken de energie is om naar de hoeveelheid energie per mol en dan naar energie per gram voedingsstof.
Alleen het rekenen met Cal heb ik zowaar geen ervaring mee.....
Ik kan de dingen wel omrekenen, je hebt immers 0,05 mol verbrand in 0,2L en de stof is 114g/mol
Dat staat gelijk aan 5,7g/0,2L of 28,5g/L
En dat staat weer gelijk aan 0,25M (mol/L)
Alleen hoe wordt de energie nu berekend.... in de aankomende periode gaat de Thermodynamica uitgebreid behandeld worden, maar ik wou me er met deze vraag alvast wat in verdiepen....
Ondertussen zal ik op internet over verder zoeken naar de juiste rekenmethoden
quote:Je hebt nog geen thermodynamica gehad!Op maandag 12 april 2010 11:34 schreef horned_reaper het volgende:
Dit zijn functionele antwoorden!
Alleen het rekenen met cal heb ik zowaar geen ervaring mee.....
Ik kan de dingen wel omrekenen, je hebt immers 0,05 mol verbrand in 0,2L en de stof is 114g/mol
Dat staat gelijk aan 5,7g/0,2L of 28,5g/L
En dat staat weer gelijk aan 0,25M (mol/L)
Alleen hoe wordt de energie nu berekend.... in de aankomende periode gaat de Thermodynamica uitgebreid behandeld worden, maar ik wou me er met deze vraag alvast wat in verdiepen....
Ondertussen zal ik op internet over verder zoeken naar de juiste rekenmethoden
Dan nog maar een paar extra tips:
een calorimeter heeft als doel te meten hoeveel energie een reactie oplevert (afstaat aan de omgeving, ΔH < 0), of opneemt (onttrekt aan de omgeving, ΔH > 0). De reactie vindt niet in het water plaats, maar de reactie geeft warmte af aan het water of onttrekt er juist warmte aan, waardoor de temperatuur van het water verandert. Dat temperatuursverschil meet je en daarmee ga je rekenen, wat jij nu moet doen!
Nog een citaat van wikipedia:
quote:Maak ook onderscheid tussen calorie en Calorie. De laatste is gelijk aan 1000 calorie en wordt daarom ook wel kilocalorie genoemd.Eén calorie is de hoeveelheid warmte die nodig is om één gram zuiver water één graad Celsius te verwarmen
Je hebt 200ml dus 200g water.
daar zit 0,05mol van een stof is dat 114g/mol is, dat komt overeen met 5,7g stof in 0,2L
Voor 1g water 1graad omhoog kost 1cal ... dus is 200g water 1 graad omhoog 200cal * 6,52 = 1304cal
Dat staat gelijk aan 1,304Cal.
Dus 1,304Cal./5,7g
1,304/5,7 = 0,23Cal/g
quote:Het antwoord klopt!Op maandag 12 april 2010 11:55 schreef horned_reaper het volgende:
Dus als ik het goed begrijp komt dat gewoon neer op.
Je hebt 200ml dus 200g water.
daar zit 0,05mol van een stof is dat 114g/mol is, dat komt overeen met 5,7g stof in 0,2L
Voor 1g water 1graad omhoog kost 1cal ... dus is 200g water 1 graad omhoog 200cal * 6,52 = 1304cal
Dat staat gelijk aan 1,304Cal.
Dus 1,304Cal./5,7g
1,304/5,7 = 0,23Cal/g
Eén ding is waarschijnlijk nog niet helemaal goed duidelijk geworden. De voedingsstof die hier onderzocht wordt, is niet opgelost in het water. De stof en het water bevinden zich in twee aparte compartimenten. Door sterke isolatie kan de reactie zijn warmte alleen afstaan aan het water, wat dan in temperatuur stijgt.
quote:Te gek!Op maandag 12 april 2010 12:09 schreef lyolyrc het volgende:
[..]
Het antwoord klopt!
Eén ding is waarschijnlijk nog niet helemaal goed duidelijk geworden. De voedingsstof die hier onderzocht wordt, is niet opgelost in het water. De stof en het water bevinden zich in twee aparte compartimenten. Door sterke isolatie kan de reactie zijn warmte alleen afstaan aan het water, wat dan in temperatuur stijgt.
Heel erg bedankt!
Eigenlijk stellen dit soort berekeningen dan niet veel voor, het lijkt allemaal lastiger dan het is ^^
quote:Graag gedaan! Ik zie het wel als je nog vragen hebt.
quote:Sowieso stelt de basis van scheikunde qua rekenwerk niet heel veel voor. Alleen moet je bij thermodynamica meer gaan letten op de eenheden. Ik zie overigens dat ik nog een vraag van een ander gemist heb, wat voor mij een stevige kluif is.Eigenlijk stellen dit soort berekeningen dan niet veel voor, het lijkt allemaal lastiger dan het is ^^
Mijn antwoord was 0,23 Cal/g
quote:Is het dan weer gewoon een kwestie van omrekenen?Bereken de verbrandingsenthalpie (ΔH in kJ/mol) van de voedingsstof (1 cal = 4,18 J).
0,23 * 4,18 = 0,9614 J/g
(de massa was, 114 g/mol)
Dus: 0,09614*114 = 109,6 J/mol
Afgerond: 0,11 KJ/mol
Is dit correct?
quote:Dit moet zijn 0,9614 kJ/gOp maandag 12 april 2010 17:01 schreef horned_reaper het volgende:
Even verdergaand op de vorige vraag.
Mijn antwoord was 0,23 Cal/g
[..]
Is het dan weer gewoon een kwestie van omrekenen?
0,23 * 4,18 = 0,9614 J/g
Immers, 1 cal komt overeen met 4,18 J, 1 Cal = 1 kcal = 1000 cal, dus 1 Cal komt overeen met 4,18 kJ.
quote:Hier heb je een 0 te veel getypt.(de massa was, 114 g/mol)
Dus: 0,09614*114 = 109,6 J/mol
quote:Het antwoord is 109,6 kJ/molAfgerond: 0,11 KJ/mol
Is dit correct?
quote:Natuurlijk, stom van me! ik ging weer uit van gewone cal....Op maandag 12 april 2010 17:25 schreef lyolyrc het volgende:
[..]
Dit moet zijn 0,9614 kJ/g
Immers, 1 cal komt overeen met 4,18 J, 1 Cal = 1 kcal = 1000 cal, dus 1 Cal komt overeen met 4,18 kJ.
[..]
Hier heb je een 0 te veel getypt.En in het antwoord heb je weer J i.p.v. kJ. Wel consequent, maar niet correct.
[..]
Het antwoord is 109,6 kJ/mol
Maar bedankt!
quote:Het is ook enorm verwarrend, cal en Cal. Dat is de reden waarom kcal handiger en gebruikelijker is. Overigens is Joule de SI-eenheid voor energie. Wees erop bedacht dat het onderscheid tussen cal en Cal en tussen cal en J bij zulk soort vraagstukken en dus ook op tentamens een 'geliefd' struikelblok is!Op maandag 12 april 2010 17:28 schreef horned_reaper het volgende:
Natuurlijk, stom van me! ik ging weer uit van gewone cal....
Maar bedankt!
Op gegeven moment zeg je: Gegeven is, 1,0M .... en vervolgens reken je daar mee verder.
Maar mijn werkoplossing daar is 4M en er wordt in de opgave duidelijk gezegd dat: "(dus [CH3COOH] + [CH3COO-] = 0,1 M)"......
Ik kan bij nader inzien even niet achterhalen hoe je daar op de 1,0M komt?
quote:Goed gezien! Foutje van mijn kant, ik ben uiteraard ook niet onfeilbaar.Op maandag 12 april 2010 17:45 schreef horned_reaper het volgende:
Nog even terugkomend op dit antwoord van je.
Op gegeven moment zeg je: Gegeven is, 1,0M .... en vervolgens reken je daar mee verder.
Maar mijn werkoplossing daar is 4M en er wordt in de opgave duidelijk gezegd dat: "(dus [CH3COOH] + [CH3COO-] = 0,1 M)"......
Ik kan bij nader inzien even niet achterhalen hoe je daar op de 1,0M komt?
Er is gegeven dat de concentratie van de buffer 0,1 M moet worden ([CH3COOH] + [CH3COO-] = 0,1 M). Waar ik dus 1,0 M typte, moet het 0,1 M zijn.
De werkoplossing van azijnzuur is 4,0 M en die moet je dus verdunnen tot de gewenste, berekende concentratie.
quote:Voor het 1e probleem: de doorsnede van de reactor en het debiet is toch gegeven? Je kan dan toch de lengte berekenen aangezien je het benodigde volume berekend hebt? (Naar de juistheid van de berekeningen heb ik nog niet gekeken)Op vrijdag 9 april 2010 13:14 schreef karelsmits87 het volgende:
De volgende irreversibele gasfase reactie wordt isotherm uitgevoerd in een buisreactor:
A → P + X
De reactie is tweede orde in A. Bereken de benodigde buislengte om 60% conversie te halen.
Gegevens:
k2 = 5.0 dm3/mol.s
CA,0 = 0.2 mol/dm3
v,0 = 1.0 dm3/s
Ac = 1.0 dm2
Nu had ik het volgende bedacht:
molbalans:
- Fa,0 * dX/dV = -k * Ca0^2(1-X)^2 omzetten naar:
dX/(1-X)^2 = k * Ca0^2 / Fa0 * dV differentiaal wegwerken:
X/1-X = k * Ca0^2 * V / Fa0 invullen geeft:
0.6/(1-0.6) = 1.5
1.5 = 5 * 0.2^2 * V / 0.2 en dit geeft aan dat 1.5 = 0.2 * V / 0.2 dus V = 1.5 dm^3
Maar hoe kom ik nou aan de lengte van de buis???
EDIT:
Nog een probleem:
De reversibele vloeistoffase reactie:
A ↔ P
Is eerste orde in zowel A als P. De reactie wordt isotherm uitgevoerd in een batch reactor met een volume van 2 m3. Op het tijdstip t = 0 geldt dat CA,0 = 2000 mol/m3 en CP,0 = 0 mol/m3.
Gegevens:
k1 = 1.4 x 10-3 s-1
k-1 = 0.7 x 10-3 s-1
Evenwichtsconversie = 67%
Bereken het tijdstip waarop de conversie van A 10% afwijkt van de evenwichtsconversie.
-ra = k1 * (Ca - Cp / Kc) vervangen Ca = Ca0*(1-X) en Cp = Ca0*X
molbalans en kinetiek combineren:
-k1 * (Ca0*(1-X) - Ca0 * X / Kc) = dCa0*(1-X) / dt tijd naar links brengen:
-k1*dt = dCa0*(1-X) / (Ca0*(1-X) - Ca0*X / Kc) hoe nu verder?
2e probleem, ik neem aan dat bij dit soort opgaven de densiteit constant blijft, je kan dan beter in termen van concentratie werken dan met conversie. Als je er niet uitkomt zal ik er nog wel eens naar kijken.
quote:De fracties:Op maandag 12 april 2010 17:51 schreef lyolyrc het volgende:
[..]
Goed gezien! Foutje van mijn kant, ik ben uiteraard ook niet onfeilbaar.
Er is gegeven dat de concentratie van de buffer 0,1 M moet worden ([CH3COOH] + [CH3COO-] = 0,1 M). Waar ik dus 1,0 M typte, moet het 0,1 M zijn.
De werkoplossing van azijnzuur is 4,0 M en die moet je dus verdunnen tot de gewenste, berekende concentratie.
HAC+ = 0,53
Ac- = 0,47
Natriumacetaat heeft gewicht van: 82 g/mol
Dus 82*8 (omdat 2L) = 656g
656g*0,47 = 308g
Bij 2L 4M Werkoplossing
Of wanneer ik gebruik zou mogen maken van verdunning met water:
4M Zuur wordt 4 keer verdunt met water tot 1M
+ 82 * 0,47 = 38,5g
* 2 (omdat 2L) = 77g
Dit lijkt me een juiste uiteindelijk uitwerking toch ?
Want HAC+ Stelt zich vanzelf naar zijn 53% wanneer ik hem meng met de 47% base?
Of niet? ^^
quote:Na vervanging van 1,0 M door 0,1 M, worden de concentraties 0,036 M voor HAc en 0,064 M voor Ac-.Op maandag 12 april 2010 18:19 schreef horned_reaper het volgende:
De fracties:
HAC+ = 0,53
Ac- = 0,47
Natriumacetaat heeft gewicht van: 82 g/mol
Dus 82*8 (omdat 2L) = 656g
656g*0,47 = 308g
Bij 2L 4M Werkoplossing
Of wanneer ik gebruik zou mogen maken van verdunning met water:
4M Zuur wordt 4 keer verdunt met water tot 1M
+ 82 * 0,47 = 38,5g
* 2 (omdat 2L) = 77g
Dit lijkt me een juiste uiteindelijk uitwerking toch ?
Want HAC+ Stelt zich vanzelf naar zijn 53% wanneer ik hem meng met de 47% base?
Of niet? ^^
De hoeveelheid HAc in de buffer is 0,036 mol/l * 2,0 l = 0,072 mol. Dit haal je uit een 4,0 M werkoplossing. Hiervan heb je nodig: 0,072 mol / 4,0 mol/l = 0,018 l = 18 ml.
De hoeveelheid Ac- in de buffer is 0,064 mol/l * 2,0 l = 0,128 mol. De bron voor Ac- is NaAc, hiervan heb je uiteraard ook 0,128 mol nodig. Dit komt overeen met 0,128 mol * 82,0 = 10,5 g NaAc.
Wanneer je de HAc werkoplossing en het NaAc-zout aanvult met water tot 2,0 l, heb je de vereiste buffer.
Hoe kom jij aan die fracties ?
Hieruit volgt: Ka/[H+] = [Ac-]/[HAc]
substitueer: Ka = 10^-4.75 en [H+] = 10^-5.0
dat geeft [Ac-]/[HAc] = 10^0.25 = 1.78
daaruit leid je af dat: [Ac-] = 1.78*[HAc]
gegeven is dat: [Ac-]+[HAc] = 0.1 M
substitueer daarin [Ac-] = 1.78*[HAc], dat geeft: 1.88*[HAc] = 0.1 M
dan is [HAc] = 0.1/1.88 = 0.53 M
en [Ac-] = 0.1 M - [HAc] = 0.47 M
quote:Je hebt het zuur-base-evenwicht: HAc <-> H+ + Ac-Op maandag 12 april 2010 20:27 schreef horned_reaper het volgende:
Ik kom toch echt op het volgende uit ? :s
Hoe kom jij aan die fracties ?
Dit geeft de volgende uitdrukking voor de evenwichtsconstante:
Ka = [H+][Ac-]/[HAc]
Je kunt het rechterlid door [H+] delen, maar dan moet je het linkerlid ook daardoor delen:
Ka/[H+] = [H+][Ac-]/[HAc][H+]. In het rechterlid staat dan [H+]/[H+], dat is uiteraard gelijk aan 1. Er blijft in het rechterlid [Ac-]/[HAc] over.
quote:Dan ga ik de Ka en [H+] invullen. In de opgave was Ka gegeven, dat wist ik niet, vandaar dat ik 10-pKa heb gebruikt, dit geeft namelijk de Ka. De eis is dat de pH gelijk moet zijn aan 5,0. [H+] = 10-pH = 10-5,0:Hieruit volgt: Ka/[H+] = [Ac-]/[HAc]
quote:Invullen in van Ka en [H+] in Ka/[H+] = [Ac-]/[HAc] geeft 10-4,75/10-5,0 = [Ac-]/[HAc] = 100,25 = 1,78substitueer: Ka = 10^-4.75 en [H+] = 10^-5.0
quote:Dit kun je omschrijven tot [Ac-] = 1.78*[HAc]dat geeft [Ac-]/[HAc] = 10^0.25 = 1.78
quote:De gezamenlijke concentratie van azijnzuur en acetaat is gegeven, namelijk 0,1 M.daaruit leid je af dat: [Ac-] = 1.78*[HAc]
quote:Hierin substitueer je [Ac-] = 1,78*[HAc], dit leidt tot 1,78*[HAc] + [HAc] = 2,78*[HAc] = 0,1 Mgegeven is dat: [Ac-]+[HAc] = 0.1 M
Dus [HAc] = 0,1 M/2,78 = 0,036 M!!!
Dan geldt [Ac-] = 0,1 - [HAc] = 0,064 M.
Wat hieronder staat heb ik niet geschreven en is ook niet correct.
quote:substitueer daarin [Ac-] = 1.78*[HAc], dat geeft: 1.88*[HAc] = 0.1 M
dan is [HAc] = 0.1/1.88 = 0.53 M
en [Ac-] = 0.1 M - [HAc] = 0.47 M
quote:Alleen die stap..... waarom zou ik van die 1,78 opeens 2,78 maken ?dit leidt tot 1,78*[HAc] + [HAc] = 2,78*[HAc] = 0,1 M
Verder was je vorige uitleg briljant !
quote:Omdat je hebt 1,78*[HAc] + [HAc], wat gelijk is aan (1,78 + 1)*[HAc] = 2,78*[HAc]Op maandag 12 april 2010 21:10 schreef horned_reaper het volgende:
Alleen die stap..... waarom zou ik van die 1,78 opeens 2,78 maken ?
Verder was je vorige uitleg briljant !
Vergelijk het met wiskunde: ab + b = (a+1)*b
quote:Dus eigenlijk kan je het gewoon als regel zien dat er 1,0 bijkomt wanneer je die b = x * z hebt ? (op de plek van de b in dit geval)Op maandag 12 april 2010 21:13 schreef lyolyrc het volgende:
[..]
Omdat je hebt 1,78*[HAc] + [HAc], wat gelijk is aan (1,78 + 1)*[HAc] = 2,78*[HAc]
Vergelijk het met wiskunde: ab + b = (a+1)*b
quote:Oei, dit is basale wiskunde.Op maandag 12 april 2010 21:16 schreef horned_reaper het volgende:
Dus eigenlijk kan je het gewoon als regel zien dat er 1,0 bijkomt wanneer je die b = x * z hebt ? (op de plek van de b in dit geval)
Ik schreef:
quote:Misschien als ik een stapje toevoeg, dat je het dan wel snapt:Op maandag 12 april 2010 21:13 schreef lyolyrc het volgende:
Omdat je hebt 1,78*[HAc] + [HAc], wat gelijk is aan (1,78 + 1)*[HAc] = 2,78*[HAc]
Vergelijk het met wiskunde: ab + b = (a+1)*b
1,78*[HAc] + [HAc] = 1,78*[HAc] + 1*[HAc] = (1,78 + 1)*[HAc] = 2,78*[HAc]
Begrijp je het met deze extra stap in de dikgedrukte tekst?
quote:Ik begrijp het nu jaOp maandag 12 april 2010 21:22 schreef lyolyrc het volgende:
[..]
Oei, dit is basale wiskunde.
Ik schreef:
[..]
Misschien als ik een stapje toevoeg, dat je het dan wel snapt:
1,78*[HAc] + [HAc] = 1,78*[HAc] + 1*[HAc] = (1,78 + 1)*[HAc] = 2,78*[HAc]
Begrijp je het met deze extra stap in de dikgedrukte tekst?
Alleen basis wiskunde of niet.... dit is voor mij compleet nieuw.....
Daar komt bij dat ik van een meer alpha profiel kom
Ik heb nooit natuurkunde gehad en nooit wiskunde B .... plus dat ik maar tot op zekere hoogste scheikunde heb gehad.
Toch heb ik die certificaten gehaald om toegelaten te worden tot geneeskunde, puur omdat ik me alleen met de stof heb bezig gehouden die van mij werd verwacht daar.... en daar zat zoiets als dit niet tussen...
Daarom kom ik ook erg vaak wiskunde, natuurkunde of chemische onderwerpen tegen die in velen hun ogen pure basis zijn, maar voor mij volstrekt nieuw!
Vooral mijn inzicht tot algebra is daarom om te janken... maar ik doe mijn best
En stel het daarom ook zeer op prijs dat je zoveel geduld met een probleem geval als mij hebt
quote:Dan ben je bijzonder ambitieus dat je het aandurft, zonder dat je wiskunde B en natuurkunde in je pakket hebt. Vind ik mooi om te zien.Op maandag 12 april 2010 21:29 schreef horned_reaper het volgende:
Ik begrijp het nu ja
Alleen basis wiskunde of niet.... dit is voor mij compleet nieuw.....
Daar komt bij dat ik van een meer alpha profiel kom
Ik heb nooit natuurkunde gehad en nooit wiskunde B .... plus dat ik maar tot op zekere hoogste scheikunde heb gehad.
Toch heb ik die certificaten gehaald om toegelaten te worden tot geneeskunde, puur omdat ik me alleen met de stof heb bezig gehouden die van mij werd verwacht daar.... en daar zat zoiets als dit niet tussen...
Daarom kom ik ook erg vaak wiskunde, natuurkunde of chemische onderwerpen tegen die in velen hun ogen pure basis zijn, maar voor mij volstrekt nieuw!
Vooral mijn inzicht tot algebra is daarom om te janken... maar ik doe mijn best
En stel het daarom ook zeer op prijs dat je zoveel geduld met een probleem geval als mij hebt
Ik was al bang dat het puur lag aan de lagere eisen qua wiskunde in het middelbare onderwijs in de afgelopen jaren. Vooral sinds de invoering van de grafische rekenmachine bij wiskunde is het niveau ontzettend omlaag gegaan. Dat merken ze bij mij op de TU ook.
Het kan bij zulke basale rekensommetjes ook helpen om getallen in te vullen. Tegenwoordig draai ik mijn hand niet meer om voor het omwerken van formules, maar vroeger had ik daar meer moeite mee. Dan had ik bijvoorbeeld een formule in de vorm A = B*C en dan moest je B vinden in plaats van A. Het simpele trucje dat ik toen hanteerde, was er een simpel sommetje van maken, bijvoorbeeld 10 = 5*2. Er geldt dan ook 5 = 10/2 en 2 = 10/5. Als je duidelijk met jezelf afspreekt voor welke variabele je welk cijfer invult, kan dat niet fout gaan.
Overigens is het voor mij ook een uitdaging om dingen uitgelegd te krijgen. Die basisdingen zijn nu gesneden koek voor mij, maar het uitleggen aan anderen is een sport op zich. En ik vind het nog een leuke sport ook!
Ik denk dat als ik eerst maar die basisprincipes goed beheers, ik daarna wel weer goed mee kan komen op chemisch gebied...
Maar ik ben nog steeds m'n hersenen aan het breken over de laatste berekening.
1,78 * x wordt inderdaad 1,78 + 1*x .... althans... taalkundig is dit correct.
Maar het gaat maar niet in m'n hoofd.... op het moment dat ik zo'n berekening zie zeggen mijn hersenen "dit is pure manipulatie van de som" en krijg ik een error. ^^
Maar als ik dit om zou zetten naar getallen zou ik bijvoorbeeld kunnen zeggen x = 5
1,78 + 1*5 = 6,78..... maar ik weet niet of x 5 is... misschien is x wel 100.....
Dus hoe je het ook wendt of keert..... je kunt simpelweg niet weten wat x is.....
Maar je weet 0,1 natuurlijk wel.... dus kun je die 1,78 en 0,1 natuurlijk samenvoegen tot één formule om x uit te rekenen.... maar dan snap ik nog altijd niet waarom je nu die extra 1 eraan toe hebt gevoegd? waarom kun je het dan niet gewoon 1,78 laten ?
quote:Je moet het wel consequent invullen.Op maandag 12 april 2010 22:07 schreef horned_reaper het volgende:
Te gek dat je er zoveel moeite in wilt steken!
Ik denk dat als ik eerst maar die basisprincipes goed beheers, ik daarna wel weer goed mee kan komen op chemisch gebied...
Maar ik ben nog steeds m'n hersenen aan het breken over de laatste berekening.
1,78 * x wordt inderdaad 1,78 + 1*x .... althans... taalkundig is dit correct.
Maar het gaat maar niet in m'n hoofd.... op het moment dat ik zo'n berekening zie zeggen mijn hersenen "dit is pure manipulatie van de som" en krijg ik een error. ^^
Maar als ik dit om zou zetten naar getallen zou ik bijvoorbeeld kunnen zeggen x = 5
1,78 + 1*5 = 6,78..... maar ik weet niet of x 5 is... misschien is x wel 100.....
Dus hoe je het ook wendt of keert..... je kunt simpelweg niet weten wat x is.....
Dit was de som:
1,78*[HAc] + [HAc] = 1,78*[HAc] + 1*[HAc] = (1,78 + 1)*[HAc] = 2,78*[HAc]
Vul eens 5 in voor [HAC]. Je krijgt dan 1,78*5 + 5 = 13,9. En als je dan zo rekent: (1,78 + 1)*5 = 13,9.
Het klopt dus!
Edit: in de wiskunde heet deze eigenschap van optellen en vermenigvuldigen distributiviteit.
quote:Maar nogmaals, X is totaal niet bekend ....Op maandag 12 april 2010 22:12 schreef lyolyrc het volgende:
[..]
Je moet het wel consequent invullen.
Dit was de som:
1,78*[HAc] + [HAc] = 1,78*[HAc] + 1*[HAc] = (1,78 + 1)*[HAc] = 2,78*[HAc]
Vul eens 5 in voor [HAC]. Je krijgt dan 1,78*5 + 5 = 13,9. En als je dan zo rekent: (1,78 + 1)*5 = 13,9.
Het klopt dus!
Edit: in de wiskunde heet deze eigenschap van optellen en vermenigvuldigen distributiviteit.
Dus als ik even heel consequent x = 7 bijvoorbeeld invul.....
Krijg ik, 1,78*7 + 7 = 19,46 of (1,78 + 1) * 7 = 19,46
Dus als x =7 dan wordt het antwoord 19,46
als x = 5 dan wordt het antwoord 13,9
Dus x = 0,1 M/19,46 = 0,00514
x = 0,1 M/13,9 = 0,00719
x had zowel 7 als 5 kunnen zijn... of een ander getal.... maar in beide gevallen kreeg ik een ander antwoord
Dus hoe kan ik dan weten wat nu werkelijk de juiste verhouding is ?
EDIT: Ik weet dat jij het goed hebt! Alleen ik vertel je gewoon even hoe ik het in m'n hoofd zie.... want ik zal het moeten leren inzien!
quote:Even een paar stappen terug. We hadden 2 vergelijkingen:Op maandag 12 april 2010 22:22 schreef horned_reaper het volgende:
Maar nogmaals, X is totaal niet bekend ....
Dus als ik even heel consequent x = 7 bijvoorbeeld invul.....
Krijg ik, 1,78*7 + 7 = 19,46 of (1,78 + 1) * 7 = 19,46
Dus als x =7 dan wordt het antwoord 19,46
als x = 5 dan wordt het antwoord 13,9
Dus x = 0,1 M/19,46 = 0,00514
x = 0,1 M/13,9 = 0,00719
x had zowel 7 als 5 kunnen zijn... of een ander getal.... maar in beide gevallen kreeg ik een ander antwoord
Dus hoe kan ik dan weten wat nu werkelijk de juiste verhouding is ?
De bovenste vullen we in in de onderste, dat geeft 1,78*[HAc] + [HAc] = 0,1 M.
Omwerken van deze formule geeft [HAc] = 0,1 M /2,78. Hieruit bereken je [HAc]. Het trucje van getallen invullen voor variabelen paste ik alleen toe om snel te zien hoe ik een formule moest omwerken. Niet om waardes te berekenen!!!
Overigens kwam je zelf al eerder aandragen met de Henderson-Hasselbalchvergelijking: pH = pKa + log([HAC]/[Ac-]). Hiermee kun je ook werken als je mijn manier van oplossen te moeilijk vindt.
[Ac-] + [HAc] = 0,1 M
Als ik dat ga samenvoegen is het inderdaad: 1,78*z + b = 0,1!
Dit lijkt nu logisch
Als ik die formule omdraai krijg ik 0,1/1,78 = z+b = 0,056
Dat lijkt een heel goed antwoord.... maar is het natuurlijk niet
Ik moet en zal het door krijgen ^^ al moet ik de hele nacht er over na gaan denken!
Ik blijf maar vast lopen op die extra één die wordt toegevoegd.....
EDIT: 1,78*[HAc] + 1*[HAc]
[HAc] en [HAc] kun je natuurlijk gewoon tegen elkaar wegstrepen!
Wacht... er begint iets te dagen
Ik voel me echt zo ongelofelijk stom nu.... deze onderwerpen zijn voor jou piece of cake... en ik kan er zelfs met jip & janneke taal nauwelijks uitkomen
[ Bericht 15% gewijzigd door horned_reaper op 12-04-2010 23:20:52 ]
quote:Je vult de bovenste formule verkeerd in. En als je hebt ingevuld, werk je de formule verkeerd om.Op maandag 12 april 2010 22:54 schreef horned_reaper het volgende:
[Ac-] = 1,78*[HAc]
[Ac-] + [HAc] = 0,1 M
Als ik dat ga samenvoegen is het inderdaad: 1,78*z + b = 0,1!
Dit lijkt nu logisch
Als ik die formule omdraai krijg ik 0,1/1,78 = z+b = 0,056
Dat lijkt een heel goed antwoord.... maar is het natuurlijk nietwant je hebt hier uitgerekend wat z en b samen zijn..... en niet de verhouding.... of ben ik nu nog maar één stap verwijderd van het antwoord?
Ik moet en zal het door krijgen ^^ al moet ik de hele nacht er over na gaan denken!
Ik blijf maar vast lopen op die extra één die wordt toegevoegd.....
Want wat je hier doet, mag niet! Alleen het zuur wordt vermenigvuldigt met die factor 1,78!
[Ac-] = 1,78*[HAc]
[Ac-] + [HAc] = 0,1 M
Je moet het rechterlid van de bovenste formule op de plaats zetten van [Ac-] in de onderste formule. Dan hou je een formule over waarin maar 1 variabele voorkomt, namelijk [HAc]. Dat kun je omwerken zoals we eerder hebben beschreven, want dat leverde die factor 2,78. Je rekent vervolgens [HAc] uit. Die uitkomst gebruik je om met de onderste formule [Ac-] te berekenen.
quote:Je hoeft je niet dom te voelen. Het overgrote deel van de Nederlanders gaat al glazig kijken bij wat jij aan het bestuderen bent. Wie is er dan dom?Op maandag 12 april 2010 22:54 schreef horned_reaper het volgende:
EDIT: 1,78*[HAc] + 1*[HAc]
[HAc] en [HAc] kun je natuurlijk gewoon tegen elkaar wegstrepen!
Wacht... er begint iets te dagen
Ik voel me echt zo ongelofelijk stom nu.... deze onderwerpen zijn voor jou piece of cake... en ik kan er zelfs met jip & janneke taal nauwelijks uitkomen
In simpele taal dan: stel je hebt 2 keer een boek en een boek, dat geeft samen 3 keer een boek. Dat betekent niet dat je ze kunt wegstrepen, maar je kunt ze wel samen nemen!
Overigens moet je ook niet te lang doorgaan. Op zijn tijd rust nemen heeft ook zin. De informatie moet door je hersenen ook verwerkt worden en dat gebeurt het best door te slapen.
quote:Ik ga nu ook lekker slapen! Bedankt voor je uitlegOp maandag 12 april 2010 23:32 schreef lyolyrc het volgende:
[..]
Je hoeft je niet dom te voelen. Het overgrote deel van de Nederlanders gaat al glazig kijken bij wat jij aan het bestuderen bent. Wie is er dan dom?
In simpele taal dan: stel je hebt 2 keer een boek en een boek, dat geeft samen 3 keer een boek. Dat betekent niet dat je ze kunt wegstrepen, maar je kunt ze wel samen nemen!
Overigens moet je ook niet te lang doorgaan. Op zijn tijd rust nemen heeft ook zin. De informatie moet door je hersenen ook verwerkt worden en dat gebeurt het best door te slapen.
En je hebt trouwens een pm van me.
Good night!
Ik ben al zover:
1. (p V q) → (p V q) [pL]
2. □((p V q) → (p V q)) [1, N]
3. □ (p V q) → □(p V q) [2, K]
4. (□p V □q) → □(p V q) [3, K]
5. (¬◊¬p v ¬◊¬q) → ¬◊¬(p V q) [4, def □]
6. (◊p V ◊q) → ◊(p V q) [pL]
Ik dacht dat dit hem was, maar ik kan hem ook verkeerd gedaan hebben.
[ Bericht 9% gewijzigd door #ANONIEM op 20-04-2010 20:17:09 ]
En voor noob-niveau graag. Gewoon simpel representaties van groepen, bewijzen dat ze (ir)reducibel zijn etc. Heb al veel gevonden op internet, maar wil een simpelere aanpak
Gebruik nu deze: http://math.berkeley.edu/~teleman/math/RepThry.pdf
Wat ik vooral wil zijn voorbeelden of opgaven met uitwerkingen (zijn ook voorbeelden).
Ik wil veel groepen zien en dan een constructie van hun representaties (met tussenstappen).
Alvast bedankt.
quote:Zo'n vraag stel je beter hier: [Bèta wiskunde] Huiswerk- en vragentopicOp zaterdag 24 april 2010 16:29 schreef Cashflow het volgende:
Heeft iemand toevallig een dictaat over representatietheorie (van groepen)?
An interference fit is realized with H7/p6 bore/shaft diameter tolerances for a nominal shaft diameter 8 mm. The dimensions of the components are assumed to be normally distributed. The standard deviation is calculated from the assumption that the tolerance interval is a μ ± 3 σ interval. In order to predict the minimum value of the torque that can be transmitted by this press-fit it is asked to calculate the 1% percentile of the diametrical interference δ in um.
Hint: First calculate the mean value and standard deviation of the interference.
Below a list of parameters that may need to be calculated to get to the answer.
Dmin
Dmax
dmin
dmax
μD
σD
μd
σd
μδ
σδ
Wat is dat u0 ? Heb het gezocht in mijn Binas en op internet gezocht, maar kan niks vinden
quote:Binas tabel 7Op maandag 26 april 2010 21:10 schreef vlam12 het volgende:
Ik heb een vraagje.
[ afbeelding ]
Wat is dat u0 ? Heb het gezocht in mijn Binas en op internet gezocht, maar kan niks vinden
Magnetische permebiliteit van vacuum 4*pi * 10^-7 H/m per definitie.
Deze formule is echter alleen van toepassing op het middelste van een spoel.
Deze formule wordt bijna nooit gebruikt.
quote:En hou er ook rekening mee dat µ0 [mu-nul] is en niet u0.Op maandag 26 april 2010 21:15 schreef Superlam het volgende:
Binas tabel 7
Magnetische permeabiliteit van vacuum 4*pi * 10^-7 H/m per definitie.
Deze formule is echter alleen van toepassing op het middelste van een spoel.
Deze formule wordt bijna nooit gebruikt.

1. U bron = 12,0 V, dus door A gaat 6.0 V en 0,52 A. R = U/i = 6,0/0,52 = 12 Ohm.
2. Deze weet ik niet helemaal. Als S open is, door A gaat dan 6,0 V en omdat A in serie staat met C + B gaat door C 6.0 V en door B ook. Door C gaat echter 0 V door de onderbreking. Dus vandaar dat de stroom die de bron levert ook afneemt waardoor A minder fel schijnt als S open is.
3. Bij 6,0 V is er een stroomsterkte van 0,52 A. De weerstand van A is dus 12 Ohm. De vervangingsweerstand van B + C wordt: 1/RV = 1/12 + 1/12 = 1/6, dus 6 Ohm. R totaal is 6 +12 = 18. I = U bron/R totaal = 12 V / 18 Ohm = 0,67 A. P = U * I = 12 V * 0,67 = 8,0 W.
Klopt dit? Alvast bedankt.
Bij C moet daarom ook de spanning omlaag, om te zorgen dat tweederde gelijk is aan 6 V. Verder moet je wel gebruik maken van de figuur, de weerstand verandert als functie van de spanning!
quote:spanning gaat nooit ergens doorheen.dus door A gaat 6.0 V
quote:Ik dacht dat ik dat wel had gedaan? Bij vraag c heb ik uit figuur 2 gehaald dat bij 6,0 V een waarde van 0,52 A hoort. Deze waarde van 0,52 A heb ik gebruikt voor vraag C. Maar ik kan het fout hebben..Op maandag 26 april 2010 23:27 schreef MichielPH het volgende:
Verder moet je wel gebruik maken van de figuur, de weerstand verandert als functie van de spanning!
De stroom door A loopt ook door B en C en doordat de lampen identiek zijn wordt de stroom 50/50 verdeeld. Als er 0.5 * 0,52 A = 0,26 A door een lamp loopt, staat er 2 V over een lamp. -->figuur 2.
Dus: P = 0,52 A * 6 V + 2 * 0,26 A * 2 V = 4,16 W
[ Bericht 100% gewijzigd door Warren op 27-04-2010 09:37:14 ]
0
0
7
10
10
10
12
13
13
13
14
14
14
15
15
16
22
thanks



Ik ben bij deze opgave alleen bij D even vastgelopen, de rest snap ik wel. Ik maak vast een hele domme denkfout, maar ik mijn vraag is waarom mijn antwoord niet klopt.
D. In het tijdsinterval 0 - 0.8s is er een eenparige vertraagde beweging. Voor een eenparige vertraagde beweging vanuit stilstand geldt: x(0) = 0 m. Dus x(t) = 0,5 a t^2.
-0,60 m = 0,5 a 0,80^2
-0,60 m = 0,32a
a = - 1,875 m/s^2
Het antwoord zou moeten zijn a = dV/dT = (0,60 - 0,90)/(0,80) = - 0,38 m/s^2.
0,60 m/s is de waarde waarmee het kopje van de tafel valt en 0,80 m/s is de snelheid op t = 0. Ik snap deze berekening, maar ik begrijp niet waarom die andere berekening niet klopt. Het lijkt alsof er geen vertraagde beweging vanuit stilstand is?
Mijn dank is groot.
[ Bericht 6% gewijzigd door Warren op 05-05-2010 13:54:24 ]
quote:Sorry, maar ik snap het nog niet. Het kopje glijdt toch alleen in het interval [0 - 0,8s]? In het interval 0,8 - 1,2 is het kopje al van de tafel gevallen. In het interval [0 - 0,8s] is er een afstand afgelegd van 0,60 m.Op woensdag 5 mei 2010 13:52 schreef BasementDweller het volgende:
De afstand die die aflegt is 1/2 at² + vt
Voor vraag a was het antwoord in ieder geval:
In het tijdsinterval [0 s; 0,80 s] is de beweging eenparig vertraagd, dus neemt de verplaatsing steeds minder toe met de tijd. De (sx,t)-grafiek levert dan een paraboolvormige grafiek op, dus een kromme grafieklijn. In het interval [0,80 s; 1,20 s] valt het kopje van de tafel. Er werkt dan op het kopje geen kracht meer in horizontale richting, dus is de horizontale beweging eenparig. De horizontale verplaatsing neemt dan lineair met de tijd toe, dus is het bijbehorende deel van de (sx,t)-grafiek een rechte lijn.
[ Bericht 17% gewijzigd door Warren op 05-05-2010 14:17:05 ]
Ik heb maandag mijn biologie herkansing, alleen ik snap iets niet. Ik hoop dat jullie mij hierbij kunnen helpen.
Het gaat om de volgende vraag:
Wietske gaat ondanks haar bloedarmoede joggen. Door haar bloedarmoede is het hemoglobinegehalte van haar bloed gedaald van 8,5 mmol/L naar 5,0 mmol/L. Bij een hemoglobinegehalte van 8,5 mmol/L bevatte haar bloed bij 100% verzadiging 205 mL O2 per liter. In haar longen is de pO2 13,0 kPa en de pCO2 is 8,0 kPa. Tijdens het joggen is de pO2 in haar beenspieren 3,0 kPa en de pCO2 is 10,7 kPa.
Bereken met behulp van Binas hoeveel mL O2/L haar bloed door de bloedarmoede minder aan haar beenspieren tijdens het joggen kan afgeven.
Ik snap wel hoe je met Binas moet aflezen hoeveel bloed er in de beenspieren wordt afgegeven, alleen ik snap niet wat er nou met dat hemoglobinegehalte moet gebeuren. Want ik neem aan dat je aan de hand daarvan kan berekenen hoeveel zuurstof er minder wordt afgegeven..
Goed, ik hoop dat iemand het weet en het mij wil uitleggen!
quote:tering, moest ik dat ook kunnen bij vwo 6 bio 1,2? kan me er niets van herinnerenOp zaterdag 8 mei 2010 15:19 schreef CrystalAnn het volgende:
Heey.
Ik heb maandag mijn biologie herkansing, alleen ik snap iets niet. Ik hoop dat jullie mij hierbij kunnen helpen.
Het gaat om de volgende vraag:
Wietske gaat ondanks haar bloedarmoede joggen. Door haar bloedarmoede is het hemoglobinegehalte van haar bloed gedaald van 8,5 mmol/L naar 5,0 mmol/L. Bij een hemoglobinegehalte van 8,5 mmol/L bevatte haar bloed bij 100% verzadiging 205 mL O2 per liter. In haar longen is de pO2 13,0 kPa en de pCO2 is 8,0 kPa. Tijdens het joggen is de pO2 in haar beenspieren 3,0 kPa en de pCO2 is 10,7 kPa.
Bereken met behulp van Binas hoeveel mL O2/L haar bloed door de bloedarmoede minder aan haar beenspieren tijdens het joggen kan afgeven.
Ik snap wel hoe je met Binas moet aflezen hoeveel bloed er in de beenspieren wordt afgegeven, alleen ik snap niet wat er nou met dat hemoglobinegehalte moet gebeuren. Want ik neem aan dat je aan de hand daarvan kan berekenen hoeveel zuurstof er minder wordt afgegeven..
Goed, ik hoop dat iemand het weet en het mij wil uitleggen!
quote:Ik snap niet waarom die grafiek opeens constant is op het laatst. Het kopje verliest opeens alle horizontale snelheid op het moment dat hij van de tafel komt?Op woensdag 5 mei 2010 14:10 schreef Warren het volgende:
[..]
Sorry, maar ik snap het nog niet. Het kopje glijdt toch alleen in het interval [0 - 0,8s]? In het interval 0,8 - 1,2 is het kopje al van de tafel gevallen. In het interval [0 - 0,8s] is er een afstand afgelegd van 0,60 m.
Voor vraag a was het antwoord in ieder geval:
In het tijdsinterval [0 s; 0,80 s] is de beweging eenparig vertraagd, dus neemt de verplaatsing steeds minder toe met de tijd. De (sx,t)-grafiek levert dan een paraboolvormige grafiek op, dus een kromme grafieklijn. In het interval [0,80 s; 1,20 s] valt het kopje van de tafel. Er werkt dan op het kopje geen kracht meer in horizontale richting, dus is de horizontale beweging eenparig. De horizontale verplaatsing neemt dan lineair met de tijd toe, dus is het bijbehorende deel van de (sx,t)-grafiek een rechte lijn.
Voor de gemiddelde vertraging op een tijdinterval kan je trouwens de snelheid aan het begin en de snelheid aan het end van het interval bepalen, daarvan het verschil nemen en delen door het tijdsinterval.
quote:Ik denk omdat bij zo'n valbeweging geen kracht in de horizontale richting werkt (wel in de verticale), dus is de horizontale beweging eenparig.Op zaterdag 8 mei 2010 15:26 schreef BasementDweller het volgende:
[..]
Ik snap niet waarom die grafiek opeens constant is op het laatst. Het kopje verliest opeens alle horizontale snelheid op het moment dat hij van de tafel komt?
Bij een berekening van de allelfrequentie met de Hardy-Weinberg regel moet je meestal uitgaan van de
homozygoot recessieve organismen.
Waarom is dit zo?
Dit heeft waarschijnlijk iets te maken met het oplossen van zulke vraagstukken als deze:
Bij schapen komt een witte vacht tot stand onder invloed van het dominante gen H en een zwarte vacht door het recessieve gen h. Uit een kudde schapen in Idaho (VS) werd een steekproef van 900 schapen genomen. Van deze schapen hadden er 891 een witte en 9 een zwarte vacht. Op deze populatie is de regel van Hardy-Weinberg van toepassing.
Bereken de frequentie van gen H in deze populatie.
Ok, stel je gaat uit van de recessieve factor dan krijg je:
De frequentie van gen H = p en de frequentie van gen h = q. Volgens de regel van Hardy-Weinberg is p2 + 2pq + q2 = 1 en p + q = 1
q² = 9 : 900 = 0,01 dus q = frequentie van h = 0,1. p = frequentie van H = 1 - 0,1 = 0,9
Maar als je uitgaat van de dominante factor, dan krijg je een andere uitkomst:
P² = 891 : 900 = 0,99 dus P = frequentie van H = 0,99.
Waarom is dit zo? De uitkomsten zouden hetzelfde moeten zijn...
quote:Nee.Op zaterdag 8 mei 2010 15:26 schreef BasementDweller het volgende:
[..]
Ik snap niet waarom die grafiek opeens constant is op het laatst. Het kopje verliest opeens alle horizontale snelheid op het moment dat hij van de tafel komt?
Voor de gemiddelde vertraging op een tijdinterval kan je trouwens de snelheid aan het begin en de snelheid aan het end van het interval bepalen, daarvan het verschil nemen en delen door het tijdsinterval.
Het eerste stuk tot 0,8 seconden is het een eenparige vertraging.
Daarna, vanaf vallen tot 1.2 sec een rechte lijn, horizontaal toenemende afstand, zelfde snelheid door ontbreken horizontale versnelling/vertraging
Daarna, het horizontale deel, is het kopje gevallen/kapot. Het blijft liggen en derhalve beweegt het niet verder. Ze gaan hierbij wel uit van een zandbak oid waar het invalt, want als het op mijn laminaat zou vallen stuitert ie nog wel even verder.
quote:Dat denk je, maar staat nergens in de vraag.Op zaterdag 8 mei 2010 15:53 schreef Holy_Goat het volgende:
[..]
Nee.
Het eerste stuk tot 0,8 seconden is het een eenparige vertraging.
Daarna, vanaf vallen tot 1.2 sec een rechte lijn, horizontaal toenemende afstand, zelfde snelheid door ontbreken horizontale versnelling/vertraging
Daarna, het horizontale deel, is het kopje gevallen/kapot. Het blijft liggen en derhalve beweegt het niet verder. Ze gaan hierbij wel uit van een zandbak oid waar het invalt, want als het op mijn laminaat zou vallen stuitert ie nog wel even verder.
quote:Haha. Kan wel kloppen. We hebben nu de nieuwe 2e fase en daar heb je dus geen biologie 1/2 meer. Alleen gewoon bio. En we zullen hoogstwaarschijnlijk nu ook andere methodes gebruiken.Op zaterdag 8 mei 2010 15:22 schreef Holy_Goat het volgende:
[..]
tering, moest ik dat ook kunnen bij vwo 6 bio 1,2? kan me er niets van herinneren
Jammer dat je het niet weet. Alsnog bedankt!
quote:Maar er is inhoudelijk niks veranderd volgens mij. Ik ben me ook aan het voorbereiden voor examens (voortentamens dat wel), maar ik gebruik ook gewoon oude stof van voor de vernieuwde 2e fase.Op zaterdag 8 mei 2010 18:02 schreef CrystalAnn het volgende:
[..]
Haha. Kan wel kloppen. We hebben nu de nieuwe 2e fase en daar heb je dus geen biologie 1/2 meer. Alleen gewoon bio. En we zullen hoogstwaarschijnlijk nu ook andere methodes gebruiken.
Jammer dat je het niet weet. Alsnog bedankt!
quote:Dan weet ik het ook niet..Op zaterdag 8 mei 2010 21:25 schreef Warren het volgende:
[..]
Maar er is inhoudelijk niks veranderd volgens mij. Ik ben me ook aan het voorbereiden voor examens (voortentamens dat wel), maar ik gebruik ook gewoon oude stof van voor de vernieuwde 2e fase.
Gelijk even een andere vraag: Weet jij het antwoord misschien wel?
NaHCO3 (aq) + C6O7H8 (aq) -> H2O (l) + CO2(g) + Na3C6O7H5 (aq)
quote:3NaHCO3 (aq) + C6O7H8 (aq) -> 3H2O (l) + 3CO2(g) + Na3C6O7H5 (aq)Op zondag 9 mei 2010 12:48 schreef Toilutpaper het volgende:
Weet iemand hier de oplossing van, goede nummertjes voor de moleculen?
NaHCO3 (aq) + C6O7H8 (aq) -> H2O (l) + CO2(g) + Na3C6O7H5 (aq)
Voor de pijl:
3 Na
11 H
9 C
16 O
Na de pijl:
3 Na
11 H
9 C
16 O
Probeer nu te begrijpen hoe ik daarop ben gekomen, anders leer je er niets van.
[En bedankt, ik moest scheikunde nog leren en ik heb nu een handig maniertje gevonden om dit snel te doen]
quote:Bedankt, en ik zie hem....Op zondag 9 mei 2010 12:52 schreef -Strawberry- het volgende:
[..]
3NaHCO3 (aq) + C6O7H8 (aq) -> 3H2O (l) + 3CO2(g) + Na3C6O7H5 (aq)
Voor de pijl:
3 Na
11 H
9 C
16 O
Na de pijl:
3 Na
11 H
9 C
16 O
Probeer nu te begrijpen hoe ik daarop ben gekomen, anders leer je er niets van.
[En bedankt, ik moest scheikunde nog leren en ik heb nu een handig maniertje gevonden om dit snel te doen]
quote:Je ziet in Binas tabel 83D dat bij een Po2 van 13,0Kpa en Pco2 8,0 Kpa een zuurstof verzadiging van 94% is. Bij pO2 3,0 kPa en pCO2 10,7 kPa is dit 24%.Op zaterdag 8 mei 2010 15:19 schreef CrystalAnn het volgende:
Heey.
Ik heb maandag mijn biologie herkansing, alleen ik snap iets niet. Ik hoop dat jullie mij hierbij kunnen helpen.
Het gaat om de volgende vraag:
Wietske gaat ondanks haar bloedarmoede joggen. Door haar bloedarmoede is het hemoglobinegehalte van haar bloed gedaald van 8,5 mmol/L naar 5,0 mmol/L. Bij een hemoglobinegehalte van 8,5 mmol/L bevatte haar bloed bij 100% verzadiging 205 mL O2 per liter. In haar longen is de pO2 13,0 kPa en de pCO2 is 8,0 kPa. Tijdens het joggen is de pO2 in haar beenspieren 3,0 kPa en de pCO2 is 10,7 kPa.
Bereken met behulp van Binas hoeveel mL O2/L haar bloed door de bloedarmoede minder aan haar beenspieren tijdens het joggen kan afgeven.
Ik snap wel hoe je met Binas moet aflezen hoeveel bloed er in de beenspieren wordt afgegeven, alleen ik snap niet wat er nou met dat hemoglobinegehalte moet gebeuren. Want ik neem aan dat je aan de hand daarvan kan berekenen hoeveel zuurstof er minder wordt afgegeven..
Goed, ik hoop dat iemand het weet en het mij wil uitleggen!
Nu is het slechts een kwestie van verhoudingen uitrekenen.
Gezond persoon:
100% -> 205ml
94%= 192.7 ml
24%= 49. 2ml
Bij haar ziekte:
205/8.5 * 5 = 120.5 ml bij 100%
94%= 113 ml
24%= 29 ml
En nu het verschil uitrekenen en je hebt je antwoord.
quote:Omdat 891 niet P2 is maar P2 + 2pq. En dan weet je meteen waarom je van de homozygoot recessieve groep uitgaat, want de vergelijking met alleen q2 is wel op te lossen en deze niet omdat je 2 onbekenden hebt en houdt.Op zaterdag 8 mei 2010 15:49 schreef Warren het volgende:
Maar als je uitgaat van de dominante factor, dan krijg je een andere uitkomst:
P² = 891 : 900 = 0,99 dus P = frequentie van H = 0,99.
Waarom is dit zo? De uitkomsten zouden hetzelfde moeten zijn...
Edit: De andere som is trouwens wel op te lossen door gebruik te maken van de vergelijking q=p-1, maar het is wel omslachtiger dan uitgaan van q2.
[ Bericht 8% gewijzigd door Jojogirl op 09-05-2010 14:04:08 ]
quote:Hoezee! Ik snap het. En net op tijd voor mijn toets!Op zondag 9 mei 2010 13:06 schreef Superlam het volgende:
[..]
Je ziet in Binas tabel 83D dat bij een Po2 van 13,0Kpa en Pco2 8,0 Kpa een zuurstof verzadiging van 94% is. Bij pO2 3,0 kPa en pCO2 10,7 kPa is dit 24%.
Nu is het slechts een kwestie van verhoudingen uitrekenen.
Gezond persoon:
100% -> 205ml
94%= 192.7 ml
24%= 49. 2ml
Bij haar ziekte:
205/8.5 * 5 = 120.5 ml bij 100%
94%= 113 ml
24%= 29 ml
En nu het verschil uitrekenen en je hebt je antwoord.
quote:HBO verpleegkunde?Op zondag 9 mei 2010 16:39 schreef CrystalAnn het volgende:
[..]
Hoezee! Ik snap het. En net op tijd voor mijn toets!Heel erg bedankt voor je hulp!
quote:Geen dank, was net mijn examenstof bio aan het leren dus dit was weer een mooie opfrisser.Op zondag 9 mei 2010 16:39 schreef CrystalAnn het volgende:
[..]
Hoezee! Ik snap het. En net op tijd voor mijn toets!Heel erg bedankt voor je hulp!
quote:Haha. Nee. Vijfde klas van het VWO. Hierna wil ik wel iets in die richting doen: Geneeskunde.
quote:Is mijn vraag toch nog ergens goed voor geweest. Succes met je examens!Op zondag 9 mei 2010 20:17 schreef Superlam het volgende:
[..]
Geen dank, was net mijn examenstof bio aan het leren dus dit was weer een mooie opfrisser.
Examen Biologie
quote:Het is toch vrij logisch dat 1 en 2 het goede antwoord is.Op maandag 10 mei 2010 12:43 schreef Silentalarm het volgende:
Iemand een antwoord op deze vraag?
Examen Biologie
Dat 1 klopt dat heb je zelf al ontdekt.
En dat 2 klopt is ook logisch, aangezien P. alles voor C heeft weggejaagd, en op dat moment jaagt C, P weg, dus heeft C het rijk alleen, dus hij profiteert van P.
Bewering 3 zegt verder helemaal niks over profiteren, alleen over het aanvalswapen.
quote:Ja klopt, ben vandaag naar mijn docent gegaan en hij gaf ongeveer hetzelfde verhaal.Op maandag 10 mei 2010 15:32 schreef Superlam het volgende:
[..]
Het is toch vrij logisch dat 1 en 2 het goede antwoord is.
Dat 1 klopt dat heb je zelf al ontdekt.
En dat 2 klopt is ook logisch, aangezien P. alles voor C heeft weggejaagd, en op dat moment jaagt C, P weg, dus heeft C het rijk alleen, dus hij profiteert van P.
Bewering 3 zegt verder helemaal niks over profiteren, alleen over het aanvalswapen.
Bedankt in ieder geval.
De situatie:
Y=count variable van aantal partners; gemiddelde Y= 31.7, standaarddeviatie=100.1
X1= competitiviteit markt
X2= verandering markt
X2=proactiviteit bedrijf
En enkele controlevariabelen.
Aangezien de y alleen (hele) waarden van 0 en meer kan aannemen, moet ik dus een poisson regressie doen. (Wellicht een negative binomial regression omdat het aantal nullen misschien te hoog waardoor de assumptie van niet te veel nullen in poisson regressie geschend wordt.)
In ieder geval, als ik dus mijn data invoer in stata, wat gebeurt er dan en wat komt er uit? Ik ben flink aan het zoeken geweest maar dan wordt het al gauw gesmijt met formula en dan snap ik het echt niet meer.
Aangezien ik log likelihood gebruikt zie worden in de literatuur, is het dan zo dat je eerst een leeg model, dan een baseline model schat met de controlevariabelen en dan de onafhankelijke variabelen toevoegt en vervolgens de twee modellen vergelijkt?
Wat betekenen de getallen verder die ik ga tegen komen en wat moet ik hiervan reporteren?
Maar het heeft voor mij ook wel weg van bedrijfskunde, dus misschien dat ze je ook kunnen helpen in het topic over de gammawetenschappen: [Gamma] 'huiswerk en vragen topic'
| 1 2 3 4 5 6 7 | . 11 13 14 10 12 13 . . 12 11 8 9 12 11 . . 14 10 12 23 21 19 . . 10 9 13 2 20 22 . . 8 12 10 24 23 24 . . . . . . . . . |
Het beeld wordt geconvolueerd met het masker:
| 1 2 3 | ω = | 1/9 1/9 1/9 | | 1/9 1/9 1/9 | |
Geef het resultaat voor de onderstreepte pixels in het beeldfragment, beschrijf in woorden wat de beeldfilter doet en maak een masker van 7x7.
Mijn vraag, wat is convulatie, en wat doet dat masker etc.? Heb dit niet gehad met m'n college's en kan zo 1,2,3 ook geen heldere uitleg vinden op internet
elk beeldpunt wordt dus vervangen door het gemiddelde van zichzelf en zijn acht buren.
quote:Ey damn, dat is best makkelijkOp woensdag 19 mei 2010 23:51 schreef GlowMouse het volgende:
http://www.giassa.net/?page_id=588
elk beeldpunt wordt dus vervangen door het gemiddelde van zichzelf en zijn acht buren.

Ik loop een beetje vast bij vraag b. Ik snap niet hoe je de golflengte bepaalt. Als je vanaf het midden naar 2,9 s gaat, dan heb je 4 toppen, dus je zou zeggen: 2,9/4 = 0,73. Helaas is dit niet goed. Het moet 2,9/2 = 1,45 zijn, maar ik snap niet waarom. Het antwoordenboek is ook niet verhelderend. Weet iemand het misschien? Alvast bedankt.
quote:Als je goed naar de grafiek kijkt, dan zie je dat het geen normaal (sinusoïde) golfpatroon is. Je kunt er wel twee overlappende golfpatronen in zien die ten opzichte van elkaar zijn verschoven (faseverschuiving gelijk aan pi). De golflengte is dus gelijk aan de afstand tussen piek n en piek n+2.Op vrijdag 21 mei 2010 00:33 schreef Warren het volgende:
[ afbeelding ]
Ik loop een beetje vast bij vraag b. Ik snap niet hoe je de golflengte bepaalt. Als je vanaf het midden naar 2,9 s gaat, dan heb je 4 toppen, dus je zou zeggen: 2,9/4 = 0,73. Helaas is dit niet goed. Het moet 2,9/2 = 1,45 zijn, maar ik snap niet waarom. Het antwoordenboek is ook niet verhelderend. Weet iemand het misschien? Alvast bedankt.
quote:Geen idee, maar rouden lijkt mij het meest voordehandliggend. Als je meerdere convoluties doet, kun je de kwaliteit verbeteren door tussentijds niet af te ronden.Op donderdag 20 mei 2010 13:38 schreef Diabox het volgende:
Klein vraagje, als er geen geheel getal uit zo'n convolutie komt, wordt deze waarde dan afgerond naar beneden? Of kan het resultaat niet gehele getallen bevatten, terwijl het origineel alleen gehele getallen bevat?
quote:2.9 s moet 2.9 m zijn. Een maximum komt overeen met een buik, een minimum met een knoop. Één golf heeft twee buiken.Op vrijdag 21 mei 2010 00:33 schreef Warren het volgende:
[ afbeelding ]
Ik loop een beetje vast bij vraag b. Ik snap niet hoe je de golflengte bepaalt. Als je vanaf het midden naar 2,9 s gaat, dan heb je 4 toppen, dus je zou zeggen: 2,9/4 = 0,73. Helaas is dit niet goed. Het moet 2,9/2 = 1,45 zijn, maar ik snap niet waarom. Het antwoordenboek is ook niet verhelderend. Weet iemand het misschien? Alvast bedankt.
quote:dit klinkt mij als onzin in de orenOp vrijdag 21 mei 2010 01:16 schreef lyolyrc het volgende:
[..]
Als je goed naar de grafiek kijkt, dan zie je dat het geen normaal (sinusoïde) golfpatroon is. Je kunt er wel twee overlappende golfpatronen in zien die ten opzichte van elkaar zijn verschoven (faseverschuiving gelijk aan pi). De golflengte is dus gelijk aan de afstand tussen piek n en piek n+2.
quote:Bedankt.Op vrijdag 21 mei 2010 01:17 schreef GlowMouse het volgende:
2.9 s moet 2.9 m zijn. Een maximum komt overeen met een buik, een minimum met een knoop. Één golf heeft twee buiken.
Lyolyrc's uitleg snap ik niet echt.. dat over faseverschuiving gelijk aan pi, maar goed.. ik ga er nog naar kijken.
Hier is de link van het examen:
http://www.havovwo.nl/vwo/vbi/bestanden/vbi01iiex.pdf
quote:Misschien is het handiger om hier alvast even de vraag uit te schrijven en uit te leggen.... zodat we niet eerst de vraag volledig uit hoeven te pluizen!Op dinsdag 25 mei 2010 18:14 schreef Warren het volgende:
Ok, nog een vraag aangaande biologie. Kan iemand mij uitleggen waarom vraag 13 C moet zijn? Alvast bedankt.
Hier is de link van het examen:
http://www.havovwo.nl/vwo/vbi/bestanden/vbi01iiex.pdf
Het is immers JOUW vraag!
2. In ieder land zijn er inkomensverschillen. Maar de inkomensongelijkheid is in arme landen vaak veel groter dan in rijke landen. Kijk maar eens naar de gegevens over Ierlad en Zambia:
In ierland verdient de armste 20% van de bevolking 10% van het inkomen
In Zambia verdient de armste 20% van de bevolking 5% van het inkomen
In Ierland verdient de rijkste 20% van de bevolking 40% van het inkomen
In Zambia verdient de rijkste 20% van de bevolking 70% van het inomen.
a) Vul met behulp van deze gegevens de onderstaande tabel in

Dit snap ik niet... het invullen ervan
quote:Op dinsdag 25 mei 2010 18:17 schreef horned_reaper het volgende:
[..]
Misschien is het handiger om hier alvast even de vraag uit te schrijven en uit te leggen.... zodat we niet eerst de vraag volledig uit hoeven te pluizen!
Het is immers JOUW vraag!


Het gaat dus om vraag 13, die C moet zijn. Waarom precies begrijp ik niet zo. Genmutatie en chromosoommutatie zullen het waarschijnlijk niet zijn omdat zij kleine gevolgen hebben (en hier is er sprake van grote gevolgen omdat beide zonen in III de ziekte hebben), maar zeker weten doe ik het niet.
Ze hebben zelf een verwarmingsketel gekocht.
De volgende gegevens zijn bekend over 2004:
- afschrijving verwarmingsketel per jaar 760 euro
- onderhoud verwarming per jaar 200 euro
prijs per kubieke meter aardgas 0,40 euro
aardgasverbruik per jaar 4500 kubieke meter
.
Joris en Myrthe hebben in 2004 in totaal 1430 uur de verwarming aan gehad
a) bereken de totale stookkosten per uur(plus berekening)
Zij kopen het aardgas van Essent en betalen een vast voorschot per maand.
Als achteraf blijkt dat ze meer verbruikt hebben moeten ze bijbetalen
Hebben ze minder verbruikt, krijgen ze geld terug van Essent.
Het maandelijkse voorschot is 142,50
b) Krijgen ze over 2004 geld terug of moeten ze bijbetalen? (plus berekening)
Joris vindt de totale stookkosten nogal hoog. Hij wilt het huis opnieuw laten isoleren. Zo kan hij 20% op aardgasverbruik besparen. De isolatie kost 2100 euro, 600 euro per gezin. Joris gaat ervan uit dat de aardgasprijs niet verandert.
c) Na hoeveel jaar heeft Joris de isolatiekosten terugverdiend? (plus berekening)
d)Stel dat de prijs stijgt, wordt de terugverdiendperiode dan langer of juist korter? + Verklaring
PLEASE!!!!
quote:Ze hebben 1430 uur de verwarming aangehad in één jaar, en in één jaar verbruiken ze 4500 kubieke meter aardgas, hoeveel aardgas verbruiken ze dan per uur? Kom op!Op dinsdag 25 mei 2010 22:28 schreef Kloonvanhoon het volgende:
Joris en Myrthe van Dalen hebben centrale verwarming.
Ze hebben zelf een verwarmingsketel gekocht.
De volgende gegevens zijn bekend over 2004:
- afschrijving verwarmingsketel per jaar 760 euro
- onderhoud verwarming per jaar 200 euro
prijs per kubieke meter aardgas 0,40 euro
aardgasverbruik per jaar 4500 kubieke meter
.
Joris en Myrthe hebben in 2004 in totaal 1430 uur de verwarming aan gehad
a) bereken de totale stookkosten per uur(plus berekening)
quote:Ze stoken 4500 kubieke meter per jaar, hoeveel verstoken ze dan per maand? Je kan dan zo berekenen hoeveel geld ze per maand verstoken!Krijgen ze over 2004 geld terug of moeten ze bijbetalen? (plus berekening)
quote:Dat "De isolatie kost 2100 euro, 600 euro per gezin" vind ik 'n beetje vaag, ik ga er maar van uit dat het dus in totaal 2700 kostc) Na hoeveel jaar heeft Joris de isolatiekosten terugverdiend? (plus berekening)
quote:Korter uiteraard, stel de aardgasprijs wordt 10 miljoen per kubieke meter (d)Stel dat de prijs stijgt, wordt de terugverdiendperiode dan langer of juist korter? + Verklaring
quote:Bedankt voor a&b.Op dinsdag 25 mei 2010 22:45 schreef Diabox het volgende:
[..]
Ze hebben 1430 uur de verwarming aangehad in één jaar, en in één jaar verbruiken ze 4500 kubieke meter aardgas, hoeveel aardgas verbruiken ze dan per uur? Kom op!
[..]
Ze stoken 4500 kubieke meter per jaar, hoeveel verstoken ze dan per maand? Je kan dan zo berekenen hoeveel geld ze per maand verstoken!
[..]
Dat "De isolatie kost 2100 euro, 600 euro per gezin" vind ik 'n beetje vaag, ik ga er maar van uit dat het dus in totaal 2700 kost. Als je 20% per jaar op je totale aardgasverbruik bespaart, hoeveel bespaar je dan per jaar? Je weet het totaal aardgasverbruik per jaar en je weet de prijs, dus dat bereken je zo, toch?
Dan bereken je ook zo hoeveel 20% besparing is! En dat is dus de besparing per jaar, en dan kijk je hoeveel jaar het duurt, voordat je die 2700 euro eruit hebt
.
[..]
Korter uiteraard, stel de aardgasprijs wordt 10 miljoen per kubieke meter (), dan bespaar je dus met 20% 2 miljoen euro per kubieke meter
Dan heb je die 2700 euro er zo uit

C moest anders zijn, ik heb het fout overgeschreven.
Joris vindt de totale stookkosten nogal hoog. Hij wilt het huis opnieuw laten isoleren. Zo kan hij 20% op aardgasverbruik besparen. De isolatie kost 2100 euro,maar de overheid geeft 25% subsidie v/d isolatiekosten tot een maximum van 600 euro per gezin. Joris gaat ervan uit dat de aardgasprijs niet verandert.
Kan je nu c nog voor me beantwoorden?
Zou het zeer op prijs stellen, want dan ben ik eindelijk klaar.
Alvast z'e'e'e'er bedankt!
quote:Bedankt.Op dinsdag 25 mei 2010 22:56 schreef Diabox het volgende:
Oke, de isolatie kost 2100 euro, maar de regering is zo lief om tot 600 euro per gezin (Joris en Dingest zijn één gezin), 25% subsidie te verstrekken. dus van die 2100 euro, wordt een deel, namelijk 600 euro, gedeeltelijk vergoed door de regering, namelijk 25% hiervan. Kom je hier verder mee?
Die snap ik weer wel, en nu snap ik A weer niet.
Kan je me jouw berekening geven? want mijn berekening komt steeds op een ander antwoord uit.
Het goede antwoord moet zijn: $1,93 per uur. en ik kom op $1.60 uit
quote:Oke, de vraag is niet helemaal correct vind ik, er staat namelijk stookkosten per uur. In mijn ogen is dat dus puur de kosten die je hebt van het stoken van aardgas per uur, en niet inclusief:Op dinsdag 25 mei 2010 23:05 schreef Kloonvanhoon het volgende:
[..]
Bedankt.
Die snap ik weer wel, en nu snap ik A weer niet.
Kan je me jouw berekening geven? want mijn berekening komt steeds op een ander antwoord uit.
Het goede antwoord moet zijn: $1,93 per uur. en ik kom op $1.60 uit
- afschrijving verwarmingsketel per jaar 760 euro
- onderhoud verwarming per jaar 200 euro
Blijkbaar vinden de makers van die vraag van wel, maar ik ben het daar mee oneens, in ieder geval, de berekening is dan als volgt:
4500 kubieke meter aardgas per jaar, 0.40 euro per kubieke meter, dus de totale aardgaskosten per jaar zijn
4500 * 0.4 = 1800 euro
Dan nog de 200 euro van onderhoud verwarming = 2000 euro
En dan nog de 760 euro afschrijving verwarmingsketel per jaar = 2760 euro.
Je stookt 1430 uur, dus 2760 / 1430 = 1,93 euro.
quote:Op dinsdag 25 mei 2010 23:12 schreef Diabox het volgende:
[..]
Oke, de vraag is niet helemaal correct vind ik, er staat namelijk stookkosten per uur. In mijn ogen is dat dus puur de kosten die je hebt van het stoken van aardgas per uur, en niet inclusief:
- afschrijving verwarmingsketel per jaar 760 euro
- onderhoud verwarming per jaar 200 euro
Blijkbaar vinden de makers van die vraag van wel, maar ik ben het daar mee oneens, in ieder geval, de berekening is dan als volgt:
4500 kubieke meter aardgas per jaar, 0.40 euro per kubieke meter, dus de totale aardgaskosten per jaar zijn
4500 * 0.4 = 1800 euro
Dan nog de 200 euro van onderhoud verwarming = 2000 euro
En dan nog de 760 euro afschrijving verwarmingsketel per jaar = 2760 euro.
Je stookt 1430 uur, dus 2760 / 1430 = 1,93 euro.
Kom je morgen mijn proefwerk maken?
Heel erg bedankt, echtwaar!
quote:Geen probleem.Op dinsdag 25 mei 2010 23:15 schreef Kloonvanhoon het volgende:
[..]




Kom je morgen mijn proefwerk maken?
Heel erg bedankt, echtwaar!
Stel je hebt een b+ boom en je wilt een nieuwe key toevoegen, maar de leaf waar die hoort toegevoegd te worden is vol, en je split dus die leaf, moet je dan een nieuwe leaf aanmaken, of moet je hem (in sommige gevallen) dan toevoegen aan een andere al bestaande leaf? (de root node krijgt nu tenslotte een andere rightmost value, dus kan ie misschien in een andere leaf). Ik kom namelijk niet echt veel voorbeelden tegen, en in de voorbeelden die ik tegenkom wordt een nieuwe leaf aangemaakt, maar dit zijn voorbeelden met leafes van 2... Dus stel de leafes zijn bijv. 4, en er is een leaf die 1 key heeft (dus underflow) waar die in kan, moet je hem dan daar aan toevoegen?
Ik hoop dat ik duidelijk ben.
U-238. Bij deze kernreactie is het aantal protonen en het aantal neutronen in de kern
veranderd.
a. Hoeveel neutronen heeft een Pb-206 atoom minder dan U-238 atoom ?
Laat zien hoe u aan uw antwoord komt.
Een loodverbinding is pyromorfiet. Deze verbinding heeft de verhoudingsformule
Pb5Cl(PO4)3
Pyromorfiet is een mengsel van twee loodzouten, waarbij Pb alleen in de Pb2+-vorm
voorkomt. Uit de formule van pyromorfiet kan worden afgeleid in welke
molverhouding deze twee zouten voorkomen.
b. Geef de formules en de namen van de twee loodzouten waaruit pyromorfiet
bestaat.
c. Leid af in welke molverhouding deze twee zouten voorkomen in pyromorfiet.
Pyromorfiet kan gebruikt worden als grondstof voor de productie van menie, Pb3O4.
Dit productieproces heeft een rendement van 98,0 %; dat wil zeggen dat van iedere
100 Pb-atomen uit het pyromorfiet er 98 in de menie terechtkomen.
d. Leg uit hoe het zout Pb3O4 is samengesteld.
e. Bereken hoeveel pyromorfiet nodig is voor de productie van 100,0 kg menie.
Kan iemand mij helpen met vraag e? De molaire massa van Pb5Cl(PO4)3 = 1356,36 g/mol en van Pb3O4 = 685,6 g/mol. Ik kan alleen niet achterhalen in welke molecuulverhouding zij reageren. Hoe kom ik hier uit? Ik kan namelijk geen goede reactievergelijking opstellen... Alvast bedankt.
[ Bericht 0% gewijzigd door Warren op 28-05-2010 16:26:17 ]
quote:Het mooie is dat je juist helemaal geen reactievgl. nodig om dit op te lossen. Wat je moet doen is realiseren dat uit je 1mol pyromorfiet 5 mol menie kan halenOp vrijdag 28 mei 2010 16:07 schreef Warren het volgende:
[...]
Pyromorfiet kan gebruikt worden als grondstof voor de productie van menie, Pb3O4
Dit productieproces heeft een rendement van 98,0 %; dat wil zeggen dat van iedere
100 Pb-atomen uit het pyromorfiet er 98 in de menie terechtkomen.
d. Leg uit hoe het zout Pb3O4 is samengesteld.
e. Bereken hoeveel pyromorfiet nodig is voor de productie van 100,0 kg menie.
Kan iemand mij helpen met vraag e? De molaire massa van Pb5Cl(PO4)3 = 1356,36 g/mol en van Pb3O4 = 685,6 g/mol. Ik kan alleen niet achterhalen in welke molecuulverhouding zij reageren. Hoe kom ik hier uit? Ik kan namelijk geen goede reactievergelijking opstellen... Alvast bedankt.
Met die kennis in je achterhoofd kan je bij het begin beginnen: Je moet eerst die 100,00 kg menie delen door de molaire massa van menie. Dan heb je het aantal mol dat in 100,00 kg menie zit.
Vermenigvuldig met de molaire massa van pyromorfiet EN DEEL VERVOLGENS DOOR 5 (uit 1mol pyromorfiet kan je 5 mol menie halen) om het benodigde aantal kilo pyromorfiet bij volledige omzetting te berekenen.
Omdat de omzetting niet 100% volledig verloopt maar een rendement van 98% kent, moet je het benodigde aantal kilo pyromorfiet delen door 98 en vermenigvuldigen met 100. Presto, daar heb je je antwoord.
quote:Volgens het antwoordenmodel kun je uit 3 mol Pb5Cl(PO4)3.... 5 mol Pb3O4 krijgen. Kennelijk kijken ze alleen naar de Pb (immers, 3*5 = 15 en 5*3=15)Op zaterdag 29 mei 2010 05:40 schreef ErictheSwift het volgende:
[..]
Het mooie is dat je juist helemaal geen reactievgl. nodig om dit op te lossen. Wat je moet doen is realiseren dat uit je 1mol pyromorfiet 5 mol menie kan halen
quote:Dit is het enige stukje waar ErictheSwift het niet goed heeft. Het gaat inderdaad om de loodionen en je moet deze constatering uit het antwoordenmodel ook gebruiken. De juiste uitwerking wordt dus:Op zaterdag 29 mei 2010 13:56 schreef Warren het volgende:
Volgens het antwoordenmodel kun je uit 3 mol Pb5Cl(PO4)3.... 5 mol Pb3O4 krijgen. Kennelijk kijken ze alleen naar de Pb (immers, 3*5 = 15 en 5*3=15)
quote:Op zaterdag 29 mei 2010 05:40 schreef ErictheSwift het volgende:
Het mooie is dat je juist helemaal geen reactievgl. nodig om dit op te lossen. Wat je moet doen is realiseren dat uit je 1mol pyromorfiet 5/3 mol menie kan halen
Met die kennis in je achterhoofd kan je bij het begin beginnen: Je moet eerst die 100,00 kg menie delen door de molaire massa van menie. Dan heb je het aantal mol dat in 100,00 kg menie zit.
Vermenigvuldig met de molaire massa van pyromorfiet EN DEEL VERVOLGENS DOOR 5/3 (uit 1mol pyromorfiet kan je 5/3 mol menie halen) om het benodigde aantal kilo pyromorfiet bij volledige omzetting te berekenen.
Omdat de omzetting niet 100% volledig verloopt maar een rendement van 98% kent, moet je het benodigde aantal kilo pyromorfiet delen door 98 en vermenigvuldigen met 100. Presto, daar heb je je antwoord.
[ Bericht 58% gewijzigd door ErictheSwift op 29-05-2010 18:35:45 ]
quote:Je begint altijd met het tekenen van de grootste koolstofketen. Voor ethylpentaan is dat pentaan, voor 3-ethyl-2,2-dimethylhexaan is dat hexaan en voor 4-(1-metylethyl)-octaan is dat octaan. Daarna ga je op de juiste plaats de zijketens aan de hoofdketen vastmaken. De cijfers geven weer aan welk koolstofatoom van de hoofdketen de zijketens moeten worden verbonden.Op zondag 30 mei 2010 17:25 schreef MrBubbles het volgende:
Heb een weekje school gemist en probeer nu weer alles in te halen, alleen snap scheikunde niet helemaal. Hoe teken ik bijvoorbeeld de structuurformules van ethylpentaan, 3-ethyl-2,2-dimethylhexaan en 4-(1-metylethyl)-octaan?
Geef de half reacties en de totaal redoxreactievergelijking van de reactie tussen kaliumpermanganaat en natriumsulfiet in zuur milieau (zwavelzuur):
Morgen een s.otje frans.
Ik zit momenteel in havo 3.
Ik heb een probleem met de vragende voornaamwoorden.. we moeten voor morgen Qui, Quel, qu'est-ce qui en qu'est-ce que kennen
Ik snap Quel en Qui wel.
Maar mijn probleem is dat die andere 2 voor mij totaal onduidelijk zijn.
Kan iemand mij aub helpen? Graag met voorbeeldzinnetjes.
Alvast bedankt!
Ik heb een som waar ik zelf de antwoord niet kan vinden kan iemand me helpen?
In de natuur heb je Mg-24, Mg-25 en Mg-26
Mg-25 en Mg-26 lijken op elkaar, bereken de percentage Mg-24, Mg-25 en Mg-26
In Binas stond
Mg-24 zo een 80procent
Mg-25 en Mg-26 zo een 10 procent beide.
Kan iemand me hiermee helpen??
Alvast bedankt keb net al geprobeerd bij school n studie kben hiernaar verweze
quote:Volgens mij ontbreekt er informatie. Je kunt beter wat duidelijker weergeven wat er berekend moet worden; op deze manier kunnen we je niet helpen.Op maandag 7 juni 2010 21:10 schreef lolyizlekker het volgende:
Hoi iedereen,
Ik heb een som waar ik zelf de antwoord niet kan vinden kan iemand me helpen?
In de natuur heb je Mg-24, Mg-25 en Mg-26
Mg-25 en Mg-26 lijken op elkaar, bereken de percentage Mg-24, Mg-25 en Mg-26
In Binas stond
Mg-24 zo een 80procent
Mg-25 en Mg-26 zo een 10 procent beide.
Kan iemand me hiermee helpen??
Alvast bedankt keb net al geprobeerd bij school n studie kben hiernaar verweze
Als bij een trekproef de yield stress (vloeispanning) wordt bereikt gaat de staaf vloeien, en vervolgens als de ultimate tensile stress wordt bereikt breekt de staaf.
Wat gebeurt er nu bij een drukproef? Het vloeien zal op dezelfde manier plaats vinden, maar wat als de ultimate tensile stress wordt bereikt?
ff overnieuw
Je hebt in de natuur Mg-24,Mg-25 en Mg-26
Mg-24 is 23,98u
Mg-25 is 24,98u
Mg-26 is 25,98u
Mg-25 en Mg-26 verschillen niet veel van elkaar
Hoeveel percentage Mg-24,25 en 26 komen er in de natuur voor
Ik had ook de gem. Mg gezocht dat was 24,31
ik dacht dat je
25,98-24,31/25,98-23,98 moest doen om het percentage Mg-24 te vinde, toen kwam ik uit op 84%
het moet volgens binas iets in de 80 zijn
quote:Ik probeer het eerst met een hint: stel de fractie Mg-25 en Mg-26 beide gelijk aan x. Dan is de fractie Mg-24 gelijk aan 1-2x. Stel hiermee een vergelijking op en los die op.Op maandag 7 juni 2010 22:40 schreef lolyizlekker het volgende:
ja sorry ,
ff overnieuw
Je hebt in de natuur Mg-24,Mg-25 en Mg-26
Mg-24 is 23,98u
Mg-25 is 24,98u
Mg-26 is 25,98u
Mg-25 en Mg-26 verschillen niet veel van elkaar
Hoeveel percentage Mg-24,25 en 26 komen er in de natuur voor
Ik had ook de gem. Mg gezocht dat was 24,31
ik dacht dat je
25,98-24,31/25,98-23,98 moest doen om het percentage Mg-24 te vinde, toen kwam ik uit op 84%
het moet volgens binas iets in de 80 zijn
Nu snap ik em
Wat is de molecuul formule van het element jodium? Geef ook het oxidatie getal ervan.
Weer een inzinking en zie door het bos de bomen niet meer, bedankt.
quote:Sulfiet heeft als formule SO32- en sulfaat SO42-. Als je ervan uitgaat dat elk zuurstofatoom een lading heeft van 2-, wat wordt dan het oxidatiegetal voor zwavel in sulfiet en sulfaat?Op woensdag 9 juni 2010 15:43 schreef vault_tec het volgende:
Geef de oxidatie getallen van zwavel in natriumsulfiet en in natriumsulfaat.
quote:Er zijn 7 tweeatomige elementen. Ken je die? En als je weet dat er twee dezelfde atomen aan elkaar vastzitten, welke van de twee zal dan het hardst aan de bindende elektronen trekken?Wat is de molecuul formule van het element jodium? Geef ook het oxidatie getal ervan.
Weer een inzinking en zie door het bos de bomen niet meer, bedankt.
[ Bericht 0% gewijzigd door lyolyrc op 09-06-2010 19:22:59 ]
Een herdershond moet een kudde schapen , die over haar totale lengte steeds 50 meter lang blijft naar een 800m verderop gelegen schuur brengen. Door steeds van de kop van de kudde naar het einde ervan te lopen (en omgekeerd) met een snelheid van 5m/s , slaagt het trouwe dier erin de kudde te verplaatsen met een gemiddelde snelheid van 1m/s.
Indien hij aan de kop van de kudde vertrekt en samen met de eerste dieren in de schuur aankomt, dan is de afstand die de herdshond afgelegd heeft, gelijk aan:
--
nu zie ik twee manieren om dit te doen. De eerste is makkelijk en is de afstand tot de schuur delen door de snelheid van de schapen: 800m/ 1m/s = 800s. De hond rent 5m/s dus in totaal legt de hond 4000m af.
Simpel lijkt het, en ook het goede antwoord volgens het correctie model.
Maar als je rekening houdt met de snelheid van de schapen kom je op iets anders. Als de hond naar het einde van de kudde rent loopt ie tegen de richting van de schapen in. Zijn snelheid is dus 5+1 = 6 m/s ten opzichte van de kudde. Hij loopt dan langs de 50m lange kudde in 50/6 = 8.33 seconde. In werkelijkheid heeft hij dan 41.65m afgelegd. Omgekeerd, als hij met de kudde mee moet lopen is zijn relatieve snelheid maar 4m/s. Dan doet hij er dus 12,5s over wat 62.5m is. Totaal legt hij dus 104.15m af om heen en weer te rennen. Over het complete rondje doet hij dus 12,5 + 8.33 = 20.83 seconde. In de 800s dat de kudde erover doet naar de schuur te lopen kan hij 38.4 rondje lopen. Maar er wordt ge-eist dat hij met de eerste dieren in de schuur aankomt, dus moet hij 39 rondjes lopen. dan loopt hij dus iets meer dan 4000m. Als je 38.4 rondje aanhoudt dan loopt hij wel precies 4000m. Dus ongetwijfeld maak ik ergens een denkfout maar ik kan de plek niet vinden
quote:Wat je zegt klopt, het is eigenlijk 39 ipv 38,4 omdat in de vraag staat dat ook de hond in de schuur moet aankomen. Ze hebben de vraag dus moeilijker gemaakt dan ze in de gaten hadden.Op maandag 21 juni 2010 16:34 schreef Telates het volgende:
Vraag uit Belgisch toelatingsexamen voor medicijnen:
Een herdershond moet een kudde schapen , die over haar totale lengte steeds 50 meter lang blijft naar een 800m verderop gelegen schuur brengen. Door steeds van de kop van de kudde naar het einde ervan te lopen (en omgekeerd) met een snelheid van 5m/s , slaagt het trouwe dier erin de kudde te verplaatsen met een gemiddelde snelheid van 1m/s.
Indien hij aan de kop van de kudde vertrekt en samen met de eerste dieren in de schuur aankomt, dan is de afstand die de herdshond afgelegd heeft, gelijk aan:
--
nu zie ik twee manieren om dit te doen. De eerste is makkelijk en is de afstand tot de schuur delen door de snelheid van de schapen: 800m/ 1m/s = 800s. De hond rent 5m/s dus in totaal legt de hond 4000m af.
Simpel lijkt het, en ook het goede antwoord volgens het correctie model.
Maar als je rekening houdt met de snelheid van de schapen kom je op iets anders. Als de hond naar het einde van de kudde rent loopt ie tegen de richting van de schapen in. Zijn snelheid is dus 5+1 = 6 m/s ten opzichte van de kudde. Hij loopt dan langs de 50m lange kudde in 50/6 = 8.33 seconde. In werkelijkheid heeft hij dan 41.65m afgelegd. Omgekeerd, als hij met de kudde mee moet lopen is zijn relatieve snelheid maar 4m/s. Dan doet hij er dus 12,5s over wat 62.5m is. Totaal legt hij dus 104.15m af om heen en weer te rennen. Over het complete rondje doet hij dus 12,5 + 8.33 = 20.83 seconde. In de 800s dat de kudde erover doet naar de schuur te lopen kan hij 38.4 rondje lopen. Maar er wordt ge-eist dat hij met de eerste dieren in de schuur aankomt, dus moet hij 39 rondjes lopen. dan loopt hij dus iets meer dan 4000m. Als je 38.4 rondje aanhoudt dan loopt hij wel precies 4000m. Dus ongetwijfeld maak ik ergens een denkfout maar ik kan de plek niet vinden
edit- tenzij ze natuurlijk er vanuit gaan dat die hond heel erg slim is en goed kan timen dat hij in zijn laatste keer heen-en-weer lopen niet tot het einde van de kudde loopt maar al eerder weer omdraait zodat hij op precies dezelfde tijd als het eerste schaap aankomt bij de schuur.
[ Bericht 7% gewijzigd door Baszh op 21-06-2010 19:15:55 ]
Maar jouw redenering lijkt me goed.
quote:Hij hoeft er niet omheen volgens mij, alleen maar van voorkant naar achterkantOp maandag 21 juni 2010 19:16 schreef BasementDweller het volgende:
Volgens mij mis je ook informatie, er staat nergens hoe breed de kudde is en in wat voor formatie ze lopen

Hoe pak je dit aan?
Ik zou eerst die laatste 3 weerstanden die in serie staan als vervangingsweerstand berekenen. En dan krijg je dus een situatie met 4 parallelle weerstanden. Maar dan?
quote:Simpele toepassing van de wetten van Ohm en Kirchhoff. Ik zal de stroom door weerstand Rk aanduiden met Ik en de spanning over weerstand Rk met Vk.Op dinsdag 22 juni 2010 19:22 schreef GoodGawd het volgende:
[ afbeelding ]
Hoe pak je dit aan?
Ik zou eerst die laatste 3 weerstanden die in serie staan als vervangingsweerstand berekenen. En dan krijg je dus een situatie met 4 parallelle weerstanden. Maar dan?
Om I2 te berekenen bepalen we eerst V2. De spanningsval over R2 is gelijk aan de spanningsval over R3, dus:
V2 = V3 = I3∙R3 = 2∙115 V = 230 V.
Dus is:
I2 = V2/R2 = 230/57,5 A = 4 A.
Om de stroom door R7 te berekenen bepalen we eerst de vervangingsweerstand van R5, R6 en R7 in serie. Deze is:
R5,6,7 = R5 + R6 + R7 = 30 Ω + 150 Ω + 50 Ω = 230 Ω.
De spanningsval V5,6,7 over R5, R6 en R7 in serie is gelijk aan de spanningsval over R4 en de spanningsval over R3, en die hadden we al berekend, namelijk V3 = 230 V. Voor de stroom door R5, R6 en R7 vinden we dan:
I5,6,7 = V5,6,7/R5,6,7 = 230/230 A = 1 A.
De stroom door R1 is gelijk aan de som van de stromen door R2, R3, R4 en de stroom door de in serie geschakelde weerstanden R5, R6 en R7, dus:
I1 = I2 + I3 + I4 + I5,6,7 = 4 A + 2 A + 5 A + 1 A = 12 A.
De spanning over R7 is gelijk aan:
V7 = I7∙R7 = 1∙50 V = 50 V.
De spanning U van de bron is gelijk aan de som van de spanningen over R1 en R2. Voor de spanning over R1 vinden we:
V1 = I1∙R1 = 12∙22,5 V = 270 V.
De bronspanning is dus:
U = V1 + V2 = 270 V + 230 V = 500 V.
staaf heeft een dwarsdoorsnede in de vorm van een rechthoekige driehoek met hoeken van 30 graden, 60 graden en 90 graden. Een rechtsdraaiende circulair gepolariseerd lichtgolf met intensiteit van 1 W/m² valt loodrecht in op de kortste rechthoekzijde.
a) Bereken de intensiteit van het direct gereflecteerde licht. Geef ook de polarisatietoestand van
dit licht.
Wat voor formule heb ik hier nodig?
http://www.wolframalpha.com/input/?i=%E2%88%9A%281-x2%29+%2F+x (druk op show steps)

en er wordt op punt P een prikkel van zodanige sterkte opgewekt, dat het een impuls opwekt. komt dit dan aan in de cellichamen van neuron 2 en 3?
en is neuron 2 een schakelneuron?
bij voorbaat dank
Ik heb de volgende matrix:

De eigenwaarden van deze matrix zijn 0.8, -1 en 0.5.
Ik wil hiervan de eigenvectoren bepalen.
Dit doe ik door drie keer (A-LI)x=0 op te lossen.
De eigenvectoren die ik er dan uitkrijg zijn:
1 -5 0
0 9 -2
0 0 3
Maar volgens mij zijn ze niet goed. Ik twijfel er in ieder geval te veel aan. Iemand die me uit de brand kan helpen?
quote:De eigenvectoren moeten bij vermenigvuldiging met de Matrix op een veelvoud van zichzelf uitkomen, dat kun je checken om te zien of je antwoorden goed zijn.Op donderdag 1 juli 2010 16:20 schreef Jesse_ het volgende:
Een vraagje:
Ik heb de volgende matrix:
[ afbeelding ]
De eigenwaarden van deze matrix zijn 0.8, -1 en 0.5.
Ik wil hiervan de eigenvectoren bepalen.
Dit doe ik door drie keer (A-LI)x=0 op te lossen.
De eigenvectoren die ik er dan uitkrijg zijn:
1 -5 0
0 9 -2
0 0 3
Maar volgens mij zijn ze niet goed. Ik twijfel er in ieder geval te veel aan. Iemand die me uit de brand kan helpen?
quote:Als je kunt vermenigvuldigen en optellen, kun je het expliciet checken, lijkt me. Wat komt daar uit?Op donderdag 1 juli 2010 16:20 schreef Jesse_ het volgende:
Een vraagje:
Ik heb de volgende matrix:
[ afbeelding ]
De eigenwaarden van deze matrix zijn 0.8, -1 en 0.5.
Ik wil hiervan de eigenvectoren bepalen.
Dit doe ik door drie keer (A-LI)x=0 op te lossen.
De eigenvectoren die ik er dan uitkrijg zijn:
1 -5 0
0 9 -2
0 0 3
Maar volgens mij zijn ze niet goed. Ik twijfel er in ieder geval te veel aan. Iemand die me uit de brand kan helpen?
quote:Het idee van dat een matrix A een eigenvector X heeft met eigenwaarde L, betekent dat
A*X=LX
In jouw geval is die matrix een lineaire afbeelding van een driedimensionale ruimte naar een driedimensionale ruimte. Die matrix laat je inwerken op een vector, en als er verder geen restricties op die matrix gelden, kan de resulterende vector elke kant "opwijzen" en elke grootte hebben die je kunt voorstellen.
Echter, wanneer je een matrix in laat werken op een eigenvector, dan blijft de richting van die eigenvector hetzelfde; het enige wat je verandert is de grootte (de norm) van die vector.
Wat je dus voor elke eigenvector zou moeten doen, is je matrix op die eigenvector laten inwerken, en kijken of je de bijbehorende eigenwaarde maal die eigenvector krijgt. Zo ja, dan zit je goed
quote:Dank je, de 1 0 0 eigenvector is in ieder geval goedOp zaterdag 3 juli 2010 17:02 schreef Haushofer het volgende:
[..]
Het idee van dat een matrix A een eigenvector X heeft met eigenwaarde L, betekent dat
A*X=LX
In jouw geval is die matrix een lineaire afbeelding van een driedimensionale ruimte naar een driedimensionale ruimte. Die matrix laat je inwerken op een vector, en als er verder geen restricties op die matrix gelden, kan de resulterende vector elke kant "opwijzen" en elke grootte hebben die je kunt voorstellen.
Echter, wanneer je een matrix in laat werken op een eigenvector, dan blijft de richting van die eigenvector hetzelfde; het enige wat je verandert is de grootte (de norm) van die vector.
Wat je dus voor elke eigenvector zou moeten doen, is je matrix op die eigenvector laten inwerken, en kijken of je de bijbehorende eigenwaarde maal die eigenvector krijgt. Zo ja, dan zit je goed
De andere twee echter niet.
Hoe leid ik ze nu af uit de volgende matrix:
0.3 1 -1
0 -1.5 -1
0 0 0
Eigenwaarde is 0.5
Die ander moet me zelf wel lukken met een antwoord
-1.5, 0 en 0.3 zijn de eigenwaarden.
En doe gewoon dit steeds oplossen voor de verschillende eigenwaarden:

en is er misschien heel misschien iemand die voor mij dit zou kunnen checken of ik dit nou goed begrepen heb...
quote:Jawel, bij de matrix die ik postte heb ik de eigenwaarde 0.5 al ingevuld en wat geveegdOp zaterdag 3 juli 2010 22:21 schreef Mathematics het volgende:
Die 0.5 klopt niet.
-1.5, 0 en 0.3 zijn de eigenwaarden.
En doe gewoon dit steeds oplossen voor de verschillende eigenwaarden:
[ afbeelding ]
Maar ik snap hem nu wel. Dank je
quote:EX(~nbin(n,p))^2 is geen gebruikelijke notatieOp zondag 4 juli 2010 02:38 schreef Hanneke12345 het volgende:
Toch nog: Ik ben nog altijd niet zo goed in het vinden van die bedelingen en als je dan een stochast in het kwadraat hebt wat dat precies inhoudt. Ik probeer nu EX(~nbin(n,p))^2 uit te rekenen, zodat ik vervolgens de variantie kan vinden, en loop hier vast; volgens mij ben ik er bijna, maar ik weet niet wat ik verder nog kan doen.
[ afbeelding ]
de sommatie over k moet pas beginnen bij k=n. De volgende stap kan dan zijn om k' = k-n substitueren en dan de haakjes van de linker k weg te werken.
quote:en is er misschien heel misschien iemand die voor mij dit zou kunnen checken of ik dit nou goed begrepen heb...
De tweede en derde zijn fout omdat je F niet differentieert.
ben jij HvB?
[ Bericht 1% gewijzigd door GlowMouse op 04-07-2010 11:25:23 ]
quote:Ah, dat van k=n had ik moeten kunnen bedenken. Oké, dan zou 't nu wel moeten lukken!Op zondag 4 juli 2010 11:17 schreef GlowMouse het volgende:
[..]
EX(~nbin(n,p))^2 is geen gebruikelijke notatie
de sommatie over k moet pas beginnen bij k=n. De volgende stap kan dan zijn om k' = k-n substitueren en dan de haakjes van de linker k weg te werken.
quote:Ah, stom, ja. Maargoed, verder snap ik dat dus wel blijkbaar.
De tweede en derde zijn fout omdat je F niet differentieert.
quote:Oei, bijna wel ja!ben jij HvB?
Ja, nee, klopt.
Of het twee dagen verwijst toch naar m'n verjaardag, dat kan ook nog. :p
De vraag hierbij is bereken de loodrechte projectie van het punt P op het vlak V.
^y= (y.u/u.u)u is de formule die ik erbij moet gebruiken geloof ik, maar ik heb geen enkel idee hoe ik V hier in betrek. Help?
quote:Is "Feite" een jongens- of een meisjesnaam?Op zondag 4 juli 2010 16:27 schreef Hanneke12345 het volgende:
Ik kan nog geen volledige naam bij die afkorting plaatsen.;x Ik neem aan dat "twee daagjes etc. etc." gaat over 't mondeling, vandaar mijn gok MM. Dan een werkgroepdocent, maar daar past de afkorting ook niet bij. BGo doet ergens een belletje rinkelen, lijkt volgens mij op de afkorting van een docent op de middelbare school, maar ik zou niet weten waarom die mij uberhaupt nog kent en weet van m'n mondeling.. Ik kom er niet uit, vertel!
Of het twee dagen verwijst toch naar m'n verjaardag, dat kan ook nog. :p
quote:Ik ken ook enkelen van Fok! IRL, hihi
quote:Godver, waar komt deze vraag nou ineens weer vandaan? ;D Jongens, ik dacht op Fok! Nog een beetje privacy te hebben!Op zondag 4 juli 2010 17:20 schreef Diabox het volgende:
[..]
Is "Feite" een jongens- of een meisjesnaam?
quote:Weet ik niet meer zo goed. In ieder geval heeft 'ie een goed geheugen!Op zondag 4 juli 2010 16:05 schreef BasementDweller het volgende:
En, Hanneke, hoe is BGo in het echt?
[ Bericht 0% gewijzigd door Hanneke12345 op 05-07-2010 01:03:43 ]
quote:Op zondag 4 juli 2010 16:57 schreef Jesse_ het volgende:
In de 3-dimensionale ruimte zijn gegeven het vlak V: 2x-y+3z=27 en het punt P(1,0,-1)
De vraag hierbij is bereken de loodrechte projectie van het punt P op het vlak V.
^y= (y.u/u.u)u is de formule die ik erbij moet gebruiken geloof ik, maar ik heb geen enkel idee hoe ik V hier in betrek. Help?
Die formule werkt alleen bij projectie op een ruimte met dimensie 1, hier werkt iets met U*INV(UT * U)UT y met U een matrix met als kolommen de basis van een vlak dat door de oorsprong gaat.
quote:Tja, als iemand jouw initialen gaat posten is het niet echt moeilijk om erachter te komen wat je volledige naam isOp maandag 5 juli 2010 00:23 schreef Hanneke12345 het volgende:
[..]
Godver, waar komt deze vraag nou ineens weer vandaan? ;D Jongens, ik dacht op Fok! Nog een beetje privacy te hebben!
quote:GoogleOp maandag 5 juli 2010 10:20 schreef Hanneke12345 het volgende:
Volgens mij kan het maar één zijn, als je een lijst van eerstejaars hebt iig. Geen idee waar jij wat vandaan haalt tho
[ Bericht 24% gewijzigd door Hanneke12345 op 05-07-2010 14:12:10 ]
quote:Klopt, echter met je initialen erbij kwam ik pas op het idee...Op maandag 5 juli 2010 14:05 schreef Hanneke12345 het volgende:
Zonder intialen had je dat dus ook kunnen vinden.
quote:Deze vraag heb je in het verkeerde topic gepost.Op zondag 4 juli 2010 16:57 schreef Jesse_ het volgende:
In de 3-dimensionale ruimte zijn gegeven het vlak V: 2x-y+3z=27 en het punt P(1,0,-1)
De vraag hierbij is bereken de loodrechte projectie van het punt P op het vlak V.
^y= (y.u/u.u)u is de formule die ik erbij moet gebruiken geloof ik, maar ik heb geen enkel idee hoe ik V hier in betrek. Help?
Ga niet goochelen met formules die je toch niet begrijpt, maar probeer inzicht te krijgen. Ik zou het als volgt aanpakken (maar het is niet gezegd dat je docent of boek het ook zo doet).
Gegeven is het vlak
(1) V: 2x - y + 3z = 27
De clou is dat je het linkerlid van (1) kunt schrijven als een inproduct (dotproduct) van een vaste vector
(2) n = (2, -1, 3)
en een variabele vector
(3) v = (x, y, z)
met een eindpunt op vlak V. In vectorvorm kunnen we vergelijking (1) nu herschrijven als:
(4) n∙v = 27
Beschouw nu tevens een vlak V' waarvan de vergelijking is gegeven door:
(5) V': 2x - y + 3z = 0
Het is evident dat vlak V' door de oorsprong gaat en er geen triplet (x, y, z) is dat aan zowel (1) als (5) kan voldoen, zodat vlak V' parallel is met vlak V. Op dezelfde manier kunnen we nu vergelijking (5) voor V' in vectorvorm schrijven als:
(6) n∙v = 0
Omdat vlak V' door de oorsprong gaat en het inproduct van elke vector v in V' met n gelijk is aan nul, betekent dit dat n loodrecht staat op elke vector v in V' en dat n dus een normaalvector is van V'. Maar omdat V parallel is met V' is n tevens een normaalvector van vlak V.
Laten we nu het voetpunt van de loodlijn uit P op vlak V aanduiden met Q, dan is het duidelijk dat lijnstuk PQ loodrecht staat op vlak V en dus evenwijdig is met de normaalvector n. Noem de vectoren OP en OQ resp. p en q, dan is het duidelijk dat de verschilvector q - p langs de normaalvector n ligt. Dit betekent dat er een reëel getal λ is, zodanig dat:
(7) q - p = λ∙n,
En dus:
(8) q = λ∙n + p
Maar nu weten we dat n = (2, -1, 3) en p = (1, 0, -1), en dus kunnen we voor (8) schrijven:
(9) q = (2λ + 1, -λ, 3λ - 1)
Ook weten we dat Q op vlak V ligt, zodat q voldoet aan (4) en dus geldt:
(10) n∙q = 27
Uit (2), (9) en (10) volgt nu dat geldt:
(11) 2∙(2λ + 1) + λ + 3∙(3λ - 1) = 27
Oplossen van deze lineaire vergelijking in λ levert λ = 2, en door substitutie hiervan in (9) volgt dat:
(12) q = (5, -2, 5)
Hiermee is dus het gevraagde punt Q(5, -2, 5) gevonden en de opgave opgelost. Merk nog op dat je nu ook de afstand van punt P tot vlak V eenvoudig kunt bepalen, deze afstand is immers gelijk aan de lengte van vector q - p, dus volgt uit (7) dat:
(13) d(P,V) = |q - p| = 2∙|n| = 2∙√14.
quote:Lijkt mij iets voor fresnelreflectieOp zondag 27 juni 2010 12:24 schreef BasementDweller het volgende:
Een glazen staaf met brekingsindex n =wortel(3) bevindt zich in lucht met brekingsindex n = 1. De
staaf heeft een dwarsdoorsnede in de vorm van een rechthoekige driehoek met hoeken van 30 graden, 60 graden en 90 graden. Een rechtsdraaiende circulair gepolariseerd lichtgolf met intensiteit van 1 W/m² valt loodrecht in op de kortste rechthoekzijde.
a) Bereken de intensiteit van het direct gereflecteerde licht. Geef ook de polarisatietoestand van
dit licht.
Wat voor formule heb ik hier nodig?
[ Bericht 5% gewijzigd door flapp0r op 16-08-2010 19:05:43 ]
namelijk wat het verschil is tussen fenomenologisch en empirisch analytisch.
Het zijn wetenschapsopvattingen, op google en in boeken staan wel beschrijvingen,
maar ik kom er niet uit wat nou het verschil is.
Ik hoop dat er iemand is die mij dit kan vertellen
[ Bericht 34% gewijzigd door Swomp op 06-09-2010 16:49:54 ]
Als je een stalen veer hebt en die indrukt voer je in principe potentiële energie toe aan het staal. Als je maar hard genoeg drukt zal uiteindelijk het steel vervormen in het plastische gebied. Je hebt dan het maximale potentiële elastische energie level overschreden.
Ik kreeg bij een bedrijf tijdens een presentatie een formule te zien met daarin E (energie), sigma (maximale spanning), E (E-modulus) en V (volume). Ik heb hem echter niet correct opgeschreven aangezien de eenheid vergelijking al niet klopt.
Mijn vraag is nu of iemand een formule weet om de maximale op te nemen energie te berekenen aan de hand van de materiaaleigenschappen en het volume.
Alvast bedankt, mocht de vraag niet duidelijk genoeg zijn hoor ik het wel.
Geef de reactievergelijking van de volgende zuur-base reactie:
1 millimol ophelost kaliumfosfaat met 1 millimil opgelost zwavelzuur
PO4 3- + 3 H30+ --> 3 H2O + H3PO4
Waarom is dit antwoord niet goed? PO4 3- neemt toch 3 H+ op?
Het antwoord moet volgens het antwoordenmodel zijn:
PO4 3- + 2 H30+ --> 2 H2O + H2PO4-
quote:Het ligt niet aan jou, de vraag is gewoon beroerd geformuleerd.Op maandag 13 september 2010 12:38 schreef Warren het volgende:
Een vraagje:
Geef de reactievergelijking van de volgende zuur-base reactie:
1 millimol ophelost kaliumfosfaat met 1 millimil opgelost zwavelzuur
PO4 3- + 3 H30+ --> 3 H2O + H3PO4
Waarom is dit antwoord niet goed? PO4 3- neemt toch 3 H+ op?
Het antwoord moet volgens het antwoordenmodel zijn:
PO4 3- + 2 H30+ --> 2 H2O + H2PO4-
Fosfaat kan maximaal 3x een H+ opnemen, maar dat gebeurt niet voor alle 3 protonen even gemakkelijk, want je hebt te maken met 3 verschillende zuurconstanten. Het eerste proton bindt al bij een lage zuurconcentratie, het tweede bij een wat hogere concentratie, voor de derde heb je een flinke bak zuur nodig. Wat er precies gebeurt, is dus afhankelijk van de pH van de oplossing.
Het antwoord van het antwoordenmodel laat het hele verhaaltje over zuurconstanten achterwege en kijkt puur naar het aantal deeltjes. Gemiddeld genomen worden er dan 2 protonen per fosfaation gebonden.
[ Bericht 79% gewijzigd door GlowMouse op 13-09-2010 22:01:18 ]
quote:E=0,5 k x² met x de lengte dat je hem indrukt? De maximale lengte dat je het materiaal kan indrukken totdat de vloeispanning wordt bereikt moet je dan even opzoeken.Op woensdag 8 september 2010 21:00 schreef qwox het volgende:
Onderwerp: maximale potentiële elastische energie van staal
Als je een stalen veer hebt en die indrukt voer je in principe potentiële energie toe aan het staal. Als je maar hard genoeg drukt zal uiteindelijk het steel vervormen in het plastische gebied. Je hebt dan het maximale potentiële elastische energie level overschreden.
Ik kreeg bij een bedrijf tijdens een presentatie een formule te zien met daarin E (energie), sigma (maximale spanning), E (E-modulus) en V (volume). Ik heb hem echter niet correct opgeschreven aangezien de eenheid vergelijking al niet klopt.
Mijn vraag is nu of iemand een formule weet om de maximale op te nemen energie te berekenen aan de hand van de materiaaleigenschappen en het volume.
Alvast bedankt, mocht de vraag niet duidelijk genoeg zijn hoor ik het wel.
quote:Als je die formule uitwerkt met spanning en E-modulus kom je totOp dinsdag 14 september 2010 01:30 schreef Quyxz_ het volgende:
[..]
E=0,5 k x² met x de lengte dat je hem indrukt? De maximale lengte dat je het materiaal kan indrukken totdat de vloeispanning wordt bereikt moet je dan even opzoeken.
in de formule die ik had was het kwadraat vergeten, op een of andere manier zag ik dat niet. iig bedankt voor de input.
Burt's utility function is U(x1,x2)=(x1+2)(x2+6), where x1 is the number of cookies and x2 is the number of glasses of milk that he consumes.
What is the slope of Burt's indifference curve at the point where he is consuming the bundle (4,6)?
help
[ Bericht 0% gewijzigd door Knuck-les op 17-09-2010 18:43:29 ]
Edit: Weet het al;
MRS = - MU1 / MU2 = - (x2+6) / (x1 + 2)
met 4 en 6 ingevuld is het dus
-(12/6) = -2. @ punt (4,6)
(x1+2)(x2+6) = 72
x2 = 72/(x1+2) - 6
dx2/dx1 = -72/(x1+2)²; als x1=4 komt er dus -2 uit. De MRS is per definitie gelijk.
quote:Op vrijdag 17 september 2010 18:10 schreef Diabox het volgende:
Is het niet gewoon 4 en 6 invullen? Dus (4+2)(6+6) = (6)(12) = 72?
Edit: Weet het al;
MRS = - MU1 / MU2 = - (x2+6) / (x1 + 2)
met 4 en 6 ingevuld is het dus
-(12/6) = -2. @ punt (4,6)
quote:TopOp vrijdag 17 september 2010 18:17 schreef GlowMouse het volgende:
De indifferentiecurve is de curve waarvoor het nut gelijk aan U(4,6)=72 is.
(x1+2)(x2+6) = 72
x2 = 72/(x1+2) - 6
dx2/dx1 = -72/(x1+2)²; als x1=4 komt er dus -2 uit. De MRS is per definitie gelijk.
Eigenlijk zeer simpel dus. Zat weer eens veel te lastig te denken
[ Bericht 37% gewijzigd door Diabox op 20-09-2010 19:14:19 ]
1. Geef in strucuurformules de substitutiereactie weer tussen 1 mol Cl2 en 1 mol propaan, wanneer er alleen monosubstitutieproducten ontstaan.
2. Geef de naam en de structuurformule van de reactieproducten.
Bij vraag 2 heb je de volgende producten:

Maar waarom staat 1-broom 1-methylbutaan er niet bij? En 2-broom 1 methylbutaan? Ik dacht namelijk dat dat ook isomeren zijn... maar kennelijk niet, waarom niet?
Alvast bedankt.
Ik snap alleen niet waar broom vandaan komt als het in de vraag totaal niet genoemd staat.
quote:O ja, bij 1-broom - 1 methylbutaan is de langste keten idd niet vier maar drie.. stom van mijOp dinsdag 21 september 2010 13:42 schreef GlowMouse het volgende:
Hoelang is de langste koolstofketen in 1-broom 1-methylbutaan?
Ik snap alleen niet waar broom vandaan komt als het in de vraag totaal niet genoemd staat.
Ik heb overigens de per ongeluk verkeerde vraag overgetypt.. het had moeten zijn:
a. Geef in molecuulformules de (mono)substitutiereactie weer tussen broom en methylbutaan en geef de naam en structuurformule van alle monobroomreactieproducten.
quote:En met een keten van vijf koolstofatomen heb je dus geen methylbutaan.Op dinsdag 21 september 2010 13:58 schreef Warren het volgende:
[..]
O ja, bij 1-broom - 1 methylbutaan is de langste keten idd niet vier maardrievijf.. stom van mij
quote:Ok, bedankt. Voor 2-broom 1 methylbutaan geldt dus uiteraard hetzelfde.Op dinsdag 21 september 2010 14:00 schreef GlowMouse het volgende:
[..]
En met een keten van vijf koolstofatomen heb je dus geen methylbutaan.