SES School, Studie en Onderwijs
Wiskunde in de brugklas, Frans voor het examen of een studie Personeel en Arbeid? Moeilijke formulieren van DUO? Iets weten over studiefinanciering of studentenverenigingen? Dit is het forum voor leerkrachten, scholieren en studenten, van brugklas tot uni



Ik snap waar je de bovengrens van y vandaan haalt, maar bereken zo niet juist het gearceerde gebied?quote:Op maandag 5 april 2010 19:34 schreef BasementDweller het volgende:
[..]
[ afbeelding ]
Kan je zelf bedenken waarom?
Het is geel en staat in mijn ondertitel!
3DS friend code: 2191-7623-9035
3DS friend code: 2191-7623-9035


Kijk eens naar de structuur van glucose (in de ringvorm), en bekijk dan welke structuur (bootvorm of stoelvorm) het gunstigste is, en in welke posities de OH groepen het best staan ivm. sterische hindering.quote:Op maandag 5 april 2010 20:08 schreef horned_reaper het volgende:
[..]
Nogmaals even ... nadat m'n vraag is ondergesneeuwd ....


Ok deze zie ik even niet:
Stel je wilt weten hoeveel gram natriumcarbonaat nodig is om al het zilver uit 10 gram zilvernitraat neer te slaan.
Je zou dan deze tabel moeten gebruiken:
De berekening is dan:
10/339,8 x 106,0 g = 3,119 g Na2Co3
Ik snap echter niet waarom de molcuulverhouding bij zilvernitraat en natriumnitraat 2 is. Kan iemand dat toelichten? Alvast bedankt.
Stel je wilt weten hoeveel gram natriumcarbonaat nodig is om al het zilver uit 10 gram zilvernitraat neer te slaan.
Je zou dan deze tabel moeten gebruiken:
De berekening is dan:
10/339,8 x 106,0 g = 3,119 g Na2Co3
Ik snap echter niet waarom de molcuulverhouding bij zilvernitraat en natriumnitraat 2 is. Kan iemand dat toelichten? Alvast bedankt.


Omdat het carbonaat gebonden is met 2 atomen zilver en natrium, me dunkt.
Weet alleen geen reet van scheikunde
Weet alleen geen reet van scheikunde
'To alcohol, the cause of and the solution to all of life's problems' - Homer J. Simpson


Waarom niet?quote:Op maandag 5 april 2010 20:20 schreef Jesse_ het volgende:
[..]
Ik snap waar je de bovengrens van y vandaan haalt, maar bereken zo niet juist het gearceerde gebied?


Voor mijn gevoel bereken je dan een heel ander gebied, maar dat zal komen omdat ik het me niet zo goed kan visualiseren :pquote:
Het is geel en staat in mijn ondertitel!
3DS friend code: 2191-7623-9035
3DS friend code: 2191-7623-9035


y zit altijd tussen 0 en (1-x)/2 in en x tussen 0 en 1. Als je de functie weglaat in de integraal, krijg je dit:quote:Op maandag 5 april 2010 22:17 schreef Jesse_ het volgende:
[..]
Voor mijn gevoel bereken je dan een heel ander gebied, maar dat zal komen omdat ik het me niet zo goed kan visualiseren :p
Dat is dus het oppervlakte van het gebiedje (klopt, want het is een driehoek en basis × hoogte / 2 = 1/4). Maar "boven" dat gebied zit nog een functie. De inhoud tussen het oppervlak en de functie reken je hiermee uit.
Het is vergelijkbaar met het volgende:
Als je de functie weglaat, krijg je:
Dat is precies de afstand waarover je integreert (analoog aan het oppervlakte waarover je integreert van de eerstbesproken integraal). Bij de integraal van xdx integreer je over een lijn en krijg je een oppervlakte, en bij jouw integraal integreer je over een oppervlakte en krijg je een volume. Je doet in principe hetzelfde alleen krijg je er een dimensie bij .
Hoop dat het een beetje duidelijk is
[ Bericht 3% gewijzigd door BasementDweller op 05-04-2010 22:33:43 ]


ah oke, volgens mij begrijp ik het. Heel erg bedankt 
Ik had zelf alleen x van 0 naar 1-2y laten lopen en y van 0 naar 1/2, omdat de integraal dan iets makkelijker wordt.
Je edit maakt het nog duidelijker, bedankt
Ik had zelf alleen x van 0 naar 1-2y laten lopen en y van 0 naar 1/2, omdat de integraal dan iets makkelijker wordt.
Je edit maakt het nog duidelijker, bedankt
Het is geel en staat in mijn ondertitel!
3DS friend code: 2191-7623-9035
3DS friend code: 2191-7623-9035


Ja mijn verhaaltje was nog niet helemaal af eigenlijkquote:Op maandag 5 april 2010 22:33 schreef Jesse_ het volgende:
ah oke, volgens mij begrijp ik het. Heel erg bedankt
Ik had zelf alleen x van 0 naar 1-2y laten lopen en y van 0 naar 1/2, omdat de integraal dan iets makkelijker wordt.
Je edit maakt het nog duidelijker, bedankt
Wat jij doet met die andere grenzen is natuurlijk ook goed
Als je nog vragen hebt over wiskunde, kan je ze beter hier stellen:
[Bèta wiskunde] Huiswerk- en vragentopic


Ik neem aan dat je vraag betrekking heeft op glucose in de lineaire in plaats van de cyclische vorm. In dit geval moet je de Fischerprojectie gebruiken om glucose te tekenen. Je kunt of de absolute configuratie (volgens regels van Cahn-Ingold-Prelog) van de chirale centra onthouden, of simpelweg onthouden in welke richting ze moeten wijzen in de Fischerprojectie.quote:Op maandag 5 april 2010 20:08 schreef horned_reaper het volgende:
Nogmaals even ... nadat m'n vraag is ondergesneeuwd ....


Dankje voor je uitleg!quote:Op dinsdag 6 april 2010 00:03 schreef lyolyrc het volgende:
[..]
Ik neem aan dat je vraag betrekking heeft op glucose in de lineaire in plaats van de cyclische vorm. In dit geval moet je de Fischerprojectie gebruiken om glucose te tekenen. Je kunt of de absolute configuratie (volgens regels van Cahn-Ingold-Prelog) van de chirale centra onthouden, of simpelweg onthouden in welke richting ze moeten wijzen in de Fischerprojectie.
Maar ik zal je even een voorbeeld geven....
In bovenstaande afbeeldingen zijn alle mogelijk isomeren te vinden.....
Stel dat alle onderstaande namen willekeurig in een bak zouden liggen.... en ik zou ze onder de juiste structuur moeten plaatsen.
Zou hier dan enige logische kennis voor nodig zijn? Of is dat puur een kwestie van uit het hoofd leren?


Dat is helaas een kwestie van stampen. Maar ik meen dat de rode OH-groepen aanduiden dat je met de D-enantiomeren te maken hebt, dus verschil tussen L en D is dan wel te maken.quote:Op dinsdag 6 april 2010 00:32 schreef horned_reaper het volgende:
Dankje voor je uitleg!
Maar ik zal je even een voorbeeld geven....
[ afbeelding ]
In bovenstaande afbeeldingen zijn alle mogelijk isomeren te vinden.....
Stel dat alle onderstaande namen willekeurig in een bak zouden liggen.... en ik zou ze onder de juiste structuur moeten plaatsen.
Zou hier dan enige logische kennis voor nodig zijn? Of is dat puur een kwestie van uit het hoofd leren?


D & L is gelukkig nooit een probleemquote:Op dinsdag 6 april 2010 00:46 schreef lyolyrc het volgende:
[..]
Dat is helaas een kwestie van stampen. Maar ik meen dat de rode OH-groepen aanduiden dat je met de D-enantiomeren te maken hebt, dus verschil tussen L en D is dan wel te maken.
Maar dan wordt dit dus even een kwestie van stampen
Bedankt!
lyolyrc: Uw persoonlijke Fok!Chemie Docent!


Bijvoorbeeld N2 + 3 H2 --> 2 NH3, 1 molecuul stikstof, reageert met 3 moleculen waterstof waaruit twee moleculen ammoniak ontstaan. Volgens het boek is de molecuulverhouding dan 1, 3 en 2.quote:Op maandag 5 april 2010 22:08 schreef BasementDweller het volgende:
Molecuulverhouding van wat staat tot wat?
Dus als ik het goed begrijp zijn de molecuulverhoudingingen 2 bij AgNO3 en NaNO3 omdat
Na2CO3 + 2 Ag NO3 --> Ag2CO3 + 2 NaNo3?


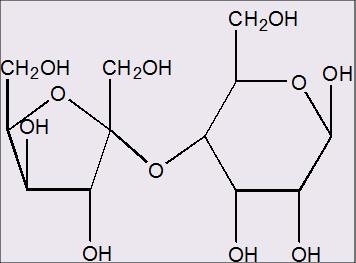
Wanneer ik kijk naar onderstaande afbeelding... is de glycosidische binding in deze disaccharide dan een 1,4 Alpha binding of een 2,4 Alpha binding?


het is in ieder geval een ,4 want de glycosidische binding zit duidelijk aan de 4de koolstof van de 6ring structuur vast.quote:
Maar ik denk dat het een 2,4 Alpha binding is, aangezien de 5 ring structuur van de fructose een ketose is en er nog een eerste koolstof voor de koolstof zit die met de dubbelgebonden O heeft willen hechten!


Je hebt gelijk, het is 2,4. Vergelijk het met saccharose, dat is ook een disaccharide bestaand uit een 5- en 6-ring.


Dit is nog een vraag voor Lyolyrc.... of ieder ander die er verstand van heeft!
Stel dat ik bijvoorbeeld, D-Glucose zou laten binden met D-Lactose.
D-Glucose is een 6 ringstructuur en D-Lactose een 5ring structuur.
Nu doet het er even niet toe of we de alpha of beta versie hebben van glucose... De eerste koolstof van D-Glucose gaat een binding aan met de 4de koolstof van D-Lactose.
Normaal gesproken zou bij een 6ring structuur aan het 4de koolstof een OH en een H groep hebben gezeten, en zou om de binding te vormen de 2 OH groepen van koolstof 1 van het eerste molecuul en koolstof 4 van het tweede molecuul met elkaar reageren tot een O-binding + H2O dat zou worden afgescheiden.
Alleen D-Lactose is een 5ring structuur en heeft aan zijn 4de koolstof een zijketen hangen plus een enkele H.
Dus heeft de OH groep van D-Glucose geen OH groep van D-Lactose om een binding mee te vormen.....
Is het dan misschien zo dat de O-binding wel wordt gevormd maar er geen water wordt uitgescheiden?
Ik weet dat de binding wel mogelijk is..... maar hoe?
Stel dat ik bijvoorbeeld, D-Glucose zou laten binden met D-Lactose.
D-Glucose is een 6 ringstructuur en D-Lactose een 5ring structuur.
Nu doet het er even niet toe of we de alpha of beta versie hebben van glucose... De eerste koolstof van D-Glucose gaat een binding aan met de 4de koolstof van D-Lactose.
Normaal gesproken zou bij een 6ring structuur aan het 4de koolstof een OH en een H groep hebben gezeten, en zou om de binding te vormen de 2 OH groepen van koolstof 1 van het eerste molecuul en koolstof 4 van het tweede molecuul met elkaar reageren tot een O-binding + H2O dat zou worden afgescheiden.
Alleen D-Lactose is een 5ring structuur en heeft aan zijn 4de koolstof een zijketen hangen plus een enkele H.
Dus heeft de OH groep van D-Glucose geen OH groep van D-Lactose om een binding mee te vormen.....
Is het dan misschien zo dat de O-binding wel wordt gevormd maar er geen water wordt uitgescheiden?
Ik weet dat de binding wel mogelijk is..... maar hoe?


Weet je zeker dat je lactose bedoelt? Volgens mij is dat namelijk een disaccharide...quote:Op woensdag 7 april 2010 15:45 schreef horned_reaper het volgende:
Dit is nog een vraag voor Lyolyrc.... of ieder ander die er verstand van heeft!
Stel dat ik bijvoorbeeld, D-Glucose zou laten binden met D-Lactose.
D-Glucose is een 6 ringstructuur en D-Lactose een 5ring structuur.
Nu doet het er even niet toe of we de alpha of beta versie hebben van glucose... De eerste koolstof van D-Glucose gaat een binding aan met de 4de koolstof van D-Lactose.
Normaal gesproken zou bij een 6ring structuur aan het 4de koolstof een OH en een H groep hebben gezeten, en zou om de binding te vormen de 2 OH groepen van koolstof 1 van het eerste molecuul en koolstof 4 van het tweede molecuul met elkaar reageren tot een O-binding + H2O dat zou worden afgescheiden.
Alleen D-Lactose is een 5ring structuur en heeft aan zijn 4de koolstof een zijketen hangen plus een enkele H.
Dus heeft de OH groep van D-Glucose geen OH groep van D-Lactose om een binding mee te vormen.....
Is het dan misschien zo dat de O-binding wel wordt gevormd maar er geen water wordt uitgescheiden?
Ik weet dat de binding wel mogelijk is..... maar hoe?


Ah sorry, dat klopt... ik bedoel natuurlijk D-Fructose!quote:Op woensdag 7 april 2010 16:04 schreef lyolyrc het volgende:
[..]
Weet je zeker dat je lactose bedoelt? Volgens mij is dat namelijk een disaccharide...


Ik zit te twijfelen aan het reactiemechanisme. Energetisch lijkt me afsplitsing van een H+ op die plek van fructose allerminst gunstig. Je krijgt dan namelijk negatieve lading op de koolstof naast een vrij elektronenpaar op de zuurstof. Daarentegen gebeurt de vorming van disacchariden natuurlijk enzymatisch, maar het mechanisme daarvan ken ik niet.quote:Op woensdag 7 april 2010 16:13 schreef horned_reaper het volgende:
Ah sorry, dat klopt... ik bedoel natuurlijk D-Fructose!
Edit: als er niet 2x H en 1x O afsplitst, dan kun je uiteraard geen condensatiereactie hebben, dus geen waterafsplitsing.


Maar wat gebeurt er dan met de 2 overgebleven Htjes? Want wanneer de O binding is gevormd zullen die toch ergens heen moeten... ?quote:Op woensdag 7 april 2010 16:42 schreef lyolyrc het volgende:
[..]
Ik zit te twijfelen aan het reactiemechanisme. Energetisch lijkt me afsplitsing van een H+ op die plek van fructose allerminst gunstig. Je krijgt dan namelijk negatieve lading op de koolstof naast een vrij elektronenpaar op de zuurstof. Daarentegen gebeurt de vorming van disacchariden natuurlijk enzymatisch, maar het mechanisme daarvan ken ik niet.
Edit: als er niet 2x H en 1x O afsplitst, dan kun je uiteraard geen condensatiereactie hebben, dus geen waterafsplitsing.


Ze zouden zich als radicaal kunnen afsplitsen, waardoor er net H2 uitgaat. Ik weet niet of dat enzymatisch mogelijk is. Ook is het misschien mogelijk dat er een zuurstofatoom tussen de C-H-binding wordt gewurmd, waarna zich water afsplitst via de normale procedure. Dit zijn de enige dingen die ik zo kan bedenken.quote:Op woensdag 7 april 2010 16:45 schreef horned_reaper het volgende:
Maar wat gebeurt er dan met de 2 overgebleven Htjes? Want wanneer de O binding is gevormd zullen die toch ergens heen moeten... ?


Kan ik mbv deze formules L te weten komen?
[ Bericht 20% gewijzigd door GoodGawd op 07-04-2010 22:36:49 ]
[ Bericht 20% gewijzigd door GoodGawd op 07-04-2010 22:36:49 ]
Blues ain't nothing but a good man feeling bad...


Z² = R² + X²
X = 2Pi* f * L
cos phi = R / Z
Dit zou je moeten kunnen herschrijven tot je L krijgt.
X = 2Pi* f * L
cos phi = R / Z
Dit zou je moeten kunnen herschrijven tot je L krijgt.
'To alcohol, the cause of and the solution to all of life's problems' - Homer J. Simpson


Ik ben eruit, merciquote:Op woensdag 7 april 2010 22:38 schreef MichielPH het volgende:
Z² = R² + X²
X = 2Pi* f * L
cos phi = R / Z
Dit zou je moeten kunnen herschrijven tot je L krijgt.
Blues ain't nothing but a good man feeling bad...


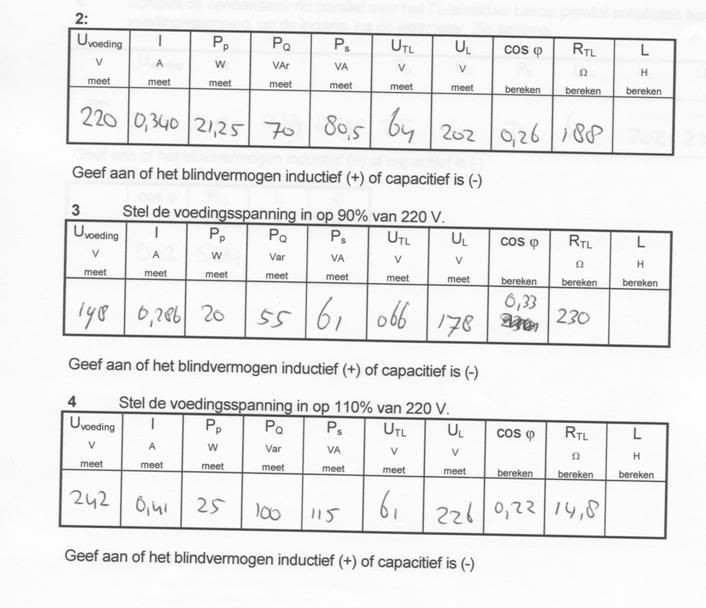
Heeft iemand hier verstand van Elektronica? If yes, mijn vraagje:
Kan je tussen Blind vermogen, werkelijk vermogen en schijnbaar vermogen onderling afleiden of het blind vermogen inductief is?
Kan je tussen Blind vermogen, werkelijk vermogen en schijnbaar vermogen onderling afleiden of het blind vermogen inductief is?
Blues ain't nothing but a good man feeling bad...


De volgende irreversibele gasfase reactie wordt isotherm uitgevoerd in een buisreactor:
A → P + X
De reactie is tweede orde in A. Bereken de benodigde buislengte om 60% conversie te halen.
Gegevens:
k2 = 5.0 dm3/mol.s
CA,0 = 0.2 mol/dm3
v,0 = 1.0 dm3/s
Ac = 1.0 dm2
Nu had ik het volgende bedacht:
molbalans:
- Fa,0 * dX/dV = -k * Ca0^2(1-X)^2 omzetten naar:
dX/(1-X)^2 = k * Ca0^2 / Fa0 * dV differentiaal wegwerken:
X/1-X = k * Ca0^2 * V / Fa0 invullen geeft:
0.6/(1-0.6) = 1.5
1.5 = 5 * 0.2^2 * V / 0.2 en dit geeft aan dat 1.5 = 0.2 * V / 0.2 dus V = 1.5 dm^3
Maar hoe kom ik nou aan de lengte van de buis???
EDIT:
Nog een probleem:
De reversibele vloeistoffase reactie:
A ↔ P
Is eerste orde in zowel A als P. De reactie wordt isotherm uitgevoerd in een batch reactor met een volume van 2 m3. Op het tijdstip t = 0 geldt dat CA,0 = 2000 mol/m3 en CP,0 = 0 mol/m3.
Gegevens:
k1 = 1.4 x 10-3 s-1
k-1 = 0.7 x 10-3 s-1
Evenwichtsconversie = 67%
Bereken het tijdstip waarop de conversie van A 10% afwijkt van de evenwichtsconversie.
-ra = k1 * (Ca - Cp / Kc) vervangen Ca = Ca0*(1-X) en Cp = Ca0*X
molbalans en kinetiek combineren:
-k1 * (Ca0*(1-X) - Ca0 * X / Kc) = dCa0*(1-X) / dt tijd naar links brengen:
-k1*dt = dCa0*(1-X) / (Ca0*(1-X) - Ca0*X / Kc) hoe nu verder?
[ Bericht 34% gewijzigd door karelsmits87 op 09-04-2010 15:45:10 ]
A → P + X
De reactie is tweede orde in A. Bereken de benodigde buislengte om 60% conversie te halen.
Gegevens:
k2 = 5.0 dm3/mol.s
CA,0 = 0.2 mol/dm3
v,0 = 1.0 dm3/s
Ac = 1.0 dm2
Nu had ik het volgende bedacht:
molbalans:
- Fa,0 * dX/dV = -k * Ca0^2(1-X)^2 omzetten naar:
dX/(1-X)^2 = k * Ca0^2 / Fa0 * dV differentiaal wegwerken:
X/1-X = k * Ca0^2 * V / Fa0 invullen geeft:
0.6/(1-0.6) = 1.5
1.5 = 5 * 0.2^2 * V / 0.2 en dit geeft aan dat 1.5 = 0.2 * V / 0.2 dus V = 1.5 dm^3
Maar hoe kom ik nou aan de lengte van de buis???
EDIT:
Nog een probleem:
De reversibele vloeistoffase reactie:
A ↔ P
Is eerste orde in zowel A als P. De reactie wordt isotherm uitgevoerd in een batch reactor met een volume van 2 m3. Op het tijdstip t = 0 geldt dat CA,0 = 2000 mol/m3 en CP,0 = 0 mol/m3.
Gegevens:
k1 = 1.4 x 10-3 s-1
k-1 = 0.7 x 10-3 s-1
Evenwichtsconversie = 67%
Bereken het tijdstip waarop de conversie van A 10% afwijkt van de evenwichtsconversie.
-ra = k1 * (Ca - Cp / Kc) vervangen Ca = Ca0*(1-X) en Cp = Ca0*X
molbalans en kinetiek combineren:
-k1 * (Ca0*(1-X) - Ca0 * X / Kc) = dCa0*(1-X) / dt tijd naar links brengen:
-k1*dt = dCa0*(1-X) / (Ca0*(1-X) - Ca0*X / Kc) hoe nu verder?
[ Bericht 34% gewijzigd door karelsmits87 op 09-04-2010 15:45:10 ]


Even een snelle en hele domme vraag van me.... want ik ben het echt even kwijt.
Wanneer ik een evewichtsreactie heb.. en tijdens het evenwicht zijn de molaire verdelingen als volgt is: 0,02 <--> 0,04 + 0,04
En hier moet ik de K van uitrekenen.
Dan schrijf je de evenwichtsconstante op: K = [0,04] * [0,04] / [0,02] = 0,08
Maar dit klopt niet, want het antwoord zou 4 moeten zijn.....
PS: De reactie verloopt in een volume van 2 liter!
Wanneer ik een evewichtsreactie heb.. en tijdens het evenwicht zijn de molaire verdelingen als volgt is: 0,02 <--> 0,04 + 0,04
En hier moet ik de K van uitrekenen.
Dan schrijf je de evenwichtsconstante op: K = [0,04] * [0,04] / [0,02] = 0,08
Maar dit klopt niet, want het antwoord zou 4 moeten zijn.....
PS: De reactie verloopt in een volume van 2 liter!


Heb je niet meer info? Want hiermee kan ik je niet echt van advies dienen.quote:Op vrijdag 9 april 2010 14:33 schreef horned_reaper het volgende:
Even een snelle en hele domme vraag van me.... want ik ben het echt even kwijt.
Wanneer ik een evewichtsreactie heb.. en tijdens het evenwicht zijn de molaire verdelingen als volgt is: 0,02 <--> 0,04 + 0,04
En hier moet ik de K van uitrekenen.
Dan schrijf je de evenwichtsconstante op: K = [0,04] * [0,04] / [0,02] = 0,08
Maar dit klopt niet, want het antwoord zou 4 moeten zijn.....
PS: De reactie verloopt in een volume van 2 liter!


We beschouwen nu de volgende evenwichtsreactie:
2 HI (g) <--> H2 (g) + I2 (g) met ∆H > 0
In een afgesloten reactievat (volume = 2 liter) wordt op tijdstip t0 0,10 mol HI gebracht. Na instelling van het evenwicht op tew blijkt er 0,04 mol I2 te zijn ontstaan.
b. Bereken de evenwichtsconstante K.
2 HI (g) <--> H2 (g) + I2 (g) met ∆H > 0
In een afgesloten reactievat (volume = 2 liter) wordt op tijdstip t0 0,10 mol HI gebracht. Na instelling van het evenwicht op tew blijkt er 0,04 mol I2 te zijn ontstaan.
b. Bereken de evenwichtsconstante K.


Op t0 heb je 0,10 mol HI, en 0 mol van zowel H2 als I2. Het eerste is gegeven, het andere weet je. Bij evenwichtsinstelling is er 0,04 mol I2 gevormd. Je had zelf al correct beredeneerd dat er dan ook 0,04 mol H2 gevormd moet zijn en dat 0,04 mol I2 en H2 gevormd wordt uit 0,08 mol HI, zodat er bij evenwicht nog maar 0,02 mol HI over is.
Het probleem zit hem in je berekening van het evenwicht, dat moet namelijk zijn: K = [H2]*[I2]/[HI]2. Je vergeet het kwadraat! Uitrekenen van dit evenwicht geeft 0,042/0,022 = 4
Het probleem zit hem in je berekening van het evenwicht, dat moet namelijk zijn: K = [H2]*[I2]/[HI]2. Je vergeet het kwadraat! Uitrekenen van dit evenwicht geeft 0,042/0,022 = 4


Ik zie het nuquote:Op vrijdag 9 april 2010 14:53 schreef lyolyrc het volgende:
Op t0 heb je 0,10 mol HI, en 0 mol van zowel H2 als I2. Het eerste is gegeven, het andere weet je. Bij evenwichtsinstelling is er 0,04 mol I2 gevormd. Je had zelf al correct beredeneerd dat er dan ook 0,04 mol H2 gevormd moet zijn en dat 0,04 mol I2 en H2 gevormd wordt uit 0,08 mol HI, zodat er bij evenwicht nog maar 0,02 mol HI over is.
Het probleem zit hem in je berekening van het evenwicht, dat moet namelijk zijn: K = [H2]*[I2]/[HI]2. Je vergeet het kwadraat! Uitrekenen van dit evenwicht geeft 0,042/0,022 = 4
Dankjewel


Dan nog even een snelle.... het blijkt maar weer dat ik echt een chemicus ben van de biochemie en de koolstofchemie 
Bereken hoeveel gram ijzerfosfaat, Fe3(PO4)2, je moet afwegen om 200 ml ijzerfosfaat-oplossing te maken die 150 mmol Fe2+-ionen per liter bevat.
Nou, de massa van Fe3(PO4)2 = 357,4 g/mol als je die waarden optelt uit het periodiek systeem...
Als er dus 357,4 gram in 1 mol zit... zou dit volgens mij ook moeten betekenen dat je 357,4 gram Fe3(PO)4 moet oplossen in 1 liter water om 1M te krijgen...
Waarna ik zeg, 357,4*0,15 = 53,61 g/150mmol
Maar blijkbaar ga ik hier al helemaal de mist in omdat het uiteindelijk antwoord toch echt 3,57g hoort te zijn....
omdat het uiteindelijk antwoord toch echt 3,57g hoort te zijn....
Bereken hoeveel gram ijzerfosfaat, Fe3(PO4)2, je moet afwegen om 200 ml ijzerfosfaat-oplossing te maken die 150 mmol Fe2+-ionen per liter bevat.
Nou, de massa van Fe3(PO4)2 = 357,4 g/mol als je die waarden optelt uit het periodiek systeem...
Als er dus 357,4 gram in 1 mol zit... zou dit volgens mij ook moeten betekenen dat je 357,4 gram Fe3(PO)4 moet oplossen in 1 liter water om 1M te krijgen...
Waarna ik zeg, 357,4*0,15 = 53,61 g/150mmol
Maar blijkbaar ga ik hier al helemaal de mist in


Ik zou zelf de andere kant op redeneren. Je hebt een 200 ml oplossing nodig met [Fe2+]=150 mM. Dit betekent dat de oplossing 0,150*0,200 = 0,030 mol Fe2+ moet bevatten. Aangezien het oplossen van 1 mol Fe3(PO4)2 leidt tot 3 mol Fe2+, betekent het dat je 30 mmol Fe2+ kunt halen uit 10 mmol Fe3(PO4)2. 10 mmol Fe3(PO4)2 komt overeen met 3,57 g.quote:Op vrijdag 9 april 2010 15:26 schreef horned_reaper het volgende:
Dan nog even een snelle.... het blijkt maar weer dat ik echt een chemicus ben van de biochemie en de koolstofchemie
Bereken hoeveel gram ijzerfosfaat, Fe3(PO4)2, je moet afwegen om 200 ml ijzerfosfaat-oplossing te maken die 150 mmol Fe2+-ionen per liter bevat.
Nou, de massa van Fe3(PO4)2 = 357,4 g/mol als je die waarden optelt uit het periodiek systeem...
Als er dus 357,4 gram in 1 mol zit... zou dit volgens mij ook moeten betekenen dat je 357,4 gram Fe3(PO)4 moet oplossen in 1 liter water om 1M te krijgen...
Waarna ik zeg, 357,4*0,15 = 53,61 g/150mmol
Maar blijkbaar ga ik hier al helemaal de mist inomdat het uiteindelijk antwoord toch echt 3,57g hoort te zijn....


Dankje voor je uitleg, maar ik snap de logica nog steeds niet helemaal....quote:Op vrijdag 9 april 2010 16:41 schreef lyolyrc het volgende:
[..]
Ik zou zelf de andere kant op redeneren. Je hebt een 200 ml oplossing nodig met [Fe2+]=150 mM. Dit betekent dat de oplossing 0,150*0,200 = 0,030 mol Fe2+ moet bevatten. Aangezien het oplossen van 1 mol Fe3(PO4)2 leidt tot 3 mol Fe2+, betekent het dat je 30 mmol Fe2+ kunt halen uit 10 mmol Fe3(PO4)2. 10 mmol Fe3(PO4)2 komt overeen met 3,57 g.
Ik kan je stap, "Dit betekent dat de oplossing 0,150*0,200 = 0,030 mol Fe2+ moet bevatten", nog niet helemaal volgen.... waarom doe je 0,150mol * 0,200L ? ... ik zie niet in waarom ik die stap zou nemen wanneer ik de vraag volgende week in een andere context zou krijgen....


Er is een gewenst volume gegeven (200 ml) en een gewenste concentratie van 150 mmol Fe2+/l = 150 mM. Als je het volume vermenigvuldigt met de concentratie, krijg je aantal mol Fe2+ dat de oplossing moet bevatten. Samengevat: liter*mol/liter = mol.quote:Op vrijdag 9 april 2010 16:54 schreef horned_reaper het volgende:
Dankje voor je uitleg, maar ik snap de logica nog steeds niet helemaal....
Ik kan je stap, "Dit betekent dat de oplossing 0,150*0,200 = 0,030 mol Fe2+ moet bevatten", nog niet helemaal volgen.... waarom doe je 0,150mol * 0,200L ? ... ik zie niet in waarom ik die stap zou nemen wanneer ik de vraag volgende week in een andere context zou krijgen....
Vanuit het aantal mol dat die vermenigvuldiging oplevert, bereken ik eerst hoeveel mol ijzersulfaat je nodig hebt en dan hoeveel gram dat is.


Ah, dus wanneer ik heb berekend hoeveel mol er in totaal in de oplossing moet, 0,150*0,200 = 0,030... is dat uitgedrukt in Fe2+ maar aangezien ik met een stof te maken heeft die Fe3 bevat, moet die 0,030 gedeeld door 3.... dat wordt 0,010 en wanneer ik mijn 357* 0,010 doe is dat = 3,57g ?quote:Op vrijdag 9 april 2010 17:00 schreef lyolyrc het volgende:
[..]
Er is een gewenst volume gegeven (200 ml) en een gewenste concentratie van 150 mmol Fe2+/l = 150 mM. Als je het volume vermenigvuldigt met de concentratie, krijg je aantal mol Fe2+ dat de oplossing moet bevatten. Samengevat: liter*mol/liter = mol.
Vanuit het aantal mol dat die vermenigvuldiging oplevert, bereken ik eerst hoeveel mol ijzersulfaat je nodig hebt en dan hoeveel gram dat is.


Je hebt hem door!quote:Op vrijdag 9 april 2010 17:15 schreef horned_reaper het volgende:
Ah, dus wanneer ik heb berekend hoeveel mol er in totaal in de oplossing moet, 0,150*0,200 = 0,030... is dat uitgedrukt in Fe2+ maar aangezien ik met een stof te maken heeft die Fe3 bevat, moet die 0,030 gedeeld door 3.... dat wordt 0,010 en wanneer ik mijn 357* 0,010 doe is dat = 3,57g ?
Aangezien de concentratie 150 mmol Fe2+ per liter is, zal 200 ml van die oplossing maar een vijfde van 150 mmol = 30 mmol bevatten. Dan maak je de stap naar het zout: 3 ionen Fe2+ haal je uit 1 zoutmolecuul Fe3(PO4)2. Vandaar dat je de 30 mmol door 3 moet delen. De laatste stap spreekt voor zich: je gaat van mol naar gram door te vermenigvuldigen met de molmassa.
Sowieso moet je zulk soort sommetjes altijd in deze volgorde oplossen. De manier waarop je begonnen was, werkt wel, maar is omslachtig.


Helemaal tegek lyolyrc ! 
Als ik dan nog één aller laatste vraag aan je zou mogen stellen, zal ik je niet meer lastig vallen
De vraag gaat als volgt: "We maken 2 liter acetaatbuffer met pH 5,0 en een sterkte van 0,1 M (dus [CH3COOH] + [CH3COO-] = 0,1 M) door de juiste hoeveelheid vast natriumacetaat (CH3COONa) en het juiste volume azijnzuur op te nemen in 2 liter water. Hoeveel gram natriumacetaat weeg je af en hoeveel ml azijnzuur (werkoplossing in de zuurkast is 4 M) heb je nodig?"
Waarschijnlijk zal ik eerste de fracties ten opzichte van elkaar moeten uitrekenen... en als ik dat weet kan ik aan de hand daarvan vrij makkelijk het aantal gram van beide stoffen uitrekenen.
Maar hoe bereken ik die fracties?
Als ik dan nog één aller laatste vraag aan je zou mogen stellen, zal ik je niet meer lastig vallen
De vraag gaat als volgt: "We maken 2 liter acetaatbuffer met pH 5,0 en een sterkte van 0,1 M (dus [CH3COOH] + [CH3COO-] = 0,1 M) door de juiste hoeveelheid vast natriumacetaat (CH3COONa) en het juiste volume azijnzuur op te nemen in 2 liter water. Hoeveel gram natriumacetaat weeg je af en hoeveel ml azijnzuur (werkoplossing in de zuurkast is 4 M) heb je nodig?"
Waarschijnlijk zal ik eerste de fracties ten opzichte van elkaar moeten uitrekenen... en als ik dat weet kan ik aan de hand daarvan vrij makkelijk het aantal gram van beide stoffen uitrekenen.
Maar hoe bereken ik die fracties?


Als je niet erg vindt, ga ik eerst even eten. Misschien dat een eerder antwoord over buffers je al een beetje op weg kan helpen.


We beginnen met de evenwichtsvergelijking (Ac- = CH3COO-): Ka = [H+]*[Ac-]/[HAc]
Hieruit volgt: Ka/[H+] = [Ac-]/[HAc]
substitueer: Ka = 10^-4.75 en [H+] = 10^-5.0
dat geeft [Ac-]/[HAc] = 10^0.25 = 1.78
daaruit leid je af dat: [Ac-] = 1.78*[HAc]
gegeven is dat: [Ac-]+[HAc] = 1.0 M
substitueer daarin [Ac-] = 1.78*[HAc], dat geeft: 2.78*[HAc] = 1.0 M
dan is [HAc] = 1.0/2.78 = 0.36 M
en [Ac-] = 1.0 M - [HAc] = 0.64 M
Gebruik deze concentraties om uit te rekenen hoeveel van de werkoplossing je nodig hebt en hoeveel gram natriumacetaat.
Hieruit volgt: Ka/[H+] = [Ac-]/[HAc]
substitueer: Ka = 10^-4.75 en [H+] = 10^-5.0
dat geeft [Ac-]/[HAc] = 10^0.25 = 1.78
daaruit leid je af dat: [Ac-] = 1.78*[HAc]
gegeven is dat: [Ac-]+[HAc] = 1.0 M
substitueer daarin [Ac-] = 1.78*[HAc], dat geeft: 2.78*[HAc] = 1.0 M
dan is [HAc] = 1.0/2.78 = 0.36 M
en [Ac-] = 1.0 M - [HAc] = 0.64 M
Gebruik deze concentraties om uit te rekenen hoeveel van de werkoplossing je nodig hebt en hoeveel gram natriumacetaat.


Hoe kom je in het begin aan de 4,75 ?quote:Op vrijdag 9 april 2010 20:00 schreef lyolyrc het volgende:
We beginnen met de evenwichtsvergelijking (Ac- = CH3COO-): Ka = [H+]*[Ac-]/[HAc]
Hieruit volgt: Ka/[H+] = [Ac-]/[HAc]
substitueer: Ka = 10^-4.75 en [H+] = 10^-5.0
dat geeft [Ac-]/[HAc] = 10^0.25 = 1.78
daaruit leid je af dat: [Ac-] = 1.78*[HAc]
gegeven is dat: [Ac-]+[HAc] = 1.0 M
substitueer daarin [Ac-] = 1.78*[HAc], dat geeft: 2.78*[HAc] = 1.0 M
dan is [HAc] = 1.0/2.78 = 0.36 M
en [Ac-] = 1.0 M - [HAc] = 0.64 M
Gebruik deze concentraties om uit te rekenen hoeveel van de werkoplossing je nodig hebt en hoeveel gram natriumacetaat.


Dat is de pKa van azijnzuur.quote:Op vrijdag 9 april 2010 20:04 schreef horned_reaper het volgende:
Hoe kom je in het begin aan de 4,75 ?
[ Bericht 0% gewijzigd door lyolyrc op 09-04-2010 20:10:31 (pKa uiteraard) ]


Kijk, daar liep ik dus vastquote:
Maar hoe zou ik zo uit m'n hoofd moeten weten wat een pKa van een willekeurige stof is ?


Lijkt me dat die op een tentamen gegeven wordt. Ik heb hem nu van wikipedia geplukt, maar het staat ook in Binas of meer professionele naslagwerken. Wellicht zelfs ergens in een scheikundeboek dat je hebt, aan de binnenkant van de kaft bijvoorbeeld.quote:Op vrijdag 9 april 2010 20:13 schreef horned_reaper het volgende:
Kijk, daar liep ik dus vastwant de rest lukt me wel....
Maar hoe zou ik zo uit m'n hoofd moeten weten wat een pKa van een willekeurige stof is ?


We mogen geen binas of naslagwerk gebruiken, en er is echt helemaal nergens een pKa gegeven, dus daarom vindt ik het nogal vreemd....quote:Op vrijdag 9 april 2010 20:17 schreef lyolyrc het volgende:
[..]
Lijkt me dat die op een tentamen gegeven wordt. Ik heb hem nu van wikipedia geplukt, maar het staat ook in Binas of meer professionele naslagwerken. Wellicht zelfs ergens in een scheikundeboek dat je hebt, aan de binnenkant van de kaft bijvoorbeeld.
Het enige dat van tevoren gegeven is is dat acetaatbuffer (Ka azijnzuur = 1,8.10-5) en fosfaatbuffer (Ka H2PO4- = 6,2.10-8)... had ik het daar uit kunnen halen dan ?