SES School, Studie en Onderwijs
Wiskunde in de brugklas, Frans voor het examen of een studie Personeel en Arbeid? Moeilijke formulieren van DUO? Iets weten over studiefinanciering of studentenverenigingen? Dit is het forum voor leerkrachten, scholieren en studenten, van brugklas tot uni



Vorige deel: [Bèta overig] 'Huiswerk- en vragentopic'.
Post hier weer al je vragen, passies, trauma's en andere dingen die je uit je slaap houden met betrekking tot de vakken:
Natuurkunde
Informatica
Scheikunde
Biologie
Algemene Natuurwetenschappen
... en alles wat verder in de richting komt.
Van MBO tot WO, hier is het topic waar je een antwoord kunt krijgen op je vragen.
Opmaak: http://betahw.mine.nu/index.php: site van GlowMouse om formules te kunnen gebruiken in je posts (op basis van Latexcode wordt een plaatje gegenereerd dat je vervolgens via het aangegeven linkje kunt opnemen).
Post hier weer al je vragen, passies, trauma's en andere dingen die je uit je slaap houden met betrekking tot de vakken:
Van MBO tot WO, hier is het topic waar je een antwoord kunt krijgen op je vragen.
Opmaak: http://betahw.mine.nu/index.php: site van GlowMouse om formules te kunnen gebruiken in je posts (op basis van Latexcode wordt een plaatje gegenereerd dat je vervolgens via het aangegeven linkje kunt opnemen).


Echt niemand ?quote:Op dinsdag 16 maart 2010 13:00 schreef horned_reaper het volgende:
Even en snelle vraag...
Hoe kan ik zien dat een Alpha-Helix rechtsdraaiend is en een collageen triple helix linksdraaiend.....
En dan ze dan samengevoegd weer rechtsdraaiend zijn?
Alvast bedankt


Mijne ook niet..
'To alcohol, the cause of and the solution to all of life's problems' - Homer J. Simpson


Hallo, weet iemand misschien in welke binastabel de formules staan voor opp inhoud omtrek en alles met cirkels, cilinders en bollen. in mijn boek staat tabel 94, maar dit klopt niet en ik kan het maar niet vinden. alvast bedankt 


De eerste bruine, 36, daar in de buurt. Of anders de laatste blauwe, één tabel eerder.
"Hell is other people." - Jean-Paul Sartre
"A first sign of the beginning of understanding is the wish to die." - Franz Kafka
"Never memorize what you can look up in books." - Albert Einstein
"A first sign of the beginning of understanding is the wish to die." - Franz Kafka
"Never memorize what you can look up in books." - Albert Einstein


Morgen een tentamen over duurzame energie. Dit is het eerste gedeelte dat een inleiding in de QM geeft om zo zonnecellen te kunnen begrijpen. Nu ben ik een oud tentamen van vorig jaar aan het bekijken en ik vroeg me iets af over vraag 4a.
Als ik Schrodinger oplos dan weet ik dat Psi een functie van A*sin(kx) + B*cos(kx) is.Maar hoe verder?
Ik zie in een iets ander voorbeeld dat ze Psi(0) en Psi(L) in gaan vullen en op Psi(L)=0=Asin(kL) uitkomen.
Kan iemand uitleggen waarom we bij 0 en L gaan kijken? Omdat dat de grenzen zijn waar het deeltje zich bevindt?
Als ik Schrodinger oplos dan weet ik dat Psi een functie van A*sin(kx) + B*cos(kx) is.Maar hoe verder?
Ik zie in een iets ander voorbeeld dat ze Psi(0) en Psi(L) in gaan vullen en op Psi(L)=0=Asin(kL) uitkomen.
Kan iemand uitleggen waarom we bij 0 en L gaan kijken? Omdat dat de grenzen zijn waar het deeltje zich bevindt?


Morgen heb ik een tentamen natuurkunde, daarvoor ben ik wat oude examens aan het oefenen, nu stuitte ik op het volgende examen: http://havovwo.nl/vwo/vna/bestanden/vna1209iiopg5.pdf
Bij vraag 23 wordt gevraagd hoe de elektronen gaan lopen, volgens mij gebeurt dit altijd van - naar + en stroom van + naar -, nu ga ik kijken naar het antwoord van dit examen, maar die beweert feitelijk het tegengestelde namelijk:
Door influentie (condensator werking) wordt het alluminium folie negatief: er lopen elektroenen van de aarde naar het folie, de stroom gaat in de andere richting, van het folie naar de aarde.
Link antwoorden: http://havovwo.nl/vwo/vna/bestanden/vna1209iiopl5.pdf
Weet iemand hoe dit werkt?
Bij vraag 23 wordt gevraagd hoe de elektronen gaan lopen, volgens mij gebeurt dit altijd van - naar + en stroom van + naar -, nu ga ik kijken naar het antwoord van dit examen, maar die beweert feitelijk het tegengestelde namelijk:
Door influentie (condensator werking) wordt het alluminium folie negatief: er lopen elektroenen van de aarde naar het folie, de stroom gaat in de andere richting, van het folie naar de aarde.
Link antwoorden: http://havovwo.nl/vwo/vna/bestanden/vna1209iiopl5.pdf
Weet iemand hoe dit werkt?


Een vraag over electronica:
Ik moet de L = µ.N2.A / l [H] Henry
te weten komen. Maar ik heb niet de gegevens van de formule, wel heb ik:
U voeding
I
Pp
Pq
Ps
UTL
UL
cos phi
RTL
Hoe kan ik L te weten komen?
[ Bericht 1% gewijzigd door GoodGawd op 28-03-2010 14:36:09 ]
Ik moet de L = µ.N2.A / l [H] Henry
te weten komen. Maar ik heb niet de gegevens van de formule, wel heb ik:
U voeding
I
Pp
Pq
Ps
UTL
UL
cos phi
RTL
Hoe kan ik L te weten komen?
[ Bericht 1% gewijzigd door GoodGawd op 28-03-2010 14:36:09 ]
Blues ain't nothing but a good man feeling bad...


Nee, ze beweren hetzelfde. Aan de buitenkant worden negatieve elektronen aangetrokken door de positieve elektronen aan de binnenkant. Die elektronen komen van de aarde.quote:Op woensdag 24 maart 2010 18:23 schreef Superlam het volgende:
Morgen heb ik een tentamen natuurkunde, daarvoor ben ik wat oude examens aan het oefenen, nu stuitte ik op het volgende examen: http://havovwo.nl/vwo/vna/bestanden/vna1209iiopg5.pdf
Bij vraag 23 wordt gevraagd hoe de elektronen gaan lopen, volgens mij gebeurt dit altijd van - naar + en stroom van + naar -, nu ga ik kijken naar het antwoord van dit examen, maar die beweert feitelijk het tegengestelde namelijk:
Door influentie (condensator werking) wordt het alluminium folie negatief: er lopen elektroenen van de aarde naar het folie, de stroom gaat in de andere richting, van het folie naar de aarde.
Link antwoorden: http://havovwo.nl/vwo/vna/bestanden/vna1209iiopl5.pdf
Weet iemand hoe dit werkt?
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


Wie zou mij hier zo snel een antwoord op kunnen geven?
Ik kan het echt niet vinden...
Verklaar waarom proline niet voorkomt in een -helix en wel in een collageen triple helix.
Ik kan het echt niet vinden...
Verklaar waarom proline niet voorkomt in een -helix en wel in een collageen triple helix.


Hallo mensen,
ik morgene en SE over radioactiviteit.
Ik snap iets kleins niet, namelijk als er een verval reactie plaatstvindt, hoe ik dan de vrij gekomen of verdwenen energie moet berekenen.
De volgende reactie:
39-19K + 1-0n > 39-18Ar + 1-1p
Ik heb de massa van het 39 isotoop van Kalium genomen en die + de massa van een neutron ..?
en aan de andere kant de massa van een 39 Ar isotoop en die bij een proton opgeteld.
Maar antwoord is:
m(K-atoom) - 19xm(elektron) + m(neutron) > m(Ar-atoom) - 18xm(elektron) + m(H-atoom) - 1x m(elektron)
Ik snap dat je er de elektronen van af moet halen, maar ik snap die H-atoom en de massa van die elektron achter de pijl niet.
En waar is de massa van de proton gebleven?
Alvast bedankt.
ik morgene en SE over radioactiviteit.
Ik snap iets kleins niet, namelijk als er een verval reactie plaatstvindt, hoe ik dan de vrij gekomen of verdwenen energie moet berekenen.
De volgende reactie:
39-19K + 1-0n > 39-18Ar + 1-1p
Ik heb de massa van het 39 isotoop van Kalium genomen en die + de massa van een neutron ..?
en aan de andere kant de massa van een 39 Ar isotoop en die bij een proton opgeteld.
Maar antwoord is:
m(K-atoom) - 19xm(elektron) + m(neutron) > m(Ar-atoom) - 18xm(elektron) + m(H-atoom) - 1x m(elektron)
Ik snap dat je er de elektronen van af moet halen, maar ik snap die H-atoom en de massa van die elektron achter de pijl niet.
En waar is de massa van de proton gebleven?
Alvast bedankt.


Oke, deze vraag is een stuk minder slim dan de bovenstaanden, maar ik kom er echt niet uit:
De vraag is; "Je hebt 1 liter vruchtensap met een sterkte van 20%. Dit is te sterk en je verdunt het met 1 dl water. Wat is nu de sterkte van de vruchtensap in %?"
Het antwoord is 18,18% maar ik snap niet waarom iemand uitleg?
iemand uitleg?
De vraag is; "Je hebt 1 liter vruchtensap met een sterkte van 20%. Dit is te sterk en je verdunt het met 1 dl water. Wat is nu de sterkte van de vruchtensap in %?"
Het antwoord is 18,18% maar ik snap niet waarom


Het totaal is 1 liter, onverdund zou het dus 20% * 1 L = 0,2 L zijn.
Je gooit er 1 dl bij, oftewel 0,1 L.
Sterkte = onverdund / totaal * 100%
0,2 / 1,1 *100% = 18,18%
Je gooit er 1 dl bij, oftewel 0,1 L.
Sterkte = onverdund / totaal * 100%
0,2 / 1,1 *100% = 18,18%
'To alcohol, the cause of and the solution to all of life's problems' - Homer J. Simpson


Bedankt!quote:Op zondag 28 maart 2010 20:17 schreef MichielPH het volgende:
Het totaal is 1 liter, onverdund zou het dus 20% * 1 L = 0,2 L zijn.
Je gooit er 1 dl bij, oftewel 0,1 L.
Sterkte = onverdund / totaal * 100%
0,2 / 1,1 *100% = 18,18%


Hoe kan je hier aan zien dat de molecuulformule C10H20O is?
Alvast bedankt.
Edit: laat maar, ik zie het al
[ Bericht 26% gewijzigd door Warren op 29-03-2010 20:35:50 ]


Laplace
f(t) = 2t3 . e4t
Dan moet je rekenregel gebruiken: f(t)e-at
En je kan niet dus:
tn
en
eat
nemen?
f(t) = 2t3 . e4t
Dan moet je rekenregel gebruiken: f(t)e-at
En je kan niet dus:
tn
en
eat
nemen?
Blues ain't nothing but a good man feeling bad...


Ik moet voor techniek een werkstukkie maken maar ik moet een voorbeeld geven in wat voor constructies driehoeken worden gebruikt.
Voor een cirkel is dit: Fietswiel
Voor een boog is dit: Viaducht
Maar wat is het voor een driehoek?
Voor een cirkel is dit: Fietswiel
Voor een boog is dit: Viaducht
Maar wat is het voor een driehoek?
-edit- Sig niet toegestaan, niet terugplaatsen-


Eehm.... de driehoek structuren als in ... de spaken van je fietswiel misschien en de driehoekstructuren onder een brug misschienquote:Op dinsdag 30 maart 2010 19:47 schreef caspergf1 het volgende:
Ik moet voor techniek een werkstukkie maken maar ik moet een voorbeeld geven in wat voor constructies driehoeken worden gebruikt.
Voor een cirkel is dit: Fietswiel
Voor een boog is dit: Viaducht
Maar wat is het voor een driehoek?


De eiffeltoren?quote:Op dinsdag 30 maart 2010 19:47 schreef caspergf1 het volgende:
Ik moet voor techniek een werkstukkie maken maar ik moet een voorbeeld geven in wat voor constructies driehoeken worden gebruikt.
Voor een cirkel is dit: Fietswiel
Voor een boog is dit: Viaducht
Maar wat is het voor een driehoek?
'To alcohol, the cause of and the solution to all of life's problems' - Homer J. Simpson


Dat en ...quote:Op dinsdag 30 maart 2010 19:56 schreef horned_reaper het volgende:
Eehm.... de driehoek structuren als in ... de spaken van je fietswiel misschien en de driehoekstructuren onder een brug misschien
dat dus. Dit noemt vakwerkconstructies.quote:


Ik zie met het blote oog zo wat de stroomsterktes worden. Maar hoe laat je dat zien met een berekening?
Blues ain't nothing but a good man feeling bad...


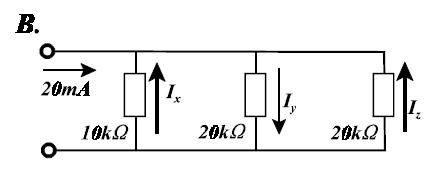
Bereken eerst de vervangweerstand van de drie parallel geschakelde weerstanden. Die bedraagt 5 kΩ. Dan weet je ook de spanning tussen de klemmen en aangezien die spanning over elk van de drie weerstanden staat kun je dan de stroomsterkte door elke weerstand afzonderlijk berekenen. Je pijltjes bij Ix en Iz staan overigens in de verkeerde richting.quote:Op zondag 4 april 2010 17:16 schreef GoodGawd het volgende:
[ afbeelding ]
Ik zie met het blote oog zo wat de stroomsterktes worden. Maar hoe laat je dat zien met een berekening?


Als het zijn eigen tekening is, staan ze verkeerd; als het direct uit de opdracht komt, moet je dus opletten dat de 2 stromen negatief gedefinieert zijn.quote:Op zondag 4 april 2010 18:27 schreef Riparius het volgende:
Je pijltjes bij Ix en Iz staan overigens in de verkeerde richting.
'To alcohol, the cause of and the solution to all of life's problems' - Homer J. Simpson


Dat dus.quote:Op zondag 4 april 2010 18:37 schreef MichielPH het volgende:
[..]
Als het zijn eigen tekening is, staan ze verkeerd; als het direct uit de opdracht komt, moet je dus opletten dat de 2 stromen negatief gedefinieert zijn.
Merci, ja logisch.
Blues ain't nothing but a good man feeling bad...


In werkelijkheid kunnen de stromen door drie parallel geschakelde weerstanden waarover een spanningsbron is aangesloten nooit in verschillende richtingen vloeien.quote:Op zondag 4 april 2010 18:37 schreef MichielPH het volgende:
[..]
Als het zijn eigen tekening is, staan ze verkeerd; als het direct uit de opdracht komt, moet je dus opletten dat de 2 stromen negatief gedefinieerd zijn.


Ik gebruik dan ook niet voor niets 'gedefinieerd'.quote:Op zondag 4 april 2010 21:25 schreef Riparius het volgende:
[..]
In werkelijkheid kunnen de stromen door drie parallel geschakelde weerstanden waarover een spanningsbron is aangesloten nooit in verschillende richtingen vloeien.
En wat een simplistische spelfout van mezelf..
'To alcohol, the cause of and the solution to all of life's problems' - Homer J. Simpson


Nog 1tje:
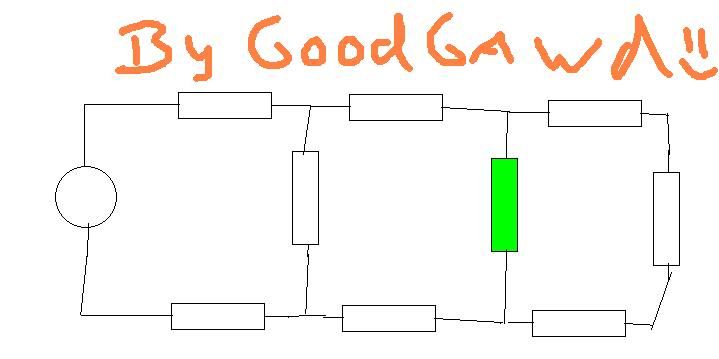
Ik vroeg me af met die schakelingen, hoe je bijvoorbeeld de stroomsterkte in de groene weerstand zou moeten berekenen als spanning en weerstanden gegeven zijn.
Maar de hoofdvraag is, hoe je dit benaderd. Normaal bereken ik de vervangings weerstand Rv. Maar hier zie ik het even niet. (al is dat wel simpel )
)
De eerste R zie je als serie, maar dan komt die splitsing en dan raak ik in de war. Moet je die laatste twee blokken nou als parallel zien? en die eerste en laaste R als serie?
Ik vroeg me af met die schakelingen, hoe je bijvoorbeeld de stroomsterkte in de groene weerstand zou moeten berekenen als spanning en weerstanden gegeven zijn.
Maar de hoofdvraag is, hoe je dit benaderd. Normaal bereken ik de vervangings weerstand Rv. Maar hier zie ik het even niet. (al is dat wel simpel
De eerste R zie je als serie, maar dan komt die splitsing en dan raak ik in de war. Moet je die laatste twee blokken nou als parallel zien? en die eerste en laaste R als serie?
Blues ain't nothing but a good man feeling bad...


Je moet eens kijken naar de wetten van Kirchhoff.
Het kan wat omslachtiger met vervangingsweerstanden:
Werk van rechts naar links. De 3 weerstanden in serie kan je optellen tot 1 weerstand. Deze vervangingsweerstand staat parallel met de verticale weerstand. De vervangingsweerstand van deze 2 parallel staat weer in serie met de 2 horizontale weerstanden.
Dit herhaal je tot je de spanningsbron, 2 weerstanden en een vervangingsweerstand van 7 weerstanden hebt. Hierna heb je de spanning over de vervaningsweerstand, en kan je weer terugrekenen naar de groene.
Duidelijk of te vaag uitgelegd nog?
Het kan wat omslachtiger met vervangingsweerstanden:
Werk van rechts naar links. De 3 weerstanden in serie kan je optellen tot 1 weerstand. Deze vervangingsweerstand staat parallel met de verticale weerstand. De vervangingsweerstand van deze 2 parallel staat weer in serie met de 2 horizontale weerstanden.
Dit herhaal je tot je de spanningsbron, 2 weerstanden en een vervangingsweerstand van 7 weerstanden hebt. Hierna heb je de spanning over de vervaningsweerstand, en kan je weer terugrekenen naar de groene.
Duidelijk of te vaag uitgelegd nog?
'To alcohol, the cause of and the solution to all of life's problems' - Homer J. Simpson


Ja duidelijk, dus dan heb je de Rv over die 7. Dan deel je de U door de R van de groene weerstand en dan heb je het antwoord denk ik.
Blues ain't nothing but a good man feeling bad...


Nee.
Houd in gedachten dat je de schakeling ook zo kan zien:
De spanning over de vervanginsweerstand van de 7 is ongelijk aan de spanning over de groene weerstand.
Rv1 = R6 + R7 + R8
Rv2 = RGroen * Rv1 / ( RGroen + Rv1 )
Rv3 = R4 + Rv2 + R5
Rv4 = R2 * Rv3 / ( R2 + Rv3 )
Spanning over Rv4:
I1 = UBron / ( R1 + Rv4 + R2 )
Uv4 = R * I = Rv4 * UBron / ( R1 + Rv4 + R2 )
Uv4 = U2 = Uv3
Uv2 = UGroen = Uv1
I2 = Uv4 / Rv3
UGroen = R * I = Rv3 * UBron / ( R4 + Rv2 + R5 )
IGroen = UGroen / RGroen
Edit: wacht, nadat ik dit hele kutverhaal getypt heb, lijkt het dat je het wel bergepen had. Shit
[ Bericht 29% gewijzigd door MichielPH op 05-04-2010 16:31:01 ]
Houd in gedachten dat je de schakeling ook zo kan zien:
De spanning over de vervanginsweerstand van de 7 is ongelijk aan de spanning over de groene weerstand.
Rv1 = R6 + R7 + R8
Rv2 = RGroen * Rv1 / ( RGroen + Rv1 )
Rv3 = R4 + Rv2 + R5
Rv4 = R2 * Rv3 / ( R2 + Rv3 )
Spanning over Rv4:
I1 = UBron / ( R1 + Rv4 + R2 )
Uv4 = R * I = Rv4 * UBron / ( R1 + Rv4 + R2 )
Uv4 = U2 = Uv3
Uv2 = UGroen = Uv1
I2 = Uv4 / Rv3
UGroen = R * I = Rv3 * UBron / ( R4 + Rv2 + R5 )
IGroen = UGroen / RGroen
Edit: wacht, nadat ik dit hele kutverhaal getypt heb, lijkt het dat je het wel bergepen had. Shit
[ Bericht 29% gewijzigd door MichielPH op 05-04-2010 16:31:01 ]
'To alcohol, the cause of and the solution to all of life's problems' - Homer J. Simpson


Wanneer je K kleiner is dan 1 wil dat zeggen dat het evenwicht van je reactie naar links loopt.quote:Op maandag 5 april 2010 15:38 schreef vault_tec het volgende:
Ik heb met scheikunde een evenwichtsconstante van 0.1258. Wat wil dit getal nou zeggen?
Wanneer de K groter is dan 1 is dit logischerwijs andersom.


Als ik zo vrij mag zijn, zou ik graag zelf ook nog een vraag willen stellen m.b.t. chemie!
Wanneer we kijken naar het molecuul D-Glucose, is te zien dat bij het 3de koolstof atoom (het 2de chirale C-atoom) de OH groep aan de linker kant staat en bij de rest van de chirale koolstof atomen staan deze OH groepen rechts van de C.
Ik ben ervan op de hoogte dat dit te maken heeft met de ruimtelijke indeling van het molecuul.... maar hoe kan ik zelf bepalen of bij een bepaald molecuul bij het 2de... het 3de of misschien wel het 4de chirale koolstofatoom de OH groep links ofwel rechs moet?
[ Bericht 11% gewijzigd door horned_reaper op 05-04-2010 20:08:14 ]
Wanneer we kijken naar het molecuul D-Glucose, is te zien dat bij het 3de koolstof atoom (het 2de chirale C-atoom) de OH groep aan de linker kant staat en bij de rest van de chirale koolstof atomen staan deze OH groepen rechts van de C.
Ik ben ervan op de hoogte dat dit te maken heeft met de ruimtelijke indeling van het molecuul.... maar hoe kan ik zelf bepalen of bij een bepaald molecuul bij het 2de... het 3de of misschien wel het 4de chirale koolstofatoom de OH groep links ofwel rechs moet?
[ Bericht 11% gewijzigd door horned_reaper op 05-04-2010 20:08:14 ]


ja
deels
Ik wijzigde het te laat. Ik weet niet hoe je het goed in woorden moet zeggen. Maar je hebt er vier dus. En je maakt groepje van 2 in serie en dat groepje zet je parallel
deels
Ik wijzigde het te laat. Ik weet niet hoe je het goed in woorden moet zeggen. Maar je hebt er vier dus. En je maakt groepje van 2 in serie en dat groepje zet je parallel
Blues ain't nothing but a good man feeling bad...


- 2 in serie
deze totale meut parallel.
- 2 in serie
deze totale meut parallel.
- 2 in serie
Blues ain't nothing but a good man feeling bad...


Even een vraagje:
Welke integraal moet ik hier voor opstellen? En vooral waarom.
Het uitrekenen ervan is niet nodig, dat zou ik zelf moeten kunnen
Alvast bedankt
Welke integraal moet ik hier voor opstellen? En vooral waarom.
Het uitrekenen ervan is niet nodig, dat zou ik zelf moeten kunnen
Alvast bedankt
Het is geel en staat in mijn ondertitel!
3DS friend code: 2191-7623-9035
3DS friend code: 2191-7623-9035


Mij is geleerd dat je accu's niet parallel mag schakelen, omdat er door kleine spanningsverschillen onbedoelde stromen rond gaan lopen.
'To alcohol, the cause of and the solution to all of life's problems' - Homer J. Simpson


Oh? Nou in dat geval kan het niet, misschien is het een strik vraag.quote:Op maandag 5 april 2010 19:27 schreef MichielPH het volgende:
Mij is geleerd dat je accu's niet parallel mag schakelen, omdat er door kleine spanningsverschillen onbedoelde stromen rond gaan lopen.
Blues ain't nothing but a good man feeling bad...


er is een wiskundetopic.quote:Op maandag 5 april 2010 19:21 schreef Jesse_ het volgende:
Even een vraagje:
[ afbeelding ]
Welke integraal moet ik hier voor opstellen? En vooral waarom.
Het uitrekenen ervan is niet nodig, dat zou ik zelf moeten kunnen
Alvast bedankt
x loopt van 0 tot 1, y loopt voor een gegeven x van .. tot ...
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


quote:Op maandag 5 april 2010 19:21 schreef Jesse_ het volgende:
Even een vraagje:
[ afbeelding ]
Welke integraal moet ik hier voor opstellen? En vooral waarom.
Het uitrekenen ervan is niet nodig, dat zou ik zelf moeten kunnen
Alvast bedankt
Kan je zelf bedenken waarom?


Noujaa, waarschijnlijk is je antwoord wel goed, maar toch heb ik liever dat het vliegtuig waar ik in zit netter is ontworpen.quote:Op maandag 5 april 2010 19:28 schreef GoodGawd het volgende:
[..]
Oh? Nou in dat geval kan het niet, misschien is het een strik vraag.
'To alcohol, the cause of and the solution to all of life's problems' - Homer J. Simpson


Nogmaals even ... nadat m'n vraag is ondergesneeuwd ....quote:Op maandag 5 april 2010 16:19 schreef horned_reaper het volgende:
Als ik zo vrij mag zijn, zou ik graag zelf ook nog een vraag willen stellen m.b.t. chemie!
Wanneer we kijken naar het molecuul D-Glucose, is te zien dat bij het 3de koolstof atoom (het 2de chirale C-atoom) de OH groep aan de linker kant staat en bij de rest van de chirale koolstof atomen staan deze OH groepen rechts van de C.
Ik ben ervan op de hoogte dat dit te maken heeft met de ruimtelijke indeling van het molecuul.... maar hoe kan ik zelf bepalen of bij een bepaald molecuul bij het 2de... het 3de of misschien wel het 4de chirale koolstofatoom de OH groep links ofwel rechs moet?


Ik snap waar je de bovengrens van y vandaan haalt, maar bereken zo niet juist het gearceerde gebied?quote:Op maandag 5 april 2010 19:34 schreef BasementDweller het volgende:
[..]
[ afbeelding ]
Kan je zelf bedenken waarom?
Het is geel en staat in mijn ondertitel!
3DS friend code: 2191-7623-9035
3DS friend code: 2191-7623-9035


Kijk eens naar de structuur van glucose (in de ringvorm), en bekijk dan welke structuur (bootvorm of stoelvorm) het gunstigste is, en in welke posities de OH groepen het best staan ivm. sterische hindering.quote:Op maandag 5 april 2010 20:08 schreef horned_reaper het volgende:
[..]
Nogmaals even ... nadat m'n vraag is ondergesneeuwd ....


Ok deze zie ik even niet:
Stel je wilt weten hoeveel gram natriumcarbonaat nodig is om al het zilver uit 10 gram zilvernitraat neer te slaan.
Je zou dan deze tabel moeten gebruiken:
De berekening is dan:
10/339,8 x 106,0 g = 3,119 g Na2Co3
Ik snap echter niet waarom de molcuulverhouding bij zilvernitraat en natriumnitraat 2 is. Kan iemand dat toelichten? Alvast bedankt.
Stel je wilt weten hoeveel gram natriumcarbonaat nodig is om al het zilver uit 10 gram zilvernitraat neer te slaan.
Je zou dan deze tabel moeten gebruiken:
De berekening is dan:
10/339,8 x 106,0 g = 3,119 g Na2Co3
Ik snap echter niet waarom de molcuulverhouding bij zilvernitraat en natriumnitraat 2 is. Kan iemand dat toelichten? Alvast bedankt.


Omdat het carbonaat gebonden is met 2 atomen zilver en natrium, me dunkt.
Weet alleen geen reet van scheikunde
Weet alleen geen reet van scheikunde
'To alcohol, the cause of and the solution to all of life's problems' - Homer J. Simpson


Waarom niet?quote:Op maandag 5 april 2010 20:20 schreef Jesse_ het volgende:
[..]
Ik snap waar je de bovengrens van y vandaan haalt, maar bereken zo niet juist het gearceerde gebied?


Voor mijn gevoel bereken je dan een heel ander gebied, maar dat zal komen omdat ik het me niet zo goed kan visualiseren :pquote:
Het is geel en staat in mijn ondertitel!
3DS friend code: 2191-7623-9035
3DS friend code: 2191-7623-9035


y zit altijd tussen 0 en (1-x)/2 in en x tussen 0 en 1. Als je de functie weglaat in de integraal, krijg je dit:quote:Op maandag 5 april 2010 22:17 schreef Jesse_ het volgende:
[..]
Voor mijn gevoel bereken je dan een heel ander gebied, maar dat zal komen omdat ik het me niet zo goed kan visualiseren :p
Dat is dus het oppervlakte van het gebiedje (klopt, want het is een driehoek en basis × hoogte / 2 = 1/4). Maar "boven" dat gebied zit nog een functie. De inhoud tussen het oppervlak en de functie reken je hiermee uit.
Het is vergelijkbaar met het volgende:
Als je de functie weglaat, krijg je:
Dat is precies de afstand waarover je integreert (analoog aan het oppervlakte waarover je integreert van de eerstbesproken integraal). Bij de integraal van xdx integreer je over een lijn en krijg je een oppervlakte, en bij jouw integraal integreer je over een oppervlakte en krijg je een volume. Je doet in principe hetzelfde alleen krijg je er een dimensie bij .
Hoop dat het een beetje duidelijk is
[ Bericht 3% gewijzigd door BasementDweller op 05-04-2010 22:33:43 ]


ah oke, volgens mij begrijp ik het. Heel erg bedankt 
Ik had zelf alleen x van 0 naar 1-2y laten lopen en y van 0 naar 1/2, omdat de integraal dan iets makkelijker wordt.
Je edit maakt het nog duidelijker, bedankt
Ik had zelf alleen x van 0 naar 1-2y laten lopen en y van 0 naar 1/2, omdat de integraal dan iets makkelijker wordt.
Je edit maakt het nog duidelijker, bedankt
Het is geel en staat in mijn ondertitel!
3DS friend code: 2191-7623-9035
3DS friend code: 2191-7623-9035


Ja mijn verhaaltje was nog niet helemaal af eigenlijkquote:Op maandag 5 april 2010 22:33 schreef Jesse_ het volgende:
ah oke, volgens mij begrijp ik het. Heel erg bedankt
Ik had zelf alleen x van 0 naar 1-2y laten lopen en y van 0 naar 1/2, omdat de integraal dan iets makkelijker wordt.
Je edit maakt het nog duidelijker, bedankt
Wat jij doet met die andere grenzen is natuurlijk ook goed
Als je nog vragen hebt over wiskunde, kan je ze beter hier stellen:
[Bèta wiskunde] Huiswerk- en vragentopic


Ik neem aan dat je vraag betrekking heeft op glucose in de lineaire in plaats van de cyclische vorm. In dit geval moet je de Fischerprojectie gebruiken om glucose te tekenen. Je kunt of de absolute configuratie (volgens regels van Cahn-Ingold-Prelog) van de chirale centra onthouden, of simpelweg onthouden in welke richting ze moeten wijzen in de Fischerprojectie.quote:Op maandag 5 april 2010 20:08 schreef horned_reaper het volgende:
Nogmaals even ... nadat m'n vraag is ondergesneeuwd ....


Dankje voor je uitleg!quote:Op dinsdag 6 april 2010 00:03 schreef lyolyrc het volgende:
[..]
Ik neem aan dat je vraag betrekking heeft op glucose in de lineaire in plaats van de cyclische vorm. In dit geval moet je de Fischerprojectie gebruiken om glucose te tekenen. Je kunt of de absolute configuratie (volgens regels van Cahn-Ingold-Prelog) van de chirale centra onthouden, of simpelweg onthouden in welke richting ze moeten wijzen in de Fischerprojectie.
Maar ik zal je even een voorbeeld geven....
In bovenstaande afbeeldingen zijn alle mogelijk isomeren te vinden.....
Stel dat alle onderstaande namen willekeurig in een bak zouden liggen.... en ik zou ze onder de juiste structuur moeten plaatsen.
Zou hier dan enige logische kennis voor nodig zijn? Of is dat puur een kwestie van uit het hoofd leren?


Dat is helaas een kwestie van stampen. Maar ik meen dat de rode OH-groepen aanduiden dat je met de D-enantiomeren te maken hebt, dus verschil tussen L en D is dan wel te maken.quote:Op dinsdag 6 april 2010 00:32 schreef horned_reaper het volgende:
Dankje voor je uitleg!
Maar ik zal je even een voorbeeld geven....
[ afbeelding ]
In bovenstaande afbeeldingen zijn alle mogelijk isomeren te vinden.....
Stel dat alle onderstaande namen willekeurig in een bak zouden liggen.... en ik zou ze onder de juiste structuur moeten plaatsen.
Zou hier dan enige logische kennis voor nodig zijn? Of is dat puur een kwestie van uit het hoofd leren?


D & L is gelukkig nooit een probleemquote:Op dinsdag 6 april 2010 00:46 schreef lyolyrc het volgende:
[..]
Dat is helaas een kwestie van stampen. Maar ik meen dat de rode OH-groepen aanduiden dat je met de D-enantiomeren te maken hebt, dus verschil tussen L en D is dan wel te maken.
Maar dan wordt dit dus even een kwestie van stampen
Bedankt!
lyolyrc: Uw persoonlijke Fok!Chemie Docent!


Bijvoorbeeld N2 + 3 H2 --> 2 NH3, 1 molecuul stikstof, reageert met 3 moleculen waterstof waaruit twee moleculen ammoniak ontstaan. Volgens het boek is de molecuulverhouding dan 1, 3 en 2.quote:Op maandag 5 april 2010 22:08 schreef BasementDweller het volgende:
Molecuulverhouding van wat staat tot wat?
Dus als ik het goed begrijp zijn de molecuulverhoudingingen 2 bij AgNO3 en NaNO3 omdat
Na2CO3 + 2 Ag NO3 --> Ag2CO3 + 2 NaNo3?


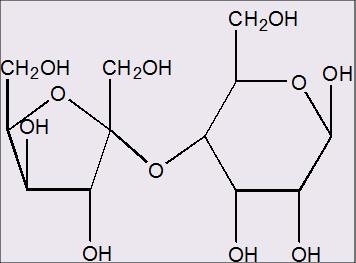
Wanneer ik kijk naar onderstaande afbeelding... is de glycosidische binding in deze disaccharide dan een 1,4 Alpha binding of een 2,4 Alpha binding?


het is in ieder geval een ,4 want de glycosidische binding zit duidelijk aan de 4de koolstof van de 6ring structuur vast.quote:
Maar ik denk dat het een 2,4 Alpha binding is, aangezien de 5 ring structuur van de fructose een ketose is en er nog een eerste koolstof voor de koolstof zit die met de dubbelgebonden O heeft willen hechten!


Je hebt gelijk, het is 2,4. Vergelijk het met saccharose, dat is ook een disaccharide bestaand uit een 5- en 6-ring.


Dit is nog een vraag voor Lyolyrc.... of ieder ander die er verstand van heeft!
Stel dat ik bijvoorbeeld, D-Glucose zou laten binden met D-Lactose.
D-Glucose is een 6 ringstructuur en D-Lactose een 5ring structuur.
Nu doet het er even niet toe of we de alpha of beta versie hebben van glucose... De eerste koolstof van D-Glucose gaat een binding aan met de 4de koolstof van D-Lactose.
Normaal gesproken zou bij een 6ring structuur aan het 4de koolstof een OH en een H groep hebben gezeten, en zou om de binding te vormen de 2 OH groepen van koolstof 1 van het eerste molecuul en koolstof 4 van het tweede molecuul met elkaar reageren tot een O-binding + H2O dat zou worden afgescheiden.
Alleen D-Lactose is een 5ring structuur en heeft aan zijn 4de koolstof een zijketen hangen plus een enkele H.
Dus heeft de OH groep van D-Glucose geen OH groep van D-Lactose om een binding mee te vormen.....
Is het dan misschien zo dat de O-binding wel wordt gevormd maar er geen water wordt uitgescheiden?
Ik weet dat de binding wel mogelijk is..... maar hoe?
Stel dat ik bijvoorbeeld, D-Glucose zou laten binden met D-Lactose.
D-Glucose is een 6 ringstructuur en D-Lactose een 5ring structuur.
Nu doet het er even niet toe of we de alpha of beta versie hebben van glucose... De eerste koolstof van D-Glucose gaat een binding aan met de 4de koolstof van D-Lactose.
Normaal gesproken zou bij een 6ring structuur aan het 4de koolstof een OH en een H groep hebben gezeten, en zou om de binding te vormen de 2 OH groepen van koolstof 1 van het eerste molecuul en koolstof 4 van het tweede molecuul met elkaar reageren tot een O-binding + H2O dat zou worden afgescheiden.
Alleen D-Lactose is een 5ring structuur en heeft aan zijn 4de koolstof een zijketen hangen plus een enkele H.
Dus heeft de OH groep van D-Glucose geen OH groep van D-Lactose om een binding mee te vormen.....
Is het dan misschien zo dat de O-binding wel wordt gevormd maar er geen water wordt uitgescheiden?
Ik weet dat de binding wel mogelijk is..... maar hoe?


Weet je zeker dat je lactose bedoelt? Volgens mij is dat namelijk een disaccharide...quote:Op woensdag 7 april 2010 15:45 schreef horned_reaper het volgende:
Dit is nog een vraag voor Lyolyrc.... of ieder ander die er verstand van heeft!
Stel dat ik bijvoorbeeld, D-Glucose zou laten binden met D-Lactose.
D-Glucose is een 6 ringstructuur en D-Lactose een 5ring structuur.
Nu doet het er even niet toe of we de alpha of beta versie hebben van glucose... De eerste koolstof van D-Glucose gaat een binding aan met de 4de koolstof van D-Lactose.
Normaal gesproken zou bij een 6ring structuur aan het 4de koolstof een OH en een H groep hebben gezeten, en zou om de binding te vormen de 2 OH groepen van koolstof 1 van het eerste molecuul en koolstof 4 van het tweede molecuul met elkaar reageren tot een O-binding + H2O dat zou worden afgescheiden.
Alleen D-Lactose is een 5ring structuur en heeft aan zijn 4de koolstof een zijketen hangen plus een enkele H.
Dus heeft de OH groep van D-Glucose geen OH groep van D-Lactose om een binding mee te vormen.....
Is het dan misschien zo dat de O-binding wel wordt gevormd maar er geen water wordt uitgescheiden?
Ik weet dat de binding wel mogelijk is..... maar hoe?


Ah sorry, dat klopt... ik bedoel natuurlijk D-Fructose!quote:Op woensdag 7 april 2010 16:04 schreef lyolyrc het volgende:
[..]
Weet je zeker dat je lactose bedoelt? Volgens mij is dat namelijk een disaccharide...


Ik zit te twijfelen aan het reactiemechanisme. Energetisch lijkt me afsplitsing van een H+ op die plek van fructose allerminst gunstig. Je krijgt dan namelijk negatieve lading op de koolstof naast een vrij elektronenpaar op de zuurstof. Daarentegen gebeurt de vorming van disacchariden natuurlijk enzymatisch, maar het mechanisme daarvan ken ik niet.quote:Op woensdag 7 april 2010 16:13 schreef horned_reaper het volgende:
Ah sorry, dat klopt... ik bedoel natuurlijk D-Fructose!
Edit: als er niet 2x H en 1x O afsplitst, dan kun je uiteraard geen condensatiereactie hebben, dus geen waterafsplitsing.


Maar wat gebeurt er dan met de 2 overgebleven Htjes? Want wanneer de O binding is gevormd zullen die toch ergens heen moeten... ?quote:Op woensdag 7 april 2010 16:42 schreef lyolyrc het volgende:
[..]
Ik zit te twijfelen aan het reactiemechanisme. Energetisch lijkt me afsplitsing van een H+ op die plek van fructose allerminst gunstig. Je krijgt dan namelijk negatieve lading op de koolstof naast een vrij elektronenpaar op de zuurstof. Daarentegen gebeurt de vorming van disacchariden natuurlijk enzymatisch, maar het mechanisme daarvan ken ik niet.
Edit: als er niet 2x H en 1x O afsplitst, dan kun je uiteraard geen condensatiereactie hebben, dus geen waterafsplitsing.


Ze zouden zich als radicaal kunnen afsplitsen, waardoor er net H2 uitgaat. Ik weet niet of dat enzymatisch mogelijk is. Ook is het misschien mogelijk dat er een zuurstofatoom tussen de C-H-binding wordt gewurmd, waarna zich water afsplitst via de normale procedure. Dit zijn de enige dingen die ik zo kan bedenken.quote:Op woensdag 7 april 2010 16:45 schreef horned_reaper het volgende:
Maar wat gebeurt er dan met de 2 overgebleven Htjes? Want wanneer de O binding is gevormd zullen die toch ergens heen moeten... ?


Kan ik mbv deze formules L te weten komen?
[ Bericht 20% gewijzigd door GoodGawd op 07-04-2010 22:36:49 ]
[ Bericht 20% gewijzigd door GoodGawd op 07-04-2010 22:36:49 ]
Blues ain't nothing but a good man feeling bad...


Z² = R² + X²
X = 2Pi* f * L
cos phi = R / Z
Dit zou je moeten kunnen herschrijven tot je L krijgt.
X = 2Pi* f * L
cos phi = R / Z
Dit zou je moeten kunnen herschrijven tot je L krijgt.
'To alcohol, the cause of and the solution to all of life's problems' - Homer J. Simpson


Ik ben eruit, merciquote:Op woensdag 7 april 2010 22:38 schreef MichielPH het volgende:
Z² = R² + X²
X = 2Pi* f * L
cos phi = R / Z
Dit zou je moeten kunnen herschrijven tot je L krijgt.
Blues ain't nothing but a good man feeling bad...


Heeft iemand hier verstand van Elektronica? If yes, mijn vraagje:
Kan je tussen Blind vermogen, werkelijk vermogen en schijnbaar vermogen onderling afleiden of het blind vermogen inductief is?
Kan je tussen Blind vermogen, werkelijk vermogen en schijnbaar vermogen onderling afleiden of het blind vermogen inductief is?
Blues ain't nothing but a good man feeling bad...


De volgende irreversibele gasfase reactie wordt isotherm uitgevoerd in een buisreactor:
A → P + X
De reactie is tweede orde in A. Bereken de benodigde buislengte om 60% conversie te halen.
Gegevens:
k2 = 5.0 dm3/mol.s
CA,0 = 0.2 mol/dm3
v,0 = 1.0 dm3/s
Ac = 1.0 dm2
Nu had ik het volgende bedacht:
molbalans:
- Fa,0 * dX/dV = -k * Ca0^2(1-X)^2 omzetten naar:
dX/(1-X)^2 = k * Ca0^2 / Fa0 * dV differentiaal wegwerken:
X/1-X = k * Ca0^2 * V / Fa0 invullen geeft:
0.6/(1-0.6) = 1.5
1.5 = 5 * 0.2^2 * V / 0.2 en dit geeft aan dat 1.5 = 0.2 * V / 0.2 dus V = 1.5 dm^3
Maar hoe kom ik nou aan de lengte van de buis???
EDIT:
Nog een probleem:
De reversibele vloeistoffase reactie:
A ↔ P
Is eerste orde in zowel A als P. De reactie wordt isotherm uitgevoerd in een batch reactor met een volume van 2 m3. Op het tijdstip t = 0 geldt dat CA,0 = 2000 mol/m3 en CP,0 = 0 mol/m3.
Gegevens:
k1 = 1.4 x 10-3 s-1
k-1 = 0.7 x 10-3 s-1
Evenwichtsconversie = 67%
Bereken het tijdstip waarop de conversie van A 10% afwijkt van de evenwichtsconversie.
-ra = k1 * (Ca - Cp / Kc) vervangen Ca = Ca0*(1-X) en Cp = Ca0*X
molbalans en kinetiek combineren:
-k1 * (Ca0*(1-X) - Ca0 * X / Kc) = dCa0*(1-X) / dt tijd naar links brengen:
-k1*dt = dCa0*(1-X) / (Ca0*(1-X) - Ca0*X / Kc) hoe nu verder?
[ Bericht 34% gewijzigd door karelsmits87 op 09-04-2010 15:45:10 ]
A → P + X
De reactie is tweede orde in A. Bereken de benodigde buislengte om 60% conversie te halen.
Gegevens:
k2 = 5.0 dm3/mol.s
CA,0 = 0.2 mol/dm3
v,0 = 1.0 dm3/s
Ac = 1.0 dm2
Nu had ik het volgende bedacht:
molbalans:
- Fa,0 * dX/dV = -k * Ca0^2(1-X)^2 omzetten naar:
dX/(1-X)^2 = k * Ca0^2 / Fa0 * dV differentiaal wegwerken:
X/1-X = k * Ca0^2 * V / Fa0 invullen geeft:
0.6/(1-0.6) = 1.5
1.5 = 5 * 0.2^2 * V / 0.2 en dit geeft aan dat 1.5 = 0.2 * V / 0.2 dus V = 1.5 dm^3
Maar hoe kom ik nou aan de lengte van de buis???
EDIT:
Nog een probleem:
De reversibele vloeistoffase reactie:
A ↔ P
Is eerste orde in zowel A als P. De reactie wordt isotherm uitgevoerd in een batch reactor met een volume van 2 m3. Op het tijdstip t = 0 geldt dat CA,0 = 2000 mol/m3 en CP,0 = 0 mol/m3.
Gegevens:
k1 = 1.4 x 10-3 s-1
k-1 = 0.7 x 10-3 s-1
Evenwichtsconversie = 67%
Bereken het tijdstip waarop de conversie van A 10% afwijkt van de evenwichtsconversie.
-ra = k1 * (Ca - Cp / Kc) vervangen Ca = Ca0*(1-X) en Cp = Ca0*X
molbalans en kinetiek combineren:
-k1 * (Ca0*(1-X) - Ca0 * X / Kc) = dCa0*(1-X) / dt tijd naar links brengen:
-k1*dt = dCa0*(1-X) / (Ca0*(1-X) - Ca0*X / Kc) hoe nu verder?
[ Bericht 34% gewijzigd door karelsmits87 op 09-04-2010 15:45:10 ]


Even een snelle en hele domme vraag van me.... want ik ben het echt even kwijt.
Wanneer ik een evewichtsreactie heb.. en tijdens het evenwicht zijn de molaire verdelingen als volgt is: 0,02 <--> 0,04 + 0,04
En hier moet ik de K van uitrekenen.
Dan schrijf je de evenwichtsconstante op: K = [0,04] * [0,04] / [0,02] = 0,08
Maar dit klopt niet, want het antwoord zou 4 moeten zijn.....
PS: De reactie verloopt in een volume van 2 liter!
Wanneer ik een evewichtsreactie heb.. en tijdens het evenwicht zijn de molaire verdelingen als volgt is: 0,02 <--> 0,04 + 0,04
En hier moet ik de K van uitrekenen.
Dan schrijf je de evenwichtsconstante op: K = [0,04] * [0,04] / [0,02] = 0,08
Maar dit klopt niet, want het antwoord zou 4 moeten zijn.....
PS: De reactie verloopt in een volume van 2 liter!


Heb je niet meer info? Want hiermee kan ik je niet echt van advies dienen.quote:Op vrijdag 9 april 2010 14:33 schreef horned_reaper het volgende:
Even een snelle en hele domme vraag van me.... want ik ben het echt even kwijt.
Wanneer ik een evewichtsreactie heb.. en tijdens het evenwicht zijn de molaire verdelingen als volgt is: 0,02 <--> 0,04 + 0,04
En hier moet ik de K van uitrekenen.
Dan schrijf je de evenwichtsconstante op: K = [0,04] * [0,04] / [0,02] = 0,08
Maar dit klopt niet, want het antwoord zou 4 moeten zijn.....
PS: De reactie verloopt in een volume van 2 liter!


We beschouwen nu de volgende evenwichtsreactie:
2 HI (g) <--> H2 (g) + I2 (g) met ∆H > 0
In een afgesloten reactievat (volume = 2 liter) wordt op tijdstip t0 0,10 mol HI gebracht. Na instelling van het evenwicht op tew blijkt er 0,04 mol I2 te zijn ontstaan.
b. Bereken de evenwichtsconstante K.
2 HI (g) <--> H2 (g) + I2 (g) met ∆H > 0
In een afgesloten reactievat (volume = 2 liter) wordt op tijdstip t0 0,10 mol HI gebracht. Na instelling van het evenwicht op tew blijkt er 0,04 mol I2 te zijn ontstaan.
b. Bereken de evenwichtsconstante K.


Op t0 heb je 0,10 mol HI, en 0 mol van zowel H2 als I2. Het eerste is gegeven, het andere weet je. Bij evenwichtsinstelling is er 0,04 mol I2 gevormd. Je had zelf al correct beredeneerd dat er dan ook 0,04 mol H2 gevormd moet zijn en dat 0,04 mol I2 en H2 gevormd wordt uit 0,08 mol HI, zodat er bij evenwicht nog maar 0,02 mol HI over is.
Het probleem zit hem in je berekening van het evenwicht, dat moet namelijk zijn: K = [H2]*[I2]/[HI]2. Je vergeet het kwadraat! Uitrekenen van dit evenwicht geeft 0,042/0,022 = 4
Het probleem zit hem in je berekening van het evenwicht, dat moet namelijk zijn: K = [H2]*[I2]/[HI]2. Je vergeet het kwadraat! Uitrekenen van dit evenwicht geeft 0,042/0,022 = 4


Ik zie het nuquote:Op vrijdag 9 april 2010 14:53 schreef lyolyrc het volgende:
Op t0 heb je 0,10 mol HI, en 0 mol van zowel H2 als I2. Het eerste is gegeven, het andere weet je. Bij evenwichtsinstelling is er 0,04 mol I2 gevormd. Je had zelf al correct beredeneerd dat er dan ook 0,04 mol H2 gevormd moet zijn en dat 0,04 mol I2 en H2 gevormd wordt uit 0,08 mol HI, zodat er bij evenwicht nog maar 0,02 mol HI over is.
Het probleem zit hem in je berekening van het evenwicht, dat moet namelijk zijn: K = [H2]*[I2]/[HI]2. Je vergeet het kwadraat! Uitrekenen van dit evenwicht geeft 0,042/0,022 = 4
Dankjewel


Dan nog even een snelle.... het blijkt maar weer dat ik echt een chemicus ben van de biochemie en de koolstofchemie 
Bereken hoeveel gram ijzerfosfaat, Fe3(PO4)2, je moet afwegen om 200 ml ijzerfosfaat-oplossing te maken die 150 mmol Fe2+-ionen per liter bevat.
Nou, de massa van Fe3(PO4)2 = 357,4 g/mol als je die waarden optelt uit het periodiek systeem...
Als er dus 357,4 gram in 1 mol zit... zou dit volgens mij ook moeten betekenen dat je 357,4 gram Fe3(PO)4 moet oplossen in 1 liter water om 1M te krijgen...
Waarna ik zeg, 357,4*0,15 = 53,61 g/150mmol
Maar blijkbaar ga ik hier al helemaal de mist in omdat het uiteindelijk antwoord toch echt 3,57g hoort te zijn....
omdat het uiteindelijk antwoord toch echt 3,57g hoort te zijn....
Bereken hoeveel gram ijzerfosfaat, Fe3(PO4)2, je moet afwegen om 200 ml ijzerfosfaat-oplossing te maken die 150 mmol Fe2+-ionen per liter bevat.
Nou, de massa van Fe3(PO4)2 = 357,4 g/mol als je die waarden optelt uit het periodiek systeem...
Als er dus 357,4 gram in 1 mol zit... zou dit volgens mij ook moeten betekenen dat je 357,4 gram Fe3(PO)4 moet oplossen in 1 liter water om 1M te krijgen...
Waarna ik zeg, 357,4*0,15 = 53,61 g/150mmol
Maar blijkbaar ga ik hier al helemaal de mist in


Ik zou zelf de andere kant op redeneren. Je hebt een 200 ml oplossing nodig met [Fe2+]=150 mM. Dit betekent dat de oplossing 0,150*0,200 = 0,030 mol Fe2+ moet bevatten. Aangezien het oplossen van 1 mol Fe3(PO4)2 leidt tot 3 mol Fe2+, betekent het dat je 30 mmol Fe2+ kunt halen uit 10 mmol Fe3(PO4)2. 10 mmol Fe3(PO4)2 komt overeen met 3,57 g.quote:Op vrijdag 9 april 2010 15:26 schreef horned_reaper het volgende:
Dan nog even een snelle.... het blijkt maar weer dat ik echt een chemicus ben van de biochemie en de koolstofchemie
Bereken hoeveel gram ijzerfosfaat, Fe3(PO4)2, je moet afwegen om 200 ml ijzerfosfaat-oplossing te maken die 150 mmol Fe2+-ionen per liter bevat.
Nou, de massa van Fe3(PO4)2 = 357,4 g/mol als je die waarden optelt uit het periodiek systeem...
Als er dus 357,4 gram in 1 mol zit... zou dit volgens mij ook moeten betekenen dat je 357,4 gram Fe3(PO)4 moet oplossen in 1 liter water om 1M te krijgen...
Waarna ik zeg, 357,4*0,15 = 53,61 g/150mmol
Maar blijkbaar ga ik hier al helemaal de mist inomdat het uiteindelijk antwoord toch echt 3,57g hoort te zijn....


Dankje voor je uitleg, maar ik snap de logica nog steeds niet helemaal....quote:Op vrijdag 9 april 2010 16:41 schreef lyolyrc het volgende:
[..]
Ik zou zelf de andere kant op redeneren. Je hebt een 200 ml oplossing nodig met [Fe2+]=150 mM. Dit betekent dat de oplossing 0,150*0,200 = 0,030 mol Fe2+ moet bevatten. Aangezien het oplossen van 1 mol Fe3(PO4)2 leidt tot 3 mol Fe2+, betekent het dat je 30 mmol Fe2+ kunt halen uit 10 mmol Fe3(PO4)2. 10 mmol Fe3(PO4)2 komt overeen met 3,57 g.
Ik kan je stap, "Dit betekent dat de oplossing 0,150*0,200 = 0,030 mol Fe2+ moet bevatten", nog niet helemaal volgen.... waarom doe je 0,150mol * 0,200L ? ... ik zie niet in waarom ik die stap zou nemen wanneer ik de vraag volgende week in een andere context zou krijgen....


Er is een gewenst volume gegeven (200 ml) en een gewenste concentratie van 150 mmol Fe2+/l = 150 mM. Als je het volume vermenigvuldigt met de concentratie, krijg je aantal mol Fe2+ dat de oplossing moet bevatten. Samengevat: liter*mol/liter = mol.quote:Op vrijdag 9 april 2010 16:54 schreef horned_reaper het volgende:
Dankje voor je uitleg, maar ik snap de logica nog steeds niet helemaal....
Ik kan je stap, "Dit betekent dat de oplossing 0,150*0,200 = 0,030 mol Fe2+ moet bevatten", nog niet helemaal volgen.... waarom doe je 0,150mol * 0,200L ? ... ik zie niet in waarom ik die stap zou nemen wanneer ik de vraag volgende week in een andere context zou krijgen....
Vanuit het aantal mol dat die vermenigvuldiging oplevert, bereken ik eerst hoeveel mol ijzersulfaat je nodig hebt en dan hoeveel gram dat is.


Ah, dus wanneer ik heb berekend hoeveel mol er in totaal in de oplossing moet, 0,150*0,200 = 0,030... is dat uitgedrukt in Fe2+ maar aangezien ik met een stof te maken heeft die Fe3 bevat, moet die 0,030 gedeeld door 3.... dat wordt 0,010 en wanneer ik mijn 357* 0,010 doe is dat = 3,57g ?quote:Op vrijdag 9 april 2010 17:00 schreef lyolyrc het volgende:
[..]
Er is een gewenst volume gegeven (200 ml) en een gewenste concentratie van 150 mmol Fe2+/l = 150 mM. Als je het volume vermenigvuldigt met de concentratie, krijg je aantal mol Fe2+ dat de oplossing moet bevatten. Samengevat: liter*mol/liter = mol.
Vanuit het aantal mol dat die vermenigvuldiging oplevert, bereken ik eerst hoeveel mol ijzersulfaat je nodig hebt en dan hoeveel gram dat is.


Je hebt hem door!quote:Op vrijdag 9 april 2010 17:15 schreef horned_reaper het volgende:
Ah, dus wanneer ik heb berekend hoeveel mol er in totaal in de oplossing moet, 0,150*0,200 = 0,030... is dat uitgedrukt in Fe2+ maar aangezien ik met een stof te maken heeft die Fe3 bevat, moet die 0,030 gedeeld door 3.... dat wordt 0,010 en wanneer ik mijn 357* 0,010 doe is dat = 3,57g ?
Aangezien de concentratie 150 mmol Fe2+ per liter is, zal 200 ml van die oplossing maar een vijfde van 150 mmol = 30 mmol bevatten. Dan maak je de stap naar het zout: 3 ionen Fe2+ haal je uit 1 zoutmolecuul Fe3(PO4)2. Vandaar dat je de 30 mmol door 3 moet delen. De laatste stap spreekt voor zich: je gaat van mol naar gram door te vermenigvuldigen met de molmassa.
Sowieso moet je zulk soort sommetjes altijd in deze volgorde oplossen. De manier waarop je begonnen was, werkt wel, maar is omslachtig.


Helemaal tegek lyolyrc ! 
Als ik dan nog één aller laatste vraag aan je zou mogen stellen, zal ik je niet meer lastig vallen
De vraag gaat als volgt: "We maken 2 liter acetaatbuffer met pH 5,0 en een sterkte van 0,1 M (dus [CH3COOH] + [CH3COO-] = 0,1 M) door de juiste hoeveelheid vast natriumacetaat (CH3COONa) en het juiste volume azijnzuur op te nemen in 2 liter water. Hoeveel gram natriumacetaat weeg je af en hoeveel ml azijnzuur (werkoplossing in de zuurkast is 4 M) heb je nodig?"
Waarschijnlijk zal ik eerste de fracties ten opzichte van elkaar moeten uitrekenen... en als ik dat weet kan ik aan de hand daarvan vrij makkelijk het aantal gram van beide stoffen uitrekenen.
Maar hoe bereken ik die fracties?
Als ik dan nog één aller laatste vraag aan je zou mogen stellen, zal ik je niet meer lastig vallen
De vraag gaat als volgt: "We maken 2 liter acetaatbuffer met pH 5,0 en een sterkte van 0,1 M (dus [CH3COOH] + [CH3COO-] = 0,1 M) door de juiste hoeveelheid vast natriumacetaat (CH3COONa) en het juiste volume azijnzuur op te nemen in 2 liter water. Hoeveel gram natriumacetaat weeg je af en hoeveel ml azijnzuur (werkoplossing in de zuurkast is 4 M) heb je nodig?"
Waarschijnlijk zal ik eerste de fracties ten opzichte van elkaar moeten uitrekenen... en als ik dat weet kan ik aan de hand daarvan vrij makkelijk het aantal gram van beide stoffen uitrekenen.
Maar hoe bereken ik die fracties?


Als je niet erg vindt, ga ik eerst even eten. Misschien dat een eerder antwoord over buffers je al een beetje op weg kan helpen.


We beginnen met de evenwichtsvergelijking (Ac- = CH3COO-): Ka = [H+]*[Ac-]/[HAc]
Hieruit volgt: Ka/[H+] = [Ac-]/[HAc]
substitueer: Ka = 10^-4.75 en [H+] = 10^-5.0
dat geeft [Ac-]/[HAc] = 10^0.25 = 1.78
daaruit leid je af dat: [Ac-] = 1.78*[HAc]
gegeven is dat: [Ac-]+[HAc] = 1.0 M
substitueer daarin [Ac-] = 1.78*[HAc], dat geeft: 2.78*[HAc] = 1.0 M
dan is [HAc] = 1.0/2.78 = 0.36 M
en [Ac-] = 1.0 M - [HAc] = 0.64 M
Gebruik deze concentraties om uit te rekenen hoeveel van de werkoplossing je nodig hebt en hoeveel gram natriumacetaat.
Hieruit volgt: Ka/[H+] = [Ac-]/[HAc]
substitueer: Ka = 10^-4.75 en [H+] = 10^-5.0
dat geeft [Ac-]/[HAc] = 10^0.25 = 1.78
daaruit leid je af dat: [Ac-] = 1.78*[HAc]
gegeven is dat: [Ac-]+[HAc] = 1.0 M
substitueer daarin [Ac-] = 1.78*[HAc], dat geeft: 2.78*[HAc] = 1.0 M
dan is [HAc] = 1.0/2.78 = 0.36 M
en [Ac-] = 1.0 M - [HAc] = 0.64 M
Gebruik deze concentraties om uit te rekenen hoeveel van de werkoplossing je nodig hebt en hoeveel gram natriumacetaat.


Hoe kom je in het begin aan de 4,75 ?quote:Op vrijdag 9 april 2010 20:00 schreef lyolyrc het volgende:
We beginnen met de evenwichtsvergelijking (Ac- = CH3COO-): Ka = [H+]*[Ac-]/[HAc]
Hieruit volgt: Ka/[H+] = [Ac-]/[HAc]
substitueer: Ka = 10^-4.75 en [H+] = 10^-5.0
dat geeft [Ac-]/[HAc] = 10^0.25 = 1.78
daaruit leid je af dat: [Ac-] = 1.78*[HAc]
gegeven is dat: [Ac-]+[HAc] = 1.0 M
substitueer daarin [Ac-] = 1.78*[HAc], dat geeft: 2.78*[HAc] = 1.0 M
dan is [HAc] = 1.0/2.78 = 0.36 M
en [Ac-] = 1.0 M - [HAc] = 0.64 M
Gebruik deze concentraties om uit te rekenen hoeveel van de werkoplossing je nodig hebt en hoeveel gram natriumacetaat.


Dat is de pKa van azijnzuur.quote:Op vrijdag 9 april 2010 20:04 schreef horned_reaper het volgende:
Hoe kom je in het begin aan de 4,75 ?
[ Bericht 0% gewijzigd door lyolyrc op 09-04-2010 20:10:31 (pKa uiteraard) ]


Kijk, daar liep ik dus vastquote:
Maar hoe zou ik zo uit m'n hoofd moeten weten wat een pKa van een willekeurige stof is ?


Lijkt me dat die op een tentamen gegeven wordt. Ik heb hem nu van wikipedia geplukt, maar het staat ook in Binas of meer professionele naslagwerken. Wellicht zelfs ergens in een scheikundeboek dat je hebt, aan de binnenkant van de kaft bijvoorbeeld.quote:Op vrijdag 9 april 2010 20:13 schreef horned_reaper het volgende:
Kijk, daar liep ik dus vastwant de rest lukt me wel....
Maar hoe zou ik zo uit m'n hoofd moeten weten wat een pKa van een willekeurige stof is ?


We mogen geen binas of naslagwerk gebruiken, en er is echt helemaal nergens een pKa gegeven, dus daarom vindt ik het nogal vreemd....quote:Op vrijdag 9 april 2010 20:17 schreef lyolyrc het volgende:
[..]
Lijkt me dat die op een tentamen gegeven wordt. Ik heb hem nu van wikipedia geplukt, maar het staat ook in Binas of meer professionele naslagwerken. Wellicht zelfs ergens in een scheikundeboek dat je hebt, aan de binnenkant van de kaft bijvoorbeeld.
Het enige dat van tevoren gegeven is is dat acetaatbuffer (Ka azijnzuur = 1,8.10-5) en fosfaatbuffer (Ka H2PO4- = 6,2.10-8)... had ik het daar uit kunnen halen dan ?