Post hier weer al je vragen, passies, trauma's en andere dingen die je uit je slaap houden met betrekking tot de vakken:
• Natuurkunde
• Informatica
• Scheikunde
• Biologie
• Algemene Natuurwetenschappen
• ... en alles wat verder in de richting komt.
Van MBO tot WO, hier is het topic waar je een antwoord kunt krijgen op je vragen.
Opmaak: http://betahw.mine.nu/index.php: site van GlowMouse om formules te kunnen gebruiken in je posts (op basis van Latexcode wordt een plaatje gegenereerd dat je vervolgens via het aangegeven linkje kunt opnemen).
quote:2-broom-1-methylbutaan bestaat niet. Dat heet 3-broompentaan.Op dinsdag 21 september 2010 14:10 schreef Warren het volgende:
Ok, bedankt. Voor 2-broom 1 methylbutaan geldt dus uiteraard hetzelfde.
Glowmouse geeft ook al een hint in die richting:
quote:Op dinsdag 21 september 2010 14:00 schreef GlowMouse het volgende:
En met een keten van vijf koolstofatomen heb je dus geen methylbutaan.
[ Bericht 0% gewijzigd door lyolyrc op 21-09-2010 18:27:46 (tellen... :')) ]
quote:Dit heb jij niet gezien, ok?
Wanda Littlemore’s utility function is U(x, y) = x + 46y - 2y^2. Her income is $135. If the price of x is $1 and the price of y is $18, how many units of good x will Wanda demand?
thnx
Het gaat over kNN algoritme (k nearest neighbour). Nou is het in principe een zeer dom algoritme waarbij het gewoon de hele training set in zijn geheel onthoudt. Nou heb ik alleen het probleem, dat de error op de test set met een kNN model verschilt als ik de training set gewoon hup doorgeef zoals ie is en als ik dezelfde training set (dus dezelfde instances!) eerst even door elkaar schud (dus de volgorde randomiseert).
Ik vind op websites en boeken niks over order, dus dacht ik dat het aan mijn code lag, maar dat heb ik nu zo vaak getest dat ik zo zit van "mis ik iets?".
Me enige andere gok is dat de euclidean distances (want dat wordt gebruikt) tot de instanties uit de training set (bij het testen van de test set) vrijwel hetzelfde is en dat je dus enkel het verschil hebt tussen nonrandom & random vanwege dat het maximaal K neighbours kan pakken (en dus niet zo zeer kijkt of er nog een paar extra neighbours zijn die even ver zitten).
Iemand?
Uitgaande van methylpropeen en stof X onstaat door additie de verbinding 2,2,4-trimethylpentaan. Dit gebeurt onder invloed van geconcentreerd zwavelzuur bij een temperatuur van 273K.
a.Geef de vergelijking van deze reactie en de naam van stof X
In een reactievat met methylpropeen wordt een druppel geconcentreerd zwavelzuur gedaan. Na verloop van tijd zijn er door additie twee nieuwe alkenen ontstaan in het reactievat. Een van die alkenen is 2,4,4-trimethyl-1penteen
b. Geef de structuruformule en de naam van het tweede product
Mijn vraag betreft vraag b. Ik snap wel hoe je tot deze twee producten komt ( de tweede is 2,5 - dimethyl - 1 hexeen), maar ik begrijp niet hoe deze twee producten een dubbele binding kunnen hebben, want in mij boek staat dat een onverzadigde verbinding door additie omgezet in een verzadigde verbinding (en deze twee producten hebben dubbele binding dus zijn ze onverzadigd).
Alvast bedankt
quote:Sowieso is volgens mij de volgorde van deze vragen nogal onlogisch. Als je snapt hoe men aan 2,4,4-trimethyl-1-penteen komt, dan snap je vast ook wel wat er nodig is om dit om te zetten naar het overeenkomstige pentaan.Op donderdag 23 september 2010 17:45 schreef Warren het volgende:
Iedereen bedankt die mij heeft geholpenNog een kleine vraag (sorry voor deze overload aan vragen):
Uitgaande van methylpropeen en stof X onstaat door additie de verbinding 2,2,4-trimethylpentaan. Dit gebeurt onder invloed van geconcentreerd zwavelzuur bij een temperatuur van 273K.
a.Geef de vergelijking van deze reactie en de naam van stof X
quote:Volgens mij komt er een ander product uit, niet 2,5-dimethyl-1-hexeen.In een reactievat met methylpropeen wordt een druppel geconcentreerd zwavelzuur gedaan. Na verloop van tijd zijn er door additie twee nieuwe alkenen ontstaan in het reactievat. Een van die alkenen is 2,4,4-trimethyl-1penteen
b. Geef de structuruformule en de naam van het tweede product
Mijn vraag betreft vraag b. Ik snap wel hoe je tot deze twee producten komt ( de tweede is 2,5 - dimethyl - 1 hexeen), maar ik begrijp niet hoe deze twee producten een dubbele binding kunnen hebben, want in mij boek staat dat een onverzadigde verbinding door additie omgezet in een verzadigde verbinding (en deze twee producten hebben dubbele binding dus zijn ze onverzadigd).
Alvast bedankt
quote:Nu het juiste antwoord
Dacht dat de afgeleide (1+46y-2y^2)/(x+46-4y) moest zijn. Maar het is gewoon 1/(46-4y).
Dan komen er toch wat lekkerdere getallen uit

quote:Zeer basaal.
Ik had dit overigens in gedachten, want er wordt dus dit gegeven:
| 1 |
| 1 2 3 4 5 6 | { u[0], u[1], u[2], v[0], v[1], v[2], w[0], w[1], w[2] } |
Edit: Ben er al uit en het werkt
[ Bericht 28% gewijzigd door Diabox op 26-09-2010 23:35:04 ]
Er zit verschillende stoffen in tandpasta, ik weet echt niet hoe je dat moet doen
met google kom ik ook niet echt verder
Nee je zal het vast kunnen laten reageren met 'n bepaalde stof, zodoende kan je achter de concentratie komen oid.
quote:Maar hoe weet ik zeker dat ie alleen met fluoride reageert, en niet met een van de andere stoffen?Op donderdag 30 september 2010 20:17 schreef Diabox het volgende:
Op de verpakking kijken.
Nee je zal het vast kunnen laten reageren met 'n bepaalde stof, zodoende kan je achter de concentratie komen oid.
Edit: Is alleen aantonen, maar zal je wel op weg helpen 'n beetje.
(Bayesian probabilities dus!)
P(x) is niet bekend en p(Class1) & p(Class2) worden slechts opgegeven als gelijk (=0.5) of 0.7 vs 0.3. (Voor een voorbeeld van hoe je de kansen in het figuur ziet: http://www.cs.bilkent.edu(...)s/cs551_bayesian.pdf pagina 33).
Klopt het dat als ik zeg dat p(fout|class1) dus hetgene is waarbij het class1 is (dus heeft een p(x|class 1)>0 op een bepaald domein in het figuur) maar waar class 2 wordt gekozen (dus aan de andere kant van de decision boundary ligt), dus dat het domein waarbij p(x|class 1) kleiner is dan p(x|class 2)?
Kortom in de link die ik gaf, pagina 33: de linkerbovenste figuur: p(fout|class 1) is dus het oppervlak onder de zwarte lijn op domein ~1.75 t/m ~4.4 (gedeelte dus onder zwarte lijn rechts van de zwarte onderbroken lijn (= decision boundary)).
En dus dat p(fout|class 2) dus het oppervlakte is, links van de zwarte onderbroken lijn onder de rode lijn?
quote:Waarschijnlijk is de opname in het bloed bij intramusculaire toediening al trager dan bij orale toediening. En mogelijk is de opname nog trager aangezien hydrofiele stoffen moelijker celmembranen passeren. Dus ik denk dat intramusculaire toediening van hydrofiele stoffen nog minder levertoxisch is.Op vrijdag 15 oktober 2010 23:52 schreef Diabox het volgende:
Orale toediening doorgaat een first-pass metabolism, intramusculaire toediening niet, waardoor oraal meer levertoxisch is (wanneer het uberhaupt dus al levertoxisch is). Mijn vraag; geldt dit ook voor hydrofiele stoffen die intramusculair worden toegediend?
quote:Iemand anders zei weer dat het dan inderdaad even hepatotoxisch is als oraal, maar dat het in de geval van de stof die ik voor ogen heb weer niet het geval is, omdat het zich direct bindt aan de androgene receptoren waardoor bij orale toediening er mg per mg meer ontgiftigt moet worden.Op zaterdag 16 oktober 2010 16:00 schreef lyolyrc het volgende:
[..]
Waarschijnlijk is de opname in het bloed bij intramusculaire toediening al trager dan bij orale toediening. En mogelijk is de opname nog trager aangezien hydrofiele stoffen moelijker celmembranen passeren. Dus ik denk dat intramusculaire toediening van hydrofiele stoffen nog minder levertoxisch is.

Deze twee stoffen 2-chloor-3-methylbutaan en 1-chloor-2-methylbutaan zijn racemeschische mengsels. Dus zouden ze spiegelbeeld isomeren van elkaar moeten zijn toch? Maar ik zie niet hoe je door de een te spiegelen de andere stof krijgt. Dit zit er voor mij uit als chemische reorganisatie
Alvast bedankt
quote:Ten eerste, het is racemisch, niet racemeschisch.Op woensdag 20 oktober 2010 22:22 schreef Warren het volgende:
Wederom heb ik jullie hulp nodig:
[ afbeelding ]
Deze twee stoffen 2-chloor-3-methylbutaan en 1-chloor-2-methylbutaan zijn racemeschische mengsels. Dus zouden ze spiegelbeeld isomeren van elkaar moeten zijn toch? Maar ik zie niet hoe je door de een te spiegelen de andere stof krijgt. Dit zit er voor mij uit als chemische reorganisatie
Alvast bedankt
Je observatie dat de beide structuren geen spiegelbeeldisomeren van elkaar zijn klopt. Het zijn overigens wel isomeren van elkaar, ze hebben namelijk elk molecuulformule C5H11Cl. Het is wel zo dat beide stoffen een stereocentrum bevatten. De bovenste bij het koolstofatoom waaraan de Cl vastzit, de onderste bij het koolstofatoom waaraan de methylgroep vastzit. Je kunt dus S-2-chloor-3-methylbutaan en R-2-chloor-3-methylbutaan hebben, welke met elkaar een racemisch mengsel vormen. En S-1-chloor-2-methylbutaan en R-1-chloor-2-methylbutaan die met elkaar een racemisch mengsel vormen.
Ik heb morgen een scheikundetoets, en nu was ik wat aan het oefenen en nu lukt het me dus niet om de vergelijking van de verbranding van calciumoxide op papier te krijgen.
Hulp, iemand?
quote:Wat wil je gaan verbranden aan calciumoxide? Verbranden betekent reactie met zuurstof, maar calciumoxide is al maximaal geoxideerd, dus er valt niet aan te verbranden.Op donderdag 21 oktober 2010 20:55 schreef Lutte het volgende:
Willen jullie mij alsjeblieft helpen?
Ik heb morgen een scheikundetoets, en nu was ik wat aan het oefenen en nu lukt het me dus niet om de vergelijking van de verbranding van calciumoxide op papier te krijgen.
Hulp, iemand?
quote:Dat zal verklaren waarom ik geen idee had wat ze bedoelden.Op donderdag 21 oktober 2010 21:01 schreef lyolyrc het volgende:
[..]
Wat wil je gaan verbranden aan calciumoxide? Verbranden betekent reactie met zuurstof, maar calciumoxide is al maximaal geoxideerd, dus er valt niet aan te verbranden.
Het zijn de vragen die een meisje op had geschreven die de toets eerder had gemaakt (ja heel slecht, fraude, ik weet het) dus er ontbreken wat dingen. Maar nu weet ik in ieder geval dat het niet is dat ik iets niet snap ofzo.
Bedankt voor de snelle reactie, kan ik ook weer rustig slapen vannacht!!
quote:De welbekende strikvraag.Op donderdag 21 oktober 2010 21:03 schreef Lutte het volgende:
Dat zal verklaren waarom ik geen idee had wat ze bedoelden.
Het zijn de vragen die een meisje op had geschreven die de toets eerder had gemaakt (ja heel slecht, fraude, ik weet het) dus er ontbreken wat dingen. Maar nu weet ik in ieder geval dat het niet is dat ik iets niet snap ofzo.
Bedankt voor de snelle reactie, kan ik ook weer rustig slapen vannacht!!
Lukt de verbranding van calcium wel?
quote:2Ca (s) + O2 (g) --> 2CaO ?Op donderdag 21 oktober 2010 21:05 schreef lyolyrc het volgende:
[..]
De welbekende strikvraag.
Lukt de verbranding van calcium wel?
quote:Appeltje eitje, zo te zien!
quote:Jeej.
quote:Bedankt. Het is mij nu duidelijk wat een racemisch mengsel isOp woensdag 20 oktober 2010 23:49 schreef lyolyrc het volgende:
[..]
Ten eerste, het is racemisch, niet racemeschisch.
Je observatie dat de beide structuren geen spiegelbeeldisomeren van elkaar zijn klopt. Het zijn overigens wel isomeren van elkaar, ze hebben namelijk elk molecuulformule C5H11Cl. Het is wel zo dat beide stoffen een stereocentrum bevatten. De bovenste bij het koolstofatoom waaraan de Cl vastzit, de onderste bij het koolstofatoom waaraan de methylgroep vastzit. Je kunt dus S-2-chloor-3-methylbutaan en R-2-chloor-3-methylbutaan hebben, welke met elkaar een racemisch mengsel vormen. En S-1-chloor-2-methylbutaan en R-1-chloor-2-methylbutaan die met elkaar een racemisch mengsel vormen.
Voorbeeld: NH4 + H20 -> NH3 + H30
<--
Stel dat je 5 mol NH4 hebt, kun je dan zeggen dat je dan ook 5 mol NH3 hebt, omdat de molverhouding 1:1 is. Dat lijkt me niet, aangezien het een evenwicht is, dus mijn vraag hoe kun je dan weten hoeveel mol H20, NH3 en H30 hebt?
quote:De reactie die je hier beschrijft, is geen evenwichtsreactie. NH3 is veel meer genegen om een H+ op te nemen, dan H2O. Deze reactie loopt af, op deze manier: NH3 + H3O+ -> NH4+ + H2O. Je gooit namelijk een sterk zuur bij ammoniak.Op zondag 24 oktober 2010 21:00 schreef Flanxx het volgende:
Molverhoudingen in evenwichtsreacties
Voorbeeld: NH4 + H20 -> NH3 + H30
<--
Stel dat je 5 mol NH4 hebt, kun je dan zeggen dat je dan ook 5 mol NH3 hebt, omdat de molverhouding 1:1 is. Dat lijkt me niet, aangezien het een evenwicht is, dus mijn vraag hoe kun je dan weten hoeveel mol H20, NH3 en H30 hebt?
Er treedt wel evenwicht op bij deze reactie: NH3 + H2O <=> NH4+ + OH-. De molverhoudingen hierin kun je berekenen uit baseconstante Kb of zuurconstante Ka voor deze reactie.
Kb = [ NH4+ ]*[ OH- ]/[ NH3 ]
en
Ka = [ NH3 ]/([ NH4+ ]*[ OH- ])
dus:
Ka = 1/Kb.
De waarde van de constanten kun je opzoeken in de literatuur. De molverhoudingen tussen de stoffen in de evenwichtsreactie kun je berekenen uit de gegeven vergelijkingen voor de evenwichtsconstanten. Deze molverhoudingen gelden uiteraard bij evenwicht, niet wanneer het evenwicht zich nog aan het instellen is.
Ik zit in 5 havo en ik heb binnenkort een SE voor natuurkunde. Het onderdeel waar ik problemen mee heb is signaalverwerking. Het probleem is dat ik van schakelingen op een systeembord bijna niets begrijp. Je moet ze zelf kunnen maken of af maken, maar dan gebeurt er bij mij niks omdat ik niet weet hoe ik moet beginnen en hoe ik verder moet gaan. En het gaat dan nog niet over uitgebreide schakelingen. Hier is een voorbeeld van de schakelingen die we moeten maken:

We moeten nu ook thuis oefenen met een programmaatje waarmee je die schakelingen maakt. Het programmaatje heet Systematic. Ik ga sowieso bijles vragen maar zou iemand me hier uitleg kunnen geven? Ik weet dat dat wel heel uitgebreid is, dus als het niet kan, dan niet.
[ Bericht 0% gewijzigd door #ANONIEM op 27-10-2010 17:09:05 ]
quote:De stof in 5 HAVO is grondig veranderd sinds ik op school zat... Desondanks zal ik toch pogen om je op weg te helpen.Op woensdag 27 oktober 2010 17:08 schreef Mark94 het volgende:
We moeten nu ook thuis oefenen met een programmaatje waarmee je die schakelingen maakt. Het programmaatje heet Systematic. Ik ga sowieso bijles vragen maar zou iemand me hier uitleg kunnen geven? Ik weet dat dat wel heel uitgebreid is, dus als het niet kan, dan niet.
Ben je bekend met digitale logica? Als je dat onder de knie hebt, wordt dit soort materie snel helderder. Weet je hoe veel 1 AND 1 is? Of 0 OR NOT(0)? Of 1 AND 0? Nee? (0)
In stap 2 verdiep je je in het probleem dat je leraar je voorgeschoteld heeft. Wat is het doel van je opdracht, wat moet je doen.
In stap 3 ga je je verdiepen in wat de functie van ieder deelcomponent op het schakelbord is. Hoe werkt zo'n comparator, hoe zit zo'n pulsteller in elkaar.
In de techniek gaat het er vaak om, om een complex probleem op te delen in mini-probleempjes, en die een voor een volledig te snappen en op te lossen. Uiteindelijk los je zo een heel probleem op.
Laat maar weten als je meer info nodig hebt.
quote:Ja dat met die EN- en OF-poorten begrijp ik wel. Dat van die deelcomponenten (wat ik het moeilijkst vind) staat toch wel goed in het boek uitgelegd dus dat moet ik nog maar even goed doorlezen. BedanktOp donderdag 28 oktober 2010 05:19 schreef Lyrebird het volgende:
[..]
De stof in 5 HAVO is grondig veranderd sinds ik op school zat... Desondanks zal ik toch pogen om je op weg te helpen.
Ben je bekend met digitale logica? Als je dat onder de knie hebt, wordt dit soort materie snel helderder. Weet je hoe veel 1 AND 1 is? Of 0 OR NOT(0)? Of 1 AND 0? Nee? (0)- google op digitale logica of iets dergelijks en zorg er voor dat je de theorie onder controle hebt. Het ziet er misschien imponerend uit, maar moeilijk is het zeer zeker niet.
In stap 2 verdiep je je in het probleem dat je leraar je voorgeschoteld heeft. Wat is het doel van je opdracht, wat moet je doen.
In stap 3 ga je je verdiepen in wat de functie van ieder deelcomponent op het schakelbord is. Hoe werkt zo'n comparator, hoe zit zo'n pulsteller in elkaar.
In de techniek gaat het er vaak om, om een complex probleem op te delen in mini-probleempjes, en die een voor een volledig te snappen en op te lossen. Uiteindelijk los je zo een heel probleem op.
Laat maar weten als je meer info nodig hebt.
[ Bericht 0% gewijzigd door #ANONIEM op 28-10-2010 17:06:36 ]
Maar ik weet even niet goed welke toets ik moet uitvoeren.
"een turbine met een capaciteit van 5 MW"
Wordt hier dan de maximale capaciteit bedoeld of hetgeen daadwerkelijk gemiddeld wordt opgewekt?
Ik zou het bijzonder vinden als het niet het maximaal vermogen was. Voorstanders van groene stroom hebben er namelijk nogal een handje van om hun plannen mooier te maken dan ze zijn met behulp van het maximaal vermogen.quote:Op dinsdag 2 november 2010 20:30 schreef PompTieDom het volgende:
Ikben bezig met een profielwerkstuk over groene stroom en ik vond ergens de zin:
"een turbine met een capaciteit van 5 MW"
Wordt hier dan de maximale capaciteit bedoeld of hetgeen daadwerkelijk gemiddeld wordt opgewekt?
Het beste grafiekenprogramma dat er te koop is, is Origin. Kost je wel een paar knaken. Kun je hele mooie en duidelijke grafieken mee maken.quote:Op woensdag 3 november 2010 19:23 schreef hello_moto1992 het volgende:
Weet iemand ook een leuk en makkelijk programma om grafieken te plotten en er letters en pijlen etc. bij te plaatsen?
Uit eigen werk (niet noodzakelijkerwijs mooi en duidelijk, maar het is een voorbeeld):

Het voordeligste alternatief blijft waarschijnlijk toch Excel, of zijn tegenhanger in Open Office.
Zou iemand misschien ook weten waar ik een code voor COACH kan verkrijgen (gratis uiteraard)? Ik zou dit programma namelijk graag thuis willen gebruiken.
Heb 't al gevonden:
SPOILER
[ Bericht 36% gewijzigd door hello_moto1992 op 04-11-2010 22:18:35 ]
Omdat de elektronegativiteit van de atomen niet gelijk is en ethaanthiol bovendien niet symmetrisch is. De dipolen zijn uiteraard wel klein, door het kleine verschil in elektronegativiteit van C,H en S.quote:Op zaterdag 6 november 2010 15:51 schreef Warren het volgende:
Kan iemand mij uitleggen waarom ethaanthiol (CH3 - CH2 - SH) dipool-dipoolbindingen tussen de moleculen heeft? C-H binding is geen polaire binding omdat het verschil in elektronegativiteit klein is (C:2,5 en H: 2,1). S heeft als elektronegativiteit 2,4.
Als we bijvoorbeeld penicilline nemen.... dit is een β-lactam antibiotica, dit betekent dat hij een β-lactamring bij zicht draagt en hiermee de DD-transpeptidase enzymen, die verantwoordelijk zijn voor de bouw van de celwand van de bacterie, afleiden om in de β-lactamring te gaan knippen van het antibioticum in plaats van op het D-ala D-ala structuur in de bacteriële wand te gaan knippen?
Of zet penicilline nu zijn β-lactamring OP de bacteriewand en blokkeert deze met zijn ring dan zo het proces van D-ala D-ala dat normaal gesproken wordt doorgeknipt? ....
Of is geen één van beide juist bedacht?
En nog even snel over bijvoorbeeld Vancomysine.... deze antibioticum gaat toch als een soort van hoedje OP de D-ala D-ala staartjes zitten zodat deze niet meer om kunnen buigen om een verbinding met elkaar aan te gaan?
Eigenlijk twee vragen in één dus...... over een erg lastig onderwerp.
Ik hoop dat iemand mij hier wat meer duidelijkheid over kan scheppen!
Ik heb m.b.t excel een modelletje opgesteld:

Klopt deze voorstelling?
"De eenheid newton is gedefinieerd als de kracht die een massa van 1 kilogram een versnelling van 1 m/s² geeft"
Moet ik hier ook nog ergens de massa van het balletje meenemen? Zoja, waar? Ik zou namelijk willen stellen dat Fres = m*a = 0, dus deze in principe al meegeteld is
Ik heb een vaag idee waar je naar toe wil, maar je vraagstelling is niet helemaal duidelijk.quote:Op woensdag 10 november 2010 21:18 schreef hello_moto1992 het volgende:
Ik heb een vraagje m.b.t. luchtweerstand.
Je hebt een balletje dat bij oplopende (lucht)snelheid een andere wrijvingskracht ondergaat, en die wrijvingskracht probeer je te berekenen, klopt dat? Als dat balletje geen versnelling ondergaat, dan betekent dat dat de wrijvingskracht gelijk is aan de kracht die dat balletje voortbeweegt. Zoals je zelf al stelt: Fres = m*a = 0.
In het geval van een bal die naar beneden valt, is die kracht gelijk aan de aantrekkingskracht van de aarde, g, en dat betekent dat Fnaar beneden = Fnaar boven, dus dat m*g = Fwrijving. Je hebt je formule voor Fwrijving, dus dat moet verder wel goed komen.
BTW, als je een model maakt, dan is het goed om ook de eenheden aan te geven. Zonder eenheden raakt een natuurkundige het overzicht kwijt.


Ik heb geen idee waar ik moet beginnen.
Zoals eerder gemeld is het bepalen van de 'terminal velocity' een fluitje van een cent. Het lastige aan jouw vraag is dat Fwrijving (en daardoor de versnelling vertraging) af zal nemen naar mate de snelheid afneemt. De oplossing ligt MI in het opstellen van een differentiaalvergelijking. Het is meer dan 10 jaar geleden dat ik dat voor het laatst gedaan heb dus mijn kennis op dat gebied is een beetje verjaard. Diabox (zie post hierboven) kan je daar misschien bij helpen.quote:Op donderdag 11 november 2010 08:52 schreef hello_moto1992 het volgende:
ik heb een voorwerp, een hockeybal van 160 gram, welke met een snelheid van bijvoorbeeld 20 m/s wordt weggeschoten. Ik wil het verloop van de snelheid laten zien na een bepaalde tijd m.b.v de luchtweerstand die op de hockeybal werkt
Een andere oplossing, als je het numeriek wil doen: beschouw de energie van de bal. Dus je begint met pure kinetische energie (1/2mv2) en naar mate de wrijving meer energie 'opeet', als in Fwrijving * s (afstand, in [m]), neemt die kinetische energie, en daarmee de snelheid af. Dit is waarschijnlijk de meest eenvoudige weg om v als functie van de afstand te plotten. Hoe je van daaruit naar v als functie van t kunt komen.. daar moet ik eens diep over nadenken.
[ Bericht 1% gewijzigd door Lyrebird op 12-11-2010 04:56:18 ]
Het kunnen er ook meerdere zijn. De term suspensie duidt simpelweg op niet-oplosbaarheid van vaste stof in vloeistof. Het maakt dan niet uit of er sprake is van een mengsel van meer dan twee stoffen.quote:Op zaterdag 20 november 2010 19:04 schreef Jmsls het volgende:
Nu even een stomme vraag tussen al die moeilijke formules; is een suspensie altijd een mengsel van 2 stoffen of kunnen het ook meerderen zijn?
Vloeistoffen die niet in elkaar oplossen vormen overigens een emulsie.
ik ben 16
http://nl.wikipedia.org/wiki/Potentiaalquote:Op zaterdag 27 november 2010 11:21 schreef HowAreYouDoing het volgende:
ik begrijp niets van het begrip potentiaal, elektrische potentiaal en elektrisch spanning. kan iemand dit uitleggen?
ik ben 16
http://nl.wikipedia.org/wiki/Elektrische_potentiaal
http://nl.wikipedia.org/wiki/Elektrische_spanning
Ik ben 20.
Ik heb morgen een tentamen voor scheikunde en ik had een klein vraagje over scheikunde misschien kan iemand mij helpen.
De stoffen jood en chloor reageren met elkaar tot joodmonochloride. Bij een experiment wordt 0,50 mmol chloorgas over 0,10 mmol jood geleid. Er ontstaat 0,20 mmol joodmonochloride.
a. Leid af of de reactie tot joodmonochloride een aflopende of een evenwichtsreactie is geweest.
Kan iemand mij vertellen wat een aflopende reactie betekent? Wat is het antwoord op de vraag?
bedankt alvast
Een aflopende reactie betekent dat de maximaal te vormen hoeveelheid product ook gevormd wordt. Met andere woorden minimaal één van de uitgangsstoffen moet totaal zijn weggereageerd. In geval van een evenwichtsreactie ontstaat er product, maar blijft er ook een bepaalde hoeveelheid van het uitgangsmateriaal over. De precieze verhouding tussen product en uitgangsstoffen wordt dan bepaald door een evenwichtsconstante.quote:Op maandag 29 november 2010 18:53 schreef Maarten302 het volgende:
Beste Fokkers,
Ik heb morgen een tentamen voor scheikunde en ik had een klein vraagje over scheikunde misschien kan iemand mij helpen.
De stoffen jood en chloor reageren met elkaar tot joodmonochloride. Bij een experiment wordt 0,50 mmol chloorgas over 0,10 mmol jood geleid. Er ontstaat 0,20 mmol joodmonochloride.
a. Leid af of de reactie tot joodmonochloride een aflopende of een evenwichtsreactie is geweest.
Kan iemand mij vertellen wat een aflopende reactie betekent? Wat is het antwoord op de vraag?
bedankt alvast
In dit geval gaat het om de volgende reactie: I2 + Cl2 -> 2 ICl
Er is gegeven dat er 0,20 mmol ICl wordt gevormd. Uit de reactieverhoudingen (1 mol I2 en 1 mol Cl2 vormen 2 mol ICl) kun je afleiden dat de gevormde 0,20 mmol ICl ontstaan is uit 0,10 mmol I2 en 0,10 mmol Cl2.
I2 reageert compleet weg in dit geval en daarom is de reactie aflopend. Van Cl2 blijft nog 0,50 - 0,10 = 0,40 mmol over.
Dankjewel, ik snap het!!!!!! Het maakt dus niet uit welk van de twee stoffen helemaal reageert. Ik heb nu nog een klein vraagjequote:Op maandag 29 november 2010 19:29 schreef lyolyrc het volgende:
[..]
Een aflopende reactie betekent dat de maximaal te vormen hoeveelheid product ook gevormd wordt. Met andere woorden minimaal één van de uitgangsstoffen moet totaal zijn weggereageerd. In geval van een evenwichtsreactie ontstaat er product, maar blijft er ook een bepaalde hoeveelheid van het uitgangsmateriaal over. De precieze verhouding tussen product en uitgangsstoffen wordt dan bepaald door een evenwichtsconstante.
In dit geval gaat het om de volgende reactie: I2 + Cl2 -> 2 ICl
Er is gegeven dat er 0,20 mmol ICl wordt gevormd. Uit de reactieverhoudingen (1 mol I2 en 1 mol Cl2 vormen 2 mol ICl) kun je afleiden dat de gevormde 0,20 mmol ICl ontstaan is uit 0,10 mmol I2 en 0,10 mmol Cl2.
I2 reageert compleet weg in dit geval en daarom is de reactie aflopend. Van Cl2 blijft nog 0,50 - 0,10 = 0,40 mmol over.
Dankjewel
Concentratiebreuk is volgens mij alleen gebruikelijk voor evenwichtsreacties, dat is de evenwichtsconstante waar ik in mijn vorige post naar refereerde. Zo'n evenwichtsconstante is alleen geldig als het evenwicht zich heeft ingesteld. Rekenen met molverhoudingen is uiteraard ook een optie.quote:Op maandag 29 november 2010 20:01 schreef Maarten302 het volgende:
[..]
Dankjewel, ik snap het!!!!!! Het maakt dus niet uit welk van de twee stoffen helemaal reageert. Ik heb nu nog een klein vraagje. Het is toch waar dat je de concentratie van een bepaalde stof op twee manieren kan berekenen. Met behulp van de concentratiebreuk (K= .../....) en met behulp van de molverhoudingen. Of kan je de concentratiebreuk alleen gebruiken als er specifiek wordt gevraagd naar een bepaalde concentratie NA een bepaalde reactie?
Dankjewel
dankjewel voor je hulp man, ik snap het helemaal!quote:Op maandag 29 november 2010 20:22 schreef lyolyrc het volgende:
[..]
Concentratiebreuk is volgens mij alleen gebruikelijk voor evenwichtsreacties, dat is de evenwichtsconstante waar ik in mijn vorige post naar refereerde. Zo'n evenwichtsconstante is alleen geldig als het evenwicht zich heeft ingesteld. Rekenen met molverhoudingen is uiteraard ook een optie.
Graag gedaan, succes met je tentamen!quote:Op maandag 29 november 2010 21:04 schreef Maarten302 het volgende:
okee
[..]
dankjewel voor je hulp man, ik snap het helemaal!
Klopt dit enigszins?
quote:Gegeven zijn de functies Fp(x)=P2X2-2PX+3
Stel een formule op van de kromme waarop alle toppen van de grafieken van Fp liggen
Dat snap ik ook nietquote:Op donderdag 2 december 2010 15:07 schreef Diabox het volgende:
Afgeleide nemen en gelijk stellen aan 0.
Je functie is opgesteld als functie van x. Dat betekent dat je de afgeleide ook naar x moet nemen. Wat is de afgeleide van P2x2 dan? En de afgeleide van -2Px? En van 3?quote:Op donderdag 2 december 2010 15:08 schreef honkeytonk het volgende:
[..]
Dat snap ik ook nietWil je wat beter uitleggen? Of uitwerking erbij?
Klopt het volgende:
Kz = [H3O+] * ([CO32-]/[HCO3-])
4,7E-11 = 10^-9,85 * ([CO32-]/[HCO3-])
[ Bericht 27% gewijzigd door hello_moto1992 op 03-12-2010 16:00:11 ]
Hier staat een voorbeeldberekening voor precies dezelfde buffer.quote:Op vrijdag 3 december 2010 15:33 schreef hello_moto1992 het volgende:
Ik moet een buffersysteem maken van 2,00M HCl en 1,40M Na2CO3. Dit moet een bepaalde pH hebben (9,85). Ik heb werkelijk geen idee waar ik moet beginnen.Zou iemand mij op weg willen helpen?
Klopt het volgende:
Kz = [H3O+] * ([CO32-]/[HCO3-])
4,7E-11 = 10^-9,85 * ([CO32-]/[HCO3-])
De uitdrukking voor de evenwichtsconstante klopt, maar je kunt beter met de pKz werken in plaats van de Kz, dat rekent makkelijker. Zie de link die ik hierboven heb gegeven.
Nu doet hij dat allemaal prima. Het probleem is alleen dat hij de command window ook volgooit met een matrix die ik gebruik voor het maken van die plot. Overal semicolon om het te onderdrukken maar dat werkt niet. Iemand een idee wat ik in de functie moet zetten om dit te stoppen? Hieronder de code:
| 1 2 3 4 5 6 7 8 | function y=unit_pulse(t_c,tau); % unit_pulse generates a pulse of height 1 of width tau which is centered % around t_c. Subsequently the function is plotted. % To call this function, simply type unit_impulse(t_c,tau). t=t_c-tau:0.01:t_c+tau; % Generates a time axis from the center time t_c - tau to t_c + tau y=heaviside(t+tau/2-t_c)-heaviside(t-tau/2-t_c); % Creates the unit step centered at t_c and with width tau(tau/2 to the left of t_c and tau/2 to the right of t_c). plot(t,y),axis([t_c-tau t_c+tau 0 1.1]); % Plots the function with an appropriate axis. end |
Dank
SPOILEROh en geen verdere comments over hoe slecht m'n skills zijn en hoe inefficiënt de code is, ik ben nog niet zo heel ervaren met matlab
Het ligt niet aan de code, maar de manier waarop je de functie aanroept.quote:Op vrijdag 3 december 2010 22:09 schreef Jac0bus het volgende:
Nouja, goed is overdreven maar een beetje weet hoe MATLAB over dingen denkt en hoe hij dingen uitvoert. Ik heb een heel simpele functie die er slechts voor zorgt dat ik een impulse krijg centered around tijd=t_c en met pulse dikte tau. Het enige wat ik wil is dat hij daar een plot van maakt, meer niet.
Nu doet hij dat allemaal prima. Het probleem is alleen dat hij de command window ook volgooit met een matrix die ik gebruik voor het maken van die plot. Overal semicolon om het te onderdrukken maar dat werkt niet. Iemand een idee wat ik in de functie moet zetten om dit te stoppen? Hieronder de code:
[ code verwijderd ]
DankSPOILEROh en geen verdere comments over hoe slecht m'n skills zijn en hoe inefficiënt de code is, ik ben nog niet zo heel ervaren met matlab
Waarschijnlijk typ jij in de command window:
| 1 | unit_pulse(c,tau) |
| 1 | unit_pulse(c,tau); |
Je kunt de puntkomma in de eerste regel van je functie weglaten, want daar definieer je alleen de functienaam en de variabelen van de functie en dat genereert geen data. Door de puntkomma wel te gebruiken als je de functie aanroept, heb je niet al die data in de command window.
SPOILERDa's dan € 450 voor het beantwoorden van je vraag.
Ok dus in de command unit_pulse(c,tau); supressed die troep idd, maar dat kan ik niet doen door iets in code zelf te doen, alleen mogelijk door een semicolon in de command window zelf?quote:Op zaterdag 4 december 2010 00:22 schreef lyolyrc het volgende:
[..]
Het ligt niet aan de code, maar de manier waarop je de functie aanroept.
Waarschijnlijk typ jij in de command window:
[ code verwijderd ]
maar als je typt:
[ code verwijderd ]
blijft de command window leeg.
Je kunt de puntkomma in de eerste regel van je functie weglaten, want daar definieer je alleen de functienaam en de variabelen van de functie en dat genereert geen data. Door de puntkomma wel te gebruiken als je de functie aanroept, heb je niet al die data in de command window.SPOILERDa's dan € 450 voor het beantwoorden van je vraag.
SPOILER
Keep the change
Inderdaad. Ik heb het net nog even nagezocht in een boek en daar staat ook dat je het niet kunt onderdrukken in de functie zelf.quote:Op zaterdag 4 december 2010 09:31 schreef Jac0bus het volgende:
[..]
Ok dus in de command unit_pulse(c,tau); supressed die troep idd, maar dat kan ik niet doen door iets in code zelf te doen, alleen mogelijk door een semicolon in de command window zelf?
quote:SPOILER
De gouden tipquote:Op zaterdag 4 december 2010 15:56 schreef koffiegast het volgende:
Je kunt het onderdrukken zonder ; door de y= in function y=unit_pulseetc weg te halen.
In mijn boek kom ik de sifting property regelmatig tegen nu. Ik heb hem wel aangenomen dat het zo is maar ik zou graag een visualisatie zien of een bewijs ofzo. Ik denk dat de delta-functie er voor zorgt dat x opschuift van tau naar t, maar hoe gebeurt dat precies met die integraal? Oftewel: hoe moet ziet dit er uit in een grafiek bijvoorbeeld?

In het kort kun je zo'n distributie zien als een operator inwerkende op een ruimte van functies. De eigenschappen van die Dirac delta "functie" bijvoorbeeld kun je met normale functies niet omvatten, wat je zelf makkelijk na kunt gaan.
Zie hier bijvoorbeeld een uitleg met een wat meer fysisch tintje (toepassingen in de kwantumveldentheorie); de rigoreuze teksten kun je vast zelf wel googlen.
de proefbeschrijving:
-pipetteer 10,00 ml van de oxaalzuuroplossing in de erlenmeyer.
-voeg een scheut (ca. 10 ml) 2 M zwavelzuur toe. Spoel de hals van de erlenmeyer zo nodig na met een (klein) beetje water.
-verwarm de oplossing in een rustige blauwe vlam al zwekende tot hij flink warm is.
-titreer de warme oplossing vervolgens met de kaliumpermanganaatoplossing tot de roze kleur net niet meer verdwijnt.
Ik moet de reactievergelijking geven voor de reagerende stoffen en in dit geval ook de deelreacties.(redoxreacties)
Ik heb nu dit:
Halfreactie oxaalzuur:
H2C2O4 --> 2 CO2 (g) + 2 H+ + 2e- × 5
Halfreactie permanganaat:
MnO4- + 8 H+ + 5e- --> Mn2+ + 4 H20 (l) × 2
Wordt:
Halfreactie oxaalzuur:
5 H2C2O4 --> 10 CO2 (g) + 10 H+ + 10e-
Halfreactie permanganaat:
2MnO4- + 16 H+ + 10e- --> 2Mn2+ + 8 H2O (l) +
Totaalreactie:
5H2C2O4 + 2MnO4- + 16 H+ -> 10 H+ + 2Mn2+ + 8 H2O + 10 CO2 (g)
Kan iemand mij vertellen of ik dit goed heb gedaan?
Een andere vraag die ik niet helemaal snap is:
Welke reactie verloopt als er geen zwavelzuur voor het titreren wordt toegevoegd?
Ik hoop dat iemand mij verder kan helpen
De halfreacties zien er goed uit, bij de totaalreactie heb je 16 H+ links en 10 H+ rechts van de reactiepijl staan. Je mag dit vereenvoudigen tot 6 H+ links. Dit verklaart meteen waarom je nog extra zuur moet toevoegen, de H+ die vrijkomt bij de oxidatie van oxaalzuur is niet voldoende om de reactie gewenste reductie van permanganaat te krijgen.quote:Op dinsdag 7 december 2010 22:41 schreef snellehenk het volgende:
Voor een scheikunde practicum moet ik een aantal opdrachten maken.
de proefbeschrijving:
-pipetteer 10,00 ml van de oxaalzuuroplossing in de erlenmeyer.
-voeg een scheut (ca. 10 ml) 2 M zwavelzuur toe. Spoel de hals van de erlenmeyer zo nodig na met een (klein) beetje water.
-verwarm de oplossing in een rustige blauwe vlam al zwekende tot hij flink warm is.
-titreer de warme oplossing vervolgens met de kaliumpermanganaatoplossing tot de roze kleur net niet meer verdwijnt.
Ik moet de reactievergelijking geven voor de reagerende stoffen en in dit geval ook de deelreacties.(redoxreacties)
Ik heb nu dit:
Halfreactie oxaalzuur:
H2C2O4 --> 2 CO2 (g) + 2 H+ + 2e- × 5
Halfreactie permanganaat:
MnO4- + 8 H+ + 5e- --> Mn2+ + 4 H20 (l) × 2
Wordt:
Halfreactie oxaalzuur:
5 H2C2O4 --> 10 CO2 (g) + 10 H+ + 10e-
Halfreactie permanganaat:
2MnO4- + 16 H+ + 10e- --> 2Mn2+ + 8 H2O (l) +
Totaalreactie:
5H2C2O4 + 2MnO4- + 16 H+ -> 10 H+ + 2Mn2+ + 8 H2O + 10 CO2 (g)
Kan iemand mij vertellen of ik dit goed heb gedaan?
Een andere vraag die ik niet helemaal snap is:
Welke reactie verloopt als er geen zwavelzuur voor het titreren wordt toegevoegd?
Ik hoop dat iemand mij verder kan helpen
Als je in BINAS kijkt, zie je dat er nog meer reacties mogelijk zijn met permanganaat:
MnO4- + e- -> MnO42-
MnO4- + 2 H2O(l) + 3 e- -> MnO2(s) + 4 OH-
De laatste reactie is niet waarschijnlijk aangezien oxaalzuur zelf nogal zuur is, maar de eerste reactie zou goed kunnen optreden.
Oke, dankjewelquote:Op woensdag 8 december 2010 16:01 schreef lyolyrc het volgende:
[..]
De halfreacties zien er goed uit, bij de totaalreactie heb je 16 H+ links en 10 H+ rechts van de reactiepijl staan. Je mag dit vereenvoudigen tot 6 H+ links. Dit verklaart meteen waarom je nog extra zuur moet toevoegen, de H+ die vrijkomt bij de oxidatie van oxaalzuur is niet voldoende om de reactie gewenste reductie van permanganaat te krijgen.
Als je in BINAS kijkt, zie je dat er nog meer reacties mogelijk zijn met permanganaat:
MnO4- + e- -> MnO42-
MnO4- + 2 H2O(l) + 3 e- -> MnO2(s) + 4 OH-
De laatste reactie is niet waarschijnlijk aangezien oxaalzuur zelf nogal zuur is, maar de eerste reactie zou goed kunnen optreden.
Nog een klein vraagje, een andere vraag die ik niet snap is:
met hoeveel mmol kaliumpermanganaat heeft dat per titratie gereageerd?
hoe kan ik dit uitrekenen?
bij het practicum heb ik ongeveer 10,00 ml kaliumpermanganaatoplossing getitreerd.
bij de vorige vraag heb ik uitgerekend hoeveel mmol oxaalzuur er bij elke titratie gebruikt is, dit is 0,5006 mmol.
Het idee van titreren is dat je de concentratie van een oplossing bepaald met behulp van een reactantoplossing waarvan je de concentratie precies kent en waarvan je precies afmeet hoeveel je ervan toevoegt.quote:Op woensdag 8 december 2010 22:54 schreef snellehenk het volgende:
[..]
Oke, dankjewel
Nog een klein vraagje, een andere vraag die ik niet snap is:
met hoeveel mmol kaliumpermanganaat heeft dat per titratie gereageerd?
hoe kan ik dit uitrekenen?
bij het practicum heb ik ongeveer 10,00 ml kaliumpermanganaatoplossing getitreerd.
bij de vorige vraag heb ik uitgerekend hoeveel mmol oxaalzuur er bij elke titratie gebruikt is, dit is 0,5006 mmol.
Dus concreet:
• wat is de concentratie van de kaliumpermanganaatoplossing?
• hoeveel precies heb je ervan toegevoegd bij de titratie? Dus niet ongeveer 10 ml, maar bijv. 10,07 ml.
Als je die gegevens hebt, dan kun je gaan rekenen:
• vermenigvuldig de concentratie van de KMnO4 met de toegevoegde hoeveelheid. Let op de eenheden!
• leid uit de totaalreactie af in welke verhouding KMnO4 en oxaalzuur reageren , bepaal hiermee het aantal mol oxaalzuur dat heeft gereageerd.
• deel het aantal mol oxaalzuur door het aantal ml oxaalzuuroplossing en je hebt de concentratie.
[ Bericht 0% gewijzigd door lyolyrc op 09-12-2010 15:48:20 ]
Dankjewelquote:Op donderdag 9 december 2010 15:09 schreef lyolyrc het volgende:
[..]
Het idee van titreren is dat je de concentratie van een oplossing bepaald met behulp van een reactantoplossing waarvan je de concentratie precies kent en waarvan je precies afmeet hoeveel je ervan toevoegt.
Dus concreet:
• wat is de concentratie van de kaliumpermanganaatoplossing?
• hoeveel precies heb je ervan toegevoegd bij de titratie? Dus niet ongeveer 10 ml, maar bijv. 10,07 ml.
Als je die gegevens hebt, dan kun je gaan rekenen:
• vermenigvuldig de concentratie van de KMnO4 met de toegevoegde hoeveelheid. Let op de eenheden!
• leid uit de totaalreactie af in welke verhouding KMnO4 en oxaalzuur reageren , bepaal hiermee het aantal mol oxaalzuur dat heeft gereageerd.
• deel het aantal mol oxaalzuur door het aantal ml oxaalzuuroplossing en je hebt de concentratie.
Je hebt me hiermee erg geholpen:)
ik doe mijn profielwerkstuk over het dopplereffect.
nu ben ik een stuk aan het schrijven over de geschiedenis en dus ook over het boek van Christian Doppler.
ik kom op wikipedia echter iets tegen wat volgens mij niet klopt:
als vw = +c dan is f/f' oneindig.
als ik dit in de formule f ' / f = (c+vw) / c invul kom ik echter op 2 uit
weet iemand of dit een fout is op wikipedia of dat ik een redeneerfout maak?
Ik kan alleen op Wikipedia informatie vinden dus daar moet ik het maar mee doen
Alvast bedankt

de noemer is niet c maar c-v. En je mist een wortel.
Mijn probleem is vooral dat ik een andere uitkomst uitkrijg wanneer ik de formule die hier staat invul: http://nl.wikipedia.org/w(...)_Himmels#cite_note-4
ik kom dus op 2 uit ipv oneindig
wanneer de waarnemer met de lichtsnelheid zou naderen, zou de verhouding f ' / f oneindig zijn
hier kom ik niet op uit wanneer ik de formule invul:
f ' / f = (c+vw) / c
f ' / f = (c+c) / c
f ' / f = (2c) / c
f ' / f = 2
ik zie mijn fout niet
Waarom dan?quote:wanneer de waarnemer met de lichtsnelheid zou naderen, zou de verhouding f ' / f oneindig zijn
dan klopt alles namelijk
Ik heb een vraagje over scheikunde. De volgende reactie is een evenwichtsreactie:
2NO2(g) --> N2O4(g)
bruin kleurloos
de omgekeerde reactie vindt dus ook plaats:
N2O4(g) --> 2NO2(g)
Het bruine gas stikstofdioxide wordt door afkoelen omgezet in het kleurloze gas distikstoftetraoxide (zie de eerste reactie). Bij verwarmen wordt de kleur donkerder en vindt de omgekeerde reactie plaats (zie de tweede reactie).
Het gaat hier dus om de temperatuur. Stel dat ze nou vragen waarom het evenwicht dan naar links of naar rechts verplaatst, is dat dan omdat temperatuur een vorm van energie is en dus het evenwicht naar de endotherme kant gaat? Of heeft het te maken met het feit dat door de hoge temperatuur er meer effectieve botsingen per tijdseenheid plaatsvinden waardoor er meer N2O4 wordt gevormd?
Dan nog een laatste vraagje. Zoals jullie hier zien heb ik twee redenen gegeven (waarvan ik niet zeker weet of ze beiden kloppen). Bij de eerste reden gaat het gewoon simpelweg naar de endotherme kant maar bij de tweede rede zou er een evenwicht moeten instellen toch? Als er meer effectieve botsingen tussen 2NO2 zal er meer N2O4 worden gevormd maar als er even later meer N2O4 is gevormd zal er door de effectieve botsingen weer meer 2NO2 worden gevormd. Een evenwicht dus.
Is het dan een evenwicht of ligt het evenwicht naar rechts?
Het is een lang verhaal ik weet het maar ik zou heel dankbaar zijn als iemand mij dit kleine probleempje zou willen uitleggen. Mijn docent is momenteel niet bereikbaar vandaar dat ik het aan jullie vraag.
bedankt alvast!
Maarten
Hoi Maarten,quote:Op maandag 13 december 2010 21:13 schreef Maarten302 het volgende:
Beste Fokkers,
Ik heb een vraagje over scheikunde. De volgende reactie is een evenwichtsreactie:
2NO2(g) --> N2O4(g)
bruin kleurloos
de omgekeerde reactie vindt dus ook plaats:
N2O4(g) --> 2NO2(g)
Het bruine gas stikstofdioxide wordt door afkoelen omgezet in het kleurloze gas distikstoftetraoxide (zie de eerste reactie). Bij verwarmen wordt de kleur donkerder en vindt de omgekeerde reactie plaats (zie de tweede reactie).
Het gaat hier dus om de temperatuur. Stel dat ze nou vragen waarom het evenwicht dan naar links of naar rechts verplaatst, is dat dan omdat temperatuur een vorm van energie is en dus het evenwicht naar de endotherme kant gaat? Of heeft het te maken met het feit dat door de hoge temperatuur er meer effectieve botsingen per tijdseenheid plaatsvinden waardoor er meer N2O4 wordt gevormd?
Dan nog een laatste vraagje. Zoals jullie hier zien heb ik twee redenen gegeven (waarvan ik niet zeker weet of ze beiden kloppen). Bij de eerste reden gaat het gewoon simpelweg naar de endotherme kant maar bij de tweede rede zou er een evenwicht moeten instellen toch? Als er meer effectieve botsingen tussen 2NO2 zal er meer N2O4 worden gevormd maar als er even later meer N2O4 is gevormd zal er door de effectieve botsingen weer meer 2NO2 worden gevormd. Een evenwicht dus.
Is het dan een evenwicht of ligt het evenwicht naar rechts?
Het is een lang verhaal ik weet het maar ik zou heel dankbaar zijn als iemand mij dit kleine probleempje zou willen uitleggen. Mijn docent is momenteel niet bereikbaar vandaar dat ik het aan jullie vraag.
bedankt alvast!
Maarten
De twee redenen die je hebt bedacht, zijn eigenlijk dezelfde. Alleen is de eerste simpelweg abstract en probeer je je bij de tweede reden een voorstelling van de eerste reden te maken.
De vorming van N2O4 is een exotherm proces, waardoor N2O4 op een lager energieniveau zit dan NO2. Om de omgekeerde weg te bewandelen moeten de moleculen eerst een "energieberg" over. Dankzij het verwarmen wordt die energie geleverd en splijt N2O4 in 2 NO2. Ik zelf denk dat repulsieve (afstotende) krachten tussen de stikstofatomen de belangrijkste oorzaak zijn dat N2O4 zich splitst, want beide zijn positief geladen. Maar misschien kan een botsing tussen twee moleculen N2O4 ook hetzelfde teweegbrengen. Ik weet zelf niet eens of er voldoende inzicht bestaat in de wetenschap om dit te verklaren.
Je aanname van een evenwichtsreactie is juist. De ligging van het evenwicht is natuurlijk afhankelijk van de omstandigheden (druk, temperatuur). Overigens zou ik zelf nooit over de 'endotherme kant' praten. De term 'endotherm' is van toepassing op de reactie die plaatsvindt, niet op de toestand waarin de moleculen zich bevinden na reactie. Zelf geef ik de voorkeur aan spreken van een 'gedissocieerde toestand' als NO2 bedoeld wordt.
Leuk hoe Maarten een abstracte gedachte op twee manieren zo verschillend van elkaar weet neer te zetten.
Energie is natuurlijk precies hetzelfde als bewegende deeltjes (golven)
Hee dankjewel man, ik snap het wat beter! De reactie kan dus eigenlijk niet lopen bij een lage temperatuur toch? Wat is dan precies de reden hiervoor? Als er een lage temperatuur is, heeft de reactie 2NO2(g) --> N2O4(g) de overhand. Waarom is dat dan? Heeft het te maken met het feit dat er nu minder effectieve botsingen tussen N2O4 plaatsvinden?quote:Op maandag 13 december 2010 23:07 schreef lyolyrc het volgende:
[..]
Hoi Maarten,
De twee redenen die je hebt bedacht, zijn eigenlijk dezelfde. Alleen is de eerste simpelweg abstract en probeer je je bij de tweede reden een voorstelling van de eerste reden te maken.
De vorming van N2O4 is een exotherm proces, waardoor N2O4 op een lager energieniveau zit dan NO2. Om de omgekeerde weg te bewandelen moeten de moleculen eerst een "energieberg" over. Dankzij het verwarmen wordt die energie geleverd en splijt N2O4 in 2 NO2. Ik zelf denk dat repulsieve (afstotende) krachten tussen de stikstofatomen de belangrijkste oorzaak zijn dat N2O4 zich splitst, want beide zijn positief geladen. Maar misschien kan een botsing tussen twee moleculen N2O4 ook hetzelfde teweegbrengen. Ik weet zelf niet eens of er voldoende inzicht bestaat in de wetenschap om dit te verklaren.
Je aanname van een evenwichtsreactie is juist. De ligging van het evenwicht is natuurlijk afhankelijk van de omstandigheden (druk, temperatuur). Overigens zou ik zelf nooit over de 'endotherme kant' praten. De term 'endotherm' is van toepassing op de reactie die plaatsvindt, niet op de toestand waarin de moleculen zich bevinden na reactie. Zelf geef ik de voorkeur aan spreken van een 'gedissocieerde toestand' als NO2 bedoeld wordt.
Is het trouwens ook zo dat de temperatuur nu wat toeneemt als deze reactie ( 2NO2(g) --> N2O4(g)) plaatsvindt? Dit is exotherme reactie waarbij energie in de omgeving opgaat toch?
bedankt dat je de moeite neemt om mij te helpen!
Maarten
nu je het zegt klinkt dat best logisch jaquote:Op dinsdag 14 december 2010 01:12 schreef horned_reaper het volgende:
Ik zat er inderdaad ook al vreemd naar te kijken ^^
Leuk hoe Maarten een abstracte gedachte op twee manieren zo verschillend van elkaar weet neer te zetten.
Energie is natuurlijk precies hetzelfde als bewegende deeltjes (golven)
Welke reactie bedoel je hier? Ik neem aan N2O4 -> 2 NO2. Zorg altijd dat je specifiek bent in wat je bedoelt; dat voorkomt misverstanden.quote:Op dinsdag 14 december 2010 09:44 schreef Maarten302 het volgende:
[..]
Hee dankjewel man, ik snap het wat beter! De reactie kan dus eigenlijk niet lopen bij een lage temperatuur toch?
In mijn vorige antwoord zei ik dat ik aanneem dat afstotende krachten verantwoordelijk zijn voor dissociatie van N2O4. Als je kijkt naar onderstaande molecuulstructuren (voor het gemak heb ik beide resonantiestructuren van N2O4 gegeven), dan zie je dat beide stikstofatomen positief geladen zijn.quote:Wat is dan precies de reden hiervoor? Als er een lage temperatuur is, heeft de reactie 2NO2(g) --> N2O4(g) de overhand. Waarom is dat dan? Heeft het te maken met het feit dat er nu minder effectieve botsingen tussen N2O4 plaatsvinden?

Beide stoten elkaar al af, waardoor de N-N-binding niet bijzonder sterk is. Door toevoeren van warmte ontstaan er hevigere trillingen in het molecuul. Logischerwijs breekt dan als eerste de zwakste van de bindingen, namelijk de N-N-binding.
De vorming van N2O4 is inderdaad exotherm, wat betekent dat er warmte vrijkomt. Volgens wikipedia: ΔH = -57 kJ/mol.quote:Is het trouwens ook zo dat de temperatuur nu wat toeneemt als deze reactie ( 2NO2(g) --> N2O4(g)) plaatsvindt? Dit is exotherme reactie waarbij energie in de omgeving opgaat toch?
bedankt dat je de moeite neemt om mij te helpen!
Maarten
Over deeltjes- en golfkarakter van elektronen ben ik maar niet begonnen. Ik neem van harte aan dat het zo is, maar het is voor mij nogal abstract. Ik ben geen natuurkundige.quote:Op dinsdag 14 december 2010 01:12 schreef horned_reaper het volgende:
Ik zat er inderdaad ook al vreemd naar te kijken ^^
Leuk hoe Maarten een abstracte gedachte op twee manieren zo verschillend van elkaar weet neer te zetten.
Energie is natuurlijk precies hetzelfde als bewegende deeltjes (golven)
Jij bent echt mijn held lyolyrc!! Ik zag net dat jij ook degene was die mijn eerdere probleempje over de aflopende- of evenwichtsreactie hebt opgelost. Ik ben je echt heel dankbaar, ga zo doorquote:Op dinsdag 14 december 2010 16:05 schreef lyolyrc het volgende:
[..]
Welke reactie bedoel je hier? Ik neem aan N2O4 -> 2 NO2. Zorg altijd dat je specifiek bent in wat je bedoelt; dat voorkomt misverstanden.
[..]
In mijn vorige antwoord zei ik dat ik aanneem dat afstotende krachten verantwoordelijk zijn voor dissociatie van N2O4. Als je kijkt naar onderstaande molecuulstructuren (voor het gemak heb ik beide resonantiestructuren van N2O4 gegeven), dan zie je dat beide stikstofatomen positief geladen zijn.
[ afbeelding ]
Beide stoten elkaar al af, waardoor de N-N-binding niet bijzonder sterk is. Door toevoeren van warmte ontstaan er hevigere trillingen in het molecuul. Logischerwijs breekt dan als eerste de zwakste van de bindingen, namelijk de N-N-binding.
[..]
De vorming van N2O4 is inderdaad exotherm, wat betekent dat er warmte vrijkomt. Volgens wikipedia: ΔH = -57 kJ/mol.
[..]
Over deeltjes- en golfkarakter van elektronen ben ik maar niet begonnen. Ik neem van harte aan dat het zo is, maar het is voor mij nogal abstract. Ik ben geen natuurkundige.
Welke is wit en welke bruin?
| 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 | Een galvanische cel is opgebouwd uit twee bekerglazen en een zoutbrug. In het linker bekerglas bevindt zich een 1,0 M NaCl-oplossing. In het rechter bekerglas bevindt zich een 1,0 M zilvernitraatoplossing. In beide oplossingen staat een elektrode van zilver. De zoutbrug bevat kaliumnitraat. Als de elektroden door een koperdraad met elkaar worden verbonden gaat er een stroom lopen. De elektrode die in de keukenzout-oplossing staat wordt daarbij bedekt met een laagje zilverchloride. a. Teken de opstelling. b. Leg uit wat de functie van de zoutbrug is. c. Geef de positieve en de negatieve pool aan, en leg uit hoe u tot die keuze komt. d. Geef de vergelijkingen van halfreacties die aan de polen in de bekerglazen plaatsvinden wanneer de cel stroom levert. e. Bereken de bronspanning. In de cel vindt transport plaats van elektronen en ionen. De media waardoor dit transport plaatsvindt zijn de stroomdraad, de oplossingen in de bekerglazen, de zoutbrug en de elektroden. f. Geef van elk van de geladen deeltjes Cl, Ag+, K+, NO3 en e aan hoe het transport verloopt en in welke richting. |
Ik snap alleen f niet helemaal. De situatie is als volgt:
Links - negatieve pool - reductor
Ag (s) + Cl- <> AgCl(s) + e-
Rechts - positieve pool - oxidator
Ag+ + e- <> Ag(s)
Nou snap ik niet hoe het transport van Cl- loopt. Het antwoordmodel zegt Cl- naar links in het linker bekerglas. Dit vind ik onlogisch.
Bij de oxidator worden Ag+ met de aangevoerde elektronen omgezet in Ag(s) dus Ag+ naar rechts in het rechter bekerglas.
Bij de reductor verwacht je het omgekeerde: Cl- wordt met Ag(s) omgezet in AgCl(s) waardoor elektronen vrijkomen. Dus Cl- gaat naar rechts... toch?
Waar klopt mijn redenering niet?
Volgens mij klopt je redenering wel. Bij de oxidatie van Ag ontstaat Ag+, wat vervolgens reageert met opgelost Cl- tot slecht oplosbaar AgCl. Er wordt dus Cl- uit de oplossing getrokken.quote:Op woensdag 15 december 2010 14:40 schreef Warren het volgende:
Kan iemand mij even met deze opgave helpen (alvast bedankt):
[ code verwijderd ]
Ik snap alleen f niet helemaal. De situatie is als volgt:
Links - negatieve pool - reductor
Ag (s) + Cl- <> AgCl(s) + e-
Rechts - positieve pool - oxidator
Ag+ + e- <> Ag(s)
Nou snap ik niet hoe het transport van Cl- loopt. Het antwoordmodel zegt Cl- naar links in het linker bekerglas. Dit vind ik onlogisch.
Bij de oxidator worden Ag+ met de aangevoerde elektronen omgezet in Ag(s) dus Ag+ naar rechts in het rechter bekerglas.
Bij de reductor verwacht je het omgekeerde: Cl- wordt met Ag(s) omgezet in AgCl(s) waardoor elektronen vrijkomen. Dus Cl- gaat naar rechts... toch?
Waar klopt mijn redenering niet?
Ik vind de omschrijvingen "naar links" en "naar rechts" nogal onduidelijk. Cl- gaat van de oplossing naar de elektrode.
Door de notatie krijg ik ook de indruk dat je de reacties als evenwichtsreacties beschouwt. Dat klopt niet. De vorming van slecht oplosbaar AgCl is de drijvende kracht die de reacties doet aflopen.
Maar hoe omschrijven ze het transport van NO3- dan in het antwoordmodel? Ook met "naar links" of iets dergelijks?quote:Op woensdag 15 december 2010 16:11 schreef Warren het volgende:
Bedankt. Het klopt zoals je zegt, het moeten aflopende reacties zijn en geen evenwichtsreacties. Mijn notatie was inderdaad fout. En vandaar zijn de "naar links/rechts" opmerkingen inderdaad raar, want Ag (s) + Cl- -> AgCl(s) + e- loopt af naar rechts (en niet zoals in het antwoordmodel staat: "naar links").
Die omschrijven ze zo:quote:Op woensdag 15 december 2010 16:19 schreef lyolyrc het volgende:
[..]
Maar hoe omschrijven ze het transport van NO3- dan in het antwoordmodel? Ook met "naar links" of iets dergelijks?
NO3- vanuit de zoutbrug naar het linkerbekerglas (vult daar de verdwenen Cl-
aan)
Omdat Cl- uit oplossing gaat, moet er inderdaad NO3- bijkomen vanuit de zoutbrug, om de verdwenen anionen aan te vullen. Maar in het rechterbekerglas ontstaat een overschot aan NO3- wat ook ergens heen moet. Dat gaat uiteraard de zoutbrug in. Het antwoordmodel is daar dus niet volledig.quote:Op woensdag 15 december 2010 16:20 schreef Warren het volgende:
[..]
Die omschrijven ze zo:
NO3- vanuit de zoutbrug naar het linkerbekerglas (vult daar de verdwenen Cl-
aan)
Deze zie ik niet helemaal. Een overschot in het rechter bekerglas aan NO3-? Ik dacht juist dat K+ naar het rechterbekerglas ging... ( om daar de verdwenen Ag+quote:Op woensdag 15 december 2010 16:26 schreef lyolyrc het volgende:
[..]
Maar in het rechterbekerglas ontstaat een overschot aan NO3- wat ook ergens heen moet.
aan te vullen)
Dom, ik heb mijn oogkleppen weer eens op.quote:Op woensdag 15 december 2010 16:47 schreef Warren het volgende:
[..]
Deze zie ik niet helemaal. Een overschot in het rechter bekerglas aan NO3-? Ik dacht juist dat K+ naar het rechterbekerglas ging... ( om daar de verdwenen Ag+
aan te vullen)
Ik maak hier uit op dat R0 een constante is. In het antwoord staat echter dat dat niet het geval is (Het is in de opgave de bedoeling de formule om te schrijven, om vanuit meetgegevens mu te bepalen.):quote:Volgens de theorie wordt het verband tussen de telsnelheid (in pulsen/s) van de gamma-straling en de aluminium dikte gegeven door
R=R0*exp(-mu*d)
waarbij R0 de telsnelheid is zonder aluminium en mu de lineaire verzwakkingcoëfficiënt.
Waarom is R0 hier geen constante?quote:Door de metingen logaritmisch uit te zetten (x-as , y-as ) krijgen we:
Ln(R)=-mu*d+ln(R0)
In feite moeten we R eerst delen door “1”met de eenheid s-1.
De helling van de rechte lijn is gelijk aan – lineaire verzwakkingcoëfficiënt (mu).
De lijn gaat niet door de oorsprong (is geen constante !!!!)
[ Bericht 0% gewijzigd door M.rak op 03-01-2011 16:20:22 ]
Het antwoord is waardeloos. Er wordt een (lnR-as, d-as) bedoeld ipv een (x-as,y-as), er staat niet wat een constante zou zijn, en waarom een constante door de oorsprong zou moeten gaan is me ook niet duidelijk.
Er geldt dat R0 = R(d=0). Als er verder niet bijstaat of R0 van de tijd oid afhangt, dan lijkt me dat R0 constant is.quote:Op maandag 3 januari 2011 15:55 schreef M.rak het volgende:
Ik heb een vraagje over de volgende tekst, uit een opgave:
[..]
Ik maak hier uit op dat R0 een constante is. In het antwoord staat echter dat dat niet het geval is (Het is in de opgave de bedoeling de formule om te schrijven, om vanuit meetgegevens mu te bepalen.):
Als je nu ln(R) uitzet tegen d, dan kun je R0 aflezen bij d=0. ln(R) is een rechte lijn, maar deze gaat natuurlijk niet door de oorsprong van je ln(R)-d diagram als R0 niet gelijk is aan 0.
Waarom zou dit impliceren dat R0 niet constant is?
Misschien begrijp ik de vraag niet, maar waarom hangt R0 van de tijd af?quote:Op maandag 3 januari 2011 16:06 schreef GlowMouse het volgende:
Voor een bepaalde bron op een bepaald tijdstip is hij wel constant. Hij verandert in de tijd uiteraard, omdat de bron vervalt.
Dat is eigenlijk precies mijn vraag, alles wijst er op dat het een constante is, maar er staat duidelijk 'is geen constante'.quote:Op maandag 3 januari 2011 16:13 schreef Haushofer het volgende:
[..]
Er geldt dat R0 = R(d=0). Als er verder niet bijstaat of R0 van de tijd oid afhangt, dan lijkt me dat R0 constant is.
Als je nu ln(R) uitzet tegen d, dan kun je R0 aflezen bij d=0. ln(R) is een rechte lijn, maar deze gaat natuurlijk niet door de oorsprong van je ln(R)-d diagram als R0 niet gelijk is aan 0.
Waarom zou dit impliceren dat R0 niet constant is?
Ik denk dat Glowmouse bedoelt dat de waarde van die constante niet helemaal constant is, alleen voor een tijd veel kleiner dan de halveringstijd. Als je de bron een jaar laat liggen, zal hij voor een deel vervallen zijn, en zal er dus een andere waarde voor R0 uitkomen (correct me if I'm wrong).quote:Op maandag 3 januari 2011 16:15 schreef Haushofer het volgende:
[..]
Misschien begrijp ik de vraag niet, maar waarom hangt R0 van de tijd af?
Zou dan zeggen dat het een typo isquote:Op maandag 3 januari 2011 16:25 schreef M.rak het volgende:
[..]
Dat is eigenlijk precies mijn vraag, alles wijst er op dat het een constante is, maar er staat duidelijk 'is geen constante'.
Ja, inderdaad, dat zag ik over het hoofd.quote:Ik denk dat Glowmouse bedoelt dat de waarde van die constante niet helemaal constant is, alleen voor een tijd veel kleiner dan de halveringstijd. Als je de bron een jaar laat liggen, zal hij voor een deel vervallen zijn, en zal er dus een andere waarde voor R0 uitkomen (correct me if I'm wrong).
je hebt in de statistiek dingen zoals correlatie... nou kan het zijn dat ik me vergis, maar bestaat er eigenlijk ook iets als correlatie tussen 2 verschillende functies/matrices? Dus dat je bijvoorbeeld een matrix A en matrix B hebt en dat je probeert te kijken in hoeverre mate deze overeenkomen, of liever nog een beschrijving kunt doen d.m.v. een soort van gaussian, met een mean en covariance en wellicht nog een parameter?
Een functie is geen grootheid die afhankelijk van het toeval een bepaalde waarde aanneemt, dus die kun je niet bestuderen in de kansrekening. Vectoren van toevalsvariabelen zijn wel heel gangbaar, en dan krijg je een covariantiematrix. Zoek daar maar eens opquote:Op maandag 10 januari 2011 21:38 schreef koffiegast het volgende:
Wellicht moet dit in het wiskunde topic, maar ik vroeg me zo af
je hebt in de statistiekkansrekening dingen zoals correlatie... nou kan het zijn dat ik me vergis, maar bestaat er eigenlijk ook iets als correlatie tussen 2 verschillende functies/matrices? Dus dat je bijvoorbeeld een matrix A en matrix B hebt en dat je probeert te kijken in hoeverre mate deze overeenkomen, of liever nog een beschrijving kunt doen d.m.v. een soort van gaussian, met een mean en covariance en wellicht nog een parameter?
Da's een goede vraagquote:Op maandag 10 januari 2011 21:49 schreef gaussie het volgende:
Kan iemand mij uitleggen wat het betekent als een electron zero angular momentum heeft? Volgens de quantum mechanica bezit de electron een duaal karakter; zowel deeltje als golf. Maar een golf moet toch over angular momentum beschikken? Waarschijnlijk begrijp ik de definitie van angular momentum niet goed. Alle hulp is welkom!
Zie ook deze thread op Physicsforums
-edit: dit ziet er zo bij een tweede kijk wel uit als een makkelijk antwoord, maar als je meer vragen hierover hebt, hoor ik het wel
[ Bericht 9% gewijzigd door Haushofer op 10-01-2011 22:55:12 ]
Mja covariantiematrix ken ik wel, maar ik vroeg me af of er ook zoiets was als een soort methode/geval/etc was die direct een relatie beschrijft tussen 2 verschillende matricesquote:Op maandag 10 januari 2011 21:55 schreef GlowMouse het volgende:
[..]
Een functie is geen grootheid die afhankelijk van het toeval een bepaalde waarde aanneemt, dus die kun je niet bestuderen in de kansrekening. Vectoren van toevalsvariabelen zijn wel heel gangbaar, en dan krijg je een covariantiematrix. Zoek daar maar eens op
Je kunt een matrix vectoriserenquote:Op maandag 10 januari 2011 23:11 schreef koffiegast het volgende:
[..]
Mja covariantiematrix ken ik wel, maar ik vroeg me af of er ook zoiets was als een soort methode/geval/etc was die direct een relatie beschrijft tussen 2 verschillende matrices
vraag 1 a
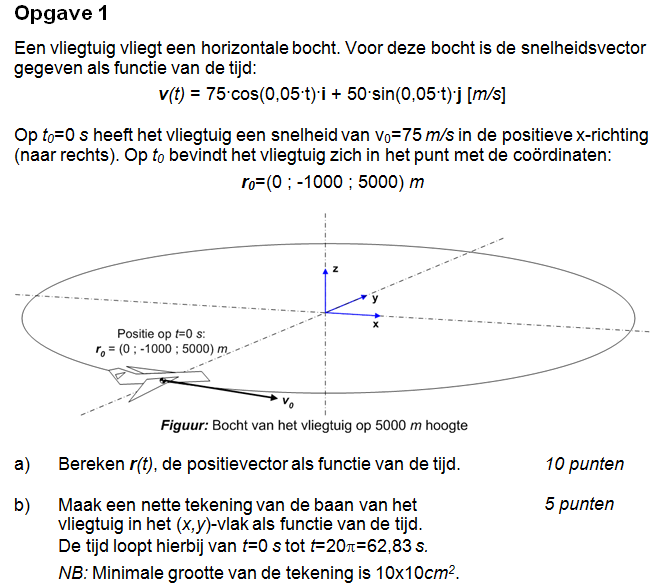
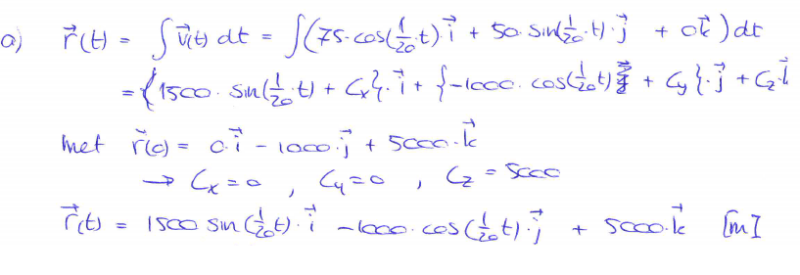
Waarom is Cy eigenlijk nul? (of Cj) x y z = i j k
Je wilt dat r(0) is zoals in het plaatje, en dat doe je door r(t) = r(0) + die integraal te pakken.
Bij toevoeren van warmte verschuift een evenwicht naar de endotherme kant. Dat is de kans met het grootste aantal deeltjes.
Dit vetgedrukte is mij niet duidelijk.
Stel we hebben:
N2 + O2 <> 2NO
De vorming van NO is endotherm. Dus bij een temperatuurstijging verschuift het evenwicht naar NO, maar waarom is deze kant de kant met het grootste aantal deeltjes??
Ik denk dat je het als volgt kunt verklaren: stel je hebt een molecuul A en een molecuul B die door zich met elkaar te verbinden het molecuul AB vormen. Tenzij A en B uitzonderlijk stabiele moleculen zijn, zal AB op een lager energieniveau zitten dan A en B, omdat er energie vrijkomt bij de vorming van de binding tussen A en B (ΔH < 0). Als het energieverschil klein is en de reactie niet totaal afloopt, zul je een evenwicht krijgen: A + B <-> AB.quote:Op woensdag 12 januari 2011 12:36 schreef Warren het volgende:
In mijn boek staat de volgende vuistregel:
Bij toevoeren van warmte verschuift een evenwicht naar de endotherme kant. Dat is de kanst met het grootste aantal deeltjes.
Dit vetgedrukte is mij niet duidelijk.
Stel we hebben:
N2 + O2 <> 2NO
De vorming van NO is endotherm. Dus bij een temperatuurstijging verschuift het evenwicht naar NO, maar waarom is deze kant de kant met het grootste aantal deeltjes??
Op het moment dat er warmte toegevoerd wordt, komt er energie beschikbaar om de binding in AB te breken en dus het verschil tussen de energieniveaus te overbruggen. Toevoeren van energie zorgt er dus voor dat het evenwicht verschuift naar de gedissocieerde kant, A en B.
Je hebt de totale versnelling die je bijv kan ontbinden in een tangentiale en normale versnelling.
Als de tangentiale snelheid nul is. Is de tangentiale versnelling dan per defenitie nul?
Ik heb nog een vraag:
Men lost 2,0 mol ammoniumchloride in water op tot 1,0 Liter.
Vraag: Hoeveel liter ammoniakgas van p=p0 en T= 298K moet men in deze oplossing inleiden om pH op 9,2 te brengen?
Ik heb een andere redenering en ik kom niet op het juiste anwtwoord.
NH4 + H2O --> NH3- + H3O+
Kz = [NH3-] [H3O+] / [NH4]
Kz = 5,6 x 10-10
Ik bereken eerst hoeveel H30+ er zit.
x2/2,0 = 5,6 x 10-10
x = h30+ = 4,73*10^-5.
De pH moet naar 9,2 dus de [H30+] moet omlaag van 4,73*10^-5 naar 6,31*10^-10... klopt dit? hoe kom ik er achter hoeveel ammoniak ik dan nodig heb??
Ik had de vraag iets anders opgevat, vandaar het antwoord dat ik heb gegeven. Door je af te vragen waarom er een endotherme kant kan zijn als er links en rechts evenveel deeltjes zijn, verwissel je regel en vuistregel. Dat bij warmte toevoeren het evenwicht naar de endotherme kant verschuift is een feit. Dat volgt immers uit de wetten van de thermodynamica. Dat er aan de endotherme kant meestal meer deeltjes staan, dat is de vuistregel.quote:Op vrijdag 14 januari 2011 13:09 schreef Warren het volgende:
Lyolyrc, bedankt.. ik doelde meer op waarom er een endotherme kant kan zijn terwijl het aantal deeltjes links en rechts gelijk is. Maar zoals Glowmouse zegt, biedt zo'n vuistregel dus niet altijd uitkomst.
Dit klopt niet. Ammonium is NH4+, niet NH4. Bij het afstaan van een proton (H+) onstaat er NH3, dat is ammoniak. NH3- bestaat niet eens, want dat zou betekenen dat het stikstofatoom 9 elektronen om zich heen heeft, wat in strijd is met de octetregel.quote:Ik heb nog een vraag:
Men lost 2,0 mol ammoniumchloride in water op tot 1,0 Liter.
Vraag: Hoeveel liter ammoniakgas van p=p0 en T= 298K moet men in deze oplossing inleiden om pH op 9,2 te brengen?
Ik heb een andere redenering en ik kom niet op het juiste anwtwoord.
NH4 + H2O --> NH3- + H3O+
Kz = [NH3-] [H3O+] / [NH4]
De juiste reactievergelijking wordt dus:
NH4+ + H2O <- -> NH3 + H3O+
Omdat NH4+ een zwakke base is, ligt het evenwicht niet totaal naar rechts. Verderop zal ik nog laten zien waar het evenwicht ligt.
De evenwichtsvoorwaarde wordt dan:
Kz = [NH3]*[H3O+] / [NH4+]
Je methode van berekenen klopt, maar de uitkomst niet. Je moet inderdaad stellen dat er x mol NH3 en ook x mol H3O+ is gevormd en dat er nog 2 - x mol NH4+ over is. Als we dan even aannemen dat x klein is (dat betekent dat het evenwicht sterk naar links ligt), dan heb je:quote:Kz = 5,6 x 10-10
Ik bereken eerst hoeveel H30+ er zit.
x2/2,0 = 5,6 x 10-10
x = h30+ = 4,73*10^-5.
x2/2,0 = 5,6 * 10-10
x = √(2,0 * 5,6 * 10-10) = 3,3 * 10-5
Hieruit volgt dat x inderdaad erg klein is, eigenlijk verwaarloosbaar klein. Ammonium dissocieert dus nagenoeg niet in water!
Nee. Uit de evenwichtsvoorwaarde volgt:quote:De pH moet naar 9,2 dus de [H30+] moet omlaag van 4,73*10^-5 naar 6,31*10^-10... klopt dit? hoe kom ik er achter hoeveel ammoniak ik dan nodig heb??
pKz = pH - log([NH3]/[NH4+])
pH - pKz = log([NH3]/[NH4+])
10(pH - pKz) = [NH3]/[NH4+]
Invullen van de gewenste pH (9,2) en pKz (-log(5,6 * 10-10)) geeft:
[NH3]/[NH4+] = 0,89
Met andere woorden, [NH3] moet 0,89 * 2,0 = 1,78 M worden. Het kleine beetje NH3 dat er gevormd wordt bij oplossen van de ammoniumchloride is uiteraard verwaarloosbaar.
Het molair volume is 24,5 dm3/mol onder gegeven omstandigheden. Dat betekent dat er 24,5 * 1,78 = 43,6 dm3 NH3 nodig is.
[ Bericht 0% gewijzigd door lyolyrc op 14-01-2011 17:45:44 ]
Het is nu veel helderder.
- Ik vond het ten eerste raar dat men voor [NH4+] 2,0 mol/L nam.. maar aangezien het een zwakke zuur is, is het wel logisch want maar een klein gedeelte gaat over in H30+ ionen.
- Ik vond het ook raar dat al het NH3 afkomstig zou zijn van het ammoniakgas, maar aangezien x verwaarloosbaar klein is, lijkt het nu wel logisch.
- In feite laat deze berekening (x2/2,0 = 5,6 * 10-10
x = (2,0 * 5,6 * 10-10) = 3,3 * 10-5) alleen zien dat x verwaarloosbaar klein is en met dit gegeven doe je niks voor het eindantwoord.
Maakt niet uit. De volgende die op iets dergelijks googlet, vindt dan ook deze uitleg waar het wel goed staat.quote:Op vrijdag 14 januari 2011 23:29 schreef Warren het volgende:
Bedankt voor deze uitleg. Ik heb als een kip zonder kop de reactievergelijking en evenwichtsvoorwaarde gekopieerd uit een andere topic waar iemand met hetzelfde probleem kwam.. maar ik heb niet opgemerkt dat die niet klopte. Excuses voor het bezorgen van extra werk.
Het ligt inderdaad aan de heel beperkte dissociatie. Als je de fractie die wel omzet naar NH3 er afhaalt, dan heb je 1,9999665 mol/l, wat we natuurlijk gewoon afronden op 2,0 M.quote:Het is nu veel helderder.
- Ik vond het ten eerste raar dat men voor [NH4+] 2,0 mol/L nam.. maar aangezien het een zwakke zuur is, is het wel logisch want maar een klein gedeelte gaat over in H30+ ionen.
Als x veel groter was geweest, had je die fractie uiteraard in mindering moeten brengen op de benodigde hoeveelheid NH3 (g).quote:- Ik vond het ook raar dat al het NH3 afkomstig zou zijn van het ammoniakgas, maar aangezien x verwaarloosbaar klein is, lijkt het nu wel logisch.
Deze berekening heb ik gedaan met de aanname dat x te verwaarlozen is. Als uit de berekening was gevolgd dat x een substantiële fractie was geweest van 2,0 M, dan had ik de berekening moeten herhalen met de abc-formule. En die fractie had ik dan ook verrekend met de 1,78 M NH3.quote:- In feite laat deze berekening (x2/2,0 = 5,6 * 10-10
x = (2,0 * 5,6 * 10-10) = 3,3 * 10-5) alleen zien dat x verwaarloosbaar klein is en met dit gegeven doe je niks voor het eindantwoord.
Ik heb nog een kort vraagje n.a.v. een vraag uit een Scheikunde 1,2 examen.
Om het even kort te houden: in de vraag komt deze zin voor:
"Bij het blok legering wordt het aluminium omgezet tot aluminiumhydroxide"
Nou moet je dus hiervan een halfreactie nemen. In het antw. model staat: Al + 3 OH- --> Al(OH)3 + 3e-. Maar deze komt in binas niet voor. In binas staat wel: Al + 4OH- --> Al(OH)4- + 3e-.
Hoe zit dit nu? Ik ben een beetje in de war... welke vergelijking klopt dan?
Beide reactievergelijkingen zijn op zich correct. Zie ook deze tabel in wikipedia bij -2.31 en -2.33 V. Maar aluminiumhydroxide is Al(OH)3. Al(OH)4- is een andere stof die tetrahydroxyaluminaat heet.quote:Op zondag 16 januari 2011 23:44 schreef Warren het volgende:
lyolyrc, je bent een held voor het helder uitleggen van de materie
Ik heb nog een kort vraagje n.a.v. een vraag uit een Scheikunde 1,2 examen.
Om het even kort te houden: in de vraag komt deze zin voor:
"Bij het blok legering wordt het aluminium omgezet tot aluminiumhydroxide"
Nou moet je dus hiervan een halfreactie nemen. In het antw. model staat: Al + 3 OH- --> Al(OH)3 + 3e-. Maar deze komt in binas niet voor. In binas staat wel: Al + 4OH- --> Al(OH)4- + 3e-.
Hoe zit dit nu? Ik ben een beetje in de war... welke vergelijking klopt dan?
Maar je moet voor een redoxreactie 2 halfreacties hebben. De eerste is gemakkelijk, namelijk de oxidatie van aluminium: Al (s) -> Al3+ + 3 e-
Omdat ik het gevoel had dat er nog wat nuttige en noodzakelijke extra informatie in het examen stond, heb ik het hele examen maar even opgezocht.
In het examen staat:
Deze halfreactie staat ook in Binas: O2 (g) + 2 H2O (l) + 4 e- -> 4 OH-quote:Bij het gaasje reageert zuurstof uit de lucht met water onder vorming van hydroxide-ionen.
Dan hoef je alleen nog maar de elektronen in balans te brengen door 4x de halfreactie van aluminium op te tellen bij 3x de halfreactie van zuurstof en water.
Al (s) -> Al3+ + 3 e- |4x|
O2 (g) + 2 H2O (l) + 4 e- -> 4 OH- |3x|
-------------------------------------------------------------------------------------- +
Je zou dan dit verwachten:
4 Al (s) + 3 O2 (g) + 6 H2O (l) -> 4 Al3+ + 12 OH-
Maar als je even een stukje terug bladert in Binas, staat er een tabel met de oplosbaarheid in water van verschillende zouten (bij mij tabel 45a). Je vindt dan dat aluminiumhydroxide slecht oplosbaar is. Met andere woorden hydroxide en aluminum vormen een neerslag, dus de totaalreactie wordt:
4 Al (s) + 3 O2 (g) + 6 H2O (l) -> 4 Al(OH)3 (s)
Eerst de algemenen formule daarna de formule voor een staaf. Eerst heb ik de horizontale staaf gedaan en daarna gewoon de verticale er bij opgeteld. Klopt dit wel?
Ik zie niet echt goed wat het precies is, is het een soort + profiel ofzo?quote:Op woensdag 19 januari 2011 14:35 schreef GoodGawd het volgende:
Ik was net bezig met het traagheidsmoment van het stelsel om as A van het stelsel van staven hieronder te bepalen. Ik heb er geen antwoorden bij, dus ik vroeg me af of ik deze wel goed heb aangepakt?
Eerst de algemenen formule daarna de formule voor een staaf. Eerst heb ik de horizontale staaf gedaan en daarna gewoon de verticale er bij opgeteld. Klopt dit wel?
[ afbeelding ]
in het boek staat de formule I (n) = I (0) × (1/2)n
I(n) = de intensiteit na n halveringsdiktes (in W/m²)
bij dikte x geldt x= n × d1/2 (met x en d1/2 in gelijke eenheden).
ik snap niet precies wat ik hiermee moet doen, wat ik waar in moet vullen?
kan iemand dit verduidelijken voor mij?
alvast bedankt
Ja het, zie het als een ijzeren constructie van een kruis, uit 1 stuk metaal.quote:Op vrijdag 21 januari 2011 14:25 schreef vaasinbloem het volgende:
[..]
Ik zie niet echt goed wat het precies is, is het een soort + profiel ofzo?Bij het elkaar optellen, heb je dan geen probleem met de overlapping?
Een kruis met een rotatiepunt aan de top toch? Die A? Als ik het even snel bekijk heb je gebruikt gemaakt van (en dan maal 2):quote:Op zondag 23 januari 2011 12:18 schreef GoodGawd het volgende:
[..]
Ja het, zie het als een ijzeren constructie van een kruis, uit 1 stuk metaal.

 ?
?http://homepages.which.ne(...)s/MOI/MOIproofs.html
Zo ja, dat is een formule als de rotatie in het middelpunt zit en niet aan de top.
Volgens mij moet je deze gebruiken:


Ik zou eerst het hele grid maken en telkens rekenen en dan telkens kleine stukjes eruit halen. De rotatiepunt moet hetzelfde blijven (boven 2).
1 2 3
4 5 6
7 8 9
Dus eerst 1-9, dan 258, 1-6, 1-3, 2.
2
5
8
1 2 3
4 5 6
1 2 3
2
Kan iemand dit bevestigen dat het klopt? En of het makkelijker kan, vind het nogal omslachtig namelijk. Is er niet op internet een kant en klare formule te vinden?
Ik neem aan dat het hier gaat over straling, die gedeeltelijk doorgelaten wordt door een materiaal? Dat materiaal heeft dan een halveringsdikte, een maat voor hoeveel straling er wordt doorgelaten. Als je straling door een materiaal stuurt, is de intensiteit van die straling na één halveringsdikte nog maar de helft van de oorspronkelijke intensiteit. Voor de intensiteit na n halveringsdiktes geldt dan je eerste formule. I (n) is die gezochte intensiteit, I(0) is de oorspronkelijke intensiteit, en bij n vul je het aantal halveringsdiktes dat je materiaal dik is in.quote:Op zondag 23 januari 2011 12:00 schreef snellehenk het volgende:
wie kan mij uitleggen, hoe de formule van de halveringsdikte precies werkt?
in het boek staat de formule I (n) = I (0) × (1/2)n
I(n) = de intensiteit na n halveringsdiktes (in W/m²)
bij dikte x geldt x= n × d1/2 (met x en d1/2 in gelijke eenheden).
ik snap niet precies wat ik hiermee moet doen, wat ik waar in moet vullen?
kan iemand dit verduidelijken voor mij?
alvast bedankt
De tweede formule geeft aan hoe je n kan berekenen, n=x/d1/2, met x de dikte van je materiaal, en d1/2 de halveringsdikte van je materiaal. Dat x en d1/2 gelijke eenheden moeten hebben betekent dat je niet de ene in meters mag zetten als de andere in centimeters staat, de eenheden moeten gelijk zijn.
Ik hoop dat het wat duidelijker is nu
Ja het ging idd over de straling, bedankt (Y)quote:Op zondag 23 januari 2011 15:38 schreef M.rak het volgende:
[..]
Ik neem aan dat het hier gaat over straling, die gedeeltelijk doorgelaten wordt door een materiaal? Dat materiaal heeft dan een halveringsdikte, een maat voor hoeveel straling er wordt doorgelaten. Als je straling door een materiaal stuurt, is de intensiteit van die straling na één halveringsdikte nog maar de helft van de oorspronkelijke intensiteit. Voor de intensiteit na n halveringsdiktes geldt dan je eerste formule. I (n) is die gezochte intensiteit, I(0) is de oorspronkelijke intensiteit, en bij n vul je het aantal halveringsdiktes dat je materiaal dik is in.
De tweede formule geeft aan hoe je n kan berekenen, n=x/d1/2, met x de dikte van je materiaal, en d1/2 de halveringsdikte van je materiaal. Dat x en d1/2 gelijke eenheden moeten hebben betekent dat je niet de ene in meters mag zetten als de andere in centimeters staat, de eenheden moeten gelijk zijn.
Ik hoop dat het wat duidelijker is nu.
Het begint al duidelijker te worden, maar zou je misschien nog iets duidelijker voor me kunnen maken, door een voorbeeld te geven?
alvast bedankt
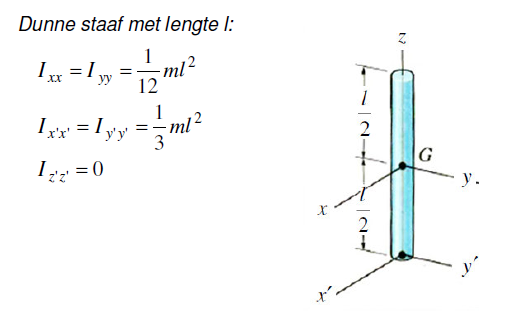
Ik denk dat je binnen de grenzen van deze formule moet blijven. Het zijn staven.
Oh, dacht dat ze vierkant warenquote:Op zondag 23 januari 2011 18:13 schreef GoodGawd het volgende:
[ afbeelding ]
Ik denk dat je binnen de grenzen van deze formule moet blijven. Het zijn staven.
Stel je hebt een loden plaat (zeg dat lood een halveringsdikte van 5 mm heeft) van 18 mm dikte. Hierdoor laat je straling vallen met een intensiteit van 500 W/m2.quote:Op zondag 23 januari 2011 18:11 schreef snellehenk het volgende:
[..]
Ja het ging idd over de straling, bedankt (Y)
Het begint al duidelijker te worden, maar zou je misschien nog iets duidelijker voor me kunnen maken, door een voorbeeld te geven?
alvast bedankt
Eerst bereken je dan n, met de formule n=x/d1/2=18/5=3.6.
Daarna vul je de overige gegevens in in de eerste formule:
I(n)=I(0)*(1/2)n=500*(1/2)3.6=41 W/m2.
dankjewelquote:Op zondag 23 januari 2011 18:54 schreef M.rak het volgende:
[..]
Stel je hebt een loden plaat (zeg dat lood een halveringsdikte van 5 mm heeft) van 18 mm dikte. Hierdoor laat je straling vallen met een intensiteit van 500 W/m2.
Eerst bereken je dan n, met de formule n=x/d1/2=18/5=3.6.
Daarna vul je de overige gegevens in in de eerste formule:
I(n)=I(0)*(1/2)n=500*(1/2)3.6=41 W/m2.
het is me nu duidelijk geworden
Gegeven f(x) = sqrt(x) / e^x
Gevraagd:
a bereken de gebieden waar f(x) dalend is en waar stijgend
b bereken de gebieden waar f(x) convex is en waar concaaf
Nu ben ik zelf wel al begonnen, maar ik hang vast
Bij f(x) = sqrt(x) / e^x krijg je een f'(x) van:
( e^x / 2*sqrt(x) - e^x * sqrt(x) ) / e ^2x
Tot zover klopt die volgens mij wel bij mij. Om het keerpunt van stijgen en dalen te berekenen wil ik het nulpunt berekenen. Dus:
( e^x / 2*sqrt(x) - e^x * sqrt(x) ) / e ^2x = 0
( e^x / 2*sqrt(x) - e^x * sqrt(x) ) = 0
e^x / 2*sqrt(x) = e^x * sqrt(x)
e^x = e^x * sqrt(x) * sqrt (x) * 2 = e^x * 2x
2x = 1
x = 0,5
Dus bij x = 0,5 is het keerpunt van stijgen en dalen, volgens de GR klopt dit ook.
Echter het convex en concaaf moet ik de kromming van de eerste functie gaan berekenen.
De f"(x) is voor mij een compleet raadsel. Nu heb de f'(x) weer gedifferentieerd, maar dit gaat niet helemaal goed. Verder vraag ik me af of die f'(x) niet vereenvoudigd kan worden.
Je antwoord op a is volgens mij correct. Ik heb als formule: (1-2x) / (2 * sqrt(x) * e^x)quote:Op dinsdag 25 januari 2011 16:25 schreef Adames het volgende:
Ik heb nog een vraag over wiskunde.
Gegeven f(x) = sqrt(x) / e^x
Gevraagd:
a bereken de gebieden waar f(x) dalend is en waar stijgend
b bereken de gebieden waar f(x) convex is en waar concaaf
Nu ben ik zelf wel al begonnen, maar ik hang vast
Bij f(x) = sqrt(x) / e^x krijg je een f'(x) van:
( e^x / 2*sqrt(x) - e^x * sqrt(x) ) / e ^2x
Tot zover klopt die volgens mij wel bij mij. Om het keerpunt van stijgen en dalen te berekenen wil ik het nulpunt berekenen. Dus:
( e^x / 2*sqrt(x) - e^x * sqrt(x) ) / e ^2x = 0
( e^x / 2*sqrt(x) - e^x * sqrt(x) ) = 0
e^x / 2*sqrt(x) = e^x * sqrt(x)
e^x = e^x * sqrt(x) * sqrt (x) * 2 = e^x * 2x
2x = 1
x = 0,5
Dus bij x = 0,5 is het keerpunt van stijgen en dalen, volgens de GR klopt dit ook.
Echter het convex en concaaf moet ik de kromming van de eerste functie gaan berekenen.
De f"(x) is voor mij een compleet raadsel. Nu heb de f'(x) weer gedifferentieerd, maar dit gaat niet helemaal goed. Verder vraag ik me af of die f'(x) niet vereenvoudigd kan worden.
Hier is wat eenvoudiger het nulpunt te bepalen vind ik. Of jij het verder handiger vindt weet ik niet
Na even wat te hebben gegeten zie ik wat je hebt gedaan, erg bedankt, daar kan ik verder mee.quote:Op dinsdag 25 januari 2011 17:56 schreef FedExpress het volgende:
[..]
Je antwoord op a is volgens mij correct. Ik heb als formule: (1-2x) / (2 * sqrt(x) * e^x)
Hier is wat eenvoudiger het nulpunt te bepalen vind ik. Of jij het verder handiger vindt weet ik niet
-edit: dan kom ik uit op een f '' (x) = (4x^2 - 4x +1)/(4*x*sqrt(x)*e^x)-
[ Bericht 5% gewijzigd door Adames op 25-01-2011 19:24:59 ]
Volgens de docente vulde ik het helemaal goed in, maar m'n rekenmachine weigert het goede antwoord te geven. Aangezien de docente een Texas gebruikt kon ze me ook niet verder helpen.
De opgave:
Op een bepaald wegvak, is het aantal passerende auto’s Poisson verdeeld met een gemiddelde intensiteit van 240 passerende auto’s per uur.
a. Bereken de kans dat gedurende een periode van één uur meer dan 275 auto’s passeren.
Goed, ik heb dus op de Casio het volgende gedaan:
STAT->DIST->POISN->Pcd
Data: variable
x: 275
u: 240
Als resultaat geeft hij p(x)=0
Dit klopt natuurlijk niet. Staat er iets fout in m'n instellingen ofzo? Hoe los ik dit op?
edit: Oja het uiteindelijke antwoord (1-p) moet 0,0123 zijn.
Je bent me net voor. Lijkt mij ook de meest logische optiequote:Op zondag 30 januari 2011 13:41 schreef GlowMouse het volgende:
Heb je niet per ongeluk de pdf ipv cdf?
Nopequote:Op zondag 30 januari 2011 13:41 schreef GlowMouse het volgende:
Heb je niet per ongeluk de pdf ipv cdf?
Iemand uit m'n klas had een ander soort casio waaruit wel het goeie resultaat kwam.
En iemand anders had dezelfde casio als ik en kreeg ook p(x)=0
formule is dus bv 234E X ( blabla / blabla )
Mij lijkt gewoon getal[EXP]getal. Dus bijvoorbeeld 2.34[EXP]5 als je 2.34 * 105 wilt hebben. Als dat niet werkt, kun je ook nog de 10x-toets gaan gebruiken.quote:Op dinsdag 1 februari 2011 15:25 schreef alors het volgende:
Weet iemand hoe de EXP functie werkt op een Casio fx-82? Ik krijg alleen maar Syntax error hoe ik het ook invoerEn hij zit in een formule die ik morgen nodig heb voor een tentamen....
formule is dus bv 234E X ( blabla / blabla )
Ik moet de reactievergelijking van de neutralisatie van verdund zwavelzuur met kaliloog geven.
Volgens het antwoordenboekje is dit het antwoord: Voor de reactie Reactievergelijking Na de reactie
H3O+ + OH- --> 2 H2O
Zelf had ik dit bedacht: H2SO4 + KOH --> SO42- + K+ + 2H2O
Kan iemand mij vertellen of dit ook goed is, zo nee waarom niet?
bedankt!!
ja maar getal met een komma erin, bv 345E1,06 trekt hij dan weer nietquote:Op dinsdag 1 februari 2011 16:05 schreef lyolyrc het volgende:
[..]
Mij lijkt gewoon getal[EXP]getal. Dus bijvoorbeeld 2.34[EXP]5 als je 2.34 * 105 wilt hebben. Als dat niet werkt, kun je ook nog de 10x-toets gaan gebruiken.
Je moet 345E6 doen.quote:Op dinsdag 1 februari 2011 16:33 schreef alors het volgende:
[..]
ja maar getal met een komma erin, bv 345E1,06 trekt hij dan weer nietEn met 10x krijg ik niet het goede antwoord... vage zooi hoor...
Dat kan toch niet? Ik kan toch niet zomaar een getal veranderen? 1.06 is geen 6. Bovendien klopt het antwoord dan nog niet.quote:
Maar je gebruikt EXP toch alleen als je iets "keer 10 tot de macht x" wil doen?quote:Op dinsdag 1 februari 2011 17:14 schreef alors het volgende:
[..]
Dat kan toch niet? Ik kan toch niet zomaar een getal veranderen? 1.06 is geen 6. Bovendien klopt het antwoord dan nog niet.
ja maar 10^6 is toch heel iets anders dan 10^1.06? Op mijn rekenmachine iig wel.quote:Op dinsdag 1 februari 2011 17:38 schreef xxiessiexx het volgende:
[..]
Maar je gebruikt EXP toch alleen als je iets "keer 10 tot de macht x" wil doen?
Kan iemand mij helpen met het opstellen van de reactie (zuur-base) van vast bariumcarbonaat en een overmaat verdund zwavelzuur? Wat ik zelf dacht was: BACO3 + 2H3O+ ---> BA2+ + 3H2O + CO2
Is dit correct?
Bedankt!
Maarten
Hmm klopt.quote:Op dinsdag 1 februari 2011 17:47 schreef alors het volgende:
[..]
ja maar 10^6 is toch heel iets anders dan 10^1.06? Op mijn rekenmachine iig wel.
Ik kan je vraag denk niet beantwoorden voor de rest. Opgave erbij zetten zou makkelijk zijn
Heb net even gekeken, mijn casio doet hetzelfde. 1.06 geeft een syntax error.quote:Op dinsdag 1 februari 2011 17:47 schreef alors het volgende:
[..]
ja maar 10^6 is toch heel iets anders dan 10^1.06? Op mijn rekenmachine iig wel.
Waarom? Zie onderstaande link
http://www.casio.com/supp(...)A9A9-98BB6FE26CFE#13
Jouw antwoord klopt niet helemaal. Verdund zwavelzuur is 2 H3O+ + SO42-. Kaliloog is een oplossing van kaliumhydroxide in water, dus: K+ + OH-.quote:Op dinsdag 1 februari 2011 16:33 schreef Maarten302 het volgende:
Kan iemand mij helpen?
Ik moet de reactievergelijking van de neutralisatie van verdund zwavelzuur met kaliloog geven.
Volgens het antwoordenboekje is dit het antwoord: Voor de reactie Reactievergelijking Na de reactie
H3O+ + OH- --> 2 H2O
Zelf had ik dit bedacht: H2SO4 + KOH --> SO42- + K+ + 2H2O
Kan iemand mij vertellen of dit ook goed is, zo nee waarom niet?
bedankt!!
De reactievergelijking wordt dan:
2 H3O+ + SO42- + K+ + OH- -> H3O+ + SO42- + K+ + 2 H2O-
Als je dan alles wegstreept wat niets doet in de reactie:
2 H3O+ + SO42- + K+ + OH- -> H3O+ + SO42- + K+ + 2 H2O-
dan krijg je:
H3O+ + OH- --> 2 H2O
Dit antwoord klopt!quote:Op dinsdag 1 februari 2011 17:52 schreef Maarten302 het volgende:
Beste Fokkers,
Kan iemand mij helpen met het opstellen van de reactie (zuur-base) van vast bariumcarbonaat en een overmaat verdund zwavelzuur? Wat ik zelf dacht was: BACO3 + 2H3O+ ---> BA2+ + 3H2O + CO2
Is dit correct?
Bedankt!
Maarten
Dankjewel voor je reactie, ik snap het!quote:Op woensdag 2 februari 2011 10:04 schreef lyolyrc het volgende:
[..]
Jouw antwoord klopt niet helemaal. Verdund zwavelzuur is 2 H3O+ + SO42-. Kaliloog is een oplossing van kaliumhydroxide in water, dus: K+ + OH-.
De reactievergelijking wordt dan:
2 H3O+ + SO42- + K+ + OH- -> H3O+ + SO42- + K+ + 2 H2O-
Als je dan alles wegstreept wat niets doet in de reactie:
2 H3O+ + SO42- + K+ + OH- -> H3O+ + SO42- + K+ + 2 H2O-
dan krijg je:
H3O+ + OH- --> 2 H2O
[..]
Dit antwoord klopt!
Ik heb alleen nog een klein vraagje:Ik heb het later aan mijn leraar gevraagd, en hij vertelde mij dat er nog een reactie plaatsvindt tussen bariumionen en de sulfaationen. Als dat zo is, is mijn antwoord fout toch?
Daar heb ik zelf ook even overheen gekeken, terwijl ik nog expres heb opgezocht of bariumcarbonaat oplosbaar was in water.quote:Op woensdag 2 februari 2011 12:56 schreef Maarten302 het volgende:
[..]
Dankjewel voor je reactie, ik snap het!
Ik heb alleen nog een klein vraagje:Ik heb het later aan mijn leraar gevraagd, en hij vertelde mij dat er nog een reactie plaatsvindt tussen bariumionen en de sulfaationen. Als dat zo is, is mijn antwoord fout toch?
Er vindt inderdaad een reactie plaats tussen barium en sulfaat. Je mag hem uiteraard eerst zelf proberen, antwoord staat in de spoiler.
SPOILERBaCO3 + 2 H3O+ + SO42- --> BaSO4 +3 H2O + CO2
Is er een wiskunde fanaat onder jullie die zich geroepen om alle mogelijkheden (= 5!) van volgorde met de getallen 1 2 3 4 5 even in een lijstje te zetten.
Dus bijvoorbeeld 12345, 23145, 31245,
Alvast bedankt,
Herlinde
en dat kan je zelf niet doen omdat?quote:Op zaterdag 5 februari 2011 18:28 schreef herlinde het volgende:
Hallo
Is er een wiskunde fanaat onder jullie die zich geroepen om alle mogelijkheden (= 5!) van volgorde met de getallen 1 2 3 4 5 even in een lijstje te zetten.
Dus bijvoorbeeld 12345, 23145, 31245,
Alvast bedankt,
Herlinde
Natuurlijk willen mensen hier wel 120 verschillende combinaties voor je uit schrijven. Als jij dan bij ze thuis de afwas doet een week langquote:Op zaterdag 5 februari 2011 18:28 schreef herlinde het volgende:
Hallo
Is er een wiskunde fanaat onder jullie die zich geroepen om alle mogelijkheden (= 5!) van volgorde met de getallen 1 2 3 4 5 even in een lijstje te zetten.
Dus bijvoorbeeld 12345, 23145, 31245,
Alvast bedankt,
Herlinde
Hiervoor heb je geen "wiskundefanaat" nodig heur
quote:Op zaterdag 5 februari 2011 18:28 schreef herlinde het volgende:
Hallo
Is er een wiskunde fanaat onder jullie die zich geroepen om alle mogelijkheden (= 5!) van volgorde met de getallen 1 2 3 4 5 even in een lijstje te zetten.
Dus bijvoorbeeld 12345, 23145, 31245,
Alvast bedankt,
Herlinde
[ Bericht 73% gewijzigd door Jac0bus op 19-02-2011 18:12:10 ]
anyway...
vraagje over scheikunde:
een weekmaker verlaagd het Tg (glaspunt) van een polymeer. maar verlaagd het dan ook het Tv? dit lijkt mij namelijk wel logisch, maar staat er in het boek niet bij.
Noem 3 dingen die als projectiel gebruikt werden voor een trebuchet en wat de bedoeling daarvan was (behalve steen)
en...
Beschrijf hoe er toen oorlog gevoerd werd en waarom de trebuchet daarbij zeer gevreesd was.
O.a. lijken om ziektes te verspreiden.quote:Op woensdag 23 februari 2011 16:52 schreef verwarmingsbank het volgende:
Weet iemand het antwoord hierop?
Noem 3 dingen die als projectiel gebruikt werden voor een trebuchet en wat de bedoeling daarvan was (behalve steen)
en...
Beschrijf hoe er toen oorlog gevoerd werd en waarom de trebuchet daarbij zeer gevreesd was.
Afijn:
zoals al gezegd, om lijken met ziektes af te schieten.
Het mechanisme is zeer vernuftig en kan van vrij ver worden gebruikt en is daarmee zeer destructief.
Verder lijkt met het een nogal moraalbrekend wapen. Niemand zal graag vooraan de linie willen staan en in formatie blijven willen staan als er een grote romp op je af komt.
Anders dan dat, geen id.
Jij weer?quote:Op woensdag 23 februari 2011 19:42 schreef Ser_Ciappelletto het volgende:
Ik zou niet teveel gaan antwoorden, volgens mij laat meneer ons zijn huiswerk maken. Hetzelfde is overigens ook in Gamma gepost.
De rede waarom ik het ook in Gamma heb gepost is omdat Koffiegast zei dat dit geen betahuiswerk is.
Rede dat ik het hier geplaatst had is omdat het voor het vak techniek is en omdat mij dat het beste bij beta leek passen.
Rest van mijn reactie mag je lezen in Gamma.
Ik heb een auto die trekt op en zijn achterwielen slippen. Gegeven heb je de statische en kinetische wrijvings coefficient van de wielen.
In de berekening van de krachten in X richting gebruiken ze dan alleen de kinetische wrijvings coefficient van de slippende wielen. Verder doen ze niks met die coefficenten.
Waarom komt die statische niet van pas?
De statische wrijvingscoëfficient wordt gebruikt als het object zich in rust bevindt als ik het mij goed herinner; de kinetische als het object in beweging is. (Als ik het mij nog beter herinner: statisch>kinetisch, er is meer kracht nodig om iets in beweging te brengen dan in beweging te houden)quote:Op donderdag 24 februari 2011 13:38 schreef GoodGawd het volgende:
Hoe zit het nu precies met statische en kinetische wrijvings coeficient?
Ik heb een auto die trekt op en zijn achterwielen slippen. Gegeven heb je de statische en kinetische wrijvings coefficient van de wielen.
In de berekening van de krachten in X richting gebruiken ze dan alleen de kinetische wrijvings coefficient van de slippende wielen. Verder doen ze niks met die coefficenten.
Waarom komt die statische niet van pas?
Dus als we met een stilstaande auto te maken hebben dan beginnen we met statische. Maar als het al rijdende is dan spreken we alleen nog over kinetische right?
Het is dus niet zo dat het dan statische plus kinetische is?
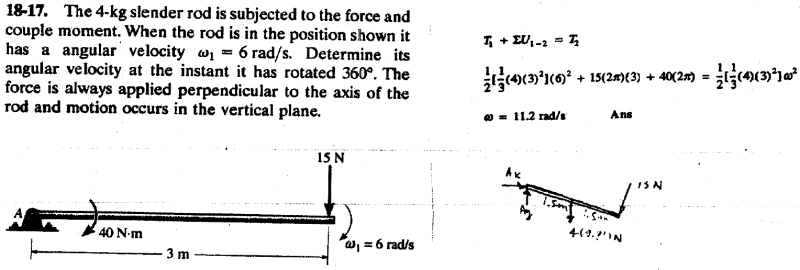
T staat voor 1/2 m v2
Waar komt die 1/3 4 32 vandaan?
Dat moet dus gelijk zijn aan de massa, maar hoe komen ze daarbij?
T staat voor 1/2 I(massatraagheidsmoment) v2 trouwens.
Ziehier:
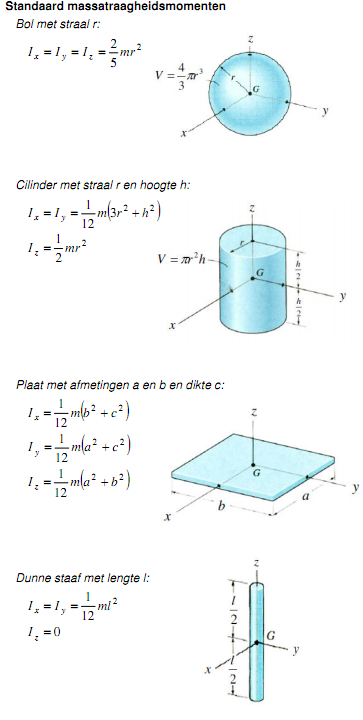
[ Bericht 24% gewijzigd door GoodGawd op 25-02-2011 17:18:54 ]
Voor een dunne staaf met lengte d geldt dan:
I = IG + m(d/2)2 = 1/12 md2 + m(d/2)2 = 1/12 md2 + 1/4 md2 = (1/12 + 1/4) md2 = 1/3md2
Zie ook deze tabel voor situatie h.
[ Bericht 0% gewijzigd door lyolyrc op 25-02-2011 23:57:03 ]

Het antwoord luidt:
Wat bedoelen ze met het vetgedrukte? C4 is toch een asymmetrische atoom waardoor je dus cis-D-, cis-L-, trans-D- en trans-L-4-chloor-2-penteen zou verwachten.quote:(1) Bij afsplitsing van één HCl-molecuul ontstaan 4-chloor-1-penteen,
en cis- en trans-4-chloor-2-penteen, waarbij de configuratie aan het asymmetrische C-atoom
niet verandert.
Mijn dank is groot.
Die dubbele binding van buteen kan toch aan de zijkant (1-) of op de middelste plek zitten (2-) ?quote:Op zondag 27 februari 2011 14:06 schreef GlowMouse het volgende:
Waarom heet die eerste stof 3-chloor-1-buteen in plaats van 3-chloorbuteen?
Ok, maar wat ik niet snap is dat bij vraag a gevraagd wordt:quote:Op zondag 27 februari 2011 14:26 schreef kevintjuhh2 het volgende:
zoek het begrip van configuratie is op;) bovendien, dubbele bindingen maken een molecuul minder beweeglijk...
En bij vraag e heb je dezelfde stof..quote:Er zijn vier stereo-isomeren met de systematische naam: 4-chloor-2-penteen.
a. Leg uit waardoor er vier isomeren zijn.
Er is een dubbele binding die cis-trans isomerie veroorzaakt en er is een asymmetrisch Catoom
(C4).
b. Hoe worden in de naamgeving deze isomeren van elkaar onderscheiden ?
De vier isomeren zijn dus cis-D-, cis-L-, trans-D- en trans-L-4-chloor-2-penteen.
[ Bericht 5% gewijzigd door Warren op 27-02-2011 14:46:49 ]
Vervolgens voeg ik AgNO3 - kristallen erbij, wat is de reactie die dan ontstaat?
Ik dacht iets met redox, maar kom er niet uit
neerslag?quote:Op zondag 27 februari 2011 17:56 schreef marsPlanets het volgende:
Ik heb een oplossing van FeCl en een oplossing van KSCN, die voeg ik bij elkaar en er ontstaat een nieuw mengsel.
Vervolgens voeg ik AgNO3 - kristallen erbij, wat is de reactie die dan ontstaat?
Ik dacht iets met redox, maar kom er niet uit
Jouw analyse klopt gewoon, aangenomen dat zowel de L- als D-configuratie aanwezig is. De opgave vertelt echter niet welke isomeren van 2,4-dichloorpentaan aanwezig zijn en daarom is het antwoord van de opgave ook niet zo specifiek. Overigens zou ik zelf liever R- en S-nomenclatuur gebruiken, omdat daarmee de absolute configuratie wordt vastgelegd.quote:Op zondag 27 februari 2011 14:38 schreef Warren het volgende:
[..]
Ok, maar wat ik niet snap is dat bij vraag a gevraagd wordt:
[..]
En bij vraag e heb je dezelfde stof..
Ben benieuwd waar jij FeCl vandaan wil gaan halen.quote:Op zondag 27 februari 2011 17:56 schreef marsPlanets het volgende:
Ik heb een oplossing van FeCl en een oplossing van KSCN, die voeg ik bij elkaar en er ontstaat een nieuw mengsel.
Vervolgens voeg ik AgNO3 - kristallen erbij, wat is de reactie die dan ontstaat?
Ik dacht iets met redox, maar kom er niet uit
En dat is inderdaad het antwoord. En welk neerslag? Hint: fotografie.quote:
Bedankt! Maar weet jij misschien wat ze bedoelen met het vetgedruktequote:Op maandag 28 februari 2011 15:18 schreef lyolyrc het volgende:
[..]
Jouw analyse klopt gewoon, aangenomen dat zowel de L- als D-configuratie aanwezig is. De opgave vertelt echter niet welke isomeren van 2,4-dichloorpentaan aanwezig zijn en daarom is het antwoord van de opgave ook niet zo specifiek. Overigens zou ik zelf liever R- en S-nomenclatuur gebruiken, omdat daarmee de absolute configuratie wordt vastgelegd.
(1) Bij afsplitsing van één HCl-molecuul ontstaan 4-chloor-1-penteen,
en cis- en trans-4-chloor-2-penteen, waarbij de configuratie aan het asymmetrische C-atoom
niet verandert.
Bedoelen ze hiermee te zeggen dat die L-en D-configuraties er niet in aanwezig zijn?
Blijkbaar was mijn eerste uitleg nog niet duidelijk genoeg, dus dan probeer ik het nog een keer. In 2,4-dichloorpentaan zijn twee stereocentra aanwezig. Na afsplitsen van een molecuul HCl wordt er een dubbele binding gevormd (cis of trans) en blijft er nog één stereocentrum over. Dat stereocentrum heeft of de R- of de S-configuratie. Die configuratie van het overgebleven stereocentrum is hetzelfde als voor afsplitsing van HCl.quote:Op dinsdag 1 maart 2011 12:33 schreef Warren het volgende:
[..]
Bedankt! Maar weet jij misschien wat ze bedoelen met het vetgedrukte
(1) Bij afsplitsing van één HCl-molecuul ontstaan 4-chloor-1-penteen,
en cis- en trans-4-chloor-2-penteen, waarbij de configuratie aan het asymmetrische C-atoom
niet verandert.
Bedoelen ze hiermee te zeggen dat die L-en D-configuraties er niet in aanwezig zijn?
Zoals ik al zei: L en D zou ik hier niet gebruiken, omdat dat meer gebruikelijk is bij biologische moleculen, terwijl R en S de absolute configuratie vastlegt.
Even een voorbeeld met een plaatje: stel je hebt 2S,4R-dichloorpentaan en HCl splitst zich af bij het 2e koolstofatoom. Het 4e koolstofatoom heeft voor afsplitsing de R-configuratie en zal dat na HCl-afsplitsing ook hebben. Links staat het isomeer van 1-penteen en rechts de isomeren van 2-penteen. De configuratie van het vierde koolstofatoom is bij dichloorpentaan al R, bij alle producten blijft dat R. Was die configuratie S geweest, dan was dat ook S gebleven na afsplitsing van HCl bij het tweede koolstofatoom. Dat is wat er bedoeld wordt met de dikgedrukte zin.

Je lost 0,84 g NaHCO3 op in 1,0 L water.
Daarbij voeg je een oplossing van 1 L met 1,06g Na2CO3.
Daarbij voeg je 250mL 0,10 M HNO3-oplossing toe.
Bereken de pH.
De eerste 2 vormen dus een buffer. De H3O+ van HNO3 ( sterk zuur ) reageert met CO3 uit de 1e oplossing, er is echter een overmaat aan H3O+ waardoor al het CO3 opreageert, hoe word de bufferformule dan??
Kz = [H3O+] * 0 / [HCO3]
Dit kan niet want de onbekende, H3O+ valt dan weg omdat je met 0 vermenigvuldigt. Hoe werkt dit?
Om te beginnen is het handig om eerst eens te berekenen hoeveel mol van elke stof aanwezig is:quote:Op dinsdag 8 maart 2011 11:10 schreef Dae1337 het volgende:
Ik heb dringend hulp nodig met deze buffer vraag!
Je lost 0,84 g NaHCO3 op in 1,0 L water.
Daarbij voeg je een oplossing van 1 L met 1,06g Na2CO3.
Daarbij voeg je 250mL 0,10 M HNO3-oplossing toe.
Bereken de pH.
De eerste 2 vormen dus een buffer. De H3O+ van HNO3 ( sterk zuur ) reageert met CO3 uit de 1e oplossing, er is echter een overmaat aan H3O+ waardoor al het CO3 opreageert, hoe word de bufferformule dan??
Kz = [H3O+] * 0 / [HCO3]
Dit kan niet want de onbekende, H3O+ valt dan weg omdat je met 0 vermenigvuldigt. Hoe werkt dit?
NaHCO3: 0,84/84,01 = 0,010 mol = 10 mmol
Na2CO3: 1,06/105,99 = 0,010 mol = 10 mmol
HNO3: 0,10*0,250 = 0,025 mol = 25 mmol
Als je het zuur bij de buffer gooit, gaan er twee reacties optreden. In eerste instantie wordt het carbonaat een keer geprotoneerd, zodat bicarbonaat wordt gevormd:
CO32- + H3O+ -> HCO3-
Er is echter slechts 10 mmol carbonaat, wat reageert met 10 mmol zuur, waardoor er nog 15 mmol zuur overblijft. Het restant van het zuur gaat reageren met bicarbonaat, wat leidt tot de vorming van koolzuur. Deze stof splitst zich weer in koolstofdioxide dat uit de oplossing bubbelt en water:
HCO3- + H3O+ -> H2CO3 -> H2O + CO2
Omdat er in totaal 20 mmol bicarbonaat is en 15 mmol zuur, zal er nog 5 mmol bicarbonaat overblijven dat een evenwicht instelt met het water:
HCO3- + H2O <-> CO32- + H3O+
Hierbij hoort de evenwichtsconstante: Ka = [H3O+][CO32-]/[HCO3-]
Laten we stellen dat van de 5 mmol HCO3- er x mmol wordt gedeprotoneerd, wat x mmol CO32- en x mmol H3O+ geeft.
Substitueer deze getallen in de evenwichtsvoorwaarde:
Ka = (x/2,25)(x/2,25)/((5*10-3 - x)/2,25)
Dit geeft de vergelijking: x2 + 2,25*Ka*x - 2,25*5*10-3*Ka = 0
Oplossen geeft x = 7,26*10-7
pH = -log([H3O+]) = -log(7,26*10-7/2,25) = 6,49
Je kunt deze waarde eventueel nog controleren met de Henderson-Hasselbalchvergelijking.
Jij bent mijn held! Duizendmaal dank! Mijn leraar geeft echter een ander antwoord, nl. pH = 5,87. Leraren zijn echter ook mensen die foutjes kunnen maken.quote:Op dinsdag 8 maart 2011 15:22 schreef lyolyrc het volgende:
[..]
Om te beginnen is het handig om eerst eens te berekenen hoeveel mol van elke stof aanwezig is:
NaHCO3: 0,84/84,01 = 0,010 mol = 10 mmol
Na2CO3: 1,06/105,99 = 0,010 mol = 10 mmol
HNO3: 0,10*0,250 = 0,025 mol = 25 mmol
Als je het zuur bij de buffer gooit, gaan er twee reacties optreden. In eerste instantie wordt het carbonaat een keer geprotoneerd, zodat bicarbonaat wordt gevormd:
CO32- + H3O+ -> HCO3-
Er is echter slechts 10 mmol carbonaat, wat reageert met 10 mmol zuur, waardoor er nog 15 mmol zuur overblijft. Het restant van het zuur gaat reageren met bicarbonaat, wat leidt tot de vorming van koolzuur. Deze stof splitst zich weer in koolstofdioxide dat uit de oplossing bubbelt en water:
HCO3- + H3O+ -> H2CO3 -> H2O + CO2
Omdat er in totaal 20 mmol bicarbonaat is en 15 mmol zuur, zal er nog 5 mmol bicarbonaat overblijven dat een evenwicht instelt met het water:
HCO3- + H2O <-> CO32- + H3O+
Hierbij hoort de evenwichtsconstante: Ka = [H3O+][CO32-]/[HCO3-]
Laten we stellen dat van de 5 mmol HCO3- er x mmol wordt gedeprotoneerd, wat x mmol CO32- en x mmol H3O+ geeft.
Substitueer deze getallen in de evenwichtsvoorwaarde:
Ka = (x/2,25)(x/2,25)/((5*10-3 - x)/2,25)
Dit geeft de vergelijking: x2 + 2,25*Ka*x - 2,25*5*10-3*Ka = 0
Oplossen geeft x = 7,26*10-7
pH = -log([H3O+]) = -log(7,26*10-7/2,25) = 6,49
Je kunt deze waarde eventueel nog controleren met de Henderson-Hasselbalchvergelijking.
Bedankt nogmaals
quote:De pH in de dikke darm varieert van 7,5 tot 8,0. Daarom komen in de dikke darm
vrijwel geen carbonzuren voor maar vooral de zuurresten van carbonzuren.
Daarom staan in dit schema niet de namen van de carbonzuren, maar de namen
van de zuurresten pyruvaat, lactaat, acetaat, butanoaat en propanoaat.
Bereken hoe groot de molverhouding propanoaat : propaanzuur in de dikke darm
tenminste is. Maak gebruik van Binas-tabel 49.

Geen moeilijke vraag, alleen in het antwoord gebruiken ze de pH van 7,5. Aangezien de pH varieert tussen 7,5 en 8,0, zou ik de pH van 7,75 nemen. Is dat fout?
Alvast bedankt.
Het antwoord op deze vraag is meer tekstverklaren dan bètawetenschapquote:Op vrijdag 11 maart 2011 12:49 schreef Warren het volgende:
[..]
[ afbeelding ]
Geen moeilijke vraag, alleen in het antwoord gebruiken ze de pH van 7,5. Aangezien de pH varieert tussen 7,5 en 8,0, zou ik de pH van 7,75 nemen. Is dat fout?
Alvast bedankt.
Let op het woordje 'tenminste'. Aangezien bij lagere pH meer zuur en minder zuurrest aanwezig is, zal de verhouding tussen zuurrest en zuur bij pH 7,5 het kleinst zijn. En omdat je de minimale verhouding tussen die twee moet bepalen, moet je rekenen met de laagste pH.quote:Bereken hoe groot de molverhouding propanoaat : propaanzuur in de dikke darm
tenminste is.
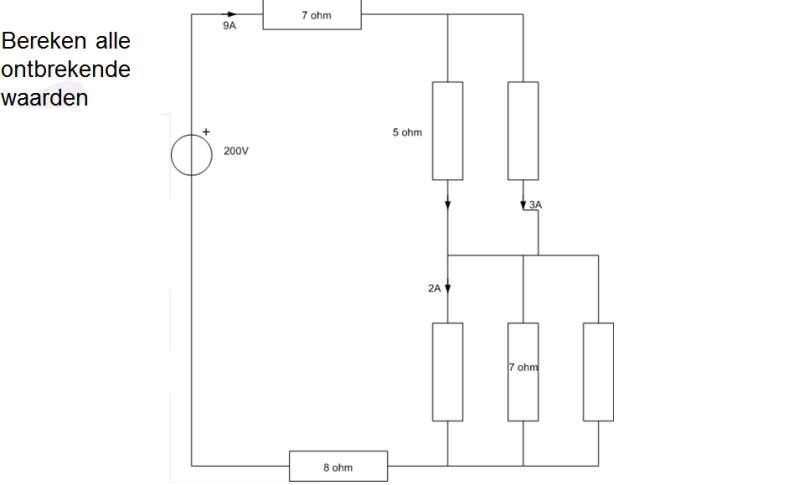
De eerste 2 weerstanden zijn 5 en 10 met 6 e 3 ampere denk ik. Maar hoe pak ik die 3 andere weerstanden aan?
Correct?
Spanning over de 3 weerstanden is 35V.
vlnr. 17,5 ohm, 7 ohm, 17,5 ohm
vlnr. 2 A, 5 A, 2 A
Klopt allemaalquote:Op woensdag 16 maart 2011 15:11 schreef GoodGawd het volgende:
Spanning over 8Ohm weerstand 72V.
Spanning over de 3 weerstanden is 35V.
vlnr. 17,5 ohm, 7 ohm, 17,5 ohm
vlnr. 2 A, 5 A, 2 A

Ik kreeg er zelf twee tegenstrijdige antwoorden uit:quote:Wordt de pH van de oplossing hoger, of lager wanneer een half kopje bakpoeder
in plaats van een kwart kopje wordt gebruikt, of krijg je een oplossing met
dezelfde pH (298 K)? Geef een verklaring voor je antwoord.
- Aan de ene kant dacht ik dat de pH hetzelfde zou zijn aangezien de Kb, Kz, en Kw niet veranderen als je meer bakpoeder toevoegt. Ook zie je nergens in de formule dat de [H3O+] afhankelijk is van de hoeveelheid bakpoeder.
- Aan de andere kant dacht ik dat de pH hoger zou worden omdat HCO3- met water als base reageert omdat het een amfolyt is en Kb>Kz. Als je meer HCO3- toevoegt, heb je meer OH- ionen en dus een hogere pH, want het evenwicht ligt meer rechts bij HCO3- + H2O <> H2CO3 + OH-
Het antwoordenmodel zegt:
Waarom is het ene antwoord "correcter" dan het andere? (Hoe is de tegenstrijdigheid te verklaren?)quote:Voorbeelden van een juist antwoord zijn:
− Volgens de gegeven formule is de [H3O+] niet afhankelijk van de
hoeveelheid bakpoeder die wordt opgelost, dus krijg je een oplossing
met dezelfde pH wanneer de dubbele hoeveelheid bakpoeder wordt
gebruikt. 2 punten
of
− Kw, Kz en Kb zijn constanten (bij 298 K), dus krijg je een oplossing met
dezelfde pH wanneer de dubbele hoeveelheid bakpoeder wordt
gebruikt. 2 punten
Indien een antwoord is gegeven als: „Natriumwaterstofcarbonaat is
(overwegend) een base, dus als je meer oplost per liter wordt de pH hoger.”
1 punt
Alvast bedankt.
Ik moest een experiment doen, waarbij ik 3 stoffen moest mensen: Natriumthiosulfaatoplossing (Na2S2O3), gedestilleerd water en waterstofchlorideoplossing (zoutzuur, HCl).
Ik heb 5 metingen gedaan, de hoeveelheden van elke vloeistof in mL:
Meting 1 2 3 4 5
Na2S2O3 10 15 20 25 30
gedes. water 35 30 25 20 15
zoutzuur 5 5 5 5 5
Nu moet ik bij elke meting de [S2O3²-] bepalen. Maar ik heb geen idee hoe?
Ook moet ik nog een paar vragen beantwoorden over medicijnen, met massa% en oplossen van jood etc. kan iemand me hierbij helpen?
alvast bedankt!
hmm, die eerste:quote:Op zondag 20 maart 2011 15:26 schreef hussyfan11 het volgende:
oke, ik moet een paar vragen doen waar ik niks van snap, hopelijk kunnen jullie helpen.
Ik moest een experiment doen, waarbij ik 3 stoffen moest mensen: Natriumthiosulfaatoplossing (Na2S2O3), gedestilleerd water en waterstofchlorideoplossing (zoutzuur, HCl).
Ik heb 5 metingen gedaan, de hoeveelheden van elke vloeistof in mL:
Meting 1 2 3 4 5
Na2S2O3 10 15 20 25 30
gedes. water 35 30 25 20 15
zoutzuur 5 5 5 5 5
Nu moet ik bij elke meting de [S2O3²-] bepalen. Maar ik heb geen idee hoe?
Ook moet ik nog een paar vragen beantwoorden over medicijnen, met massa% en oplossen van jood etc. kan iemand me hierbij helpen?
alvast bedankt!
werk eerst de reactievergelijkingen uit, gebruik binas tabel 48,
je hebt aanwezig:
S203 2-, H2O, H +, CL-
kijk naar sterkste oxidator en reductor... (cl en s2o3) en schrijf halfvergelijkingen en totaalvergelijking op
dan kijk hoeveel ml je toevoegd van alles, en reken dit om naar mol. (je weet molair?)
vergelijk molverhoudingen in de reactievergelijkingen en klaar is kees:D
Bedankt! Maar ik weet niet hoe ik omreken van ml naar mol?quote:Op zondag 20 maart 2011 17:30 schreef kevintjuhh2 het volgende:
[..]
hmm, die eerste:
werk eerst de reactievergelijkingen uit, gebruik binas tabel 48,
je hebt aanwezig:
S203 2-, H2O, H +, CL-
kijk naar sterkste oxidator en reductor... (cl en s2o3) en schrijf halfvergelijkingen en totaalvergelijking op
dan kijk hoeveel ml je toevoegd van alles, en reken dit om naar mol. (je weet molair?)
vergelijk molverhoudingen in de reactievergelijkingen en klaar is kees:D
heb jij 5 ml dan heb je 5 milli mol (of 5 * 10^-3 * 1 mol) snap je?
ah bedankt!quote:Op zondag 20 maart 2011 18:48 schreef kevintjuhh2 het volgende:
nou je hebt wss de molariteit van de gebruikte oplossingen gekregen (of je hebt de oplossingen zelf gemaakt), bijv 1.0 M (molair) wat beteken 1 mol per liter...
heb jij 5 ml dan heb je 5 milli mol (of 5 * 10^-3 * 1 mol) snap je?
edit: ik kom er toch niet helemaal uit, kun je misschien eentje voor doen?
[ Bericht 13% gewijzigd door hussyfan11 op 20-03-2011 20:36:27 ]
ik los 20 gram jood op in 150 ml water, bereken de concentratie I-, (ga er hierbij vanuit dat het volume door het oplossen van jood niet veranderd)
20 gram jood = 20 / molaire massa jood (I2 let op 2x) = 20 / ( 2*126,9)
echter opgelost levert dit weer I- (aq) is dus weer 2x zoveel molair als I2 (s)...
dus in de oplossing krijg je uiteindelijk 20 / 126.9 = 0.158 mol I- = 1.58 * 10^-1 mol
dit zit in 150 ml. maar molair (of concentratie) is per liter. dus je doet aantal mol / aantal liter --> 1.58 * 10^-1 / 0.150 = 1.05 mol per liter...
ik snap het nu bijna, alleen weet ik niet hoe ik dit bereken met de gegevens die ik heb.quote:Op zondag 20 maart 2011 21:17 schreef kevintjuhh2 het volgende:
hmm, ik zal dan een iets andere pakken, dan snap je het miss eerder:P
ik los 20 gram jood op in 150 ml water, bereken de concentratie I-, (ga er hierbij vanuit dat het volume door het oplossen van jood niet veranderd)
20 gram jood = 20 / molaire massa jood (I2 let op 2x) = 20 / ( 2*126,9)
echter opgelost levert dit weer I- (aq) is dus weer 2x zoveel molair als I2 (s)...
dus in de oplossing krijg je uiteindelijk 20 / 126.9 = 0.158 mol I- = 1.58 * 10^-1 mol
dit zit in 150 ml. maar molair (of concentratie) is per liter. dus je doet aantal mol / aantal liter --> 1.58 * 10^-1 / 0.150 = 1.05 mol per liter...
Ik heb dus een mengsel van gedestilleerd water, zoutzuur en natriumthiosulfaatoplossing waarvan ik alleen weet hoeveel ml ik van elke stof heb, geen massa, en nu moet ik de concentratie S2O3 berekenen. ;p
weet iemand wanneer je bij levensverzekeringswiskunde bij een kleine 'a' een streepje zet?
Ik dacht bij het berekenen van pensioen gerelateerde dingen.. Maar in de uitwerkingen blijkt dat niet zo te zijn. Weet iemand dit??

Toen was de conclusie:
4 kopen en dan als volg schakelen:
2serie
-
2serie
En deze 2 in serie weer parallel. Maar nu kwam ik dit weer tegen en dacht hoe kan dat?
Want 12V/100A in serie daar komt toch uit: 24V/100A...
Of zie ik dit verkeerd omdat dit spannings bronnen zijn dus tel je stroom bijelkaar op.
Je moet inderdaad 4 stukken van [2 in serie] in parallel hebben.
Staat er ook een getal bij?quote:Op zondag 20 maart 2011 22:41 schreef Mekkalomp het volgende:
geen idee of ik het in t goede topic plaats...
weet iemand wanneer je bij levensverzekeringswiskunde bij een kleine 'a' een streepje zet?
Ik dacht bij het berekenen van pensioen gerelateerde dingen.. Maar in de uitwerkingen blijkt dat niet zo te zijn. Weet iemand dit??
Ik heb inmiddels mijn tentamen gehadquote:taat er ook een getal bij?
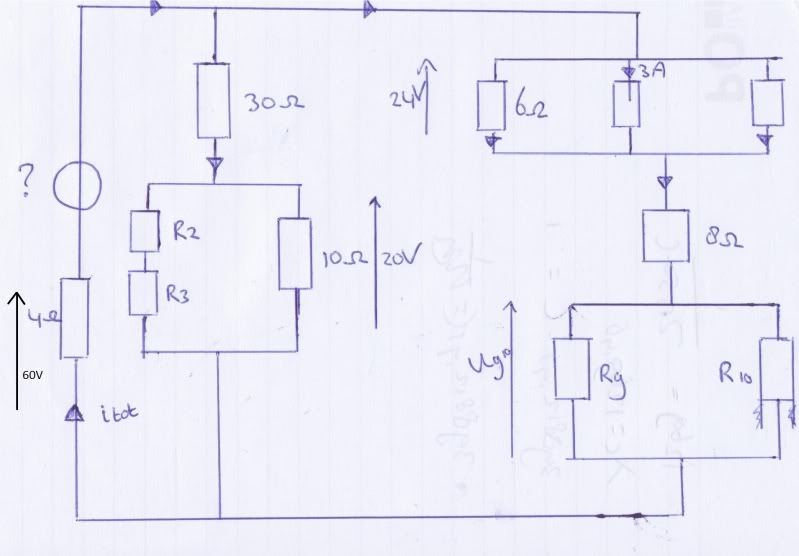
Zie hierboven een sommetje dat gegeven werd in 't college. Dit gaf hij zo op. Vervolgens heeft hij alles uitgewerkt. Ik heb dus alle waarde en antwoorden en hoe hij dingen oplost mbv subsitutie. Bij onder andere R9/R10 en R2/R3.
Nu heb ik dus dit, das heel simpel:
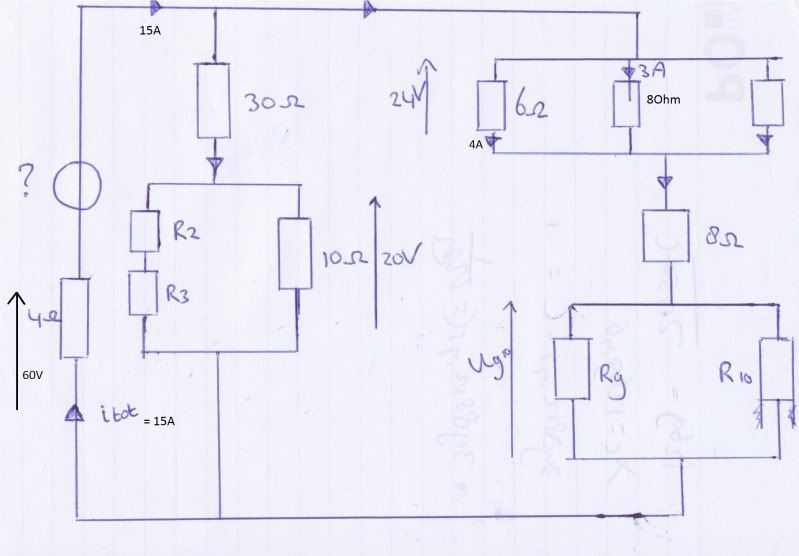
Maar nu zie ik niet meer waar ik verder moet.... Ik weet dat de 15A zich opsplitst door het middelste weerstanden blok 5A lopen en door het rechtse weerstanden blok 10A. Maar ik zie even niet hoe ik er kom.
Kan iemand even een voorzet geven? Daarna kom ik er wel uit (:
Door de weerstand van 10 Ohm gaat 2 A. Dat kun je sowieso nog toevoegen. Ik vraag me trouwens af of je ooit R2 en R3 kunt bepalen. Die weerstanden staan in serie en zijn daarom te vervangen door een weerstand R2 + R3. Maar hoe kun je ze afzonderlijk bepalen als je niet tenminste de spanning over een van beide afzonderlijk weet?quote:Op dinsdag 22 maart 2011 22:43 schreef GoodGawd het volgende:
Ik word gek:
[ afbeelding ]
Zie hierboven een sommetje dat gegeven werd in 't college. Dit gaf hij zo op. Vervolgens heeft hij alles uitgewerkt. Ik heb dus alle waarde en antwoorden en hoe hij dingen oplost mbv subsitutie. Bij onder andere R9/R10 en R2/R3.
Nu heb ik dus dit, das heel simpel:
[ afbeelding ]
Maar nu zie ik niet meer waar ik verder moet.... Ik weet dat de 15A zich opsplitst door het middelste weerstanden blok 5A lopen en door het rechtse weerstanden blok 10A. Maar ik zie even niet hoe ik er kom.
Kan iemand even een voorzet geven? Daarna kom ik er wel uit (:
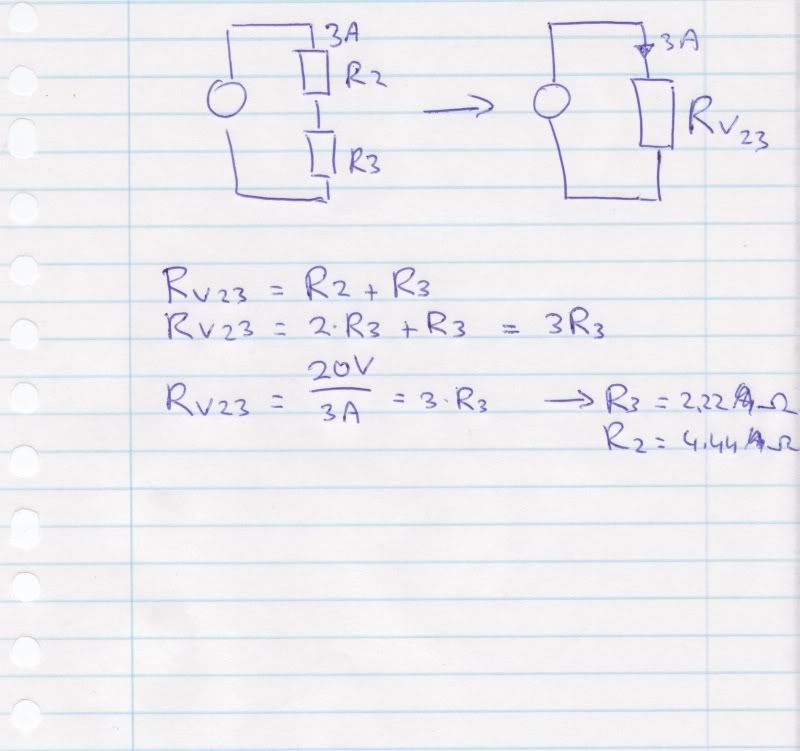
Zo werd dat vandaag in 't college gedaan, mbv subsitutie. Maar om daar te komen moet ik toch eerst er achter komen hoe ik de stap daarvoor zet. Want die 3A heb ik nog niet.
Dit ziet er ook leuk uit trouwens, maar ik zie die hele subsitutie niet meer waar ik dat vanmiddag nog wel door had.
SPOILERdie 2A was ik even vergeten er bij te zetten.
Uit de uitwerking die je hier geeft, leid ik af dat je weet hoe R2 en R3 zich tot elkaar verhouden. Want je stelt R2 = 2*R3. Als je niet weet hoe die twee zich verhouden, of wat de spanning over een van beide is, zou je R2 en R3 niet kunnen bepalen.quote:Op dinsdag 22 maart 2011 23:53 schreef GoodGawd het volgende:
Het stukje uitvergroot, spanningsbron dus zien als 20V :
[ afbeelding ]
Zo werd dat vandaag in 't college gedaan, mbv subsitutie. Maar om daar te komen moet ik toch eerst er achter komen hoe ik de stap daarvoor zet. Want die 3A heb ik nog niet.
Dit ziet er ook leuk uit trouwens, maar ik zie die hele subsitutie niet meer waar ik dat vanmiddag nog wel door had. SPOILERdie 2A was ik even vergeten er bij te zetten.
SPOILERdie 2A was ik even vergeten er bij te zetten.
Maar nu dit bekend is, moet ik nog de stap ervoor weten....Hmm...
SPOILERIk ga er morgen nog eens goed naar kijken. Als het het echt blijkt dat het niet kan, dan mis ik heeeeel waarschijnlijk een waarde. (als ik die waarde wel weet, dan kom ik er voor de rest wel uit (: Maar als iemand een weg ziet, met de gegevens die er nu staan, dan zou ik dat graag willen horen!
[ Bericht 16% gewijzigd door GoodGawd op 23-03-2011 00:12:42 ]
Het zou zomaar kunnen dat er nog iets gegeven was over de weerstand rechtsboven. Anders zou ik het ook niet weten.quote:Op woensdag 23 maart 2011 00:07 schreef GoodGawd het volgende:
Oh verrek! Ja lampje brandt weer! Er werd iets onder de som geschreven, maar dat kon ik niet lezen dus nam ik dat niet over. Dacht dat het gewoon wat gebrabbel was. Maar dat waren de verhoudingen, kan niet anders. Bij R9 en R10 is de verhouding: R10 = 4xR9. (leid ik af uit mijn aantekeningen)
Maar nu dit bekend is, moet ik nog de stap ervoor weten....Hmm...SPOILERIk ga er morgen nog eens goed naar kijken. Als het het echt blijkt dat het niet kan, dan mis ik heeeeel waarschijnlijk een waarde. (als ik die waarde wel weet, dan kom ik er voor de rest wel uit (: Maar als iemand een weg ziet, met de gegevens die er nu staan, dan zou ik dat graag willen horen!
De spanning over weerstand 9 en 10 is niet bekend, of wel? Als die bekend is, is het uit te rekenen, anders gaat het geloof ik niet met de waarden die er nu staan.quote:Op woensdag 23 maart 2011 00:07 schreef GoodGawd het volgende:
Oh verrek! Ja lampje brandt weer! Er werd iets onder de som geschreven, maar dat kon ik niet lezen dus nam ik dat niet over. Dacht dat het gewoon wat gebrabbel was. Maar dat waren de verhoudingen, kan niet anders. Bij R9 en R10 is de verhouding: R10 = 4xR9. (leid ik af uit mijn aantekeningen)
Maar nu dit bekend is, moet ik nog de stap ervoor weten....Hmm...SPOILERIk ga er morgen nog eens goed naar kijken. Als het het echt blijkt dat het niet kan, dan mis ik heeeeel waarschijnlijk een waarde. (als ik die waarde wel weet, dan kom ik er voor de rest wel uit (: Maar als iemand een weg ziet, met de gegevens die er nu staan, dan zou ik dat graag willen horen!
Ik blijf toch het gevoel houden dat er nog iets is met de weerstand rechtsboven. Als hij onbekend is, zou er minimaal R7 bij moeten staan. Is hij wel bekend, zou de grootte van de weerstand vermeld moeten staan. Maar juist omdat er niets staat, zou het zomaar kunnen zijn dat je iets vergeten bent. Ook het "gekrabbel" onder de schakeling, dat je niet hebt overgenomen, kan nog belangrijke informatie hebben bevat.quote:Op woensdag 23 maart 2011 15:17 schreef GoodGawd het volgende:
Nee is niet bekend. Ik denk dat dat ik de eerste aftakking 5A als gegeven moet geven. Dan lukt het allemaal wel (:
Ik heb wel de formule maar de afgeleide van wortel(1,1) is gewoon 0, dus ik kan er niet veel mee.
Stel de formule als wortel (x,y)?quote:Op donderdag 24 maart 2011 15:26 schreef KeizerKuzco het volgende:
Ik ben bezig met de Taylorreeks, en nu is het de bedoeling dat ik wortel(1,1) bereken tot op 4 significante cijfers nauwkeurig door middel van de taylorreeks.
Ik heb wel de formule maar de afgeleide van wortel(1,1) is gewoon 0, dus ik kan er niet veel mee.
Het hele idee is dat je hem benadert met een benadering vanaf punt 1. Met de taylor stel je een alternatieve formule op die, hoe meer termen die heeft, hoe preciezer wordt over een wijder bereik. Er is ook een formule die ik zo niet uit mijn hoofd weet waarmee je na kunt gaan hoe precies een taylorbenadering is dacht ik.quote:Op donderdag 24 maart 2011 15:35 schreef KeizerKuzco het volgende:
Maar als ik de taylorbenadering geef voor wortel(x) rond x=1 dan vergeet ik die 0,1 uit de wortel. Of kan ik die dan nog apart benaderen met een tweede taylorreeks?
f(1) + f'(1)*(x-1) + 1/2f''(1)*(x-1)^2 + 1/3f'''(1)*(x-1)^3
Ik weet ook wel hoe ik wortel(x) af moet leiden, maar moet ik dan gewoon invullen in de formule?
Als ik nu ga invullen, en ik vul 1,1 in voor x dan krijg ik:
1 + 0,05 - 1,25*10^-3 + 6,25*10^-5 = 1,0488
Met mijn rekenmachine zie ik dat wortel(1,1) inderdaad 1,048808848 is.
Wat bedoel je met de foutterm? Ik moet er inderdaad voor zorgen dat de rest kleiner is dan 5*10^-4
Bedankt he
Bij de eerste is er een verhaaltje ervoor: Jodiumtinctuur bevat 2,0 massa% jood, 2,5 massa% natriumjodide (of kaliumjodide) en 48% ethanol.
Waardoor lost in jodiumtinctuur zowel het apolaire jood als de twee jodidezouten op?
De 2e vraag:
Geef de vergelijking van de reactie waarin een molecuul povidonjood (voor te stellen als PV(I2)n ) een molecuul jood afstaat.
Wat voor reactie zal dit worden? Loopt deze reactie vanzelf? Ik snap niet zo goed hoe de reactie zal lopen.
Alvast bedankt!
[ Bericht 0% gewijzigd door hussyfan11 op 24-03-2011 19:38:33 ]
Voor oplossen is het van belang dat de op te lossen stof en het oplosmiddel graag bij elkaar in de buurt zitten. Dat betekent dat apolaire stoffen graag in een apolair of weinig polair oplosmiddel zitten, terwijl polaire stoffen en zouten graag in een polair oplosmiddel vertoeven.quote:Op donderdag 24 maart 2011 19:19 schreef hussyfan11 het volgende:
Ik heb nog 2 vragen waar ik niet uit kom.
Bij de eerste is er een verhaaltje ervoor: Jodiumtinctuur bevat 2,0 massa% jood, 2,5 massa% natriumjodide (of kaliumjodide) en 48% ethanol.
Waardoor lost in jodiumtinctuur zowel het apolaire jood als de twee jodidezouten op?
De jodidezouten lossen daarom op in een polair oplosmiddel, in dit geval water. Jood wil juist een apolair of minder polair oplosmiddel, in dit geval ethanol. Ethanolmoleculen richten de apolaire staart op de joodmoleculen, zodat elk joodmolecuul totaal omsloten wordt door ethanol. De polaire alcoholgroep van elk ethanolmolecuul is op het omringende water is gericht, zodat de waterige oplossing en de ethanoloplossing zich ook met elkaar vermengen.
Met deze notatie voor povidonjood zou ik zeggen:quote:De 2e vraag:
Geef de vergelijking van de reactie waarin een molecuul povidonjood (voor te stellen als PV(I2)n ) een molecuul jood afstaat.
Wat voor reactie zal dit worden? Loopt deze reactie vanzelf? Ik snap niet zo goed hoe de reactie zal lopen.
Alvast bedankt!
PV(I2)n -> PV(I2)n-1 + I2
Bedankt! Dit helpt me echt!quote:Op donderdag 24 maart 2011 19:55 schreef lyolyrc het volgende:
[..]
Voor oplossen is het van belang dat de op te lossen stof en het oplosmiddel graag bij elkaar in de buurt zitten. Dat betekent dat apolaire stoffen graag in een apolair of weinig polair oplosmiddel zitten, terwijl polaire stoffen en zouten graag in een polair oplosmiddel vertoeven.
De jodidezouten lossen daarom op in een polair oplosmiddel, in dit geval water. Jood wil juist een apolair of minder polair oplosmiddel, in dit geval ethanol. Ethanolmoleculen richten de apolaire staart op de joodmoleculen, zodat elk joodmolecuul totaal omsloten wordt door ethanol. De polaire alcoholgroep van elk ethanolmolecuul is op het omringende water is gericht, zodat de waterige oplossing en de ethanoloplossing zich ook met elkaar vermengen.
[..]
Met deze notatie voor povidonjood zou ik zeggen:
PV(I2)n -> PV(I2)n-1 + I2
Buiten rendement, radioactiviteit en halfwaardetijd kan ik enkel economische en milieu argumenten bedenken.
Iemand die mij wat dieper vanuit de natuurkunde kan helpen kijken op kernenergie?
Ik vind dit nog steeds een van de meest interessante artikelen die er op het web te vinden zijn:quote:Op zondag 27 maart 2011 18:37 schreef Blaqman het volgende:
Nu met kernenergie dagelijks in het nieuws mogen wij van de docent gaan beredeneren wat de voor- en tegenargumenten van kernenergie, gezien vanuit de natuurkunde.
Buiten rendement, radioactiviteit en halfwaardetijd kan ik enkel economische en milieu argumenten bedenken.
Iemand die mij wat dieper vanuit de natuurkunde kan helpen kijken op kernenergie?
http://www.ornl.gov/info/ornlreview/rev26-34/text/colmain.html
Bij een normaal werkende kerncentrale blijft het afval opgesloten zitten. Je houdt er altijd controle over. Bij een met kolen gestookte centrale wordt het radioactieve materiaal het milieu in gepompt.
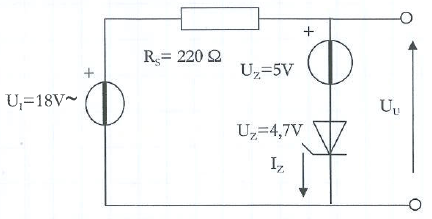
Hierbij is Ui een wisselspanning met effectieve waarde 18V.
Als Ui hoog is, staat de zenerdiode in doorlaatrichting en wordt de uitgang ongeveer 5V (+drempelspanning). Als Ui laag, staat de zener in sper en wordt de uitgang ongeveer 0,3V.
Maar wat gebeurt er als Ui tussen deze spanningen zit? Wordt dat een steile lijn of een gemiddelde waarde?
In som 2, krijg je de kinetische en statische. Daarin passen ze de statische toe op het wiel dat slipt en de statische gebruiken ze niet.
http://img10.imageshack.us/img10/7900/fsgdf.png (copy/paste deze link)
Wat is nou het verschil tussen een wiel die aandrijving heeft en een wiel dat vrij rolt. Als ik het oppervlak tussen die 2 wielen onder loep zou nemen zou ik niet echt een verschil kunnen verzinnen. Mij lijkt dat een vrij lopend wiel ook die zelfde statische wrijving heeft...?
Ik denk dat ze aannemen dat er geen kracht achter een vrij lopend wiel zit. Deze rolt dus mee (remt niet en versnelt niet) en het gewicht van de wielen mogen verwaarloosd worden, dus er is geen inertia.quote:Op dinsdag 29 maart 2011 14:04 schreef GoodGawd het volgende:
In volgende 2 opgaven zit ik altijd de klooien met de wrijving coëfficiënten. Bij de eerste geven ze je de statische wrijving coëfficiënt. Zoals je in het VLS tekeningetje ziet passen ze de statische toe bij het wiel dat de aandrijving levert. T wiel dat vrij rolt heeft geen wrijving blijkbaar.
In som 2, krijg je de kinetische en statische. Daarin passen ze de statische toe op het wiel dat slipt en de statische gebruiken ze niet.
[ http://img10.imageshack.us/img10/7900/fsgdf.png (copy/paste deze link) ]
Wat is nou het verschil tussen een wiel die aandrijving heeft en een wiel dat vrij rolt. Als ik het oppervlak tussen die 2 wielen onder loep zou nemen zou ik niet echt een verschil kunnen verzinnen. Mij lijkt dat een vrij lopend wiel ook die zelfde statische wrijving heeft...?

Het berekenen op sterkte vind ik een makkie, maar op stijfheid lukt me maar niet.
Ik dacht eraan om eerst:
W te berekenen, dan I en daarna de hoogte (h).
Het is nogal lang geleden voor mij, maar ik denk dat je het volgende moet doen:quote:Op dinsdag 5 april 2011 20:10 schreef ajacied4lf het volgende:
ik heb een vraagje over Mechanica, hoop dat er iemand is die me kan helpen:
[ afbeelding ]
Het berekenen op sterkte vind ik een makkie, maar op stijfheid lukt me maar niet.
Ik dacht eraan om eerst:
W te berekenen, dan I en daarna de hoogte (h).
Er bestaan formules voor de maximale doorbuiging van balken. Je gebruikt de formule die van toepassing is op deze situatie en je stelt de maximale doorbuiging gelijk aan de toelaatbare doorbuiging. Hiermee bereken je het oppervlaktetraagheidsmoment I. Vervolgens bereken je de hoogte weer met behulp van de formule voor I.
In mijn mechanicaboek vond ik voor de maximale doorbuiging in deze situatie: -5wL4/(384EI). Mijn boek gebruikt mogelijk andere symbolen dan je gewend bent. In deze formule is w gelijk aan q in jouw plaatje, L is de lengte van de balk, E is de elasticiteitsmodulus en I het oppervlaktetraagheidsmoment.
Ik heb zelf de berekening al uitgevoerd, maar ik twijfel een beetje aan de uitkomst. Mocht deze benadering niet goed zijn, dan biedt het misschien nog aanknopingspunten voor de juiste benadering.
Dit moet hem zijn, ik zal het morgen even proberen
Bedankt
Allereerst is het natuurlijk belangrijk om te bekijken wat je precies moet berekenen en hoe je daar uit kan komen. Gegeven is dat een bal stil blijft liggen, dat betekent dat de resulterende kracht op een object in de trein nul moet zijn. Je kan voor een object in de trein (bv een bal) een krachtendiagram opstellen waarbij je alle krachten op de bal tekent. Je hoe groot de middelpuntzoekende versnelling is (als functie van de snelheid v), dan is het een kwestie van alles invullen en oplossen.quote:Op woensdag 6 april 2011 21:26 schreef rubensanti het volgende:
Ik heb morgen een natuurkunde toets en ik zit nu een beetje op internet te oefenen met een vraagstuk dat vorig jaar ook in de toets zat. Het betreft het volgende vraagstuk : http://www.natuurkunde.nl/artikelen/view.do?supportId=2062 en ik snap er geen ene moer van ook al staan de uitwerkingen eronder. Iemand die het wel snapt?
Het is misschien een beetje (te) kort uitgelegd, als het niet duidelijk is zal je iets specifieker moeten zeggen waar je het niet meer volgt
Dat de bal stil blijft liggen komt volgens mij doordat Fn = Fz. Ik heb alleen geen flauw benul hoe ik de v kan uitrekenen. Ook met het krachtendiagram erbij heb ik gewoon te weinig gegevens, namelijk alleen dat de helling 9 graden is en dat de straal 500 meter is. Bij de uitwerkingen doen ze dit:quote:Op woensdag 6 april 2011 21:42 schreef M.rak het volgende:
[..]
Allereerst is het natuurlijk belangrijk om te bekijken wat je precies moet berekenen en hoe je daar uit kan komen. Gegeven is dat een bal stil blijft liggen, dat betekent dat de resulterende kracht op een object in de trein nul moet zijn. Je kan voor een object in de trein (bv een bal) een krachtendiagram opstellen waarbij je alle krachten op de bal tekent. Je hoe groot de middelpuntzoekende versnelling is (als functie van de snelheid v), dan is het een kwestie van alles invullen en oplossen.
Het is misschien een beetje (te) kort uitgelegd, als het niet duidelijk is zal je iets specifieker moeten zeggen waar je het niet meer volgt.
Alleen de normaalkracht hoeft te worden ontbonden in:
F nx = F n·cos en F ny = F n·sin
En dan...
F = m·a >>
F z + F n = m·a
oor de x-richting levert dit op:
0 + F n·cos = m· 2·r
Voor de y-richting levert dit op:
-m·g + F n·sin = 0
Combineren van deze twee geeft v = 28 m/s
Ik snap alleen niet wat je hier kan invullen en vooral die laatste combinatie geeft me hoofdpijn
Bijna, je vergeet echter dat de trein onder een hoek staat, waardoor de normaalkracht zowel een x-component als een y-component heeft. De y-component moet nu gelijk zijn aan de zwaartekracht, zo is er geen resulterende kracht in de verticale richting. In de horizontale richting moet er natuurlijk wel een resulterende kracht zijn (itt wat ik in m'n eerdere post zei, dat klopte niet), namelijk de middelpuntzoekende kracht.quote:Op woensdag 6 april 2011 21:52 schreef rubensanti het volgende:
[..]
Dat de bal stil blijft liggen komt volgens mij doordat Fn = Fz.
Deze middelpuntzoekende kracht heeft als formule Fmpz=mv2/r. Je weet dat de x-component van de normaalkracht de enige kracht in de horizontale richting is, deze moet dus de middelpuntzoekende kracht 'leveren' (de Fmpz is geen kracht die bovenop de andere krachten werkt, het is een resultante van de werkende krachten).
Probeer het nu nog eens helemaal uit te schrijven van het begin (liefst zonder uitwerkingen ernaast
Je bedoeltquote:Op woensdag 6 april 2011 22:12 schreef lyolyrc het volgende:
Hou er ook even rekening mee dat er een fout staat in de uitwerking!
?SPOILERde sinus en cosinus die omgewisseld zijn
Inderdaad.quote:Op woensdag 6 april 2011 22:14 schreef M.rak het volgende:
[..]
Je bedoelt?SPOILERde sinus en cosinus die omgewisseld zijn
[ Bericht 10% gewijzigd door rubensanti op 06-04-2011 23:18:59 ]
Bedoel je met Fc de middelpuntzoekende kracht? In dat geval, je hoeft deze kracht ook niet precies uit te rekenen. Ik zal het stap voor stap proberen uit te leggenquote:Op woensdag 6 april 2011 22:28 schreef rubensanti het volgende:
Ik snap eigenlijk nog steeds niet hoe ik de som aan moet pakken. Zouden jullie misschien een kleine tip kunnen geven met hoe ik moet beginnen. Ik zit nu al een uur naar de hoek van 9 graden en de straal van 500 te kijken maar ik heb geen idee hoe ik dit kan omrekenen naar Fc omdat ik geen massa heb
• Je weet dat de krachten in de verticale richting elkaar op moeten heffen, hieruit kan je een uitdrukking vinden voor de normaalkracht.
• Je weet dat de resulterende kracht, de x-component van de normaalkracht, de gelijk is aan mv2/r.
• Met deze informatie kan je nu v uitrekenen
De massa heb je hierin niet nodig, omdat deze wegvalt als je alles opschrijft.
Alle krachten in x-richting optellen en gelijkstellen aan m*ax.quote:Op woensdag 6 april 2011 22:39 schreef rubensanti het volgende:
Ja die heb ik een tijd geleden wel gehad, maar ik zie het verband niet.
Ook alle krachten in y-richting optellen en gelijstellen aan m*ay.
Als twee krachten tegengesteld werken, een van beide negatief nemen.
Dit geeft je twee uitdrukkingen, waarbij je uiteindelijk de een kunt omwerken en substitueren in de ander. Dan valt m ook weg, zoals M.rak zegt.
en
ay=mv2/r
Bedoelen jullie dit?
Nee, ay=0 (bedenk zelf waarom), ax=v2/r (Fx=mv2/r).quote:Op woensdag 6 april 2011 22:47 schreef rubensanti het volgende:
ax=mv2/r
en
ay=mv2/r
Bedoelen jullie dit?
Probeer zelf goed te kijken of je begrijpt waarom dit geldt, dat is namelijk essentieel bij zo'n soort vragen. Als je eenmaal in de gaten hebt hoe het werkt, stelt het niet zo veel meer voor.
Die uitdrukkingen kloppen niet, want a = v2/r.quote:Op woensdag 6 april 2011 22:47 schreef rubensanti het volgende:
ax=mv2/r
en
ay=mv2/r
Bedoelen jullie dit?
Nee, wat ik bedoel is dat je kijkt welke krachten je hebt in x-richting en welke in y-richting en die stel je gelijk aan de massa keer de versnelling in die richting.
In x-richting heb je de x-component van FN. Die stel je gelijk aan de max.
FNx = max
In y-richting heb je 2 krachten, tel die op en stel ze gelijk aan m*ay.
0= v2/r is dit die van y?
En wat kan ik doen met de hoek van 9 graden?
ay is inderdaad nul omdat de Fny en de Fz elkaar opheffen, dat weet je omdat de bal stil blijft liggen (eigenlijk nogal een nutteloze toevoeging, in principe geldt dit altijd lijkt me).quote:Op woensdag 6 april 2011 23:08 schreef rubensanti het volgende:
ay= 0 omdat de Fny en de Fz elkaar opheffen? en de enigste kracht die er is is de Fxn.
0= v2/r is dit die van y?
En wat kan ik doen met de hoek van 9 graden?
0= v2/r, wat bedoel je daarmee? In de y-richting hoef je de Fmpz helemaal niet te gebruiken, die geldt alleen in de x-richting. In de y-richting geldt ay=0, in de x-richting geldt ax= v2/r.
Met de hoek kan je de normaalkracht in componenten ontbinden (x- en y-component).
geeft v= 70 , en dan dit vermenigvuldigen met sin(9) kom ik op 28,8 m/s. Kan dit kloppen?
Met dingetjes proberen kom je er niet, het is wel de bedoeling dat je weet wat je doet natuurlijk. Probeer het eens stap voor stap netjes op te schrijven. In principe moet het, met de tips die gegeven zijn, nu wel lukken om de oplossing uit te schrijven.quote:Op woensdag 6 april 2011 23:19 schreef rubensanti het volgende:
Ik ben nu gewoon een beetje dingetjes aan het proberen, en net had ik g=v2/r
geeft v= 70 , en dan dit vermenigvuldigen met sin(9) kom ik op 28,8 m/s. Kan dit kloppen?
Bij een proefwerk of examen zal je de uitkomst namelijk niet gegeven krijgen, waardoor je niet naar dat antwoord toe kan werken. Voor zomaar iets proberen zal je ook geen punten krijgen, voor het netjes uitwerken van de gegevens wel.
mg = mv2/r
g = v2/r
v = wortel( g*r)
dan krijg je wortel(9,81 * 500) = 70
en dan 70 * sin(9) om de schuine zijde van het krachtendiagram te krijgen, maar ik weet niet of dat ergens opslaat. Maar het komt wel uit op 28,8 m/s en volgens de uitwerking is het 28 m/s.
Het probleem is dat ik ondanks de tips nog steeds niet echt weet wat ik er mee kan doen ( ben niet zo'n natuurkunde baas ) en met iets proberen kan je nog altijd puntjes scoren als je het goed doet
Hoe kom je aan die eerste regel, mg = mv2/r ?quote:Op woensdag 6 april 2011 23:33 schreef rubensanti het volgende:
Ik dacht:
mg = mv2/r
g = v2/r
v = wortel( g*r)
dan krijg je wortel(9,81 * 500) = 70
en dan 70 * sin(9) om de schuine zijde van het krachtendiagram te krijgen, maar ik weet niet of dat ergens opslaat. Maar het komt wel uit op 28,8 m/s en volgens de uitwerking is het 28 m/s.
Het probleem is dat ik ondanks de tips nog steeds niet echt weet wat ik er mee kan doen ( ben niet zo'n natuurkunde baas ) en met iets proberen kan je nog altijd puntjes scoren als je het goed doet
Waarom zouden die gelijk moeten zijn?quote:
Tip: Kijk eens goed naar het plaatje in de uitwerking, daar staan de verschillende krachten getekend.
krachten in de y richting zijn Fn en Fz, en in de x richting de Fmpz. Maar wat bedoelen jullie precies met de componenten ontbinden?
Tja, bij dat sommetje geldt dat misschien, die gelijkheden moet je voor iedere som opnieuw bekijkenquote:Op woensdag 6 april 2011 23:41 schreef rubensanti het volgende:
Ik zag in mijn natuurkunde boek een sommetje dat er een beetje op leek en daar gebruikten ze dat.
krachten in de y richting zijn Fn en Fz, en in de x richting de Fmpz. Maar wat bedoelen jullie precies met de componenten ontbinden?
De normaalkracht staat niet recht, maar schuin (vanwege de hoek van 9o). Deze kracht bestaat uit een component (een soort gedeelte) in de x-richting en een component in de y-richting. Het nut hiervan is dat je, in dit geval, de y-component van de normaalkracht gelijk kan stellen aan de zwaartekracht.

In dit plaatje zie je ook dat de schuine pijl als het ware wordt gevormd door een horizontaal deel en een verticaal deel.
Toen ik op het VWO zat, deden wij dit soort sommen niet. Dit soort dingen oplossen heb ik pas op de universiteit bij werktuigbouwkunde geleerd.quote:Op woensdag 6 april 2011 23:50 schreef rubensanti het volgende:
Ik zit nu in 5VWO N&T. We zijn nu bezig met het hoofdstuk kromme banen, en ik snap het eigenlijk wel alleen bij deze som zie het gewoon niet.
Ik denk persoonlijk dat we dan te abstract bezig zijn.
Je kunt de normaalkracht ontbinden in twee componenten, eentje in x-richting en een in y-richting. Zie het plaatje van M.rak. Het is in de uitwerking ook met stippenlijntjes aangegeven.
Met goniometrische formules kun dat doen. Hier geldt: sin(α) = FNx/FN en cos(α) = FNy/FN. Dit kun je omwerken tot: FNx=FNsin(α) en FNy = FNcos(α)
Die componenten gebruik je weer om een krachtenbalans in x-richting en een krachtenbalans in y-richting op te stellen.
Ik meen dat wij dit soort sommen ook wel eens gehad hebben op de middelbare, maar daar kan ik me in vergissen. Dat we te abstract bezig zijn zou inderdaad kunnen, ik studeer zelf natuurkunde, dus daar kan ik wel eens last van hebbenquote:Op donderdag 7 april 2011 00:01 schreef lyolyrc het volgende:
[..]
Toen ik op het VWO zat, deden wij dit soort sommen niet. Dit soort dingen oplossen heb ik pas op de universiteit bij werktuigbouwkunde geleerd.
Ik denk persoonlijk dat we dan te abstract bezig zijn.
Je zou mij totaal zijn kwijtgeraakt, als ik toen zo'n som had moeten doen. Ik kijk even of ik het nu via dm kan afhandelen.quote:Op donderdag 7 april 2011 00:20 schreef M.rak het volgende:
[..]
Ik meen dat wij dit soort sommen ook wel eens gehad hebben op de middelbare, maar daar kan ik me in vergissen. Dat we te abstract bezig zijn zou inderdaad kunnen, ik studeer zelf natuurkunde, dus daar kan ik wel eens last van hebben. Excuses in dat geval, ik hoop dat het voor rubensanti evengoed wat duidelijker is geworden.
Krachtenbalans voor de x-richting:
FN sin(α) = ma
Gebruikmakend van a = v2/r geeft dit:
FN sin(α) = mv2/r
Krachtenbalans voor de y-richting:
Fz + FNcos(α) = 0
Invullen van Fz = mg en toevoegen van een minteken, want FNy en Fz zijn tegengesteld gericht geeft dit:
-mg + FNcos(α) = 0
Werk de laatste formule om tot:
FN = mg/cos(α)
En substitueer dit in de formule voor de x-richting:
mgsin(α)/cos(α) = mv2/r
Dit kun je vereenvoudigen tot:
mgtan(α) = mv2/r
Streep m aan beide kanten weg en werk de formule om tot een expressie voor v:
v = √(grtan(α))
Invullen geeft v = 28 m/s.
Altijd handig om te weten wat er mogelijk op een toets gevraagd gaat worden.quote:Op donderdag 7 april 2011 10:25 schreef rubensanti het volgende:
nog bedankt voor de hulp van gister, ik kreeg de opgave op het proefwerk. Verder ging de toets goed, jullie zijn echt helden!
Ik heb ooit een boek opgespoord op basis waarvan een docent mechanicatentamens samenstelde.
