SES School, Studie en Onderwijs
Wiskunde in de brugklas, Frans voor het examen of een studie Personeel en Arbeid? Moeilijke formulieren van DUO? Iets weten over studiefinanciering of studentenverenigingen? Dit is het forum voor leerkrachten, scholieren en studenten, van brugklas tot uni



Oh, dacht dat ze vierkant warenquote:Op zondag 23 januari 2011 18:13 schreef GoodGawd het volgende:
[ afbeelding ]
Ik denk dat je binnen de grenzen van deze formule moet blijven. Het zijn staven.


Stel je hebt een loden plaat (zeg dat lood een halveringsdikte van 5 mm heeft) van 18 mm dikte. Hierdoor laat je straling vallen met een intensiteit van 500 W/m2.quote:Op zondag 23 januari 2011 18:11 schreef snellehenk het volgende:
[..]
Ja het ging idd over de straling, bedankt (Y)
Het begint al duidelijker te worden, maar zou je misschien nog iets duidelijker voor me kunnen maken, door een voorbeeld te geven?
alvast bedankt
Eerst bereken je dan n, met de formule n=x/d1/2=18/5=3.6.
Daarna vul je de overige gegevens in in de eerste formule:
I(n)=I(0)*(1/2)n=500*(1/2)3.6=41 W/m2.
The biggest argument against democracy is a five minute discussion with the average voter.


dankjewelquote:Op zondag 23 januari 2011 18:54 schreef M.rak het volgende:
[..]
Stel je hebt een loden plaat (zeg dat lood een halveringsdikte van 5 mm heeft) van 18 mm dikte. Hierdoor laat je straling vallen met een intensiteit van 500 W/m2.
Eerst bereken je dan n, met de formule n=x/d1/2=18/5=3.6.
Daarna vul je de overige gegevens in in de eerste formule:
I(n)=I(0)*(1/2)n=500*(1/2)3.6=41 W/m2.
het is me nu duidelijk geworden


Ik heb nog een vraag over wiskunde.
Gegeven f(x) = sqrt(x) / e^x
Gevraagd:
a bereken de gebieden waar f(x) dalend is en waar stijgend
b bereken de gebieden waar f(x) convex is en waar concaaf
Nu ben ik zelf wel al begonnen, maar ik hang vast
Bij f(x) = sqrt(x) / e^x krijg je een f'(x) van:
( e^x / 2*sqrt(x) - e^x * sqrt(x) ) / e ^2x
Tot zover klopt die volgens mij wel bij mij. Om het keerpunt van stijgen en dalen te berekenen wil ik het nulpunt berekenen. Dus:
( e^x / 2*sqrt(x) - e^x * sqrt(x) ) / e ^2x = 0
( e^x / 2*sqrt(x) - e^x * sqrt(x) ) = 0
e^x / 2*sqrt(x) = e^x * sqrt(x)
e^x = e^x * sqrt(x) * sqrt (x) * 2 = e^x * 2x
2x = 1
x = 0,5
Dus bij x = 0,5 is het keerpunt van stijgen en dalen, volgens de GR klopt dit ook.
Echter het convex en concaaf moet ik de kromming van de eerste functie gaan berekenen.
De f"(x) is voor mij een compleet raadsel. Nu heb de f'(x) weer gedifferentieerd, maar dit gaat niet helemaal goed. Verder vraag ik me af of die f'(x) niet vereenvoudigd kan worden.
Gegeven f(x) = sqrt(x) / e^x
Gevraagd:
a bereken de gebieden waar f(x) dalend is en waar stijgend
b bereken de gebieden waar f(x) convex is en waar concaaf
Nu ben ik zelf wel al begonnen, maar ik hang vast
Bij f(x) = sqrt(x) / e^x krijg je een f'(x) van:
( e^x / 2*sqrt(x) - e^x * sqrt(x) ) / e ^2x
Tot zover klopt die volgens mij wel bij mij. Om het keerpunt van stijgen en dalen te berekenen wil ik het nulpunt berekenen. Dus:
( e^x / 2*sqrt(x) - e^x * sqrt(x) ) / e ^2x = 0
( e^x / 2*sqrt(x) - e^x * sqrt(x) ) = 0
e^x / 2*sqrt(x) = e^x * sqrt(x)
e^x = e^x * sqrt(x) * sqrt (x) * 2 = e^x * 2x
2x = 1
x = 0,5
Dus bij x = 0,5 is het keerpunt van stijgen en dalen, volgens de GR klopt dit ook.
Echter het convex en concaaf moet ik de kromming van de eerste functie gaan berekenen.
De f"(x) is voor mij een compleet raadsel. Nu heb de f'(x) weer gedifferentieerd, maar dit gaat niet helemaal goed. Verder vraag ik me af of die f'(x) niet vereenvoudigd kan worden.


Je antwoord op a is volgens mij correct. Ik heb als formule: (1-2x) / (2 * sqrt(x) * e^x)quote:Op dinsdag 25 januari 2011 16:25 schreef Adames het volgende:
Ik heb nog een vraag over wiskunde.
Gegeven f(x) = sqrt(x) / e^x
Gevraagd:
a bereken de gebieden waar f(x) dalend is en waar stijgend
b bereken de gebieden waar f(x) convex is en waar concaaf
Nu ben ik zelf wel al begonnen, maar ik hang vast
Bij f(x) = sqrt(x) / e^x krijg je een f'(x) van:
( e^x / 2*sqrt(x) - e^x * sqrt(x) ) / e ^2x
Tot zover klopt die volgens mij wel bij mij. Om het keerpunt van stijgen en dalen te berekenen wil ik het nulpunt berekenen. Dus:
( e^x / 2*sqrt(x) - e^x * sqrt(x) ) / e ^2x = 0
( e^x / 2*sqrt(x) - e^x * sqrt(x) ) = 0
e^x / 2*sqrt(x) = e^x * sqrt(x)
e^x = e^x * sqrt(x) * sqrt (x) * 2 = e^x * 2x
2x = 1
x = 0,5
Dus bij x = 0,5 is het keerpunt van stijgen en dalen, volgens de GR klopt dit ook.
Echter het convex en concaaf moet ik de kromming van de eerste functie gaan berekenen.
De f"(x) is voor mij een compleet raadsel. Nu heb de f'(x) weer gedifferentieerd, maar dit gaat niet helemaal goed. Verder vraag ik me af of die f'(x) niet vereenvoudigd kan worden.
Hier is wat eenvoudiger het nulpunt te bepalen vind ik. Of jij het verder handiger vindt weet ik niet
~Si vis amari, ama~


Na even wat te hebben gegeten zie ik wat je hebt gedaan, erg bedankt, daar kan ik verder mee.quote:Op dinsdag 25 januari 2011 17:56 schreef FedExpress het volgende:
[..]
Je antwoord op a is volgens mij correct. Ik heb als formule: (1-2x) / (2 * sqrt(x) * e^x)
Hier is wat eenvoudiger het nulpunt te bepalen vind ik. Of jij het verder handiger vindt weet ik niet
-edit: dan kom ik uit op een f '' (x) = (4x^2 - 4x +1)/(4*x*sqrt(x)*e^x)-
[ Bericht 5% gewijzigd door Adames op 25-01-2011 19:24:59 ]


Ik heb een beetje ruzie met m'n rekenmachine (Casio CFX-9850GC PLUS).
Volgens de docente vulde ik het helemaal goed in, maar m'n rekenmachine weigert het goede antwoord te geven. Aangezien de docente een Texas gebruikt kon ze me ook niet verder helpen.
De opgave:
Op een bepaald wegvak, is het aantal passerende auto’s Poisson verdeeld met een gemiddelde intensiteit van 240 passerende auto’s per uur.
a. Bereken de kans dat gedurende een periode van één uur meer dan 275 auto’s passeren.
Goed, ik heb dus op de Casio het volgende gedaan:
STAT->DIST->POISN->Pcd
Data: variable
x: 275
u: 240
Als resultaat geeft hij p(x)=0
Dit klopt natuurlijk niet. Staat er iets fout in m'n instellingen ofzo? Hoe los ik dit op?
edit: Oja het uiteindelijke antwoord (1-p) moet 0,0123 zijn.
Volgens de docente vulde ik het helemaal goed in, maar m'n rekenmachine weigert het goede antwoord te geven. Aangezien de docente een Texas gebruikt kon ze me ook niet verder helpen.
De opgave:
Op een bepaald wegvak, is het aantal passerende auto’s Poisson verdeeld met een gemiddelde intensiteit van 240 passerende auto’s per uur.
a. Bereken de kans dat gedurende een periode van één uur meer dan 275 auto’s passeren.
Goed, ik heb dus op de Casio het volgende gedaan:
STAT->DIST->POISN->Pcd
Data: variable
x: 275
u: 240
Als resultaat geeft hij p(x)=0
Dit klopt natuurlijk niet. Staat er iets fout in m'n instellingen ofzo? Hoe los ik dit op?
edit: Oja het uiteindelijke antwoord (1-p) moet 0,0123 zijn.


Heb je niet per ongeluk de pdf ipv cdf?
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


Je bent me net voor. Lijkt mij ook de meest logische optiequote:Op zondag 30 januari 2011 13:41 schreef GlowMouse het volgende:
Heb je niet per ongeluk de pdf ipv cdf?
~Si vis amari, ama~


Nopequote:Op zondag 30 januari 2011 13:41 schreef GlowMouse het volgende:
Heb je niet per ongeluk de pdf ipv cdf?


Bij ppd komt er trouwens wel een getal uit. Maar daar heb ik dus niks aan.
Iemand uit m'n klas had een ander soort casio waaruit wel het goeie resultaat kwam.
En iemand anders had dezelfde casio als ik en kreeg ook p(x)=0
Iemand uit m'n klas had een ander soort casio waaruit wel het goeie resultaat kwam.
En iemand anders had dezelfde casio als ik en kreeg ook p(x)=0


Weet iemand hoe de EXP functie werkt op een Casio fx-82? Ik krijg alleen maar Syntax error hoe ik het ook invoer  En hij zit in een formule die ik morgen nodig heb voor een tentamen....
En hij zit in een formule die ik morgen nodig heb voor een tentamen....
formule is dus bv 234E X ( blabla / blabla )
formule is dus bv 234E X ( blabla / blabla )
know'm sayin?
×
word? word.
×
word? word.


Mij lijkt gewoon getal[EXP]getal. Dus bijvoorbeeld 2.34[EXP]5 als je 2.34 * 105 wilt hebben. Als dat niet werkt, kun je ook nog de 10x-toets gaan gebruiken.quote:Op dinsdag 1 februari 2011 15:25 schreef alors het volgende:
Weet iemand hoe de EXP functie werkt op een Casio fx-82? Ik krijg alleen maar Syntax error hoe ik het ook invoerEn hij zit in een formule die ik morgen nodig heb voor een tentamen....
formule is dus bv 234E X ( blabla / blabla )


Kan iemand mij helpen?
Ik moet de reactievergelijking van de neutralisatie van verdund zwavelzuur met kaliloog geven.
Volgens het antwoordenboekje is dit het antwoord: Voor de reactie Reactievergelijking Na de reactie
H3O+ + OH- --> 2 H2O
Zelf had ik dit bedacht: H2SO4 + KOH --> SO42- + K+ + 2H2O
Kan iemand mij vertellen of dit ook goed is, zo nee waarom niet?
bedankt!!
Ik moet de reactievergelijking van de neutralisatie van verdund zwavelzuur met kaliloog geven.
Volgens het antwoordenboekje is dit het antwoord: Voor de reactie Reactievergelijking Na de reactie
H3O+ + OH- --> 2 H2O
Zelf had ik dit bedacht: H2SO4 + KOH --> SO42- + K+ + 2H2O
Kan iemand mij vertellen of dit ook goed is, zo nee waarom niet?
bedankt!!


ja maar getal met een komma erin, bv 345E1,06 trekt hij dan weer nietquote:Op dinsdag 1 februari 2011 16:05 schreef lyolyrc het volgende:
[..]
Mij lijkt gewoon getal[EXP]getal. Dus bijvoorbeeld 2.34[EXP]5 als je 2.34 * 105 wilt hebben. Als dat niet werkt, kun je ook nog de 10x-toets gaan gebruiken.
know'm sayin?
×
word? word.
×
word? word.


Je moet 345E6 doen.quote:Op dinsdag 1 februari 2011 16:33 schreef alors het volgende:
[..]
ja maar getal met een komma erin, bv 345E1,06 trekt hij dan weer nietEn met 10x krijg ik niet het goede antwoord... vage zooi hoor...


Dat kan toch niet? Ik kan toch niet zomaar een getal veranderen? 1.06 is geen 6. Bovendien klopt het antwoord dan nog niet.quote:
know'm sayin?
×
word? word.
×
word? word.


Maar je gebruikt EXP toch alleen als je iets "keer 10 tot de macht x" wil doen?quote:Op dinsdag 1 februari 2011 17:14 schreef alors het volgende:
[..]
Dat kan toch niet? Ik kan toch niet zomaar een getal veranderen? 1.06 is geen 6. Bovendien klopt het antwoord dan nog niet.


ja maar 10^6 is toch heel iets anders dan 10^1.06? Op mijn rekenmachine iig wel.quote:Op dinsdag 1 februari 2011 17:38 schreef xxiessiexx het volgende:
[..]
Maar je gebruikt EXP toch alleen als je iets "keer 10 tot de macht x" wil doen?
know'm sayin?
×
word? word.
×
word? word.


Beste Fokkers,
Kan iemand mij helpen met het opstellen van de reactie (zuur-base) van vast bariumcarbonaat en een overmaat verdund zwavelzuur? Wat ik zelf dacht was: BACO3 + 2H3O+ ---> BA2+ + 3H2O + CO2
Is dit correct?
Bedankt!
Maarten
Kan iemand mij helpen met het opstellen van de reactie (zuur-base) van vast bariumcarbonaat en een overmaat verdund zwavelzuur? Wat ik zelf dacht was: BACO3 + 2H3O+ ---> BA2+ + 3H2O + CO2
Is dit correct?
Bedankt!
Maarten


Hmm klopt.quote:Op dinsdag 1 februari 2011 17:47 schreef alors het volgende:
[..]
ja maar 10^6 is toch heel iets anders dan 10^1.06? Op mijn rekenmachine iig wel.
Ik kan je vraag denk niet beantwoorden voor de rest. Opgave erbij zetten zou makkelijk zijn


Heb net even gekeken, mijn casio doet hetzelfde. 1.06 geeft een syntax error.quote:Op dinsdag 1 februari 2011 17:47 schreef alors het volgende:
[..]
ja maar 10^6 is toch heel iets anders dan 10^1.06? Op mijn rekenmachine iig wel.
Waarom? Zie onderstaande link
http://www.casio.com/supp(...)A9A9-98BB6FE26CFE#13
~Si vis amari, ama~


Jouw antwoord klopt niet helemaal. Verdund zwavelzuur is 2 H3O+ + SO42-. Kaliloog is een oplossing van kaliumhydroxide in water, dus: K+ + OH-.quote:Op dinsdag 1 februari 2011 16:33 schreef Maarten302 het volgende:
Kan iemand mij helpen?
Ik moet de reactievergelijking van de neutralisatie van verdund zwavelzuur met kaliloog geven.
Volgens het antwoordenboekje is dit het antwoord: Voor de reactie Reactievergelijking Na de reactie
H3O+ + OH- --> 2 H2O
Zelf had ik dit bedacht: H2SO4 + KOH --> SO42- + K+ + 2H2O
Kan iemand mij vertellen of dit ook goed is, zo nee waarom niet?
bedankt!!
De reactievergelijking wordt dan:
2 H3O+ + SO42- + K+ + OH- -> H3O+ + SO42- + K+ + 2 H2O-
Als je dan alles wegstreept wat niets doet in de reactie:
2 H3O+ + SO42- + K+ + OH- -> H3O+ + SO42- + K+ + 2 H2O-
dan krijg je:
H3O+ + OH- --> 2 H2O
Dit antwoord klopt!quote:Op dinsdag 1 februari 2011 17:52 schreef Maarten302 het volgende:
Beste Fokkers,
Kan iemand mij helpen met het opstellen van de reactie (zuur-base) van vast bariumcarbonaat en een overmaat verdund zwavelzuur? Wat ik zelf dacht was: BACO3 + 2H3O+ ---> BA2+ + 3H2O + CO2
Is dit correct?
Bedankt!
Maarten


Dankjewel voor je reactie, ik snap het!quote:Op woensdag 2 februari 2011 10:04 schreef lyolyrc het volgende:
[..]
Jouw antwoord klopt niet helemaal. Verdund zwavelzuur is 2 H3O+ + SO42-. Kaliloog is een oplossing van kaliumhydroxide in water, dus: K+ + OH-.
De reactievergelijking wordt dan:
2 H3O+ + SO42- + K+ + OH- -> H3O+ + SO42- + K+ + 2 H2O-
Als je dan alles wegstreept wat niets doet in de reactie:
2 H3O+ + SO42- + K+ + OH- -> H3O+ + SO42- + K+ + 2 H2O-
dan krijg je:
H3O+ + OH- --> 2 H2O
[..]
Dit antwoord klopt!
Ik heb alleen nog een klein vraagje:Ik heb het later aan mijn leraar gevraagd, en hij vertelde mij dat er nog een reactie plaatsvindt tussen bariumionen en de sulfaationen. Als dat zo is, is mijn antwoord fout toch?


Daar heb ik zelf ook even overheen gekeken, terwijl ik nog expres heb opgezocht of bariumcarbonaat oplosbaar was in water.quote:Op woensdag 2 februari 2011 12:56 schreef Maarten302 het volgende:
[..]
Dankjewel voor je reactie, ik snap het!
Ik heb alleen nog een klein vraagje:Ik heb het later aan mijn leraar gevraagd, en hij vertelde mij dat er nog een reactie plaatsvindt tussen bariumionen en de sulfaationen. Als dat zo is, is mijn antwoord fout toch?
Er vindt inderdaad een reactie plaats tussen barium en sulfaat. Je mag hem uiteraard eerst zelf proberen, antwoord staat in de spoiler.
SPOILEROm spoilers te kunnen lezen moet je zijn ingelogd. Je moet je daarvoor eerst gratis Registreren. Ook kun je spoilers niet lezen als je een ban hebt.


Hallo
Is er een wiskunde fanaat onder jullie die zich geroepen om alle mogelijkheden (= 5!) van volgorde met de getallen 1 2 3 4 5 even in een lijstje te zetten.
Dus bijvoorbeeld 12345, 23145, 31245,
Alvast bedankt,
Herlinde
Is er een wiskunde fanaat onder jullie die zich geroepen om alle mogelijkheden (= 5!) van volgorde met de getallen 1 2 3 4 5 even in een lijstje te zetten.
Dus bijvoorbeeld 12345, 23145, 31245,
Alvast bedankt,
Herlinde
fgrgdg


en dat kan je zelf niet doen omdat?quote:Op zaterdag 5 februari 2011 18:28 schreef herlinde het volgende:
Hallo
Is er een wiskunde fanaat onder jullie die zich geroepen om alle mogelijkheden (= 5!) van volgorde met de getallen 1 2 3 4 5 even in een lijstje te zetten.
Dus bijvoorbeeld 12345, 23145, 31245,
Alvast bedankt,
Herlinde
~Si vis amari, ama~


Natuurlijk willen mensen hier wel 120 verschillende combinaties voor je uit schrijven. Als jij dan bij ze thuis de afwas doet een week langquote:Op zaterdag 5 februari 2011 18:28 schreef herlinde het volgende:
Hallo
Is er een wiskunde fanaat onder jullie die zich geroepen om alle mogelijkheden (= 5!) van volgorde met de getallen 1 2 3 4 5 even in een lijstje te zetten.
Dus bijvoorbeeld 12345, 23145, 31245,
Alvast bedankt,
Herlinde
Hiervoor heb je geen "wiskundefanaat" nodig heur
Ik schrijf boeken over wetenschap en filosofie!
https://www.epsilon-uitga(...)e-tijd-materie/10996
https://www.spectrumboeke(...)k-niet-9789000386765
https://www.spectrumboeke(...)tronen-9789000395071
https://www.epsilon-uitga(...)e-tijd-materie/10996
https://www.spectrumboeke(...)k-niet-9789000386765
https://www.spectrumboeke(...)tronen-9789000395071


quote:Op zaterdag 5 februari 2011 18:28 schreef herlinde het volgende:
Hallo
Is er een wiskunde fanaat onder jullie die zich geroepen om alle mogelijkheden (= 5!) van volgorde met de getallen 1 2 3 4 5 even in een lijstje te zetten.
Dus bijvoorbeeld 12345, 23145, 31245,
Alvast bedankt,
Herlinde


Heeft er hier iemand enig idee wat de term 'retrieval' betekend in de context van weer/klimaat studies?


EDIT: vraag opgelost, ik zat te slapen 
[ Bericht 73% gewijzigd door Jac0bus op 19-02-2011 18:12:10 ]
[ Bericht 73% gewijzigd door Jac0bus op 19-02-2011 18:12:10 ]
I had this song playing when Mary Ellen was born. Had her right there on the pool table, and they didn't stop the game...


over die cijfers, dat is gewoon 5^5 toch?
anyway...
vraagje over scheikunde:
een weekmaker verlaagd het Tg (glaspunt) van een polymeer. maar verlaagd het dan ook het Tv? dit lijkt mij namelijk wel logisch, maar staat er in het boek niet bij.
anyway...
vraagje over scheikunde:
een weekmaker verlaagd het Tg (glaspunt) van een polymeer. maar verlaagd het dan ook het Tv? dit lijkt mij namelijk wel logisch, maar staat er in het boek niet bij.


Weet iemand het antwoord hierop?
Noem 3 dingen die als projectiel gebruikt werden voor een trebuchet en wat de bedoeling daarvan was (behalve steen)
en...
Beschrijf hoe er toen oorlog gevoerd werd en waarom de trebuchet daarbij zeer gevreesd was.
Noem 3 dingen die als projectiel gebruikt werden voor een trebuchet en wat de bedoeling daarvan was (behalve steen)
en...
Beschrijf hoe er toen oorlog gevoerd werd en waarom de trebuchet daarbij zeer gevreesd was.


O.a. lijken om ziektes te verspreiden.quote:Op woensdag 23 februari 2011 16:52 schreef verwarmingsbank het volgende:
Weet iemand het antwoord hierop?
Noem 3 dingen die als projectiel gebruikt werden voor een trebuchet en wat de bedoeling daarvan was (behalve steen)
en...
Beschrijf hoe er toen oorlog gevoerd werd en waarom de trebuchet daarbij zeer gevreesd was.


Gevreesd? is dit wel beta huiswerk?
Afijn:
zoals al gezegd, om lijken met ziektes af te schieten.
Het mechanisme is zeer vernuftig en kan van vrij ver worden gebruikt en is daarmee zeer destructief.
Verder lijkt met het een nogal moraalbrekend wapen. Niemand zal graag vooraan de linie willen staan en in formatie blijven willen staan als er een grote romp op je af komt.
Anders dan dat, geen id.
Afijn:
zoals al gezegd, om lijken met ziektes af te schieten.
Het mechanisme is zeer vernuftig en kan van vrij ver worden gebruikt en is daarmee zeer destructief.
Verder lijkt met het een nogal moraalbrekend wapen. Niemand zal graag vooraan de linie willen staan en in formatie blijven willen staan als er een grote romp op je af komt.
Anders dan dat, geen id.


Ik zou niet teveel gaan antwoorden, volgens mij laat meneer ons zijn huiswerk maken. Hetzelfde is overigens ook in Gamma gepost.


Jij weer?quote:Op woensdag 23 februari 2011 19:42 schreef Ser_Ciappelletto het volgende:
Ik zou niet teveel gaan antwoorden, volgens mij laat meneer ons zijn huiswerk maken. Hetzelfde is overigens ook in Gamma gepost.
De rede waarom ik het ook in Gamma heb gepost is omdat Koffiegast zei dat dit geen betahuiswerk is.
Rede dat ik het hier geplaatst had is omdat het voor het vak techniek is en omdat mij dat het beste bij beta leek passen.
Rest van mijn reactie mag je lezen in Gamma.


Hoe zit het nu precies met statische en kinetische wrijvings coeficient?
Ik heb een auto die trekt op en zijn achterwielen slippen. Gegeven heb je de statische en kinetische wrijvings coefficient van de wielen.
In de berekening van de krachten in X richting gebruiken ze dan alleen de kinetische wrijvings coefficient van de slippende wielen. Verder doen ze niks met die coefficenten.
Waarom komt die statische niet van pas?
Ik heb een auto die trekt op en zijn achterwielen slippen. Gegeven heb je de statische en kinetische wrijvings coefficient van de wielen.
In de berekening van de krachten in X richting gebruiken ze dan alleen de kinetische wrijvings coefficient van de slippende wielen. Verder doen ze niks met die coefficenten.
Waarom komt die statische niet van pas?
Blues ain't nothing but a good man feeling bad...


De statische wrijvingscoëfficient wordt gebruikt als het object zich in rust bevindt als ik het mij goed herinner; de kinetische als het object in beweging is. (Als ik het mij nog beter herinner: statisch>kinetisch, er is meer kracht nodig om iets in beweging te brengen dan in beweging te houden)quote:Op donderdag 24 februari 2011 13:38 schreef GoodGawd het volgende:
Hoe zit het nu precies met statische en kinetische wrijvings coeficient?
Ik heb een auto die trekt op en zijn achterwielen slippen. Gegeven heb je de statische en kinetische wrijvings coefficient van de wielen.
In de berekening van de krachten in X richting gebruiken ze dan alleen de kinetische wrijvings coefficient van de slippende wielen. Verder doen ze niks met die coefficenten.
Waarom komt die statische niet van pas?


Het is toch zo dat de statische bepaald hoeveel kracht er nodig is om het in beweging te krijgen. En de kinetische bepaald hoeveel kracht er nodig is als het al bewegend is.
Dus als we met een stilstaande auto te maken hebben dan beginnen we met statische. Maar als het al rijdende is dan spreken we alleen nog over kinetische right?
Het is dus niet zo dat het dan statische plus kinetische is?
Dus als we met een stilstaande auto te maken hebben dan beginnen we met statische. Maar als het al rijdende is dan spreken we alleen nog over kinetische right?
Het is dus niet zo dat het dan statische plus kinetische is?
Blues ain't nothing but a good man feeling bad...


Statische wrijvingskrachten heb je bij normaal contact tussen band en grond. Dynamisch zodra het zaakje begint te slippen. Vandaar ook ABS - zodra de band niet draait en de auto in beweging is, heb je dynamische wrijving, die veel lager is dan statische wrijving. Dat remt niet goed.
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson


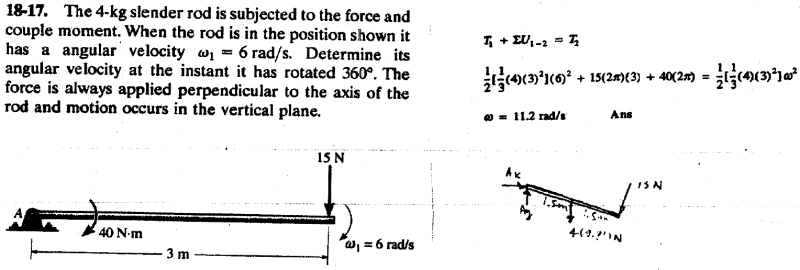
T staat voor 1/2 m v2
Waar komt die 1/3 4 32 vandaan?
Dat moet dus gelijk zijn aan de massa, maar hoe komen ze daarbij?
Blues ain't nothing but a good man feeling bad...


Dat is het traagheidsmoment van die stok.
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


Oh, ik dacht dat het voor een dunne staaf 1/12 was..dat zegt het formule blad tenminste.
T staat voor 1/2 I(massatraagheidsmoment) v2 trouwens.
Ziehier:
[ Bericht 24% gewijzigd door GoodGawd op 25-02-2011 17:18:54 ]
T staat voor 1/2 I(massatraagheidsmoment) v2 trouwens.
Ziehier:
[ Bericht 24% gewijzigd door GoodGawd op 25-02-2011 17:18:54 ]
Blues ain't nothing but a good man feeling bad...


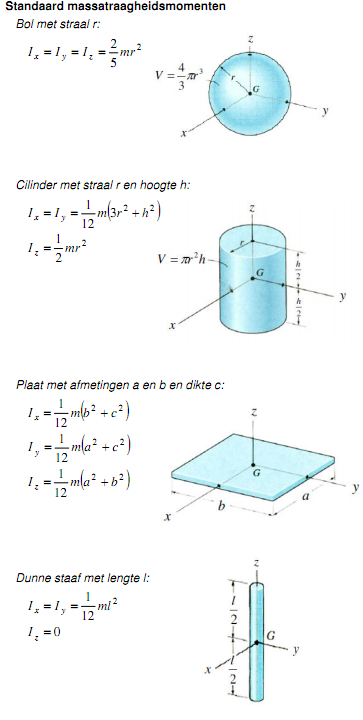
Houd er wel rekening mee dat de as waarom de staaf draait niet door het massamiddelpunt van de staaf loopt. Je moet het massatraagheidsmoment daarop aanpassen.
Voor een dunne staaf met lengte d geldt dan:
I = IG + m(d/2)2 = 1/12 md2 + m(d/2)2 = 1/12 md2 + 1/4 md2 = (1/12 + 1/4) md2 = 1/3md2
Zie ook deze tabel voor situatie h.
[ Bericht 0% gewijzigd door lyolyrc op 25-02-2011 23:57:03 ]
Voor een dunne staaf met lengte d geldt dan:
I = IG + m(d/2)2 = 1/12 md2 + m(d/2)2 = 1/12 md2 + 1/4 md2 = (1/12 + 1/4) md2 = 1/3md2
Zie ook deze tabel voor situatie h.
[ Bericht 0% gewijzigd door lyolyrc op 25-02-2011 23:57:03 ]


Kan iemand mij a.u.b. helpen met vraag e?
Het antwoord luidt:
Mijn dank is groot.
Het antwoord luidt:
Wat bedoelen ze met het vetgedrukte? C4 is toch een asymmetrische atoom waardoor je dus cis-D-, cis-L-, trans-D- en trans-L-4-chloor-2-penteen zou verwachten.quote:(1) Bij afsplitsing van één HCl-molecuul ontstaan 4-chloor-1-penteen,
en cis- en trans-4-chloor-2-penteen, waarbij de configuratie aan het asymmetrische C-atoom
niet verandert.
Mijn dank is groot.


Waarom heet die eerste stof 3-chloor-1-buteen in plaats van 3-chloorbuteen?
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


zoek het begrip van configuratie is op;) bovendien, dubbele bindingen maken een molecuul minder beweeglijk...


Die dubbele binding van buteen kan toch aan de zijkant (1-) of op de middelste plek zitten (2-) ?quote:Op zondag 27 februari 2011 14:06 schreef GlowMouse het volgende:
Waarom heet die eerste stof 3-chloor-1-buteen in plaats van 3-chloorbuteen?
gr gr


Ok, maar wat ik niet snap is dat bij vraag a gevraagd wordt:quote:Op zondag 27 februari 2011 14:26 schreef kevintjuhh2 het volgende:
zoek het begrip van configuratie is op;) bovendien, dubbele bindingen maken een molecuul minder beweeglijk...
En bij vraag e heb je dezelfde stof..quote:Er zijn vier stereo-isomeren met de systematische naam: 4-chloor-2-penteen.
a. Leg uit waardoor er vier isomeren zijn.
Er is een dubbele binding die cis-trans isomerie veroorzaakt en er is een asymmetrisch Catoom
(C4).
b. Hoe worden in de naamgeving deze isomeren van elkaar onderscheiden ?
De vier isomeren zijn dus cis-D-, cis-L-, trans-D- en trans-L-4-chloor-2-penteen.
[ Bericht 5% gewijzigd door Warren op 27-02-2011 14:46:49 ]


Ik heb een oplossing van FeCl en een oplossing van KSCN, die voeg ik bij elkaar en er ontstaat een nieuw mengsel.
Vervolgens voeg ik AgNO3 - kristallen erbij, wat is de reactie die dan ontstaat?
Ik dacht iets met redox, maar kom er niet uit
Vervolgens voeg ik AgNO3 - kristallen erbij, wat is de reactie die dan ontstaat?
Ik dacht iets met redox, maar kom er niet uit


neerslag?quote:Op zondag 27 februari 2011 17:56 schreef marsPlanets het volgende:
Ik heb een oplossing van FeCl en een oplossing van KSCN, die voeg ik bij elkaar en er ontstaat een nieuw mengsel.
Vervolgens voeg ik AgNO3 - kristallen erbij, wat is de reactie die dan ontstaat?
Ik dacht iets met redox, maar kom er niet uit


Jouw analyse klopt gewoon, aangenomen dat zowel de L- als D-configuratie aanwezig is. De opgave vertelt echter niet welke isomeren van 2,4-dichloorpentaan aanwezig zijn en daarom is het antwoord van de opgave ook niet zo specifiek. Overigens zou ik zelf liever R- en S-nomenclatuur gebruiken, omdat daarmee de absolute configuratie wordt vastgelegd.quote:Op zondag 27 februari 2011 14:38 schreef Warren het volgende:
[..]
Ok, maar wat ik niet snap is dat bij vraag a gevraagd wordt:
[..]
En bij vraag e heb je dezelfde stof..
Ben benieuwd waar jij FeCl vandaan wil gaan halen.quote:Op zondag 27 februari 2011 17:56 schreef marsPlanets het volgende:
Ik heb een oplossing van FeCl en een oplossing van KSCN, die voeg ik bij elkaar en er ontstaat een nieuw mengsel.
Vervolgens voeg ik AgNO3 - kristallen erbij, wat is de reactie die dan ontstaat?
Ik dacht iets met redox, maar kom er niet uit
En dat is inderdaad het antwoord. En welk neerslag? Hint: fotografie.quote:


Bedankt! Maar weet jij misschien wat ze bedoelen met het vetgedruktequote:Op maandag 28 februari 2011 15:18 schreef lyolyrc het volgende:
[..]
Jouw analyse klopt gewoon, aangenomen dat zowel de L- als D-configuratie aanwezig is. De opgave vertelt echter niet welke isomeren van 2,4-dichloorpentaan aanwezig zijn en daarom is het antwoord van de opgave ook niet zo specifiek. Overigens zou ik zelf liever R- en S-nomenclatuur gebruiken, omdat daarmee de absolute configuratie wordt vastgelegd.
(1) Bij afsplitsing van één HCl-molecuul ontstaan 4-chloor-1-penteen,
en cis- en trans-4-chloor-2-penteen, waarbij de configuratie aan het asymmetrische C-atoom
niet verandert.
Bedoelen ze hiermee te zeggen dat die L-en D-configuraties er niet in aanwezig zijn?


Blijkbaar was mijn eerste uitleg nog niet duidelijk genoeg, dus dan probeer ik het nog een keer. In 2,4-dichloorpentaan zijn twee stereocentra aanwezig. Na afsplitsen van een molecuul HCl wordt er een dubbele binding gevormd (cis of trans) en blijft er nog één stereocentrum over. Dat stereocentrum heeft of de R- of de S-configuratie. Die configuratie van het overgebleven stereocentrum is hetzelfde als voor afsplitsing van HCl.quote:Op dinsdag 1 maart 2011 12:33 schreef Warren het volgende:
[..]
Bedankt! Maar weet jij misschien wat ze bedoelen met het vetgedrukte
(1) Bij afsplitsing van één HCl-molecuul ontstaan 4-chloor-1-penteen,
en cis- en trans-4-chloor-2-penteen, waarbij de configuratie aan het asymmetrische C-atoom
niet verandert.
Bedoelen ze hiermee te zeggen dat die L-en D-configuraties er niet in aanwezig zijn?
Zoals ik al zei: L en D zou ik hier niet gebruiken, omdat dat meer gebruikelijk is bij biologische moleculen, terwijl R en S de absolute configuratie vastlegt.
Even een voorbeeld met een plaatje: stel je hebt 2S,4R-dichloorpentaan en HCl splitst zich af bij het 2e koolstofatoom. Het 4e koolstofatoom heeft voor afsplitsing de R-configuratie en zal dat na HCl-afsplitsing ook hebben. Links staat het isomeer van 1-penteen en rechts de isomeren van 2-penteen. De configuratie van het vierde koolstofatoom is bij dichloorpentaan al R, bij alle producten blijft dat R. Was die configuratie S geweest, dan was dat ook S gebleven na afsplitsing van HCl bij het tweede koolstofatoom. Dat is wat er bedoeld wordt met de dikgedrukte zin.


Lyolyrc, bedankt  . Ik snap nu wat met de configuratie van het asymmetrische C-atoom wordt bedoeld. Hiermee is de zaak opgehelderd.
. Ik snap nu wat met de configuratie van het asymmetrische C-atoom wordt bedoeld. Hiermee is de zaak opgehelderd.


Ik heb dringend hulp nodig met deze buffer vraag!
Je lost 0,84 g NaHCO3 op in 1,0 L water.
Daarbij voeg je een oplossing van 1 L met 1,06g Na2CO3.
Daarbij voeg je 250mL 0,10 M HNO3-oplossing toe.
Bereken de pH.
De eerste 2 vormen dus een buffer. De H3O+ van HNO3 ( sterk zuur ) reageert met CO3 uit de 1e oplossing, er is echter een overmaat aan H3O+ waardoor al het CO3 opreageert, hoe word de bufferformule dan??
Kz = [H3O+] * 0 / [HCO3]
Dit kan niet want de onbekende, H3O+ valt dan weg omdat je met 0 vermenigvuldigt. Hoe werkt dit?
Je lost 0,84 g NaHCO3 op in 1,0 L water.
Daarbij voeg je een oplossing van 1 L met 1,06g Na2CO3.
Daarbij voeg je 250mL 0,10 M HNO3-oplossing toe.
Bereken de pH.
De eerste 2 vormen dus een buffer. De H3O+ van HNO3 ( sterk zuur ) reageert met CO3 uit de 1e oplossing, er is echter een overmaat aan H3O+ waardoor al het CO3 opreageert, hoe word de bufferformule dan??
Kz = [H3O+] * 0 / [HCO3]
Dit kan niet want de onbekende, H3O+ valt dan weg omdat je met 0 vermenigvuldigt. Hoe werkt dit?


Om te beginnen is het handig om eerst eens te berekenen hoeveel mol van elke stof aanwezig is:quote:Op dinsdag 8 maart 2011 11:10 schreef Dae1337 het volgende:
Ik heb dringend hulp nodig met deze buffer vraag!
Je lost 0,84 g NaHCO3 op in 1,0 L water.
Daarbij voeg je een oplossing van 1 L met 1,06g Na2CO3.
Daarbij voeg je 250mL 0,10 M HNO3-oplossing toe.
Bereken de pH.
De eerste 2 vormen dus een buffer. De H3O+ van HNO3 ( sterk zuur ) reageert met CO3 uit de 1e oplossing, er is echter een overmaat aan H3O+ waardoor al het CO3 opreageert, hoe word de bufferformule dan??
Kz = [H3O+] * 0 / [HCO3]
Dit kan niet want de onbekende, H3O+ valt dan weg omdat je met 0 vermenigvuldigt. Hoe werkt dit?
NaHCO3: 0,84/84,01 = 0,010 mol = 10 mmol
Na2CO3: 1,06/105,99 = 0,010 mol = 10 mmol
HNO3: 0,10*0,250 = 0,025 mol = 25 mmol
Als je het zuur bij de buffer gooit, gaan er twee reacties optreden. In eerste instantie wordt het carbonaat een keer geprotoneerd, zodat bicarbonaat wordt gevormd:
CO32- + H3O+ -> HCO3-
Er is echter slechts 10 mmol carbonaat, wat reageert met 10 mmol zuur, waardoor er nog 15 mmol zuur overblijft. Het restant van het zuur gaat reageren met bicarbonaat, wat leidt tot de vorming van koolzuur. Deze stof splitst zich weer in koolstofdioxide dat uit de oplossing bubbelt en water:
HCO3- + H3O+ -> H2CO3 -> H2O + CO2
Omdat er in totaal 20 mmol bicarbonaat is en 15 mmol zuur, zal er nog 5 mmol bicarbonaat overblijven dat een evenwicht instelt met het water:
HCO3- + H2O <-> CO32- + H3O+
Hierbij hoort de evenwichtsconstante: Ka = [H3O+][CO32-]/[HCO3-]
Laten we stellen dat van de 5 mmol HCO3- er x mmol wordt gedeprotoneerd, wat x mmol CO32- en x mmol H3O+ geeft.
Substitueer deze getallen in de evenwichtsvoorwaarde:
Ka = (x/2,25)(x/2,25)/((5*10-3 - x)/2,25)
Dit geeft de vergelijking: x2 + 2,25*Ka*x - 2,25*5*10-3*Ka = 0
Oplossen geeft x = 7,26*10-7
pH = -log([H3O+]) = -log(7,26*10-7/2,25) = 6,49
Je kunt deze waarde eventueel nog controleren met de Henderson-Hasselbalchvergelijking.


Jij bent mijn held! Duizendmaal dank! Mijn leraar geeft echter een ander antwoord, nl. pH = 5,87. Leraren zijn echter ook mensen die foutjes kunnen maken.quote:Op dinsdag 8 maart 2011 15:22 schreef lyolyrc het volgende:
[..]
Om te beginnen is het handig om eerst eens te berekenen hoeveel mol van elke stof aanwezig is:
NaHCO3: 0,84/84,01 = 0,010 mol = 10 mmol
Na2CO3: 1,06/105,99 = 0,010 mol = 10 mmol
HNO3: 0,10*0,250 = 0,025 mol = 25 mmol
Als je het zuur bij de buffer gooit, gaan er twee reacties optreden. In eerste instantie wordt het carbonaat een keer geprotoneerd, zodat bicarbonaat wordt gevormd:
CO32- + H3O+ -> HCO3-
Er is echter slechts 10 mmol carbonaat, wat reageert met 10 mmol zuur, waardoor er nog 15 mmol zuur overblijft. Het restant van het zuur gaat reageren met bicarbonaat, wat leidt tot de vorming van koolzuur. Deze stof splitst zich weer in koolstofdioxide dat uit de oplossing bubbelt en water:
HCO3- + H3O+ -> H2CO3 -> H2O + CO2
Omdat er in totaal 20 mmol bicarbonaat is en 15 mmol zuur, zal er nog 5 mmol bicarbonaat overblijven dat een evenwicht instelt met het water:
HCO3- + H2O <-> CO32- + H3O+
Hierbij hoort de evenwichtsconstante: Ka = [H3O+][CO32-]/[HCO3-]
Laten we stellen dat van de 5 mmol HCO3- er x mmol wordt gedeprotoneerd, wat x mmol CO32- en x mmol H3O+ geeft.
Substitueer deze getallen in de evenwichtsvoorwaarde:
Ka = (x/2,25)(x/2,25)/((5*10-3 - x)/2,25)
Dit geeft de vergelijking: x2 + 2,25*Ka*x - 2,25*5*10-3*Ka = 0
Oplossen geeft x = 7,26*10-7
pH = -log([H3O+]) = -log(7,26*10-7/2,25) = 6,49
Je kunt deze waarde eventueel nog controleren met de Henderson-Hasselbalchvergelijking.
Bedankt nogmaals


quote:De pH in de dikke darm varieert van 7,5 tot 8,0. Daarom komen in de dikke darm
vrijwel geen carbonzuren voor maar vooral de zuurresten van carbonzuren.
Daarom staan in dit schema niet de namen van de carbonzuren, maar de namen
van de zuurresten pyruvaat, lactaat, acetaat, butanoaat en propanoaat.
Bereken hoe groot de molverhouding propanoaat : propaanzuur in de dikke darm
tenminste is. Maak gebruik van Binas-tabel 49.
Geen moeilijke vraag, alleen in het antwoord gebruiken ze de pH van 7,5. Aangezien de pH varieert tussen 7,5 en 8,0, zou ik de pH van 7,75 nemen. Is dat fout?
Alvast bedankt.


Het antwoord op deze vraag is meer tekstverklaren dan bètawetenschapquote:Op vrijdag 11 maart 2011 12:49 schreef Warren het volgende:
[..]
[ afbeelding ]
Geen moeilijke vraag, alleen in het antwoord gebruiken ze de pH van 7,5. Aangezien de pH varieert tussen 7,5 en 8,0, zou ik de pH van 7,75 nemen. Is dat fout?
Alvast bedankt.
Let op het woordje 'tenminste'. Aangezien bij lagere pH meer zuur en minder zuurrest aanwezig is, zal de verhouding tussen zuurrest en zuur bij pH 7,5 het kleinst zijn. En omdat je de minimale verhouding tussen die twee moet bepalen, moet je rekenen met de laagste pH.quote:Bereken hoe groot de molverhouding propanoaat : propaanzuur in de dikke darm
tenminste is.


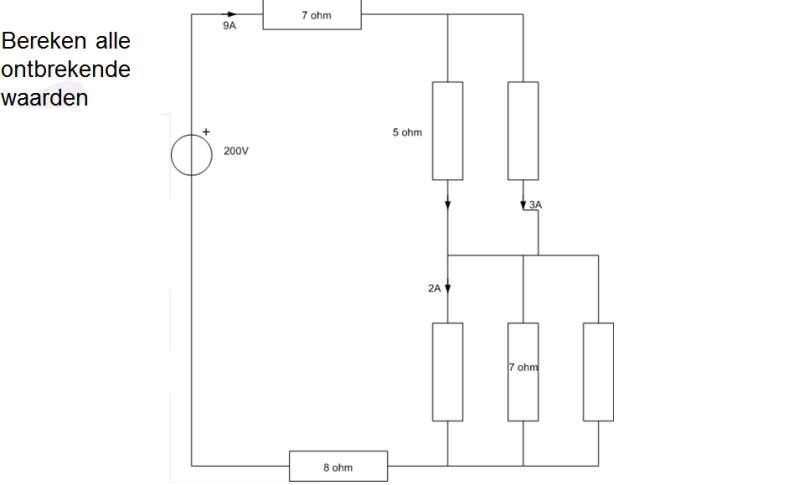
Beetje simpel basisvraag, ben weer even aan het opfrissen elektrotechniek:
De eerste 2 weerstanden zijn 5 en 10 met 6 e 3 ampere denk ik. Maar hoe pak ik die 3 andere weerstanden aan?
De eerste 2 weerstanden zijn 5 en 10 met 6 e 3 ampere denk ik. Maar hoe pak ik die 3 andere weerstanden aan?
Blues ain't nothing but a good man feeling bad...


Oh wacht ik denk dat ik het weet. Je berekent nog even de spanning over de 8 ohm weerstand. Vervolgens trekt je alle spanningen van de Bron spanning af. Dan hou je getal voor de spanning over de 3 weerstanden over. En dan is het eitje.
Correct?
Correct?
Blues ain't nothing but a good man feeling bad...


Dat is volgens mij correct. Wat krijg je voor waarden?
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson


Spanning over 8Ohm weerstand 72V.
Spanning over de 3 weerstanden is 35V.
vlnr. 17,5 ohm, 7 ohm, 17,5 ohm
vlnr. 2 A, 5 A, 2 A
Spanning over de 3 weerstanden is 35V.
vlnr. 17,5 ohm, 7 ohm, 17,5 ohm
vlnr. 2 A, 5 A, 2 A
Blues ain't nothing but a good man feeling bad...


Klopt allemaalquote:Op woensdag 16 maart 2011 15:11 schreef GoodGawd het volgende:
Spanning over 8Ohm weerstand 72V.
Spanning over de 3 weerstanden is 35V.
vlnr. 17,5 ohm, 7 ohm, 17,5 ohm
vlnr. 2 A, 5 A, 2 A
The biggest argument against democracy is a five minute discussion with the average voter.


Ik kreeg er zelf twee tegenstrijdige antwoorden uit:quote:Wordt de pH van de oplossing hoger, of lager wanneer een half kopje bakpoeder
in plaats van een kwart kopje wordt gebruikt, of krijg je een oplossing met
dezelfde pH (298 K)? Geef een verklaring voor je antwoord.
- Aan de ene kant dacht ik dat de pH hetzelfde zou zijn aangezien de Kb, Kz, en Kw niet veranderen als je meer bakpoeder toevoegt. Ook zie je nergens in de formule dat de [H3O+] afhankelijk is van de hoeveelheid bakpoeder.
- Aan de andere kant dacht ik dat de pH hoger zou worden omdat HCO3- met water als base reageert omdat het een amfolyt is en Kb>Kz. Als je meer HCO3- toevoegt, heb je meer OH- ionen en dus een hogere pH, want het evenwicht ligt meer rechts bij HCO3- + H2O <> H2CO3 + OH-
Het antwoordenmodel zegt:
Waarom is het ene antwoord "correcter" dan het andere? (Hoe is de tegenstrijdigheid te verklaren?)quote:Voorbeelden van een juist antwoord zijn:
− Volgens de gegeven formule is de [H3O+] niet afhankelijk van de
hoeveelheid bakpoeder die wordt opgelost, dus krijg je een oplossing
met dezelfde pH wanneer de dubbele hoeveelheid bakpoeder wordt
gebruikt. 2 punten
of
− Kw, Kz en Kb zijn constanten (bij 298 K), dus krijg je een oplossing met
dezelfde pH wanneer de dubbele hoeveelheid bakpoeder wordt
gebruikt. 2 punten
Indien een antwoord is gegeven als: „Natriumwaterstofcarbonaat is
(overwegend) een base, dus als je meer oplost per liter wordt de pH hoger.”
1 punt
Alvast bedankt.


oke, ik moet een paar vragen doen waar ik niks van snap, hopelijk kunnen jullie helpen.
Ik moest een experiment doen, waarbij ik 3 stoffen moest mensen: Natriumthiosulfaatoplossing (Na2S2O3), gedestilleerd water en waterstofchlorideoplossing (zoutzuur, HCl).
Ik heb 5 metingen gedaan, de hoeveelheden van elke vloeistof in mL:
Meting 1 2 3 4 5
Na2S2O3 10 15 20 25 30
gedes. water 35 30 25 20 15
zoutzuur 5 5 5 5 5
Nu moet ik bij elke meting de [S2O3²-] bepalen. Maar ik heb geen idee hoe?
Ook moet ik nog een paar vragen beantwoorden over medicijnen, met massa% en oplossen van jood etc. kan iemand me hierbij helpen?
alvast bedankt!
Ik moest een experiment doen, waarbij ik 3 stoffen moest mensen: Natriumthiosulfaatoplossing (Na2S2O3), gedestilleerd water en waterstofchlorideoplossing (zoutzuur, HCl).
Ik heb 5 metingen gedaan, de hoeveelheden van elke vloeistof in mL:
Meting 1 2 3 4 5
Na2S2O3 10 15 20 25 30
gedes. water 35 30 25 20 15
zoutzuur 5 5 5 5 5
Nu moet ik bij elke meting de [S2O3²-] bepalen. Maar ik heb geen idee hoe?
Ook moet ik nog een paar vragen beantwoorden over medicijnen, met massa% en oplossen van jood etc. kan iemand me hierbij helpen?
alvast bedankt!
| Forum Opties | |
|---|---|
| Forumhop: | |
| Hop naar: | |