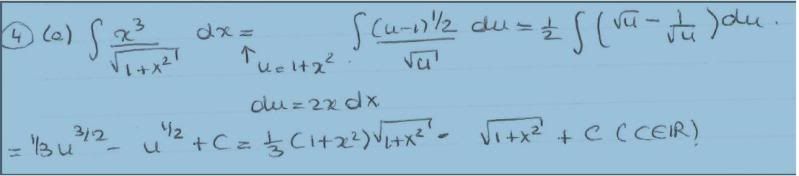SES School, Studie en Onderwijs
Wiskunde in de brugklas, Frans voor het examen of een studie Personeel en Arbeid? Moeilijke formulieren van DUO? Iets weten over studiefinanciering of studentenverenigingen? Dit is het forum voor leerkrachten, scholieren en studenten, van brugklas tot uni



Vorige deel: [Bèta overig] 'Huiswerk- en vragentopic'.
Post hier weer al je vragen, passies, trauma's en andere dingen die je uit je slaap houden met betrekking tot de vakken:
Natuurkunde
Informatica
Scheikunde
Biologie
Algemene Natuurwetenschappen
... en alles wat verder in de richting komt.
Van MBO tot WO, hier is het topic waar je een antwoord kunt krijgen op je vragen.
Opmaak: http://betahw.mine.nu/index.php: site van GlowMouse om formules te kunnen gebruiken in je posts (op basis van Latexcode wordt een plaatje gegenereerd dat je vervolgens via het aangegeven linkje kunt opnemen).
Post hier weer al je vragen, passies, trauma's en andere dingen die je uit je slaap houden met betrekking tot de vakken:
Van MBO tot WO, hier is het topic waar je een antwoord kunt krijgen op je vragen.
Opmaak: http://betahw.mine.nu/index.php: site van GlowMouse om formules te kunnen gebruiken in je posts (op basis van Latexcode wordt een plaatje gegenereerd dat je vervolgens via het aangegeven linkje kunt opnemen).
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson


Nog maar een keer dan:
Hoe béta dit precies is zou ik zo niet weten, maar misschien heeft iemand een idee in dit topic.
Ik vroeg me het volgende af: Is het correct dat de Vena Hepaticus rechtstreeks naar de Vena Cava Posterior loopt
Hoe béta dit precies is zou ik zo niet weten, maar misschien heeft iemand een idee in dit topic.
Ik vroeg me het volgende af: Is het correct dat de Vena Hepaticus rechtstreeks naar de Vena Cava Posterior loopt


Die vraag uit het vorige topic, over het gehoor en Matlab, is wel geinig. Ik zit nu een beetje te kloten met Matlab, en chirps te maken:
t = 0:0.0001:20; % 20 secs @ 10kHz sample rate
y=chirp(t,1500,20,0); % Start @ 1500 Hz, cross 0 Hz at t = 20 s
figure; plot(y);
sound(y,10000);
t = 0:0.0001:20; % 20 secs @ 10kHz sample rate
y=chirp(t,1500,20,0); % Start @ 1500 Hz, cross 0 Hz at t = 20 s
figure; plot(y);
sound(y,10000);
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson


Volgens mijn anatomieboek (Human Anatomy & Physiology, geschreven door Elaine M. Marieb) monden de Venae Hepaticae (het zijn er twee!) uit in de Vena Cava Inferior. Er wordt geen Vena Cava Posterior genoemd.quote:Op zaterdag 5 december 2009 14:24 schreef horned_reaper het volgende:
Nog maar een keer dan:
Hoe béta dit precies is zou ik zo niet weten, maar misschien heeft iemand een idee in dit topic.
Ik vroeg me het volgende af: Is het correct dat de Vena Hepaticus rechtstreeks naar de Vena Cava Posterior loopt
Voor degenen die geen Latijn snappen: de leveraders monden uit in de onderste holle ader.


Ik heb een vraagje over een opdracht bij een systeembord:
Maak een inbraakalarm dat niet alleen reageert op het bewegen voor een lichtsensor, maar ook op geluid
Omdat een lichtsensor normaal reageert als er licht brandt en nu juist moet reageren omdat er geen licht brandt, heb ik een invertor gebruikt.
Nu heb ik het volgende:
Zit het zo goed in elkaar of mist er nog iets?
Maak een inbraakalarm dat niet alleen reageert op het bewegen voor een lichtsensor, maar ook op geluid
Omdat een lichtsensor normaal reageert als er licht brandt en nu juist moet reageren omdat er geen licht brandt, heb ik een invertor gebruikt.
Nu heb ik het volgende:
Zit het zo goed in elkaar of mist er nog iets?


Het moet ook op geluid reageren, dus gebruik een OR-port i.p.v. 'n AND-port  . Mits ik de vraag goed interpreteer... Moet het alarm afgaan als er geluid én beweging is? Of als het één van beide is? Als het één van beide is moet je de AND-port vervangen door een OR-port. Nu even zelf 'n vraagje, betreft een boole algebra, ik moet een boolse expressie vereenvoudigen, dit doe ik als volgt:
. Mits ik de vraag goed interpreteer... Moet het alarm afgaan als er geluid én beweging is? Of als het één van beide is? Als het één van beide is moet je de AND-port vervangen door een OR-port. Nu even zelf 'n vraagje, betreft een boole algebra, ik moet een boolse expressie vereenvoudigen, dit doe ik als volgt:
Klopt dit allemaal wel? Heb er al een tijd niet meer meegewerkt en kan ik hem nog verder vereenvoudigen met 'n regeltje mits alles klopt? Ik heb geen idee helaas.
Zelfde vraag voor het volgende:
[ Bericht 11% gewijzigd door Diabox op 06-12-2009 16:23:19 ]
| 1 2 3 4 5 6 7 8 9 | = B.!N(!T + T) + T.!B.!N + T.B.N (1e distrubutieve wet) = B.!N + T.!B.!N + T.B.N (rekenregel, (!T + T) = 1) = B.(!N + T.N) + T.!B.!N (1e distrubutieve wet) = B.(!N + T) + T.!B.!N (absorptie wet) = B.!N + B.T + T.!B.!N (1e distrubutieve wet) = B.!N + T(B + !B.!N) (1e distrubutieve wet) = B.!N + T(B + !N) (absorptie wet) = B.!N + T.B + T.!N (1e distrubutieve wet) |
Klopt dit allemaal wel? Heb er al een tijd niet meer meegewerkt en kan ik hem nog verder vereenvoudigen met 'n regeltje mits alles klopt? Ik heb geen idee helaas.
Zelfde vraag voor het volgende:
| 1 2 3 4 5 6 | = T.N(!B + B) + !T.B.N + T.B.!N (1e distrubutieve wet) = T.N + !T.B.N + T.B.!N (rekenregel, (!B + B) = 1) = T(N + B.!N) + !T.B.N (1e distrubutieve wet) = T(N + B) + !T.B.N (absorptie wet) = T.N + T.B + !T.B.N (1e distrubutieve wet) |
[ Bericht 11% gewijzigd door Diabox op 06-12-2009 16:23:19 ]


Oja ik zie het.quote:Op zondag 6 december 2009 16:17 schreef Diabox het volgende:
Het moet ook op geluid reageren, dus gebruik een OR-port i.p.v. 'n AND-port. Mits ik de vraag goed interpreteer... Moet het alarm afgaan als er geluid én beweging is? Of als het één van beide is? Als het één van beide is moet je de AND-port vervangen door een OR-port.
Het alarm moet reageren als één van beide aanwezig is (en ook als beide aanwezig zijn natuurlijk). Dan moet het natuurlijk een OR-poort zijn.
[ Bericht 0% gewijzigd door Butterfly91 op 06-12-2009 16:34:28 ]


| 1 2 3 | -------- - ---------------------------------------------- 2^16 2^I |
Hoe zou je bovenstaande kunnen vereenvoudigen tot een enkele formule? Als ik het plot is het bijna een e-macht, afgezien dat de uitkomst bij I > 16 natuurlijk 0 is. Oftewel: is afkappen wiskundig te benaderen?
'To alcohol, the cause of and the solution to all of life's problems' - Homer J. Simpson


Scheikunde:
Ik ben bezig geweest met het maken van titratiecurven bij een zuur-base titratie. Nu moeten we het equivalentiepunt bepalen aan de hand van twee methoden: de tweede afgeleide en de gran-plot methode.
Ik weet hoe en wat ik moet doen, maar ik weet niet waarom / wat het principe erachter is. Wat heb je als je die grafieken hebt gemaakt?
Kan iemand mij dat misschien beknopt uitleggen en/of verwijzen naar een bron?
Ik ben bezig geweest met het maken van titratiecurven bij een zuur-base titratie. Nu moeten we het equivalentiepunt bepalen aan de hand van twee methoden: de tweede afgeleide en de gran-plot methode.
Ik weet hoe en wat ik moet doen, maar ik weet niet waarom / wat het principe erachter is. Wat heb je als je die grafieken hebt gemaakt?
Kan iemand mij dat misschien beknopt uitleggen en/of verwijzen naar een bron?
"Everything we are, we are when we're alone."


Met de eerste afgeleide bepaal je de steilheid van een curve, met de tweede afgeleide de verandering van de steilheid, waardoor je de buigpunten van een curve kunt bepalen. Het idee achter deze methode is dat het equivalentiepunt op het steilste punt van de lijn curve ligt, precies in het buigpunt van de curve.quote:Op dinsdag 8 december 2009 15:24 schreef Meursault het volgende:
Scheikunde:
Ik ben bezig geweest met het maken van titratiecurven bij een zuur-base titratie. Nu moeten we het equivalentiepunt bepalen aan de hand van twee methoden: de tweede afgeleide en de gran-plot methode.
Ik weet hoe en wat ik moet doen, maar ik weet niet waarom / wat het principe erachter is. Wat heb je als je die grafieken hebt gemaakt?
Kan iemand mij dat misschien beknopt uitleggen en/of verwijzen naar een bron?
Een nadeel is dat deze methode geen rekening houdt met meetfouten. Bij de Gran-plot curve worden waarden gemiddeld, waardoor meetfouten minder zwaar gaan wegen.
Wikipedia is je vriend: Gran-plot en Tweede afgeleide


Wie zou deze vraag even voor mij uit kunnen werken !! 
"The H2/CO ratio in mixtures of carbon monoxide and hydrogen (called synthesis gas) is increased by the water-gas shift reaction CO(g) + H2O(g) <==> CO2(g) + H2(g), Which has an equilibrium constant Kc = 4,24 at 800 K.
Calculate the equilibrium concentrations of Co2, H2, Co and H2O at 800 K if only CO and H2O are present initially at concentrations of 0,150 M."
"The H2/CO ratio in mixtures of carbon monoxide and hydrogen (called synthesis gas) is increased by the water-gas shift reaction CO(g) + H2O(g) <==> CO2(g) + H2(g), Which has an equilibrium constant Kc = 4,24 at 800 K.
Calculate the equilibrium concentrations of Co2, H2, Co and H2O at 800 K if only CO and H2O are present initially at concentrations of 0,150 M."


Eerst schrijven we het evenwicht maar eens even op: Kc = [CO2][H2]/([CO][H2O]) = 4.24
Op t = t0 geldt:
[CO] = [H2O] = 0.150 M
Bij evenwicht geldt:
[CO2] = [H2] = x
[CO] = [H2O] = 0.150 M - x
Invullen in de uitdrukking voor Kc geeft: Kc = x2/(0.150-x)2 = 4.24
Werk dit uit met de abc-formule. Er komen dan twee concentraties uit. Slechts één daarvan is de goede oplossing (welke?!)
Op t = t0 geldt:
[CO] = [H2O] = 0.150 M
Bij evenwicht geldt:
[CO2] = [H2] = x
[CO] = [H2O] = 0.150 M - x
Invullen in de uitdrukking voor Kc geeft: Kc = x2/(0.150-x)2 = 4.24
Werk dit uit met de abc-formule. Er komen dan twee concentraties uit. Slechts één daarvan is de goede oplossing (welke?!)


Maar ik mag de ABC formule hier niet bij gebruiken.quote:Op donderdag 10 december 2009 11:39 schreef lyolyrc het volgende:
Eerst schrijven we het evenwicht maar eens even op: Kc = [CO2][H2]/([CO][H2O]) = 4.24
Op t = t0 geldt:
[CO] = [H2O] = 0.150 M
Bij evenwicht geldt:
[CO2] = [H2] = x
[CO] = [H2O] = 0.150 M - x
Invullen in de uitdrukking voor Kc geeft: Kc = x2/(0.150-x)2 = 4.24
Werk dit uit met de abc-formule. Er komen dan twee concentraties uit. Slechts één daarvan is de goede oplossing (welke?!)
Wat zou je dan doen ?
(denk aan Wortel trekken)


Ik zie zo niet in hoe het anders opgelost moet worden. Het evenwicht geeft een tweedgraads vergelijking. Dan is de abc-formule de oplossingsstrategie. Misschien dat anderen nog een idee hebben?quote:Op donderdag 10 december 2009 11:57 schreef horned_reaper het volgende:
Maar ik mag de ABC formule hier niet bij gebruiken.
Wat zou je dan doen ?
(denk aan Wortel trekken)


Kwadraat afsplitsen, maar eigenlijk ben je dan gewoon de grunt work voor het afleiden van de ABC-formule aan het doen.quote:Op donderdag 10 december 2009 12:36 schreef lyolyrc het volgende:
[..]
Ik zie zo niet in hoe het anders opgelost moet worden. Het evenwicht geeft een tweedgraads vergelijking. Dan is de abc-formule de oplossingsstrategie. Misschien dat anderen nog een idee hebben?


Dat is toch veel te omslachtig in dit geval! Ik kan me niet voorstellen dat het probleem op deze manier moet worden opgelost. Maar wel bedankt voor je bijdrage!quote:Op donderdag 10 december 2009 16:52 schreef ErictheSwift het volgende:
Kwadraat afsplitsen, maar eigenlijk ben je dan gewoon de grunt work voor het afleiden van de ABC-formule aan het doen.


Vraag:
Noem de drie belangrijkste verschillen tussen de Single Cycle machine en de Multicycle machine qua hardware opbouw.
Naja, ik weet dat een multicycle machine geen adders heeft voor de PC, maar verder kom ik niet Iemand ideeën?
Iemand ideeën?
Noem de drie belangrijkste verschillen tussen de Single Cycle machine en de Multicycle machine qua hardware opbouw.
Naja, ik weet dat een multicycle machine geen adders heeft voor de PC, maar verder kom ik niet


De vergelijking is:quote:Op donderdag 10 december 2009 18:06 schreef lyolyrc het volgende:
[..]
Dat is toch veel te omslachtig in dit geval! Ik kan me niet voorstellen dat het probleem op deze manier moet worden opgelost. Maar wel bedankt voor je bijdrage!
x2/(0.150-x)2 = 4.24
Een dergelijke vergelijking kun je best oplossen zonder gebruik van de abc-formule en zonder kwadraatafsplitsing.
Eerst wil je de breuk in het linkerlid kwijtraken. Dat doe je door beide leden te vermenigvuldigen met (0.150-x)2. Dan krijgen we:
x2 = 4.24∙(0.150-x)2
Nu kun je bedenken dat je het rechterlid ook als een kwadraat kunt schrijven, 4.24 is immers het kwadraat van de vierkantswortel uit 4.24. Dan krijgen we:
x2 = (√(4.24)∙(0.150-x))2
Als de kwadraten van twee grootheden gelijk zijn, dan zijn die grootheden zelf ofwel aan elkaar gelijk, ofwel elkaars tegendeel. Dus krijgen we:
x = √(4.24)∙(0.150-x) óf x = -√(4.24)∙(0.150-x)
Hiermee is de kwadratische vergelijking herleid tot twee lineaire vergelijkingen die je gemakkelijk op kunt lossen.


Je hebt gelijk, de abc-formule was niet per se noodzakelijk. Oogkleppen...quote:Op vrijdag 11 december 2009 19:59 schreef Riparius het volgende:
De vergelijking is:
x2/(0.150-x)2 = 4.24
Een dergelijke vergelijking kun je best oplossen zonder gebruik van de abc-formule en zonder kwadraatafsplitsing.
Eerst wil je de breuk in het linkerlid kwijtraken. Dat doe je door beide leden te vermenigvuldigen met (0.150-x)2. Dan krijgen we:
x2 = 4.24∙(0.150-x)2
Nu kun je bedenken dat je het rechterlid ook als een kwadraat kunt schrijven, 4.24 is immers het kwadraat van de vierkantswortel uit 4.24. Dan krijgen we:
x2 = (√(4.24)∙(0.150-x))2
Als de kwadraten van twee grootheden gelijk zijn, dan zijn die grootheden zelf ofwel aan elkaar gelijk, ofwel elkaars tegendeel. Dus krijgen we:
x = √(4.24)∙(0.150-x) óf x = -√(4.24)∙(0.150-x)
Hiermee is de kwadratische vergelijking herleid tot twee lineaire vergelijkingen die je gemakkelijk op kunt lossen.


Even een scheikundige vraag betreft asymmetrische koolstofatomen.
Is het zo dat als er een cycloverbinding is, elk C-atoom in de cycloverbinding asymmetrisch is Zowel bij een alfa-glucose als een alfa-fructose structuur is dit namelijk het geval. Ik vroeg me af of dat ook bij de andere cycloverbindingen het geval is (in het geval van suikers).
Zowel bij een alfa-glucose als een alfa-fructose structuur is dit namelijk het geval. Ik vroeg me af of dat ook bij de andere cycloverbindingen het geval is (in het geval van suikers).
a-glucose
a-fructose
Het scheelt me weer nazoeken als dit daadwerkelijk geldt voor elk cyclomolecuul. Ik verwacht overigens dat dit niet altijd het geval is, maar ben toch wel benieuwd of iemand dit weet. Uiteraard kan ik ze allemaal gaan uittekenen om er achter te komen, maar daar voel ik niet zo heel veel voor
Is het zo dat als er een cycloverbinding is, elk C-atoom in de cycloverbinding asymmetrisch is
a-glucose
a-fructose
Het scheelt me weer nazoeken als dit daadwerkelijk geldt voor elk cyclomolecuul. Ik verwacht overigens dat dit niet altijd het geval is, maar ben toch wel benieuwd of iemand dit weet. Uiteraard kan ik ze allemaal gaan uittekenen om er achter te komen, maar daar voel ik niet zo heel veel voor
A "Nederlands restaurant" is a 'contradictio in terminus'.
If it don't matter to you, it don't matter to me
If it don't matter to you, it don't matter to me


Je geeft het antwoord zelf al! Kijk nog eens goed naar de fructosestructuur die je hebt gepost.quote:Op maandag 14 december 2009 16:38 schreef beertenderrr het volgende:
Even een scheikundige vraag betreft asymmetrische koolstofatomen.
Is het zo dat als er een cycloverbinding is, elk C-atoom in de cycloverbinding asymmetrisch isZowel bij een alfa-glucose als een alfa-fructose structuur is dit namelijk het geval. Ik vroeg me af of dat ook bij de andere cycloverbindingen het geval is (in het geval van suikers).
[ afbeelding ]
a-glucose
[ afbeelding ]
a-fructose
Het scheelt me weer nazoeken als dit daadwerkelijk geldt voor elk cyclomolecuul. Ik verwacht overigens dat dit niet altijd het geval is, maar ben toch wel benieuwd of iemand dit weet. Uiteraard kan ik ze allemaal gaan uittekenen om er achter te komen, maar daar voel ik niet zo heel veel voor


Daar is elke C een asymmetrisch koolstofatoom hoorquote:Op maandag 14 december 2009 16:54 schreef lyolyrc het volgende:
[..]
Je geeft het antwoord zelf al! Kijk nog eens goed naar de fructosestructuur die je hebt gepost.
A "Nederlands restaurant" is a 'contradictio in terminus'.
If it don't matter to you, it don't matter to me
If it don't matter to you, it don't matter to me


En hoe zit het dan met de methyleengroep (-CH2-) naast de zuurstof van de cycloether? Die is zeker niet asymmetrisch!quote:Op maandag 14 december 2009 17:04 schreef beertenderrr het volgende:
Daar is elke C een asymmetrisch koolstofatoom hoor
[ Bericht 0% gewijzigd door lyolyrc op 14-12-2009 17:31:04 ]


ja die is het niet iddquote:Op maandag 14 december 2009 17:22 schreef lyolyrc het volgende:
[..]
En hoe zit het dan met de methyleengroep (-CH2-) naast de zuurstof van de cycloether? Die is zeker niet asymmetrisch!
A "Nederlands restaurant" is a 'contradictio in terminus'.
If it don't matter to you, it don't matter to me
If it don't matter to you, it don't matter to me


Er zitten twee CH2-groepen in het fructosemolecuul. Ik bedoel de groep die ik rood omkaderd heb in de afbeelding. Die groep maakt deel uit van de ring en is geen stereocentrumquote:Op maandag 14 december 2009 18:04 schreef beertenderrr het volgende:
ja die is het niet iddmijn vraag betrof alleen de C-atomen in de cycloverbinding


quote:Op maandag 14 december 2009 22:35 schreef lyolyrc het volgende:
[..]
Er zitten twee CH2-groepen in het fructosemolecuul. Ik bedoel de groep die ik rood omkaderd heb in de afbeelding. Die groep maakt deel uit van de ring en is geen stereocentrum
[ afbeelding ]
ik zie net dat ik dus het verkeerde molecuul heb gevonden op internet. Volgens mij is het niet eens fructose
anyway, het is in ieder geval duidelijk, thnx voor de hulp
A "Nederlands restaurant" is a 'contradictio in terminus'.
If it don't matter to you, it don't matter to me
If it don't matter to you, it don't matter to me


Er bestaan verschillende cyclovormen van fructose. Vanuit de lineaire isomeer kan er een vijfring of zesring worden gevormd. Zie het Engelse wikipedia-artikel.quote:Op maandag 14 december 2009 23:31 schreef beertenderrr het volgende:je hebt gelijk!
ik zie net dat ik dus het verkeerde molecuul heb gevonden op internet. Volgens mij is het niet eens fructose
anyway, het is in ieder geval duidelijk, thnx voor de hulp


Ik heb een vraag over een gyroscoop. In een project willen we de gyroscoop gebruiken om schokken op te vangen (een plateau boven op een wagentje moet waterpas blijven). Door een schijf met een bepaalde massatraagheidsmoment met een bepaalde snelheid te laten draaien kunnen je zorgen dat wanneer er een kracht op de constructie wordt uitgeoefend er tegengestelde kracht optreed waardoor die recht blijft.
Nu zijn wij op zoek naar formules die wij kunnen gebruiken om te bepalen welke combinatie van hoeksnelheid en massatraagheidsmoment we kunnen gaan gebruiken. Als je echter opzoek gaat naar de werking van de gyroscoop krijg je alleen voorbeelden met bijvoorbeeld een tol en formules over de precessie.
Onze vraag is dan ook of iemand een site of een boek weet waar in staat hoe een gyroscoop reageert op een externe kracht.
Alvast bedankt.
gr
Qwox
Nu zijn wij op zoek naar formules die wij kunnen gebruiken om te bepalen welke combinatie van hoeksnelheid en massatraagheidsmoment we kunnen gaan gebruiken. Als je echter opzoek gaat naar de werking van de gyroscoop krijg je alleen voorbeelden met bijvoorbeeld een tol en formules over de precessie.
Onze vraag is dan ook of iemand een site of een boek weet waar in staat hoe een gyroscoop reageert op een externe kracht.
Alvast bedankt.
gr
Qwox


Dat is een uitermate ambitieuze aanpak. Een klassiek massa/veer/demper systeem is niet toegestaan? Ik heb goede ervaringen met perslucht. Ideaal om schokken op te vangen.quote:Op dinsdag 15 december 2009 10:18 schreef qwox het volgende:
Ik heb een vraag over een gyroscoop. In een project willen we de gyroscoop gebruiken om schokken op te vangen (een plateau boven op een wagentje moet waterpas blijven).
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson


We hebben de vrijheid om te kiezen wat we maar willen en je hebt gelijk dat het een ambitieuze aanpak is. Het is een project met werktuigbouwkundige en elektrotechnici samen. Omdat er al veel elektronica in zit wilde we proberen het op te lossen met een meer mechanisch systeem.quote:Op dinsdag 15 december 2009 10:40 schreef Lyrebird het volgende:
[..]
Dat is een uitermate ambitieuze aanpak. Een klassiek massa/veer/demper systeem is niet toegestaan? Ik heb goede ervaringen met perslucht. Ideaal om schokken op te vangen.
Met bijvoorbeeld perslucht kun je wel schokken opvangen, echter wanneer het wagentje een heuveltje opgaat (max 15 graden) dan zal het plateau toch schuin gaan zonder regelsysteem.
Als het ons niet lukt om de theorie rond een gyroscoop volledig te begrijpen zullen we waarschijnlijk naar een ontwerp gaan die meet en corrigeert.


Mijn statistiek docent ging vandaag weer even helemaal uit z'n dak in de les, en aangezien ik meer een bioloog ben dan iemand van de Wiskunde A volgde ik het niet helemaal.
Uiteindelijke kwam hij tot de conclusie dat twee formules essentieel voor ons zijn... mijn vraag was of er een bepaalde naam voor deze formules is en of er meer informatie over te vinden is zodat ik de precieze definitie van al die leuke tekentjes wat beter kan begrijpen.
De twee formules waren de volgende: (Op die tweede X moet nog een streepje maar die krijg ik er niet op)
_
Xιn - 1,96 σ / √n < μ < Xιn + 1,96 σ / √n
en (op deze X hoort uiteraard ook nog een streepje)
μ = Xn ± t (n - 1) S / √n
[ Bericht 1% gewijzigd door horned_reaper op 15-12-2009 22:17:32 ]
Uiteindelijke kwam hij tot de conclusie dat twee formules essentieel voor ons zijn... mijn vraag was of er een bepaalde naam voor deze formules is en of er meer informatie over te vinden is zodat ik de precieze definitie van al die leuke tekentjes wat beter kan begrijpen.
De twee formules waren de volgende: (Op die tweede X moet nog een streepje maar die krijg ik er niet op)
_
Xιn - 1,96 σ / √n < μ < Xιn + 1,96 σ / √n
en (op deze X hoort uiteraard ook nog een streepje)
μ = Xn ± t (n - 1) S / √n
[ Bericht 1% gewijzigd door horned_reaper op 15-12-2009 22:17:32 ]


Ik denk dat je hiervoor beter in het wiskundetopic kunt posten, dan krijg je direct deskundig commentaar erbij.quote:Op dinsdag 15 december 2009 22:10 schreef horned_reaper het volgende:
Mijn statistiek docent ging vandaag weer even helemaal uit z'n dak in de les, en aangezien ik meer een bioloog ben dan iemand van de Wiskunde A volgde ik het niet helemaal.
Uiteindelijke kwam hij tot de conclusie dat twee formules essentieel voor ons zijn... mijn vraag was of er een bepaalde naam voor deze formules is en of er meer informatie over te vinden is zodat ik de precieze definitie van al die leuke tekentjes wat beter kan begrijpen.
De twee formules waren de volgende: (Op die tweede X moet nog een streepje maar die krijg ik er niet op)
_
Xιn - 1,96 σ / √n < μ < Xιn + 1,96 σ / √n
en (op deze X hoort uiteraard ook nog een streepje)
μ = Xn ± t (n - 1) S / √n


De eerste vergelijking is de vergelijking voor een betrouwbaarheidsinterval voor grote groepen monstersquote:Op dinsdag 15 december 2009 22:10 schreef horned_reaper het volgende:
Mijn statistiek docent ging vandaag weer even helemaal uit z'n dak in de les, en aangezien ik meer een bioloog ben dan iemand van de Wiskunde A volgde ik het niet helemaal.
Uiteindelijke kwam hij tot de conclusie dat twee formules essentieel voor ons zijn... mijn vraag was of er een bepaalde naam voor deze formules is en of er meer informatie over te vinden is zodat ik de precieze definitie van al die leuke tekentjes wat beter kan begrijpen.
De twee formules waren de volgende: (Op die tweede X moet nog een streepje maar die krijg ik er niet op)
_
Xιn - 1,96 σ / √n < μ < Xιn + 1,96 σ / √n
en (op deze X hoort uiteraard ook nog een streepje)
μ = Xn ± t (n - 1) S / √n
Die X met een streepje erboven staat voor de gemiddelde waarde van de monsters
de σ is de standaarddeviatie van je X
n is het aantal monsters van je meting
μ is de werkelijke waarde van je monster
de 1,96 geeft aan dat het om een 95% betrouwbaarsheidsinterval gaat
De tweede vergelijking is de vergelijking voor een betrouwbaarheidsinterval voor kleine groepen monsters
Die X met een streepje is wederom de gemiddelde waarde van de monsters
de t(n-1) is de t-waarde die hoort bij de gewenste precisie bij n-1 vrijheidsgraden
S is de standaarddeviatie van je X
n is het aantal monsters van je meting.
Ik weet niet of dit helemaal klopt, maar het zou wel ongeveer moeten kloppen


Hey allemaal,
Stel ik schiet een kogel geheel recht de lucht in met een bepaalde snelheid. Klopt het dan dat, in een ideale situatie (geen luchtwrijving), de tijd die de kogel nodig heeft om het hoogtepunt te bereiken gelijk is aan de tijd die het nodig heeft voor de 'afdaling'?
Alvast bedankt
Stel ik schiet een kogel geheel recht de lucht in met een bepaalde snelheid. Klopt het dan dat, in een ideale situatie (geen luchtwrijving), de tijd die de kogel nodig heeft om het hoogtepunt te bereiken gelijk is aan de tijd die het nodig heeft voor de 'afdaling'?
Alvast bedankt


Volgens mij niet. Bij zijn vlucht omhoog wordt de kogel voortgestuwd door zijn beginsnelheid en afgeremd door de zwaartekracht. Bij zijn vlucht omlaag is er alleen de zwaartekracht. Dit geeft een verschil.quote:Op dinsdag 22 december 2009 11:59 schreef Gordon__Gekko het volgende:
Hey allemaal,
Stel ik schiet een kogel geheel recht de lucht in met een bepaalde snelheid. Klopt het dan dat, in een ideale situatie (geen luchtwrijving), de tijd die de kogel nodig heeft om het hoogtepunt te bereiken gelijk is aan de tijd die het nodig heeft voor de 'afdaling'?
Alvast bedankt
Ik kan het eventueel ook in formules uitwerken als je daar behoefte aan hebt.


Laat dat dan maar eens zien (die afleiding), want wat jij hier beweert is onzin. Een kogel wordt niet 'voortgestuwd' louter door het feit dat deze een snelheid heeft.quote:Op dinsdag 22 december 2009 18:25 schreef lyolyrc het volgende:
[..]
Volgens mij niet. Bij zijn vlucht omhoog wordt de kogel voortgestuwd door zijn beginsnelheid en afgeremd door de zwaartekracht. Bij zijn vlucht omlaag is er alleen de zwaartekracht. Dit geeft een verschil.
Ik kan het eventueel ook in formules uitwerken als je daar behoefte aan hebt.


Ik drukte me misschien een beetje ongelukkig uit. Wat ik bedoel is dat de kogel bij afschieten een beginsnelheid heeft die groter is dan nul, terwijl de kogel op zijn hoogste punt met een beginsnelheid gelijk aan nul aan zijn val begint.quote:Op dinsdag 22 december 2009 18:57 schreef Riparius het volgende:
Laat dat dan maar eens zien (die afleiding), want wat jij hier beweert is onzin. Een kogel wordt niet 'voortgestuwd' louter door het feit dat deze een snelheid heeft.
De afleiding wil ik wel geven, maar op zijn vroegst morgenmiddag. Mijn afstudeerpraatje heeft nu even voorrang.


tvp voor de afleiding, want het is namelijk onzin 
Klopt 100%.quote:Op dinsdag 22 december 2009 11:59 schreef Gordon__Gekko het volgende:
Hey allemaal,
Stel ik schiet een kogel geheel recht de lucht in met een bepaalde snelheid. Klopt het dan dat, in een ideale situatie (geen luchtwrijving), de tijd die de kogel nodig heeft om het hoogtepunt te bereiken gelijk is aan de tijd die het nodig heeft voor de 'afdaling'?
Alvast bedankt
Op dinsdag 23 augustus 2011 23:18 schreef problematiQue het volgende:
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.


Ok, weet niet of ik het zo goed formuleer, maar daar zijn die andere knappe koppen voor  Onderaan is de kinetische energie bij het schot maximaal, waar de zwaarte-energie minimaal is. Bovenaan is dit precies andersom (kogel gaat niet meer omhoog, dus kinetische energie is 0). De wet van behoud van energie is hier van toepassing, en daarom is de tijd aan elkaar gelijk.
Onderaan is de kinetische energie bij het schot maximaal, waar de zwaarte-energie minimaal is. Bovenaan is dit precies andersom (kogel gaat niet meer omhoog, dus kinetische energie is 0). De wet van behoud van energie is hier van toepassing, en daarom is de tijd aan elkaar gelijk.
Je zou het eventueel de zwaarte-energie gelijk kunnen stellen aan de kinetische energie, en als het goed is moet er aan beide kanten hetzelfde uitkomen Maar daarvoor moet je bij de echte natuurkundigen in dit topic zijn
Maar daarvoor moet je bij de echte natuurkundigen in dit topic zijn 
Klopt mijn uitleg een beetje?
Je zou het eventueel de zwaarte-energie gelijk kunnen stellen aan de kinetische energie, en als het goed is moet er aan beide kanten hetzelfde uitkomen
Klopt mijn uitleg een beetje?
A "Nederlands restaurant" is a 'contradictio in terminus'.
If it don't matter to you, it don't matter to me
If it don't matter to you, it don't matter to me


Je drukte je uit op een manier die mij doet vermoeden dat je geen kaas hebt gegeten van (elementaire) natuurkunde. Je gedachte dat de snelheid van de kogel op het moment dat deze op zijn uitgangspunt terugkeert - afgezien van de tegengestelde richting - anders zou zijn dan op het moment dat deze wordt afgeschoten is onjuist.quote:Op dinsdag 22 december 2009 23:57 schreef lyolyrc het volgende:
[..]
Ik drukte me misschien een beetje ongelukkig uit. Wat ik bedoel is dat de kogel bij afschieten een beginsnelheid heeft die groter is dan nul, terwijl de kogel op zijn hoogste punt met een beginsnelheid gelijk aan nul aan zijn val begint.
Ik ben erg benieuwd naar je 'afleiding' want die is gegarandeerd fout. Toch wil ik die afleiding graag zien, want ik ben wel geïnteresseerd in drogredeneringen, altijd leuk om door te prikken.quote:De afleiding wil ik wel geven, maar op zijn vroegst morgenmiddag. Mijn afstudeerpraatje heeft nu even voorrang.
En om onnodige welles-nietes discussies te voorkomen zal ik meteen even laten zien dat je ongelijk hebt.
We nemen aan dat de kogel een puntmassa is die verticaal wordt afgeschoten met een zekere beginsnelheid v0. Zoals aangegeven door de vragensteller nemen we ook aan dat er geen luchtwrijving is. Laten we de hoogte boven het punt van afschieten op tijdstip t aangeven met st (spatium) en de snelheid op tijdstip t met vt (velocitas). Dan moeten we dus eerst het tijdstip t bepalen waarop de kogel weer terugkeert op zijn vertrekpunt en dan de daarbij behorende snelheid vt bepalen.
Nu is de snelheid vt op enig tijdstip t gelijk aan de afgeleide van de weg s naar de tijd t, oftewel:
(1) vt = ds/dt
Voorts is de versnelling op enig tijdstip t, die we zullen aangeven met at (acceleratio) gelijk aan de afgeleide van de snelheid v naar de tijd t, dus:
(2) at = dv/dt
Nu is echter de versnelling die de puntmassa ondervindt onder invloed van de zwaartekracht constant. Volgens de tweede wet van Newton geldt immers F = ma, waarbij F de zwaartekracht is en m de massa van de kogel, zodat a = F/m inderdaad constant is. Uiteraard geldt a = -g, waarbij g de gravitatieversnelling is (ca. 9,81 m/sec2). Het minteken is nodig omdat de zwaartekracht naar beneden is gericht en de beweging van de kogel op het moment dat deze wordt afgeschoten omhoog, zodat er sprake is van een deceleratie. We hebben dus:
(3) at = -g
En dus volgens (2) ook:
(4) dv/dt = -g
Zodat we hebben:
(5) vt = -gt + c,
waarin c een nader te bepalen constante is. De waarde van deze constante is eenvoudig te bepalen, want door t = 0 te substitueren in (5) vinden we
(6) v0 = c,
en uit (5) en (6) volgt dan:
(7) vt = -gt + v0
Uit (1) en (7) volgt dan:
(8) ds/dt = -gt + v0,
Zodat we vinden:
(9) st = -½gt2 + v0t + c,
waarin c weer een nader te bepalen constante is. Substitutie van t = 0 in (9) levert s0 = c, en aangezien s0 de hoogte boven het punt van afschieten voorstelt op het moment van afschieten is s0 = 0, zodat dus c = 0. Zo vinden we dat geldt:
(10) st = -½gt2 + v0t
Nu hebben we alles wat we nodig hebben om uit te rekenen op welk tijdstip de kogel weer op zijn uitgangspunt is teruggekeerd, én wat op dat moment zijn snelheid is. We bepalen eerst het tijdstip waarvoor geldt st = 0. Uit (10) volgt dat dit het geval is als geldt:
(11) -½gt2 + v0t = 0
Halen we hier t buiten haakjes, dan hebben we:
(12) t(-½gt + v0) = 0
Aan (12) is voldaan indien t = 0 (het moment van afschieten) of indien:
(13) -½gt + v0 = 0,
waaruit volgt:
(14) t = 2v0/g,
en dat is dus het tijdstip waarop de met snelheid v0 afgeschoten kogel terugkeert op het vertrekpunt. De snelheid van de kogel op dit moment vinden we nu door waarde van t uit (14) in te vullen in (7). Voor de snelheid vt op het tijdstip t = 2v0/g krijgen we dan:
(15) vt = -g(2v0/g) + v0 = -2v0 + v0 = -v0
De snelheid op het moment dat de kogel terugkeert op het vertrekpunt is dus precies even groot als de snelheid op het moment dat de kogel werd afgeschoten, alleen is - zoals wordt uitgedrukt door het minteken - de bewegingsrichting tegengesteld aan de bewegingsrichting op het moment van afschieten.
Verder kunnen we ook nog even kijken naar het tijdstip waarop de kogel zijn hoogste punt bereikt. Op dat moment is de snelheid van de kogel gelijk aan nul, dus vt = 0. Uit (7) volgt dat dit het geval is als -gt + v0 = 0 en dus:
(16) t = v0/g
Vergelijken we het tijdstip t in (16) waarop de kogel het hoogste punt bereikt met het tijdstip t in (14) waarop de kogel op zijn vertrekpunt terugkeert, dan zien we dat de kogel precies op de helft van de tijd die hij nodig heeft om weer op zijn vertrekpunt terug te keren het hoogste punt bereikt. De weg terug naar beneden vanaf het hoogste punt duurt dus precies even lang als de weg vanaf het vertrekpunt naar het hoogste punt.
QED.
[ Bericht 3% gewijzigd door Riparius op 23-12-2009 04:16:07 ]


Je hebt gelijk. Ik had een nogal ingewikkelde berekening gedaan, waardoor ik het mezelf moeilijk maakte en foute conclusies trok. Net heb ik het nagerekend en ik kwam via een iets andere weg op hetzelfde antwoord uit.quote:


Het vermoeden van Schanuel is als volgt:
Zij a_1,...,a_n (elementen in C) algebraische getallen over Q. Stel dat a_1,...,a_n lineair onafhankelijk zijn over Q dan geldt:
trdegQ(a_1,...,a_n,exp(a_1),,..,exp(a_n)) >= n
Met dit vermoeden heb ik laten zien dat als a (in C\{0,1}) algebraisch is dan geldt log(a) en loglog(a) algebraisch onafhankelijk zijn over Q.
Nu wil ik het volgende laten zien:
Zij a, b (in C) algebraisch over Q, stel dat a !=0,1 en dat b graad d heeft. Dan zijn loga, ab, ab^2, ..., ab^(d-1) algebraisch onafhankelijk zijn, m.a.w
trdegQ(loga, ab, ab^2, ..., ab^(d-1)) =d
Ik liet eerst zien dat {loglog(a), blog(a),..,bd-1log(a)} lin. onafhankelijk is over Q en toen
paste ik het vermoeden toe en vind de ongelijkheid (**)
trdegQ(loglog(a), blog(a),..,bd-1log(a),loga, ab, ab^2, ..., ab^(d-1))=trdegQ(logloga, loga, ab, ab^2, ..., ab^(d-1)) >=d
Hier zit ik vast. Ik heb d+1 elementen en ik weet dat ik d kan kiezen die alg. onafhankelijk zijn. Als ik veronderstel dat mijn oorspronkelijke verzameling loga, ab, ab^2, ..., ab^(d-1) alg. afhankelijk is dan kan ik maximaal 1 element weggooien zonder dat ik de ongelijkheid ** schend. Ik kan dus of loga of ab^i weggooien met i in 1,...,d-1. Maar als ik verder ga, kan ik geen tegenspraak afleiden. Enig idee hoe het wel kan?
Zij a_1,...,a_n (elementen in C) algebraische getallen over Q. Stel dat a_1,...,a_n lineair onafhankelijk zijn over Q dan geldt:
trdegQ(a_1,...,a_n,exp(a_1),,..,exp(a_n)) >= n
Met dit vermoeden heb ik laten zien dat als a (in C\{0,1}) algebraisch is dan geldt log(a) en loglog(a) algebraisch onafhankelijk zijn over Q.
Nu wil ik het volgende laten zien:
Zij a, b (in C) algebraisch over Q, stel dat a !=0,1 en dat b graad d heeft. Dan zijn loga, ab, ab^2, ..., ab^(d-1) algebraisch onafhankelijk zijn, m.a.w
trdegQ(loga, ab, ab^2, ..., ab^(d-1)) =d
Ik liet eerst zien dat {loglog(a), blog(a),..,bd-1log(a)} lin. onafhankelijk is over Q en toen
paste ik het vermoeden toe en vind de ongelijkheid (**)
trdegQ(loglog(a), blog(a),..,bd-1log(a),loga, ab, ab^2, ..., ab^(d-1))=trdegQ(logloga, loga, ab, ab^2, ..., ab^(d-1)) >=d
Hier zit ik vast. Ik heb d+1 elementen en ik weet dat ik d kan kiezen die alg. onafhankelijk zijn. Als ik veronderstel dat mijn oorspronkelijke verzameling loga, ab, ab^2, ..., ab^(d-1) alg. afhankelijk is dan kan ik maximaal 1 element weggooien zonder dat ik de ongelijkheid ** schend. Ik kan dus of loga of ab^i weggooien met i in 1,...,d-1. Maar als ik verder ga, kan ik geen tegenspraak afleiden. Enig idee hoe het wel kan?


Oeps, ik denk dat ik het gevonden heb, ik ben met een 'moeilijke' verzameling begonnen. Een betere verzameling is bijv {loga, blog(a),...,bd-1log(a)} geeft direct via Schanuel vermoeden dat loga,ab,..,ab^(d-1) algebraisch onafhankelijk zijn.


Klein vraagje over natuurkunde:
Je kan de hardheid van geluid in veel eenheden meten. Ik vroeg me af wat precies het veschil is tussen de eenheden W/m2 en Pascal, hoe je het naar elkaar omzet, en hoe ze veranderen als zeg maar hetzelfde geluid tegelijk vanuit twee bronnen klinkt(dus in fase).
Ik hoop dat iemand kan helpen, alvast bednkt!
Ik heb al wat gevonden:
http://members.home.nl/snannenberg/Decibel.htm
[ Bericht 30% gewijzigd door minibeer op 29-12-2009 13:27:35 ]
Je kan de hardheid van geluid in veel eenheden meten. Ik vroeg me af wat precies het veschil is tussen de eenheden W/m2 en Pascal, hoe je het naar elkaar omzet, en hoe ze veranderen als zeg maar hetzelfde geluid tegelijk vanuit twee bronnen klinkt(dus in fase).
Ik hoop dat iemand kan helpen, alvast bednkt!
Ik heb al wat gevonden:
http://members.home.nl/snannenberg/Decibel.htm
[ Bericht 30% gewijzigd door minibeer op 29-12-2009 13:27:35 ]
Finally, someone let me out of my cage


Wat denk je zelf?quote:Op dinsdag 29 december 2009 12:02 schreef minibeer het volgende:
Klein vraagje over natuurkunde:
Je kan de hardheid van geluid in veel eenheden meten. Als hetzelfde geluid zeg maar vanuit twee bronnen tegelijk klinkt, hoe veranderen dan de hardheid gemeten in Pascal en de hardheid gemeten in W/m2.
Khoop dat iemand kan helpen!
Hoe veel W/m2 is 1 Pa?
Dit is overigens geen eenvoudig probleem, zonder bepaalde aannames. Mag je er van uit gaan dat de twee bronnen in fase zijn daar waar je het geluid meet? Met in fase bedoel ik dat ze allebei op dezelfde tijd een maximum, minimum, maximum, etc. genereren op die plaats. In dat geval kun je de twee signalen bij elkaar optellen, in Pa en in W/m2.
Maar hoe verandert het geluid in dB?
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson


Je 'moet' in het wiskunde-topic zijn.quote:Op zaterdag 26 december 2009 13:21 schreef Optimistic1 het volgende:
Oeps, ik denk dat ik het gevonden heb, ik ben met een 'moeilijke' verzameling begonnen. Een betere verzameling is bijv {loga, blog(a),...,bd-1log(a)} geeft direct via Schanuel vermoeden dat loga,ab,..,ab^(d-1) algebraisch onafhankelijk zijn.
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


Die klopt helemaal. Je uitleg is ook veel eleganter dan de andere uitleg (die ik niet gecheckt heb omdat er veel te veel formules in staan), want je hebt maar een formule nodig: Utotaal = m g h + 1/2 m v2. Hierbij is Utotaal de totale energie, m de massa, g de valversnelling, h de hoogte en v de snelheid van de kogel. Hierbij is het wel zinvol om de beginsnelheid op h = 0, of de eindhoogte waar v = 0 te kennen. Op h = 0 geldt dan Utotaal = 1/2 m v2, en op de eindhoogte geldt Utotaal = m g h.quote:Op woensdag 23 december 2009 01:20 schreef beertenderrr het volgende:
Ok, weet niet of ik het zo goed formuleer, maar daar zijn die andere knappe koppen voorOnderaan is de kinetische energie bij het schot maximaal, waar de zwaarte-energie minimaal is. Bovenaan is dit precies andersom (kogel gaat niet meer omhoog, dus kinetische energie is 0). De wet van behoud van energie is hier van toepassing, en daarom is de tijd aan elkaar gelijk.
Je zou het eventueel de zwaarte-energie gelijk kunnen stellen aan de kinetische energie, en als het goed is moet er aan beide kanten hetzelfde uitkomenMaar daarvoor moet je bij de echte natuurkundigen in dit topic zijn
Klopt mijn uitleg een beetje?
Hiermee kun je op willekeurig welke hoogte dan ook de snelheid bepalen.
Het mooie is ook dat de massa er helemaal niet toe doet, dus deze formule geldt voor willekeurig welk zwaar voorwerp. Of je nu een olifant 10 meter de lucht in wilt schieten, of een muisje: de beginsnelheid zal precies hetzelfde zijn. De energie die nodig is om dat te doen, is natuurlijk niet gelijk. Dat zul je ondervinden als je geraakt wordt door een olifant die 10 meter naar beneden valt, of een muisje.
Wat is natuurkunde toch een mooi vak.
Kies altijd voor de wet van behoud van energie als daar een mogeljikheid voor is.
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson


Weet jij dan misschien ook het volgende probleem nu een stuiterbal ipv een kogel:
Stel dat vanaf een hoogte h0 een bal (recht naar beneden) wordt laten vallen. Uiteraard zal deze enkele malen stuiteren op de grond waarnaar hij uiteindelijk tot stilstand komt. Zoals bekend zal bij elk contact met het oppervlak een proportie p aan kinetische energie verloren gaan. t0 is het moment van het eerste contact met het oppervlak en t1 het tweede moment.
De vraag is nu als volgt. Stel dat je de totale tijd weet vanaf het moment van het loslaten van de bal tot het moment dat de bal 'uitgestuiterd' is en dus weer stilligt. En stel dat je bovendien weet hoe lang het interval tussen t0 en t1 duurt.
Hoe kun je dan aan de hand hiervan de p berekenen?
Alvast hartelijk bedankt!
Stel dat vanaf een hoogte h0 een bal (recht naar beneden) wordt laten vallen. Uiteraard zal deze enkele malen stuiteren op de grond waarnaar hij uiteindelijk tot stilstand komt. Zoals bekend zal bij elk contact met het oppervlak een proportie p aan kinetische energie verloren gaan. t0 is het moment van het eerste contact met het oppervlak en t1 het tweede moment.
De vraag is nu als volgt. Stel dat je de totale tijd weet vanaf het moment van het loslaten van de bal tot het moment dat de bal 'uitgestuiterd' is en dus weer stilligt. En stel dat je bovendien weet hoe lang het interval tussen t0 en t1 duurt.
Hoe kun je dan aan de hand hiervan de p berekenen?
Alvast hartelijk bedankt!


Ik zal je op weg helpen.quote:Op dinsdag 29 december 2009 13:26 schreef Gordon__Gekko het volgende:
Weet jij dan misschien ook het volgende probleem nu een stuiterbal ipv een kogel:
Stel dat vanaf een hoogte h0 een bal (recht naar beneden) wordt laten vallen. Uiteraard zal deze enkele malen stuiteren op de grond waarnaar hij uiteindelijk tot stilstand komt. Zoals bekend zal bij elk contact met het oppervlak een proportie p aan kinetische energie verloren gaan. t0 is het moment van het eerste contact met het oppervlak en t1 het tweede moment.
De vraag is nu als volgt. Stel dat je de totale tijd weet vanaf het moment van het loslaten van de bal tot het moment dat de bal 'uitgestuiterd' is en dus weer stilligt. En stel dat je bovendien weet hoe lang het interval tussen t0 en t1 duurt.
Hoe kun je dan aan de hand hiervan de p berekenen?
Alvast hartelijk bedankt!
Laten we er van uitgaan dat de beginsnelheid op hoogte h0, van waar de bal valt, 0 m/s is.
Wat is de totale energie op het moment dat de bal de grond raakt, nadat de bal t0 seconden lang is gevallen? Tip: hoe kun je de totale hoogtel h0 bepalen, als je t0 kent? Hiermee kun je de beginenergie bepalen.
De bal stuitert, wat het extra lastig maakt. Dat betekent dat de bal omhoog en omlaag gaat in de periode van t0 naar t1. In de helft van de tijd (ga zelf na waarom) van die periode zal het hoogste punt h1 worden bereikt. Wat is de energie van een bal die 1/2 ( t1 - t0) seconden lang gevallen is (of omhoogstuitert in dezelfde tijd)? Wat betekent dit voor de maximale hoogte van de bal h1?
Het verlies aan energie p is nu gelijk aan m g h0 - m g h1.
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson


Bedankt, maar dit had ik zelf ook al bedacht en had ik nodig voor voorgaande (deel)vragen. Misschien moet ik wat preciezer zijn:
De vraag is: stel je krijgt de totale tijd vanaf loslaten tot aan dat de bal uitgestuiterd is en bovendien de tijd tussen interval t0 en t1, hoe bereken je dan aan de hand van deze twee waarden de p. Bovendien is de p (logischerwijs) altijd kleiner dan 1.
Je laatste regel snap ik ook en klopt ook, maar ik heb helemaal geen waarden voor h0 en ook niet voor de massa. Dat kan ik dus niet gebruiken.
In ieder geval bedankt, ik waardeer je input.
De vraag is: stel je krijgt de totale tijd vanaf loslaten tot aan dat de bal uitgestuiterd is en bovendien de tijd tussen interval t0 en t1, hoe bereken je dan aan de hand van deze twee waarden de p. Bovendien is de p (logischerwijs) altijd kleiner dan 1.
Je laatste regel snap ik ook en klopt ook, maar ik heb helemaal geen waarden voor h0 en ook niet voor de massa. Dat kan ik dus niet gebruiken.
In ieder geval bedankt, ik waardeer je input.


Geluidsterkte wordt op verschillende manieren weergegeven:
- Als geluidsvermogen W [Watt]
- Als geluidsintensiteit: I [Watt/m2]
- Als geluidsdruk: P [Pa]
Ik had in mn laatste post gezegd dat ik het had gevonden maar het is me nog steeds niet duidelijk: Wat is het verband tussen deze eenheden?
- Als geluidsvermogen W [Watt]
- Als geluidsintensiteit: I [Watt/m2]
- Als geluidsdruk: P [Pa]
Ik had in mn laatste post gezegd dat ik het had gevonden maar het is me nog steeds niet duidelijk: Wat is het verband tussen deze eenheden?
Finally, someone let me out of my cage


Ik zie nu dat ik weer behoorlijk van je vraag was afgeweken.quote:Op dinsdag 29 december 2009 14:11 schreef Gordon__Gekko het volgende:
Bedankt, maar dit had ik zelf ook al bedacht en had ik nodig voor voorgaande (deel)vragen. Misschien moet ik wat preciezer zijn:
De vraag is: stel je krijgt de totale tijd vanaf loslaten tot aan dat de bal uitgestuiterd is en bovendien de tijd tussen interval t0 en t1, hoe bereken je dan aan de hand van deze twee waarden de p. Bovendien is de p (logischerwijs) altijd kleiner dan 1.
Je laatste regel snap ik ook en klopt ook, maar ik heb helemaal geen waarden voor h0 en ook niet voor de massa. Dat kan ik dus niet gebruiken.
In ieder geval bedankt, ik waardeer je input.
Laten we er van uit gaan dat t0 5 seconden lang was, en de tijd van t0 tot t1 2 seconden, zodat de tijd die nodig is om weer omhoog te stuiteren 1 seconde is. Stel g = 10:
In dat geval is de hoogte h0 = 1/2gt2 = 1/2 * 10 * 25 = 125 m.
Verder is hoogte h1 = 1/2gt2 = 1/2 * 10 * 1 = 5 m
Nu p, als een percentage, berekenen:
Uh0 = m g 125
Uh1 = m g 5
Uverlies = (m g 125) - (m g 5) = m g 120
p = Uverlies / Uh0 * 100%= m g 120 / m g 125 * 100% = 96%, of 0.96
In plaats van 5s en 2s voor de tijden kun je ook t's gebruiken, maar dan wordt het boekhoudkundig een zooitje en dan ga ik in ieder geval fouten maken.
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson


1 W/m2 = 1 Paquote:Op dinsdag 29 december 2009 14:26 schreef minibeer het volgende:
Geluidsterkte wordt op verschillende manieren weergegeven:
- Als geluidsvermogen W [Watt]
- Als geluidsintensiteit: I [Watt/m2]
- Als geluidsdruk: P [Pa]
Ik had in mn laatste post gezegd dat ik het had gevonden maar het is me nog steeds niet duidelijk: Wat is het verband tussen deze eenheden?
Het geluidsvermogen in W, is bijvoorbeeld het vermogen dat een luidspreker produceert. Afhankelijk van hoe ver je er van af staat, kun je de geluidsdruk (in Pa) berekenen, maar ook hiervoor zul je bepaalde aannames moeten doen.
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson


Bedankt voor je hulp, maar ik begrijp het nog niet helemaal.quote:Op dinsdag 29 december 2009 14:45 schreef Lyrebird het volgende:
[..]
1 W/m2 = 1 Pa
Het geluidsvermogen in W, is bijvoorbeeld het vermogen dat een luidspreker produceert. Afhankelijk van hoe ver je er van af staat, kun je de geluidsdruk (in Pa) berekenen, maar ook hiervoor zul je bepaalde aannames moeten doen.
het geluidsvermogen is me wel vrij duidelijk denk ik, alleen die geluidsdruk nog niet. Is daar niet een formule voor? 1 W/m2 = 1 Pa, wanneer geldt dat? 1 Pa = 1 N / m2, dat weet ik wel.
EDIT:
Ik heb ergens dit gevonden(zonder verdere uitleg): 1W/m2 = (20Pa)2 / 400.
Waarom 400?
Even voor de goede orde, mijn vraag is nu:
Wat is het verband tussen de geluidsdruk en de geluidsintensiteit?
Edit:
http://nl.wikipedia.org/wiki/Geluidsniveau
sorry
[ Bericht 7% gewijzigd door minibeer op 29-12-2009 15:20:23 ]
Finally, someone let me out of my cage


Klassiek geval van slaapgebrek. 1 N/m2 is idd 1 Pa.quote:Op dinsdag 29 december 2009 15:09 schreef minibeer het volgende:
[..]
Bedankt voor je hulp, maar ik begrijp het nog niet helemaal.
het geluidsvermogen is me wel vrij duidelijk denk ik, alleen die geluidsdruk nog niet. Is daar niet een formule voor? 1 W/m2 = 1 Pa, wanneer geldt dat? 1 Pa = 1 N / m2, dat weet ik wel.
EDIT:
Ik heb ergens dit gevonden(zonder verdere uitleg): 1W/m2 = (20Pa)2 / 400.
Waarom 400?
Even voor de goede orde, mijn vraag is nu:
Wat is het verband tussen de geluidsdruk en de geluidsintensiteit?
Edit:
http://nl.wikipedia.org/wiki/Geluidsniveau
sorry
De rest blijf ik je schuldig tot morgen; ik ga nu pitten.
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson


ik heb het uitgezocht:quote:Op dinsdag 29 december 2009 16:48 schreef Lyrebird het volgende:
[..]
Klassiek geval van slaapgebrek. 1 N/m2 is idd 1 Pa.
De rest blijf ik je schuldig tot morgen; ik ga nu pitten.
J = p2 / (ρ ּ c)
ρ ּ c = ongeveer 400
Finally, someone let me out of my cage


ik ben op zoek naar een goede, en vooral goed uitgelegde manier om de geluidssterkte van twee geluiden op te tellen. Wat ik overal vind is: als de geluidsbronnen in fase zijn: +6 dB bij dezelfde geluidssterktes, en bij niet in fase +3 dB.
Waarom? Meestal wordt de formule Ltotaal = 1010Log(10L1/10+10L2/10) gebruikt.
Dus, de geluidsintensiteiten (J, in W/m2) wordt gebruikt?
Dat zou erop duiden dat bij een geluid met fase versterking er ook maximaal 3 dB verschil in zit:
want sin(x) + sin(x) = 2sin(x) en dan is J toch 2 keer zo groot als daarvoor:
L = 1010Log(2/1) = 3
Hoe kan je dan op 6 uitkomen?
Ik hoop dat iemand me kan helpen!
Waarom? Meestal wordt de formule Ltotaal = 1010Log(10L1/10+10L2/10) gebruikt.
Dus, de geluidsintensiteiten (J, in W/m2) wordt gebruikt?
Dat zou erop duiden dat bij een geluid met fase versterking er ook maximaal 3 dB verschil in zit:
want sin(x) + sin(x) = 2sin(x) en dan is J toch 2 keer zo groot als daarvoor:
L = 1010Log(2/1) = 3
Hoe kan je dan op 6 uitkomen?
Ik hoop dat iemand me kan helpen!
Finally, someone let me out of my cage


TeeVeePee
Your task is not to seek for love, but merely to seek and find all the barriers within yourself that you have built against it. -Mevlana


Ik had eerlijk gezegd ook 3 dB verwacht voor twee bronnen die in fase zijn. Maar ik ben meer bekend met licht, en als je daar twee golven bij elkaar optelt, dan moet je daarna het zaakje kwadrateren om de intensiteit te krijgen. (I = A2) Waarschijnlijk speelt iets soortgelijks bij geluid.quote:Op donderdag 31 december 2009 00:42 schreef minibeer het volgende:
ik ben op zoek naar een goede, en vooral goed uitgelegde manier om de geluidssterkte van twee geluiden op te tellen. Wat ik overal vind is: als de geluidsbronnen in fase zijn: +6 dB bij dezelfde geluidssterktes, en bij niet in fase +3 dB.
Waarom? Meestal wordt de formule Ltotaal = 1010Log(10L1/10+10L2/10) gebruikt.
Dus, de geluidsintensiteiten (J, in W/m2) wordt gebruikt?
Dat zou erop duiden dat bij een geluid met fase versterking er ook maximaal 3 dB verschil in zit:
want sin(x) + sin(x) = 2sin(x) en dan is J toch 2 keer zo groot als daarvoor:
L = 1010Log(2/1) = 3
Hoe kan je dan op 6 uitkomen?
Ik hoop dat iemand me kan helpen!
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson


Ja, dat is het iddquote:Op zondag 3 januari 2010 07:30 schreef Lyrebird het volgende:
[..]
Ik had eerlijk gezegd ook 3 dB verwacht voor twee bronnen die in fase zijn. Maar ik ben meer bekend met licht, en als je daar twee golven bij elkaar optelt, dan moet je daarna het zaakje kwadrateren om de intensiteit te krijgen. (I = A2) Waarschijnlijk speelt iets soortgelijks bij geluid.
Finally, someone let me out of my cage


Een hele domme vraag. Maar maandag heb ik een herkansing statistiek. (hemel, wat een kutvak is dat ook  ). Maar nu ben ik bezig met rentes uitrekenen. Alleen weet iemand met welke knop op de rekenmachine kan vermenigvuldigen. Dus niet de x knop. Maar bijvoorbeeld om rentes over langere periodes uit te rekenen, dan staat er zo'n kleine cijfer boven.
). Maar nu ben ik bezig met rentes uitrekenen. Alleen weet iemand met welke knop op de rekenmachine kan vermenigvuldigen. Dus niet de x knop. Maar bijvoorbeeld om rentes over langere periodes uit te rekenen, dan staat er zo'n kleine cijfer boven.
Een hele domme vraag ik weet het, maar zou toch fijn zijn als iemand mij zou kunnen helpen.
Een hele domme vraag ik weet het, maar zou toch fijn zijn als iemand mij zou kunnen helpen.


Bedoel je de exponent? Meestal staat hij op een rekenmachine als xy.
Dus als je 1,02 * 1,02 * 1,02 * 1,02 = (1,02)4 wilt toets je in: 1,02 xy 4.
Dus als je 1,02 * 1,02 * 1,02 * 1,02 = (1,02)4 wilt toets je in: 1,02 xy 4.
Op dinsdag 23 augustus 2011 23:18 schreef problematiQue het volgende:
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.


quote:Op vrijdag 8 januari 2010 22:14 schreef Gebraden_Wombat het volgende:
Bedoel je de exponent? Meestal staat hij op een rekenmachine als xy.
Dus als je 1,02 * 1,02 * 1,02 * 1,02 = (1,02)4 wilt toets je in: 1,02 xy 4.
*gaat zich doodschamen*
[ Bericht 1% gewijzigd door Zinedinho op 08-01-2010 22:33:50 ]


Ik heb even een lastige quantum mechanica vraag waar ik niet uit kom. Het gaat om de volgende twee pagina's uit mijn Quantum Theory boek en dan met name om de aangegeven vergelijking. Volgens mij worden hier een paar stappen ineen genomen maar ik zie het niet en ik kom er niet uit. Iemand die me dit wel kan uitleggen


Vragen over spuitgieten, hoe worden uitsteeksels die niet terugkunnen, zoals haken op een onderdeel, gemaakt met spuitgieten?


max(x,y) geeft toch het hoogste/maximale getal?
dus bij
max(x, (y + x)/2)
of
max(tentamen, (gemiddelde van de vijf beste tussentoetsen + tentamen)/2)
maakt het niet uit wat voor cijfer je hebt voor de tussentoetsen, als je het tentamen maar haalt?
dus bij
max(x, (y + x)/2)
of
max(tentamen, (gemiddelde van de vijf beste tussentoetsen + tentamen)/2)
maakt het niet uit wat voor cijfer je hebt voor de tussentoetsen, als je het tentamen maar haalt?


Ik had even spoed hulp bij een vraag nodig !
De vraag was, ik heb 25ml H2SO4- 0,025M oplossing (bereken de pH hiervan)
Dus ik deed het volgende:
h2SO4- dat is in totaal 0.025 mol/liter
dus je hebt 0.025mol h2SO4
dat bestaat dus uit 2 H+ en uit 1 SO4
verhouding is dus 2:1
0.025 / 3 = 0.00833333333
0.00833333333 * 2 = 0.0166666667
-log(0.0166666667) = 1.77815125
Dus zou de pH 1,78 moeten zijn....
Maar nu zegt mijn antwoordenboek dat de pH 1,3 moet zijn.... waar zit mijn fout ! ?
De vraag was, ik heb 25ml H2SO4- 0,025M oplossing (bereken de pH hiervan)
Dus ik deed het volgende:
h2SO4- dat is in totaal 0.025 mol/liter
dus je hebt 0.025mol h2SO4
dat bestaat dus uit 2 H+ en uit 1 SO4
verhouding is dus 2:1
0.025 / 3 = 0.00833333333
0.00833333333 * 2 = 0.0166666667
-log(0.0166666667) = 1.77815125
Dus zou de pH 1,78 moeten zijn....
Maar nu zegt mijn antwoordenboek dat de pH 1,3 moet zijn.... waar zit mijn fout ! ?


Ja. Als je je tentamen haalt, dan heb je in ieder geval het vak gehaald.quote:Op dinsdag 12 januari 2010 11:55 schreef .aeon het volgende:
max(x,y) geeft toch het hoogste/maximale getal?
dus bij
max(x, (y + x)/2)
of
max(tentamen, (gemiddelde van de vijf beste tussentoetsen + tentamen)/2)
maakt het niet uit wat voor cijfer je hebt voor de tussentoetsen, als je het tentamen maar haalt?
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


1 mol H2SO4 levert 2 mol H+, daar zit je fout.... Stel de ionisatievergelijking maar eens op.quote:Op dinsdag 12 januari 2010 22:06 schreef horned_reaper het volgende:
Ik had even spoed hulp bij een vraag nodig !
De vraag was, ik heb 25ml H2SO4- 0,025M oplossing (bereken de pH hiervan)
Dus ik deed het volgende:
h2SO4- dat is in totaal 0.025 mol/liter
dus je hebt 0.025mol h2SO4
dat bestaat dus uit 2 H+ en uit 1 SO4
verhouding is dus 2:1
0.025 / 3 = 0.00833333333
0.00833333333 * 2 = 0.0166666667
-log(0.0166666667) = 1.77815125
Dus zou de pH 1,78 moeten zijn....
Maar nu zegt mijn antwoordenboek dat de pH 1,3 moet zijn.... waar zit mijn fout ! ?
Dan kom je dus op 0,050 mol H+ uit, en dan klopt je berekening wel denk ik.


Die 0.025 mol wordt niet in drieën gedeeld waarvan 2 deeltjes H+, maar uit één deeltje H2SO4 komen twee deeltjes H+ (wordt direct duidelijk als je de reactie tekent met structuurformules).quote:Op dinsdag 12 januari 2010 22:06 schreef horned_reaper het volgende:
Ik had even spoed hulp bij een vraag nodig !
De vraag was, ik heb 25ml H2SO4- 0,025M oplossing (bereken de pH hiervan)
Dus ik deed het volgende:
h2SO4- dat is in totaal 0.025 mol/liter
dus je hebt 0.025mol h2SO4
dat bestaat dus uit 2 H+ en uit 1 SO4
verhouding is dus 2:1
0.025 / 3 = 0.00833333333
0.00833333333 * 2 = 0.0166666667
-log(0.0166666667) = 1.77815125
Dus zou de pH 1,78 moeten zijn....
Maar nu zegt mijn antwoordenboek dat de pH 1,3 moet zijn.... waar zit mijn fout ! ?
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


Ja ! bedankt beide ! ik zag het net ook opeens 
Stom van me..... teveel met andere dingen gerekend de laatste tijd dat ik de basismethoden helemaal kwijt ben
Stom van me..... teveel met andere dingen gerekend de laatste tijd dat ik de basismethoden helemaal kwijt ben


En wanneer ik 100 ml 0,20 M HF-oplossing heb.... en ik wil hier de pH van berekenen...
Er zal eerst een reactievergelijking gemaakt moeten worden.... daar zal zich een evenwicht opstellen, omdat het hier om een zwakke oplossing draait.
Maar hoe zal dit evenwicht gaan verlopen ?
HF + H2O ----> H3O+ + F- loopt maar 1 kant uit
Er zal eerst een reactievergelijking gemaakt moeten worden.... daar zal zich een evenwicht opstellen, omdat het hier om een zwakke oplossing draait.
Maar hoe zal dit evenwicht gaan verlopen ?
HF + H2O ----> H3O+ + F- loopt maar 1 kant uit


ook een pijl terug, anders is het geen evenwicht.
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


ja idd, maar deze vergelijking zal dus gewoon 1 : 1 staan ?quote:Op dinsdag 12 januari 2010 22:26 schreef GlowMouse het volgende:
ook een pijl terug, anders is het geen evenwicht.
Maar ik ben echt even de draad kwijt hoe ik hem nu af moet maken, want er spoken allemaal enge regels in mn hoofd als het om zwakke zuren en basen gaat...
Iets met wortels !


Kz= [H3O+][F-]/[HF]
Je begint met 0,020 mol HF; stel in het evenwicht is er nog 0,020-x mol over dan heb je x mol H3O+ en x mol F-. Je krijgt dan Kz = (10x)*(10x)/(10*(0,020-x)).
Je begint met 0,020 mol HF; stel in het evenwicht is er nog 0,020-x mol over dan heb je x mol H3O+ en x mol F-. Je krijgt dan Kz = (10x)*(10x)/(10*(0,020-x)).
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


De eerste is de exacte bepaling van de zuurconstante, de tweede een goede benadering in geval van kleine x.quote:Op dinsdag 12 januari 2010 22:43 schreef horned_reaper het volgende:
Kz=(x * x)/(0,20 - x) ---> Kz= x^2/0,20
Want x<2%
Is dit ook logisch dan ?


Hoi,
Voor het precieze verbruik van een auto die rijdt op waterstof wil ik berekenen hoeveel Joule energie (met elektriciteit) je per mol H2 eindproduct moet toevoegen. Dit is om de totale uitstoot (die dus vooral bij de opwekking van de elektriciteit wordt gegenereerd) te berekenen per km rijden met zo'n auto.
Op internet kan ik hier nergens over vinden, weet iemand hier het antwoord?
Voor het precieze verbruik van een auto die rijdt op waterstof wil ik berekenen hoeveel Joule energie (met elektriciteit) je per mol H2 eindproduct moet toevoegen. Dit is om de totale uitstoot (die dus vooral bij de opwekking van de elektriciteit wordt gegenereerd) te berekenen per km rijden met zo'n auto.
Op internet kan ik hier nergens over vinden, weet iemand hier het antwoord?


Helpt dit je?quote:Op woensdag 13 januari 2010 15:08 schreef CaptainCookie het volgende:
Hoi,
Voor het precieze verbruik van een auto die rijdt op waterstof wil ik berekenen hoeveel Joule energie (met elektriciteit) je per mol H2 eindproduct moet toevoegen. Dit is om de totale uitstoot (die dus vooral bij de opwekking van de elektriciteit wordt gegenereerd) te berekenen per km rijden met zo'n auto.
Op internet kan ik hier nergens over vinden, weet iemand hier het antwoord?
http://books.google.nl/books?id=OUIaM1V3ThsC&lpg=PT218&ots=vYyMgelYCI&dq="-571.7" enthalpy&pg=PT218#v=onepage&q="It is important to include the physical"&f=false
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Bedankt! Maar is 571,7kJ per mol waterstof niet wat veel?quote:Op woensdag 13 januari 2010 15:19 schreef Iblis het volgende:
[..]
Helpt dit je?
http://books.google.nl/books?id=OUIaM1V3ThsC&lpg=PT218&ots=vYyMgelYCI&dq="-571.7" enthalpy&pg=PT218#v=onepage&q="It is important to include the physical"&f=false


Met dit soort theorie heb ik erg veel moeite. Het enige dat ik je aan kan raden, is om in de bieb the Feynman lectures te halen, en dezelfde theorie in zijn lectures op te zoeken. Hij is een meester in het uitleggen.quote:Op zondag 10 januari 2010 20:56 schreef Telates het volgende:
Ik heb even een lastige quantum mechanica vraag waar ik niet uit kom. Het gaat om de volgende twee pagina's uit mijn Quantum Theory boek en dan met name om de aangegeven vergelijking. Volgens mij worden hier een paar stappen ineen genomen maar ik zie het niet en ik kom er niet uit. Iemand die me dit wel kan uitleggen
[ afbeelding ]
[ afbeelding ]
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson


Ik heb een vraag over een oud biologie-examenopgave , en dan vraag 12.
Na een tijd puzzelen kwam ik wel op een antwoord (en nog de goede ook):
q= 725/9049 = 0,08 --> q2= 0,006
Datzelfde geldt voor de meisjes:
0,006*9072= 58 dus antwoord A.
Is dit een juiste uitwerking of is het puur toeval dat ik op het juiste antwoord uitkom?
En als deze uitwerking goed is, zijn er dan ook andere uitwerkingen? Daar ben ik dan ook wel benieuwd naar.
Na een tijd puzzelen kwam ik wel op een antwoord (en nog de goede ook):
q= 725/9049 = 0,08 --> q2= 0,006
Datzelfde geldt voor de meisjes:
0,006*9072= 58 dus antwoord A.
Is dit een juiste uitwerking of is het puur toeval dat ik op het juiste antwoord uitkom?
En als deze uitwerking goed is, zijn er dan ook andere uitwerkingen? Daar ben ik dan ook wel benieuwd naar.


Ik denk dat je redenatie ongeveer goed is, maar dat de vraag eigenlijk niet te beantwoorden is.
Hun redenatie zal zijn: van de 9049 jongens zijn er 725 die kleurenblind zijn; als jongen hoef je maar 1 keer het foute gen te hebben (namelijk op het X-chromosoom) en het is mis. De kans dat je één fout X-chromosoom krijgt (van je moeder) is dus 8%.
Maar meisjes hebben twee X-chromosomen, en moeten dus twee foute X-chromosomen krijgen 8% · 8% = 0,6%, dus 0,6% van de meisjes zal kleurenblind zijn, en dat is 0,006 · 9072 = 58, dus antwoord A.
Maar m.i. valt er nog wel het nodige op dit antwoord af te dingen omdat je eigenlijk niet genoeg informatie hebt.
Hun redenatie zal zijn: van de 9049 jongens zijn er 725 die kleurenblind zijn; als jongen hoef je maar 1 keer het foute gen te hebben (namelijk op het X-chromosoom) en het is mis. De kans dat je één fout X-chromosoom krijgt (van je moeder) is dus 8%.
Maar meisjes hebben twee X-chromosomen, en moeten dus twee foute X-chromosomen krijgen 8% · 8% = 0,6%, dus 0,6% van de meisjes zal kleurenblind zijn, en dat is 0,006 · 9072 = 58, dus antwoord A.
Maar m.i. valt er nog wel het nodige op dit antwoord af te dingen omdat je eigenlijk niet genoeg informatie hebt.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


tvp
In fact, recent observations and simulations have suggested that a network of cosmic strings stretches across the entire universe.


Dat is toch gewoon (11.44) invullen en haakjes uitwerken? Je krijgt dan vier termen (q_n+1 q_n+1, q_n+1 q_n, q_n q_n+1 en q_n q_n. Ik weet dat ik het een keertje uitgewerkt heb, maar ik heb mijn aantekeningen hier niet.quote:Op zondag 10 januari 2010 20:56 schreef Telates het volgende:
Ik heb even een lastige quantum mechanica vraag waar ik niet uit kom. Het gaat om de volgende twee pagina's uit mijn Quantum Theory boek en dan met name om de aangegeven vergelijking. Volgens mij worden hier een paar stappen ineen genomen maar ik zie het niet en ik kom er niet uit. Iemand die me dit wel kan uitleggen
[ afbeelding ]
[ afbeelding ]


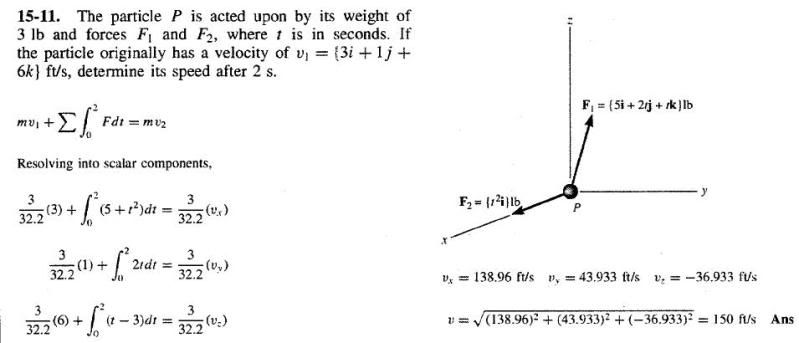
Vraagje waarom delen ze door 32,2 (de zwaartekracht).
m is toch gewoon massa in kg of in dit geval lb? Dus dan zou je toch gewoon 3 kunnen laten staan?
Blues ain't nothing but a good man feeling bad...


het is de omrekening van pound-force (lbf) naar pound-mass (lbm). De eerste is een eenheid voor kracht, de tweede een eenheid voor massa. Zie wikipedia.quote:Op zondag 17 januari 2010 16:14 schreef GoodGawd het volgende:
[ afbeelding ]
Vraagje waarom delen ze door 32,2 (de zwaartekracht).
m is toch gewoon massa in kg of in dit geval lb? Dus dan zou je toch gewoon 3 kunnen laten staan?


Ah okay! Dus als het 3 kg was geweest in plaats van die lbf dan had die omrekening niet gedaan hoeven te worden right 
Blues ain't nothing but a good man feeling bad...


Nee, inderdaad. Vergeet niet dat kg een massaeenheid is, terwijl lbf een maat voor kracht is. Voor dat laatste hanteren wij de SI-eenheid Newton.quote:Op zondag 17 januari 2010 17:13 schreef GoodGawd het volgende:
Ah okay! Dus als het 3 kg was geweest in plaats van die lbf dan had die omrekening niet gedaan hoeven te worden right


Naar een rij of kolom ontwikkelen. Dan krijg je dus:
Die tweede determinant die met vermenigvuldigd wordt is uiteraard 0, dus valt weg.
Die tweede determinant die met vermenigvuldigd wordt is uiteraard 0, dus valt weg.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Volgens mij klopt de laatste term van de ontwikkelde matrix niet.quote:Op maandag 18 januari 2010 15:59 schreef Iblis het volgende:
Naar een rij of kolom ontwikkelen. Dan krijg je dus:
[ afbeelding ]
Die tweede determinant die met [ afbeelding ] vermenigvuldigd wordt is uiteraard 0, dus valt weg.
edit: te laat


Ja, copy-pastefoutje.quote:Op maandag 18 januari 2010 16:01 schreef lyolyrc het volgende:
[..]
Volgens mij klopt de laatste term van de ontwikkelde matrix niet.
edit: te laat
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Meer mechanica vragen:
Ik snap niet wat ze bij de 5e regel opeens doen. Opeens zijn die 2e machten verdwenen en is die 12 foetsie. Wat is er aan de hand?
Ik snap niet wat ze bij de 5e regel opeens doen. Opeens zijn die 2e machten verdwenen en is die 12 foetsie. Wat is er aan de hand?
Blues ain't nothing but a good man feeling bad...


Ze beginnen met een tweede gelijkheid die moet gelden: de totale impuls moet gelijk blijven.
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


En dan hebben ze dus 2 vergelijkingen met 2 onbekenden.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


En dit zijn nog de makkelijke sommen, het volgende hoofdstuk is geen touw aan vast te knopen.
Blues ain't nothing but a good man feeling bad...


Nee dat zie je verkeerd. Er wordt eerst met de Wet van behoud van energie een betrekking afgeleid tussen de kwadraten van de beide snelheden vb en vc. Vervolgens wordt met de Wet van behoud van impuls een tweede betrekking afgeleid, nu tussen vb en vc zelf. Dan heb je twee vergelijkingen in twee onbekenden en kun je dus vb en vc beide uitrekenen.quote:Op woensdag 20 januari 2010 14:20 schreef GoodGawd het volgende:
Meer mechanica vragen:
[ afbeelding ]
Ik snap niet wat ze bij de 5e regel opeens doen. Opeens zijn die 2e machten verdwenen en is die 12 foetsie. Wat is er aan de hand?


ik weet het al 
[ Bericht 98% gewijzigd door GoodGawd op 20-01-2010 18:01:17 ]
[ Bericht 98% gewijzigd door GoodGawd op 20-01-2010 18:01:17 ]
Blues ain't nothing but a good man feeling bad...


Ik loop een beetje vast!
De vraag op zich is wel redelijk te begrijpen.... maar de manier om het uit te werken
De vraag op zich is wel redelijk te begrijpen.... maar de manier om het uit te werken
Het antwoord is in ieder geval: 1,4 : 1quote:Je hebt een HCO3- / CO32- buffer nodig met pH = 10,40.
Bereken in welke molverhouding je de stoffen NaHCO3 en Na2CO3 moet oplossen om een bufferoplossing te krijgen met pH = 10,40. Gegeven: Ka (H2CO¬3) = 4,4∙10-7 en Ka (HCO3-) = 5,6∙10-11.


quote:Op woensdag 20 januari 2010 17:51 schreef horned_reaper het volgende:
Ik loop een beetje vast!
De vraag op zich is wel redelijk te begrijpen.... maar de manier om het uit te werken
[..]
Het antwoord is in ieder geval: 1,4 : 1
nou, om te beginnen moet je de evenwichtsvergelijking opstellen:
Kacid = [H+]*[Base-]/[HB]
deze omvormen naar de pH-buffervergelijking door links en rechts de -10log te nemen:
pKacid = pH - log([Base-]/[HB])
nu is het een kwestie van invullen van gegevens
Je hebt een HCO3- / CO32- buffer nodig met pH = 10,40.
Bereken in welke molverhouding je de stoffen NaHCO3 en Na2CO3 moet oplossen om een bufferoplossing te krijgen met pH = 10,40.
Gegeven:
Kacid(H2CO3) = 4,4∙10-7 en Kacid(HCO3-) = 5,6∙10-11.
Je hebt een waterstofcarbonaat/carbonaat buffer nodig dus NaHCO3 is hier je zuur.
De vgl. wordt daarmee: pK[HCO3-] = 10.40 -log([CO3--]/[HCO3-])
constanten bij elkaar voegen: pK[HCO3-] - 10.40 = -log([CO3--]/[HCO3-])
aan de linkerkant komt een getal te staan, dus betekent dat er rechts hetzelfde getal moet komen te staan. Door links en rechts met -1 te vermenigvuldigen en vervolgens 10 te verheffen tot die macht, rolt direct je molverhouding uit de buffervgl.
[ Bericht 17% gewijzigd door ErictheSwift op 21-01-2010 17:42:29 ]


Kan iemand mij dit uitleggen.
0,5 * Integraal (u-1)/ wortel( u) wordt opeens --> 0,5 * integraal wortel( u) - 1/ wortel (u).
Dat vetgedrukte snap ik niet. Hoe kan u/wortel (u) nou wortel (u) zijn?
0,5 * Integraal (u-1)/ wortel( u) wordt opeens --> 0,5 * integraal wortel( u) - 1/ wortel (u).
Dat vetgedrukte snap ik niet. Hoe kan u/wortel (u) nou wortel (u) zijn?
In fact, recent observations and simulations have suggested that a network of cosmic strings stretches across the entire universe.


Hierbij toch maar een plaatje upgeload van het probleem:
In fact, recent observations and simulations have suggested that a network of cosmic strings stretches across the entire universe.


Even lang uitgeschreven:

Op dinsdag 23 augustus 2011 23:18 schreef problematiQue het volgende:
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.


Ah stom, ik had het ook zo uitgeschreven, maar op een of andere vaag manier had ik U2 - U-1/2 gebruikt. Vermoeiing he  hehhe.
hehhe.
In fact, recent observations and simulations have suggested that a network of cosmic strings stretches across the entire universe.


Ja, of √u√u = u, dus u/√u = √u, dat is net zo helder hoop ik als dat 2·2 = 4 dus 4/2 = 2  .
.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Heb een paar maanden terug een proef gedaan maar ben alles kwijt en heb nu last van een black out.
Als jullie mijn vragen willen beantwoorden zou ik erg blij zijn!
Vierkantsvergelijking van broomwater en heptaan
Welk type reactie is er opgetreden
Geef de namen voor de gevormde reactieproducten
Welke reactie treedt erop tussen 3-deceen en broom, geef de reactie vergelijking.
Welk type reactie is er opgetreden?
Geef de namen voor de gevormde reactie producten
Mijn dank is groot
Als jullie mijn vragen willen beantwoorden zou ik erg blij zijn!
Vierkantsvergelijking van broomwater en heptaan
Welk type reactie is er opgetreden
Geef de namen voor de gevormde reactieproducten
Welke reactie treedt erop tussen 3-deceen en broom, geef de reactie vergelijking.
Welk type reactie is er opgetreden?
Geef de namen voor de gevormde reactie producten
Mijn dank is groot


zoek eens op reactie van alkanen met halogenen, volgens mij kom je dan maar 1 type tegen.
Voor reacties tussen alkenen en halogenen kom je ook maar 1 type tegen..
En dan is het een kwestie van tekenen.
Voor reacties tussen alkenen en halogenen kom je ook maar 1 type tegen..
En dan is het een kwestie van tekenen.


Tekenen met structuurformules.
Dus heptaan even uittekenen, en kijken hoeveel producten daarbij kunnen ontstaan.
Het zelfde voor de reactie van 3-deceen en broom(daar ben je ws. sneller klaar).
Dus heptaan even uittekenen, en kijken hoeveel producten daarbij kunnen ontstaan.
Het zelfde voor de reactie van 3-deceen en broom(daar ben je ws. sneller klaar).


Gegoogled, kom er nog steeds niet uit... Liefst heb ik het antwoord met uitleg erbij ipv hint...
[ Bericht 82% gewijzigd door vault_tec op 21-01-2010 21:19:31 ]
[ Bericht 82% gewijzigd door vault_tec op 21-01-2010 21:19:31 ]


Ter illustratie:
De reacties tussen halogenen en alkanen vallen onder de zgn. substitutiereactie (substitutie oftewel omwisseling/vervanging) en gaat schematisch als volgt:
broomwater is niet meer als broom opgelost/gedispergeerd in water, zeg maar Br2(aq). Onder invloed van licht (hf) valt het broommolekuul Br2(aq) uiteen in twee losse broomatomen met elk een ongepaard electron, twee Br* -radicalen dus.
1 zo'n broomradicaal reageert met een alkaan tot een monohalogeenalkaan en HBr. Zolang er maar genoeg broom is zal op ten duur elk waterstofatoom van de alkanen gesubstitueerd worden voor een broomatoom.
Deze reactie verloopt, zoals je boven al hebt kunnen raden, alleen in licht.
De reacties tussen halogenen en alkenen behoren tot de zgn. additiereacties (additie oftewel toevoeging/optelling). Alkenen hebben die dubbele binding (-HC=CH-) die bol staat van elektronen(dichtheid), en halogenen zijn maar wat gek op elektronen dankzij die BIJ-NA volle buitenste schil. Dr zal dus een complex gevormd worden waarbij een broommolekuul met 1 kant/atoom aan de dubbele binding gaat hechten. Het buitenste broomatoom splitst zich af, er ontstaat een -HCBr-CH*- reactie-intermediair, en vervolgens zal het tweede broomatoom, dat zich zojuist heeft afgesplitst, vanaf de andere kant aan het andere C-atoom hechten. Uiteindelijk krijg je dan een dihalogeenkoolwaterstof met een -HCBr-CHBr- waarbij de broomatomen zich elk aan de andere kant van het molekuul begeven dankzij de sterische belemmering (broomatomen zijn groot ivm koolstof en waterstof).
Additiereacties verlopen dus zowel in het donker als in het licht. Merk op dat in het licht de substitutiereactie tegelijk met de additiereactie optreedt.
Voor een betere visualisatie kan je beter even je organisch chemisch boek erbij pakken of naar de wikipedia-page surfen.
De reacties tussen halogenen en alkanen vallen onder de zgn. substitutiereactie (substitutie oftewel omwisseling/vervanging) en gaat schematisch als volgt:
broomwater is niet meer als broom opgelost/gedispergeerd in water, zeg maar Br2(aq). Onder invloed van licht (hf) valt het broommolekuul Br2(aq) uiteen in twee losse broomatomen met elk een ongepaard electron, twee Br* -radicalen dus.
1 zo'n broomradicaal reageert met een alkaan tot een monohalogeenalkaan en HBr. Zolang er maar genoeg broom is zal op ten duur elk waterstofatoom van de alkanen gesubstitueerd worden voor een broomatoom.
Deze reactie verloopt, zoals je boven al hebt kunnen raden, alleen in licht.
De reacties tussen halogenen en alkenen behoren tot de zgn. additiereacties (additie oftewel toevoeging/optelling). Alkenen hebben die dubbele binding (-HC=CH-) die bol staat van elektronen(dichtheid), en halogenen zijn maar wat gek op elektronen dankzij die BIJ-NA volle buitenste schil. Dr zal dus een complex gevormd worden waarbij een broommolekuul met 1 kant/atoom aan de dubbele binding gaat hechten. Het buitenste broomatoom splitst zich af, er ontstaat een -HCBr-CH*- reactie-intermediair, en vervolgens zal het tweede broomatoom, dat zich zojuist heeft afgesplitst, vanaf de andere kant aan het andere C-atoom hechten. Uiteindelijk krijg je dan een dihalogeenkoolwaterstof met een -HCBr-CHBr- waarbij de broomatomen zich elk aan de andere kant van het molekuul begeven dankzij de sterische belemmering (broomatomen zijn groot ivm koolstof en waterstof).
Additiereacties verlopen dus zowel in het donker als in het licht. Merk op dat in het licht de substitutiereactie tegelijk met de additiereactie optreedt.
Voor een betere visualisatie kan je beter even je organisch chemisch boek erbij pakken of naar de wikipedia-page surfen.


Dank je wel, zo was het even helemaal kwijt terwijl ik dit al 8 weken langs op school behandel.
Fijne avond verder
Fijne avond verder


Dringende vraag!
Hoe kan ik dit met Excel uitrekenen?
"Het gewicht van appel is normaal verdeeld met "mU" (Gemiddelde) = 100 en Sigma (St,afw) = 20"
"Wel percentage appels heeft een gewicht tussen 70 en 110 g? "
Hoe kan ik dit met Excel uitrekenen?
"Het gewicht van appel is normaal verdeeld met "mU" (Gemiddelde) = 100 en Sigma (St,afw) = 20"
"Wel percentage appels heeft een gewicht tussen 70 en 110 g? "


NORMDIST(x;mu;sigma;TRUE) geeft de kans dat X<x.quote:Op vrijdag 22 januari 2010 09:04 schreef horned_reaper het volgende:
Dringende vraag!
Hoe kan ik dit met Excel uitrekenen?
"Het gewicht van appel is normaal verdeeld met "mU" (Gemiddelde) = 100 en Sigma (St,afw) = 20"
"Wel percentage appels heeft een gewicht tussen 70 en 110 g? "
Dus bereken NORMDIST(110;100;20;TRUE) en NORMDIST(70;100;20;TRUE). Het verschil van deze twee waarden is de waarde die je zoekt.


Ik heb drie (even grote) massa's en die geef ik een beginpositie en beginsnelheid. De differentiaalvergelijkingen los ik numeriek op met een programma, waarmee ik op ieder tijdstip de positie, snelheid en versnelling van elke drie massa's kan uitrekenen.
Hoe kan ik de totale potentiële energie berekenen in het systeem met de drie massa's op verschillende tijdstippen?
Moet je dan als referentiepunt het massamiddelpunt van de drie massa's nemen?
[ Bericht 19% gewijzigd door BasementDweller op 24-01-2010 00:27:42 ]
Hoe kan ik de totale potentiële energie berekenen in het systeem met de drie massa's op verschillende tijdstippen?
Moet je dan als referentiepunt het massamiddelpunt van de drie massa's nemen?
[ Bericht 19% gewijzigd door BasementDweller op 24-01-2010 00:27:42 ]


Je hebt posities, uitrekkingen van veren, hoeken, elektrische velden die werken op de massa’s, ladingen en nog wat meer nodig.
Maar, misschien is het makkelijker dat je het vraagstuk stelt.
Maar, misschien is het makkelijker dat je het vraagstuk stelt.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Het is "gewoon" een leeg heelal waarin 3 puntmassa's zweven. Dus je hebt alleen te maken met zwaartekracht. De vraag is als volgt:quote:Op zondag 24 januari 2010 00:22 schreef Iblis het volgende:
Je hebt posities, uitrekkingen van veren, hoeken, elektrische velden die werken op de massa’s, ladingen en nog wat meer nodig.
Maar, misschien is het makkelijker dat je het vraagstuk stelt.
8. Bereken de kinetische, de potentiële en totale (kinetische plus potentiële) energie van het systeem op t=0 (exact) en ook op t=50 (numeriek). Met welk percentage is de totale energie veranderd. Waarom is de totale energie op t=50 niet exact hetzelfde als op t=0?
De kinetische energie is geen probleem, omdat ik op ieder moment de snelheden heb. Maar hoe ik de Epot kan uitrekenen....
Om dit vraagstuk op te lossen heb je natuurlijk meer gegevens nodig (massa, beginpositie, beginsnelheid, gravitatieconstante, ...) en die heb ik ook, maar het gaat me om de methode.


http://scienceworld.wolfr(...)PotentialEnergy.html geeft in ieder geval een formule, en volgens mij kun je die paarsgewijs toepassen, maar houd me ten goede. Het is dat het zo laat is, anders had ik gezegd, beter wacht je nog even op iemand die er meer verstand van heeft.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Die formule ken ik ja. De vraag is eigenlijk wat neem je als referentiepunt...quote:Op zondag 24 januari 2010 00:43 schreef Iblis het volgende:
http://scienceworld.wolfr(...)PotentialEnergy.html geeft in ieder geval een formule, en volgens mij kun je die paarsgewijs toepassen, maar houd me ten goede. Het is dat het zo laat is, anders had ik gezegd, beter wacht je nog even op iemand die er meer verstand van heeft.
Ik denk trouwens misschien gewoon een willekeurige massa. Het maakt niet uit of je massa1, 2 of 3 neemt want het is een symmetrisch geval.
Dat is natuurlijk niet waar. Blijft het massamiddelpunt over als logische keus denk ik...
Trouwens ook vreemd dat de totale energie dan niet gelijk zou moeten zijn.
edit:
Heb deze gevonden:
Ziet er wel logisch uit
Snap nog steeds niet waarom de totale energie verandert
[ Bericht 5% gewijzigd door BasementDweller op 24-01-2010 04:08:23 ]


Ik wel. Wat ben je namelijk aan het doen om het probleem op te lossen?quote:Op zondag 24 januari 2010 00:46 schreef BasementDweller het volgende:
Snap nog steeds niet waarom de totale energie verandert
Op dinsdag 23 augustus 2011 23:18 schreef problematiQue het volgende:
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.


Numerieke berekeningen uitvoeren. Daar verwacht je toch geen afwijking van meer dan 1% in, als je dat soms bedoelt?quote:Op zondag 24 januari 2010 11:51 schreef Gebraden_Wombat het volgende:
[..]
Ik wel. Wat ben je namelijk aan het doen om het probleem op te lossen?


Welke formule kan het volgende verloop van getallen beschrijven:
000111222333 of
000033336666 of
224466881010
000111222333 of
000033336666 of
224466881010


Ik snap er niets van. Is dit één vraag, of zijn het er drie?quote:Op zondag 24 januari 2010 12:11 schreef .aeon het volgende:
Welke formule kan het volgende verloop van getallen beschrijven:
000111222333 of
000033336666 of
224466881010
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Specifieker ben je een numerieke benadering aan het uitvoeren. Hoe groot de fout daarin is hangt helemaal af van je systeem en de eigenschappen van je numerieke benadering.quote:Op zondag 24 januari 2010 12:11 schreef BasementDweller het volgende:
[..]
Numerieke berekeningen uitvoeren. Daar verwacht je toch geen afwijking van meer dan 1% in, als je dat soms bedoelt?
De vraag is bovendien:
Antwoord: omdat er een fout in de numerieke benadering zit ten opzichte van een exacte oplossing (als die bestaat).quote:Waarom is de totale energie op t=50 niet exact hetzelfde als op t=0?
Op dinsdag 23 augustus 2011 23:18 schreef problematiQue het volgende:
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.


Ah. Ik vond net een afwijking van 10%, en dat kan je haast niet toeschrijven aan onnauwkeurigheid. Ik heb echter een foutje gevonden en nu komt er een verschil in van 0.001%. Dan zit het inderdaad in de onnauwkeurigheid.quote:Op zondag 24 januari 2010 13:25 schreef Gebraden_Wombat het volgende:
[..]
Specifieker ben je een numerieke benadering aan het uitvoeren. Hoe groot de fout daarin is hangt helemaal af van je systeem en de eigenschappen van je numerieke benadering.
De vraag is bovendien:
[..]
Antwoord: omdat er een fout in de numerieke benadering zit ten opzichte van een exacte oplossing (als die bestaat).


Toevallig ben ik nu bezig met een vak over signalen, en daar zou je die serie getallen in discrete tijd opschrijven alsquote:Op zondag 24 januari 2010 12:29 schreef Iblis het volgende:
Ah, zo. Dat is iets als:
[ afbeelding ]
De Entier functie.
met u[n] de "unit step function" = 0 voor n<0 en 1 voor n=>0.
a is dan de "hoogte van een stap", b het aantal herhalingen in een stap en c de eerste n waar het signaal ongelijk aan 0 is.
Op dinsdag 23 augustus 2011 23:18 schreef problematiQue het volgende:
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.


[55 - (52,5 - X) *0,2] / 1,12 = X
Is dit op te lossen en zo ja, hoe ?
Is dit op te lossen en zo ja, hoe ?
"Vanity, definitely my favorite sin. . . ."


Ja, één vergelijking met één onbekende heeft een oplossing. Je zou de haakjes weg kunnen werken aan de linkerkant en alles delen door 1,12. Dan hou je een term over met X erin. Vervolgens haal je die term naar rechts. Begin daar eens meequote:Op zondag 24 januari 2010 18:32 schreef One_conundrum het volgende:
[55 - (52,5 - X) *0,2] / 1,12 = X
Is dit op te lossen en zo ja, hoe ?


Het is eenvoudiger om eerst beide leden met 1,12 te vermenigvuldigen omdat je daarmee de breuk in het linkerlid kwijtraakt en dus niet meer met quotiënten van decimale breuken hoeft te werken.quote:Op zondag 24 januari 2010 19:13 schreef BasementDweller het volgende:
[..]
Ja, één vergelijking met één onbekende heeft een oplossing. Je zou de haakjes weg kunnen werken aan de linkerkant en alles delen door 1,12. Dan hou je een term over met X erin. Vervolgens haal je die term naar rechts. Begin daar eens mee


Je vermenigvuldigt eerst beide leden met 1,12 om de breuk in het linkerlid kwijt te raken. Dan krijgen we:quote:Op zondag 24 januari 2010 18:32 schreef One_conundrum het volgende:
[55 - (52,5 - X) *0,2] / 1,12 = X
Is dit op te lossen en zo ja, hoe ?
55 - (52,5 - X) *0,2 = 1,12*X
Nu jij weer.


En hoe krijg ik dan een X aan één kant 
Edit: heb em. Ben niet dom, tis gewoon gheel roestig ":P
Edit: heb em. Ben niet dom, tis gewoon gheel roestig ":P
"Vanity, definitely my favorite sin. . . ."


Godver,
Dus;
55 - 10,5 - 0,2X = 1,12X
44,5 - 0,2X = 1,12X
44,5 = 1,32X
Klopt dat?
Dus;
55 - 10,5 - 0,2X = 1,12X
44,5 - 0,2X = 1,12X
44,5 = 1,32X
Klopt dat?
"Vanity, definitely my favorite sin. . . ."


nee, je werkt de haakjes niet goed weg
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


Hier gaat het al fout.quote:Op zondag 24 januari 2010 21:02 schreef One_conundrum het volgende:
Godver,
Dus;
55 - 10,5 - 0,2X = 1,12X


Dat had ik ook al door. Ik zou het wel lief vinden als iemand me vertelt hoe wél moet...
"Vanity, definitely my favorite sin. . . ."


papegaaiquote:
(10,5 - 0,2X).quote:
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


Je blijft dus net zo lang zagen tot iemand het je van A tot Z voorkauwt?quote:Op zondag 24 januari 2010 21:23 schreef One_conundrum het volgende:
Dat had ik ook al door. Ik zou het wel lief vinden als iemand me vertelt hoe wél moet...
We hadden:
55 - (52,5 - X)*0,2 = 1,12*X
Haakjes wegwerken geeft:
55 - 10,5 + 0,2*X = 1,12*X
Zie je ook waarom?


Ik vroeg toch gelijk 'hoe' ? Ik snap het niet een daarom kom ik hier. Nu snap ik het wel. Bedankt daarvoor. Niet zo belerend doen aub.quote:Op zondag 24 januari 2010 21:26 schreef Riparius het volgende:
[..]
Je blijft dus net zo lang zagen tot iemand het je van A tot Z voorkauwt?
Maar ik begrijp nu wat ik fout deed, ik vergat een - .. Tijd voor een goeie opfris cursus
Bedankt
"Vanity, definitely my favorite sin. . . ."


Kw is de evenwichtsconstante voor water. Water kan dissociëren in H3O+ en OH- en de gevormde ionen kunnen weer associëren tot H2O.
De evenwichtsconstante die hierbij hoort is temperatuursafhankelijk en daarom niet altijd gelijk aan 1,0 * 10 -14.
De evenwichtsconstante die hierbij hoort is temperatuursafhankelijk en daarom niet altijd gelijk aan 1,0 * 10 -14.


Vraagje over predikaatlogica, zou je de volgende zin zo kunnen formaliseren?
- Voor iedere x en y geldt: x houdt van y alleen als x lekker in zijn vel zit.
(waarbij V (alle) vrouwen zijn, M (alle) mannen, H(x,y) staat voor 'x houdt van y' en 'lekker in je vel zitten' wordt gedefinieerd als van jezelf houden.)
∀x,y∈M∪V[H(x,x)→H(x,y)]
of is dat te makkelijk gedacht?
- Voor iedere x en y geldt: x houdt van y alleen als x lekker in zijn vel zit.
(waarbij V (alle) vrouwen zijn, M (alle) mannen, H(x,y) staat voor 'x houdt van y' en 'lekker in je vel zitten' wordt gedefinieerd als van jezelf houden.)
∀x,y∈M∪V[H(x,x)→H(x,y)]
of is dat te makkelijk gedacht?


Heb je een officiële formalisering van ‘alleen als’?
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Nee ik geloof van niet. Wel de dubbele pijl f↔g die staat voor 'f ..dan en slechts dan als.. g', maar die heb ik volgens mij niet nodig. Ik zou zeggen
¬f→¬g ∧f→g
dus
∀x,y∈M∪V[¬H(x,x)→¬H(x,y)∧H(x,x)→H(x,y)]
Klopt dat?
edit: hoewel, volgens mij is dat hetzelfde als ↔
[ Bericht 5% gewijzigd door .aeon op 25-01-2010 19:17:45 ]
¬f→¬g ∧f→g
dus
∀x,y∈M∪V[¬H(x,x)→¬H(x,y)∧H(x,x)→H(x,y)]
Klopt dat?
edit: hoewel, volgens mij is dat hetzelfde als ↔
[ Bericht 5% gewijzigd door .aeon op 25-01-2010 19:17:45 ]


Dan zou ik nog ∀x ∈ M, ∀y ∈ V doen, omdat je nu in principe ook een x en y kunt kiezen die ‘oorspronkelijk’ beide in M of V zaten.
En over je alleen als. Je hebt nu:
¬H(x,x) → ¬H(x,y) ∧ H(x,x) → H(x,y)
Wanneer is dit waar? Als je uit het uitwerkt vind je: H(x,x) ↔ H(x, y). Immers, is b.v. H(x,x) waar maar H(x,y) niet, dan is het rechterlid van de conjunctie niet waar, is H(x,x) onwaar, maar H(x,y) waar, dan is het linkerlid onwaar. Wat je dus ook in je dit opmerkt.
En over je alleen als. Je hebt nu:
¬H(x,x) → ¬H(x,y) ∧ H(x,x) → H(x,y)
Wanneer is dit waar? Als je uit het uitwerkt vind je: H(x,x) ↔ H(x, y). Immers, is b.v. H(x,x) waar maar H(x,y) niet, dan is het rechterlid van de conjunctie niet waar, is H(x,x) onwaar, maar H(x,y) waar, dan is het linkerlid onwaar. Wat je dus ook in je dit opmerkt.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Ja, van mij wel.quote:Op maandag 25 januari 2010 19:25 schreef .aeon het volgende:
Ja dat laatste zag ik ook al
Maar ze mogen toch ook beide uit M of V komen?
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Nu begint ik dus eerst voor 1.0 M.quote:Acetic acid, CH3CO2H, is the solute that gives vinegar its characteristic odor and sour taste. Calculate the pH and the concentrations of all species present (H3O+, CH3CO2-, CH3CO2H, and OH-) in:
(a) 1.00 M CH3CO2H
(b) 0.0100 M CH3CO2H
H3CO2H + H2O <--> H3O+ + CH3CO2-
K = [ H3O+ ] * [ CH3CO2- ] / [ H3CO2H ]
Dat maakt: Ka = [X] * [X] / [1-X]
En dan snap ik het niet meer


Een dunne balk met een homogeen verdeelde massa, heeft twee kleine balletjes vastgeplakt aan beide uiteinden. Als je de balk horizontaal tekent op papier, komt staat de as loodrecht op het papier, door het midden van de balk. Op t=0 komt er een balletje los, waardoor de balk gaat draaien. Nu moet ik de hoekversnelling berekenen precies nadat het ene balletje los is gekomen.
Gegevens:
Massa balk: 3.80kg
Massa balletjes: 2.50kg
Lengte balk: 0.80m
g=9.81 m/s²
I = mL²/12
Mijn poging:
Omdat de hoek tussen de arm en de kracht 90 graden is, geldt:
t = r F = I a (torque = lever arm * force = moment of inertia * angular accelleration)
Omdat de massa van de balk homogeen verdeeld is en de as in het midden zit, heffen de torques ten gevolge van de zwaartekracht op de balk elkaar op, dus alleen de zwaartekracht op het balletje speelt een rol.
Het balletje zit op een afstand van 0.80/2=0.40m. Dus t = 0.40 * 2.50 * 9.81 = 9.81 = (mL²/12) a .
Ik kan nu oplossen voor a, maar dan krijg ik een uitdrukking met L erin, maar ik zou een getal moeten krijgen. Wat moet ik doen?
Ik weet wel dat L=I w (L= angular momentum, w=angular velocity), maar omdat ie op t=0 nog geen hoeksnelheid heeft zou ik krijgen dat 0=9.81?
[ Bericht 1% gewijzigd door BasementDweller op 26-01-2010 13:03:11 ]
Gegevens:
Massa balk: 3.80kg
Massa balletjes: 2.50kg
Lengte balk: 0.80m
g=9.81 m/s²
I = mL²/12
Mijn poging:
Omdat de hoek tussen de arm en de kracht 90 graden is, geldt:
t = r F = I a (torque = lever arm * force = moment of inertia * angular accelleration)
Omdat de massa van de balk homogeen verdeeld is en de as in het midden zit, heffen de torques ten gevolge van de zwaartekracht op de balk elkaar op, dus alleen de zwaartekracht op het balletje speelt een rol.
Het balletje zit op een afstand van 0.80/2=0.40m. Dus t = 0.40 * 2.50 * 9.81 = 9.81 = (mL²/12) a .
Ik kan nu oplossen voor a, maar dan krijg ik een uitdrukking met L erin, maar ik zou een getal moeten krijgen. Wat moet ik doen?
Ik weet wel dat L=I w (L= angular momentum, w=angular velocity), maar omdat ie op t=0 nog geen hoeksnelheid heeft zou ik krijgen dat 0=9.81?
[ Bericht 1% gewijzigd door BasementDweller op 26-01-2010 13:03:11 ]


L is toch gegeven? 
quote:Lengte balk: 0.80m
Op dinsdag 23 augustus 2011 23:18 schreef problematiQue het volgende:
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.


Waarom zou de angular momentum in de formule voor de moment of inertia (I) zitten? Dat klopt dimensioneel ook niet.quote:Op dinsdag 26 januari 2010 13:00 schreef BasementDweller het volgende:
[..]
L = angular momentum en niet de lengte van de balk, als je dat dacht..?
I = mL2 /12
[kg] [m2] = [kg] [L2]
--> [L] = [m]
Op dinsdag 23 augustus 2011 23:18 schreef problematiQue het volgende:
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.


quote:Op dinsdag 26 januari 2010 13:06 schreef Gebraden_Wombat het volgende:
[..]
Waarom zou de angular momentum in de formule voor de moment of inertia (I) zitten? Dat klopt dimensioneel ook niet.
I = mL2 /12
[kg] [m2] = [kg] [L2]
--> [L] = [m]
Ik weet niet waar je dat vandaan haalt.
Lees dit nog maar eens door: http://en.wikipedia.org/wiki/Moment_of_inertia
Met die vierkante haken geef je aan dat je de eenheid bedoelt van de grootheid tussen die haken. Je zegt [kg]... dat betekent dus de eenheid van kg?? Kg is al een eenheid...


Hij vult voor l en m de eenheden in, en kijkt dan welke eenheid L logischerwijs moet hebben.quote:Op dinsdag 26 januari 2010 13:26 schreef BasementDweller het volgende:
[..]

Ik weet niet waar je dat vandaan haalt.
Lees dit nog maar eens door: http://en.wikipedia.org/wiki/Moment_of_inertia
Met die vierkante haken geef je aan dat je de eenheid bedoelt van de grootheid tussen die haken. Je zegt [kg]... dat betekent dus de eenheid van kg?? Kg is al een eenheid...
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Oh wat dom. Ik dacht dat je de L's door elkaar haalde, maar dat is precies wat ik zelf fout doe  . Ik kan het beter R noemen.
. Ik kan het beter R noemen.
Even kijken of ik op het goede antwoord kom.
Even kijken of ik op het goede antwoord kom.


Ik krijg 12*.4*2.5*9.81 / (3.80* .8²) = 48.3 maar het antwoord moet 16.1 rad/s² zijn. Ergens een factor 3 fout dus....quote:Op dinsdag 26 januari 2010 14:03 schreef BasementDweller het volgende:
Even kijken of ik op het goede antwoord kom.
Ik zie nergens de fout.
[ Bericht 4% gewijzigd door BasementDweller op 26-01-2010 14:12:28 ]


Even ter herinnering 
H3CO2H + H2O <--> H3O+ + CH3CO2-
K = [ H3O+ ] * [ CH3CO2- ] / [ H3CO2H ]
Dat maakt: Ka = [X] * [X] / [1-X]
En dan snap ik het niet meer
Nu begint ik dus eerst voor 1.0 M.quote:Acetic acid, CH3CO2H, is the solute that gives vinegar its characteristic odor and sour taste. Calculate the pH and the concentrations of all species present (H3O+, CH3CO2-, CH3CO2H, and OH-) in:
(a) 1.00 M CH3CO2H
(b) 0.0100 M CH3CO2H
H3CO2H + H2O <--> H3O+ + CH3CO2-
K = [ H3O+ ] * [ CH3CO2- ] / [ H3CO2H ]
Dat maakt: Ka = [X] * [X] / [1-X]
En dan snap ik het niet meer


Nou, je begint met 1 mol azijnzuur..
Dat splitst maar gedeeltelijk, omdat het een zwak zuur is. Het gedeelte wat opsplitst noem ik X.
De hoeveelheid azijnzuur in het evenwicht is dan 1-X
Er ontstaat dan een hoeveelheid H3O+ en CH3CO2-, de hoeveelheden die daarbij ontstaan zijn X.
Dit vul je in in de Kz, en je kan de haakjes wegwerken, en de vergelijking oplossen, en dan heb je dus X. De waarde van Kz kan je in je binas vinden(tabel 48 of 49).
Weet je de concentratie H3O+, dan kan je de pH berekenen, en via de waterconstante ook de concentratie OH-
Dat splitst maar gedeeltelijk, omdat het een zwak zuur is. Het gedeelte wat opsplitst noem ik X.
De hoeveelheid azijnzuur in het evenwicht is dan 1-X
Er ontstaat dan een hoeveelheid H3O+ en CH3CO2-, de hoeveelheden die daarbij ontstaan zijn X.
Dit vul je in in de Kz, en je kan de haakjes wegwerken, en de vergelijking oplossen, en dan heb je dus X. De waarde van Kz kan je in je binas vinden(tabel 48 of 49).
Weet je de concentratie H3O+, dan kan je de pH berekenen, en via de waterconstante ook de concentratie OH-


Ik moest even puzzelen voor ik je opgave begreep. Als je het tekent heb je dus een zwaartekracht die naar beneden wijst?quote:Op dinsdag 26 januari 2010 14:05 schreef BasementDweller het volgende:
[..]
Ik krijg 12*.4*2.5*9.81 / (3.80* .8²) = 48.3 maar het antwoord moet 16.1 rad/s² zijn. Ergens een factor 3 fout dus....
Ik zie nergens de fout.
Wat je denk ik fout doet is het verkeerde impulsmoment nemen. Het hele systeem van balk+bal moet gaan draaien, en je moet dus ook het totale impulsmoment Itot in je uiteindelijk opgestelde vergelijking invullen.
De bijdrage aan het impulsmoment van de balk had je al, namelijk Ibalk = mL2/12. De bijdrage van de bal is Ibal = r2mbal = L2mbal/4.
Op dinsdag 23 augustus 2011 23:18 schreef problematiQue het volgende:
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.


Ah, ja natuurlijk. Dat is hemquote:Op dinsdag 26 januari 2010 17:55 schreef Gebraden_Wombat het volgende:
[..]
Ik moest even puzzelen voor ik je opgave begreep. Als je het tekent heb je dus een zwaartekracht die naar beneden wijst?
Wat je denk ik fout doet is het verkeerde impulsmoment nemen. Het hele systeem van balk+bal moet gaan draaien, en je moet dus ook het totale impulsmoment Itot in je uiteindelijk opgestelde vergelijking invullen.
De bijdrage aan het impulsmoment van de balk had je al, namelijk Ibalk = mL2/12. De bijdrage van de bal is Ibal = r2mbal = L2mbal/4.
Bedankt!


Nog even snel een vraag !
Ik reken het op de volgende manier uit:
-log(3,2 * 10 ^-8) = 7,49
7,3 = 7,49 +log b/z
Dus: Log b/z = 7,3 - 7,49
Log b/z = -0,19
10^-0,19 = 0,64
Dus mijn antwoord is 0,64
Maar nu zegt mijn antwoordblad dat het antwoord 1,56 is.... en dat 0,64 eigenlijk de omgekeerde verhouding is en daar striktelijk gezien niet om gevraagd wordt...
Maar met welke stap kom ik dan tot die 1,56... want dit brengt even een vraagteken bij me naar boven!
Ik reken het op de volgende manier uit:
-log(3,2 * 10 ^-8) = 7,49
7,3 = 7,49 +log b/z
Dus: Log b/z = 7,3 - 7,49
Log b/z = -0,19
10^-0,19 = 0,64
Dus mijn antwoord is 0,64
Maar nu zegt mijn antwoordblad dat het antwoord 1,56 is.... en dat 0,64 eigenlijk de omgekeerde verhouding is en daar striktelijk gezien niet om gevraagd wordt...
Maar met welke stap kom ik dan tot die 1,56... want dit brengt even een vraagteken bij me naar boven!


Wat je doet is goed. Ik kan me alleen voorstellen dat ze met de verhouding tussen HOCl en ClO- bedoelen: [HOCl]/[ClO-], i.p.v. [ClO-]/[HOCl] wat je nu uitrekent.quote:Op dinsdag 26 januari 2010 22:55 schreef horned_reaper het volgende:
Nog even snel een vraag !
[ afbeelding ]
Ik reken het op de volgende manier uit:
-log(3,2 * 10 ^-8) = 7,49
7,3 = 7,49 +log b/z
Dus: Log b/z = 7,3 - 7,49
Log b/z = -0,19
10^-0,19 = 0,64
Dus mijn antwoord is 0,64
Maar nu zegt mijn antwoordblad dat het antwoord 1,56 is.... en dat 0,64 eigenlijk de omgekeerde verhouding is en daar striktelijk gezien niet om gevraagd wordt...
Maar met welke stap kom ik dan tot die 1,56... want dit brengt even een vraagteken bij me naar boven!


Dankjequote:Op woensdag 27 januari 2010 00:10 schreef lyolyrc het volgende:
[..]
Wat je doet is goed. Ik kan me alleen voorstellen dat ze met de verhouding tussen HOCl en ClO- bedoelen: [HOCl]/[ClO-], i.p.v. [ClO-]/[HOCl] wat je nu uitrekent.
Alleen mocht het vanochtend allemaal niet baten
Ik heb m'n tentamen zwaar verprutst.... en dat is de eerste dit jaar....


Jammer van je tentamen!quote:Op woensdag 27 januari 2010 12:24 schreef horned_reaper het volgende:
Dankje
Alleen mocht het vanochtend allemaal niet baten
Ik heb m'n tentamen zwaar verprutst.... en dat is de eerste dit jaar....


Natuurkunde,
Reken om 10kWh en het antwoord moet 36000 kJ zijn. Hoe reken ik dit uit?
Mijn dank is groot!
Reken om 10kWh en het antwoord moet 36000 kJ zijn. Hoe reken ik dit uit?
Mijn dank is groot!


Een Watt is een Joule / seconde.quote:Op donderdag 28 januari 2010 11:30 schreef vault_tec het volgende:
Natuurkunde,
Reken om 10kWh en het antwoord moet 36000 kJ zijn. Hoe reken ik dit uit?
Mijn dank is groot!
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


36000/ 3600 = 10.
Mijn dank is groot
Nog 1 vraag.
3 door drie in serie geschakelde weerstanden loopt een stroom van 4 A. Ze zijn aangesloten op een spanning van 120 V. Wat is de weerstand van R3 als verder gegeven is: R1 = 8 Ohm en R2 = 12 Ohm.
[ Bericht 44% gewijzigd door vault_tec op 28-01-2010 14:22:08 ]
Mijn dank is groot
Nog 1 vraag.
3 door drie in serie geschakelde weerstanden loopt een stroom van 4 A. Ze zijn aangesloten op een spanning van 120 V. Wat is de weerstand van R3 als verder gegeven is: R1 = 8 Ohm en R2 = 12 Ohm.
[ Bericht 44% gewijzigd door vault_tec op 28-01-2010 14:22:08 ]


Hint: Er is sprake van een serieschakeling, dan geldt de formule: (R1+R2+R3)*I = Vquote:Op donderdag 28 januari 2010 11:38 schreef vault_tec het volgende:
36000/ 3600 = 10.
Mijn dank is groot
Nog 1 vraag.
3 door drie in serie geschakelde weerstanden loopt een stroom van 4 A. Ze zijn aangesloten op een spanning van 120 V. Wat is de weerstand van R3 als verder gegeven is: R1 = 8 Ohm en R2 = 12 Ohm.


ik had een tentamen over een stukje kansberekening en volgens mij heeft de docent een methode gebruikt die niet toepasbaar is op het vraagstuk.
bij dit vraagstuk veranderd de kans elke keer als er een knikker uit de bak gaat. De berekening maakt gebruik van een binomiale verdeling, volgens mag die alleen maar gebruikt worden als de kans gelijk blijft. Bijvoorbeeld de kans dat een bout een fout bevat bij de productie is 0,01, hoe groot is de kans dat als ik er 100 bekijk dat er 5 een fout bevatten.
voor ik naar de docent ga en roep dat die het verkeerd doet wilde ik graag eerst even de mening van jullie. ik hoop dat iemand van jullie me kan en wil helpen.
gr
Qwox
bij dit vraagstuk veranderd de kans elke keer als er een knikker uit de bak gaat. De berekening maakt gebruik van een binomiale verdeling, volgens mag die alleen maar gebruikt worden als de kans gelijk blijft. Bijvoorbeeld de kans dat een bout een fout bevat bij de productie is 0,01, hoe groot is de kans dat als ik er 100 bekijk dat er 5 een fout bevatten.
voor ik naar de docent ga en roep dat die het verkeerd doet wilde ik graag eerst even de mening van jullie. ik hoop dat iemand van jullie me kan en wil helpen.
gr
Qwox


En het is zeker ‘zonder terugleggen’?
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


de vraag kreeg ik precies zo als in het plaatje staat, ik leid daarvan af dat het idd zonder terugleggen is. Zou het gek vinden als het anders zou zijn.quote:


Tja, de uitwerking is alsof je terug legt. Als je dat niet doet, is het fout inderdaad, dan is het:quote:Op donderdag 28 januari 2010 23:32 schreef qwox het volgende:
[..]
de vraag kreeg ik precies zo als in het plaatje staat, ik leid daarvan af dat het idd zonder terugleggen is. Zou het gek vinden als het anders zou zijn.
Ik moet zeggen dat ik ook zou verwachten op die opgave alleen dat het zonder terugleggen is, en dat het dus fout is.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


bedankt voor de reactie en het bevestigen van mijn vermoede.
De methode die je gebruikt voor het antwoord, heeft die toevallig een naam. Heb geprobeerd zelf uit die opgave te komen, wat niet lukt aangezien het niet was behandeld in de stof zover ik weet. En snap ook waar cijfers uit je berekening vandaan komen, wil even kijken of ik er meer over kan vinden.
gr
qwox
De methode die je gebruikt voor het antwoord, heeft die toevallig een naam. Heb geprobeerd zelf uit die opgave te komen, wat niet lukt aangezien het niet was behandeld in de stof zover ik weet. En snap ook waar cijfers uit je berekening vandaan komen, wil even kijken of ik er meer over kan vinden.
gr
qwox


Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Kan iemand helpen met het volgende vraagstuk? (zie crappy pic voor tekening):
Het gaat over de afbuiging van een elektron in een elektrisch veld van twee horizontale evenwijdige platen. De veldsterkte is E = 12000 N.C-1.
Het elektron wordt eerst versneld door een potentiaalverschil van 2000 V, dus ik heb al gevonden dat de snelheid waarmee het het veld (in het midden en evenwijdig) binnendringt 26,5.106 m.s-1 zal zijn.
Immers: Ek + Ep = cte dus Ek = -q.V(r) = -(-1,6.10-19.2000) (lading elektron vermenigvuldigd met potentiaalverschil)
Ek = 0,5 mv2 dus v = 26,5.106 m.s-1
Dat wil dan ook zeggen dat de tijd dat het elektron tussen de platen zal verblijven gelijk is aan 7,54.10-10 s.
Om nu de verticale verplaatsing tussen de platen te berekenen dacht ik dat je de afstand tussen beide platen zou nodig hebben? De formules voor veldsterkte E die ik ken zijn E = FC/q' (coulombkracht per lading) en E = dV(r)/dr (potentiaal per afstand).
Als iemand mij hiervoorbij kan helpen ben ik blij . Denk dat de rest dan ook wel zal lukken.
. Denk dat de rest dan ook wel zal lukken.
Een andere formule die misschien bruikbaar is:
Thanks alvast!
Het gaat over de afbuiging van een elektron in een elektrisch veld van twee horizontale evenwijdige platen. De veldsterkte is E = 12000 N.C-1.
Het elektron wordt eerst versneld door een potentiaalverschil van 2000 V, dus ik heb al gevonden dat de snelheid waarmee het het veld (in het midden en evenwijdig) binnendringt 26,5.106 m.s-1 zal zijn.
Immers: Ek + Ep = cte dus Ek = -q.V(r) = -(-1,6.10-19.2000) (lading elektron vermenigvuldigd met potentiaalverschil)
Ek = 0,5 mv2 dus v = 26,5.106 m.s-1
Dat wil dan ook zeggen dat de tijd dat het elektron tussen de platen zal verblijven gelijk is aan 7,54.10-10 s.
Om nu de verticale verplaatsing tussen de platen te berekenen dacht ik dat je de afstand tussen beide platen zou nodig hebben? De formules voor veldsterkte E die ik ken zijn E = FC/q' (coulombkracht per lading) en E = dV(r)/dr (potentiaal per afstand).
Als iemand mij hiervoorbij kan helpen ben ik blij
Een andere formule die misschien bruikbaar is:
Thanks alvast!


De veldsterkte tussen de afbuigplaten is constant en je kent deze veldsterkte. Dan kun je dus ook de verticale kracht uitrekenen die op het elektron wordt uitgeoefend, en als je dan de massa van het elektron kent kun je dus ook de verticale versnelling uitrekenen. Je weet al hoe lang deze verticale versnelling werkzaam is, namelijk gedurende de tijd dat het elektron zich tussen de twee platen bevindt, en zo kun je dan de verticale verplaatsing berekenen, alsmede de hoek die het elektron maakt met de horizontaal op het moment dat het elektron de ruimte tussen de afbuigplaten verlaat. Vanaf dat moment beweegt het elektron zich in een rechte lijn, zodat je ook de verticale afstand waar het elektron het scherm treft kunt berekenen.quote:Op woensdag 3 februari 2010 00:11 schreef tony_clifton- het volgende:
Kan iemand helpen met het volgende vraagstuk? (zie crappy pic voor tekening):
Het gaat over de afbuiging van een elektron in een elektrisch veld van twee horizontale evenwijdige platen. De veldsterkte is E = 12000 N.C-1.
Het elektron wordt eerst versneld door een potentiaalverschil van 2000 V, dus ik heb al gevonden dat de snelheid waarmee het het veld (in het midden en evenwijdig) binnendringt 26,5.106 m.s-1 zal zijn.
Immers: Ek + Ep = cte dus Ek = -q.V(r) = -(-1,6.10-19.2000) (lading elektron vermenigvuldigd met potentiaalverschil)
Ek = 0,5 mv2 dus v = 26,5.106 m.s-1
Dat wil dan ook zeggen dat de tijd dat het elektron tussen de platen zal verblijven gelijk is aan 7,54.10-10 s.
Om nu de verticale verplaatsing tussen de platen te berekenen dacht ik dat je de afstand tussen beide platen zou nodig hebben? De formules voor veldsterkte E die ik ken zijn E = FC/q' (coulombkracht per lading) en E = dV(r)/dr (potentiaal per afstand).
[ afbeelding ]
Als iemand mij hiervoorbij kan helpen ben ik blij. Denk dat de rest dan ook wel zal lukken.
Een andere formule die misschien bruikbaar is:
[ afbeelding ]
Thanks alvast!


Thanks! Direct proberen!
Eigenlijk wel logisch maar na een tijd zie je enkel je eigen foute methode .
.
Eigenlijk wel logisch maar na een tijd zie je enkel je eigen foute methode


Ik weet wel iets van DV maar ik zou graag willen weten hoe een DV eruit ziet (globale beschrijving) voor het volgende systeem:
Er is een vat met water en dat heeft een leegloopkanaal. Bij een normaal systeem zou het leeglopen van het vat een 1e orde DV zijn, afhankelijk van de hoogte van het waterniveau. Echter het leegloopkanaal is geen statisch kanaal. Het kanaal opent zich redelijk langzaam en sluit dan weer ook redelijk langzaam. Omdat de opening in het begin nauwer is dan enkele seconde later, ligt de maximale leegloopsnelheid van het vat niet in het begin maar ergens anders.
Nu vroeg ik mij af of iemand een globale beschrijving kan geven van hoe het leeglopen van het vat eruit ziet in een DV.
Er is een vat met water en dat heeft een leegloopkanaal. Bij een normaal systeem zou het leeglopen van het vat een 1e orde DV zijn, afhankelijk van de hoogte van het waterniveau. Echter het leegloopkanaal is geen statisch kanaal. Het kanaal opent zich redelijk langzaam en sluit dan weer ook redelijk langzaam. Omdat de opening in het begin nauwer is dan enkele seconde later, ligt de maximale leegloopsnelheid van het vat niet in het begin maar ergens anders.
Nu vroeg ik mij af of iemand een globale beschrijving kan geven van hoe het leeglopen van het vat eruit ziet in een DV.


Je berekening van de hoek is verkeerd omdat je daarbij geen rekening houdt met de horizontale snelheid van het elektron. Je hoeft overigens helemaal niet met de tangens te werken. Bepaal de verhouding tussen de verticale en de horizontale snelheid op het moment dat het elektron de ruimte tussen de afbuigplaten verlaat. Deze verhouding geeft dan tevens de verhouding tussen de verdere verticale en horizontale verplaatsing van het elektron, omdat de snelheid van het elektron immers constant blijft zodra het de ruimte tussen de afbuigplaten heeft verlaten.quote:Op woensdag 3 februari 2010 15:21 schreef tony_clifton- het volgende:
Hmm... lukt nog niet... Kan iemand helpen troubleshooten?
Dit is mijn verdere uitwerking so far:
[ afbeelding ]
[ Bericht 0% gewijzigd door Riparius op 04-02-2010 06:36:36 ]


Je vraag is te weinig concreet om antwoord op te geven. In het eenvoudige geval dat je noemt zou je de uitstroomsnelheid op ieder tijdstip evenredig kunnen veronderstellen aan de hoeveelheid water die zich nog in het vat bevindt, en dat levert inderdaad een eenvoudige dv op. Maar je zult eerst moeten preciseren hoe de uitstroomsnelheid (het debiet) tevens afhangt van de opening en hoe je die opening als functie van de tijd kunt beschrijven.quote:Op woensdag 3 februari 2010 17:37 schreef Luciano23 het volgende:
Ik weet wel iets van DV maar ik zou graag willen weten hoe een DV eruit ziet (globale beschrijving) voor het volgende systeem:
Er is een vat met water en dat heeft een leegloopkanaal. Bij een normaal systeem zou het leeglopen van het vat een 1e orde DV zijn, afhankelijk van de hoogte van het waterniveau. Echter het leegloopkanaal is geen statisch kanaal. Het kanaal opent zich redelijk langzaam en sluit dan weer ook redelijk langzaam. Omdat de opening in het begin nauwer is dan enkele seconde later, ligt de maximale leegloopsnelheid van het vat niet in het begin maar ergens anders.
Nu vroeg ik mij af of iemand een globale beschrijving kan geven van hoe het leeglopen van het vat eruit ziet in een DV.
Ik heb een hele tijd geleden alweer eens een opgave opgelost die ging over zoutconcentraties in twee met elkaar in verbinding staande vaten waar zowel vers water in stroomde als zilt water uit wegstroomde. Niet helemaal jouw vraagstelling, maar wellicht dat je uit de uitwerking inspiratie op kunt doen over het opstellen van een dv voor jouw vraagstuk. Kijk maar even hier, en ook in de rest van dat topic voor mijn uitwerking.


Hoi bedankt voor je reactie. Ik kom er niet helemaal uit met de vraag die jij eerder oploste, vooral omdat mijn probleem juist die wisselende debiet is. Ik zal proberen het iets concreter te maken, maar de precieze getallen zijn niet van belang. De diameter van opening waardoor het vat leegstroom is d in cm en t in s:quote:Op woensdag 3 februari 2010 21:05 schreef Riparius het volgende:
[..]
Je vraag is te weinig concreet om antwoord op te geven. In het eenvoudige geval dat je noemt zou je de uitstroomsnelheid op ieder tijdstip evenredig kunnen veronderstellen aan de hoeveelheid water die zich nog in het vat bevindt, en dat levert inderdaad een eenvoudige dv op. Maar je zult eerst moeten preciseren hoe de uitstroomsnelheid (het debiet) tevens afhangt van de opening en hoe je die opening als functie van de tijd kunt beschrijven.
Ik heb een hele tijd geleden alweer eens een opgave opgelost die ging over zoutconcentraties in twee met elkaar in verbinding staande vaten waar zowel vers water in stroomde als zilt water uit wegstroomde. Niet helemaal jouw vraagstelling, maar wellicht dat je uit de uitwerking inspiratie op kunt doen over het opstellen van een dv voor jouw vraagstuk. Kijk maar even hier, en ook in de rest van dat topic voor mijn uitwerking.
d= 0 op t = 0
d=0,5 op t= 1
d=1 op t=2
d=1.5 op t =3
d= 2 op t = 4
d= 1.5 op t=5
d= 1 op t=6
d=0.5 op t=7
d=0 op t=8
op t=8 zit er nog steeds water in de tank. Als de diameter constant was kan je het leegstromen beschrijven met h'+c*h=0 dacht ik en is de oplossing h=k*e^(c*t). Echter nu met de wisselende uitstroomdiameter kan ik me voorstellen dat de uitstroom op bijvoorbeeld t=3 hoger is dan op t=1.


Uit je lijstje blijkt dat je de diameter van de uitstroomopening over het tijdsinterval [0,4] lineair met de tijd laat toenemen van d=0 tot d=4 en dat je daarna over het interval [4,8] de diameter van de uitstroomopening lineair met de tijd laat afnemen van d=4 tot d=0. Het is lastig om dit in één differentiaalvergelijking te krijgen omdat je hier d als functie van t niet in één elementaire (algebraïsche) functie kunt uitdrukken. Je zou dan twee differentiaalvergelijkingen kunnen opstellen, één voor het tijdsinterval [0,4] en één voor het tijdsinterval [4,8].quote:Op vrijdag 5 februari 2010 10:39 schreef Luciano23 het volgende:
[..]
Hoi bedankt voor je reactie. Ik kom er niet helemaal uit met de vraag die jij eerder oploste, vooral omdat mijn probleem juist die wisselende debiet is. Ik zal proberen het iets concreter te maken, maar de precieze getallen zijn niet van belang. De diameter van opening waardoor het vat leegstroomt is d in cm en t in s:
d= 0 op t = 0
d=0,5 op t= 1
d=1 op t=2
d=1.5 op t =3
d= 2 op t = 4
d= 1.5 op t=5
d= 1 op t=6
d=0.5 op t=7
d=0 op t=8
op t=8 zit er nog steeds water in de tank. Als de diameter constant was kan je het leegstromen beschrijven met h'+c*h=0 dacht ik en is de oplossing h=k*e^(-c*t). Echter nu met de wisselende uitstroomdiameter kan ik me voorstellen dat de uitstroom op bijvoorbeeld t=3 hoger is dan op t=1.
Aangenomen dat h de hoogte van het water in het reservoir voorstelt en aangenomen dat het debiet op ieder moment evenredig is met de hoogte van de waterstand kom je dan inderdaad tot:
(1) dh/dt = -c∙h
Maar als we nu tevens veronderstellen dat het debiet evenredig is met de oppervlakte van de uitstroomopening, dan wordt c in deze vergelijking dus afhankelijk van de tijd. En aangezien de oppervlakte van een ronde opening evenredig is met het kwadraat van de diameter die volgens jou weer lineair afhankelijk is van de tijd, krijg je voor het tijdsinterval [0,4] dus:
(2) c = k∙t2
En voor het tijdsinterval [4,8] geldt dan:
(3) c = k∙(8-t)2
Door nu (2) resp. (3) in (1) in te vullen verkrijg je dus twee differentiaalvergelijkingen, waarvan er één de waterstand op het tijdsinterval [0,4] beschrijft en de andere de waterstand op het tijdsinterval [4,8].


Voor mijn PWS wil ik kijken of het mogelijk is om zelf een batterij te bouwen (om deze te vergelijken met een standaard Daniëllcel)
Hiervoor wilde ik deze 'bouwtekening' gebruiken:
Alleen, hoe krijg ik die 'vochtige pasta' zoals in het plaatje beschreven wordt?
Hiervoor wilde ik deze 'bouwtekening' gebruiken:
Alleen, hoe krijg ik die 'vochtige pasta' zoals in het plaatje beschreven wordt?


Neem een citroen (ja echt, google er maar eens op). Of maak een batterij met een lege jampot met daarin een salmiakoplossing. Dat bruinsteen heb je niet nodig tenzij je persé een zogeheten droge batterij wil maken.quote:Op woensdag 10 februari 2010 16:53 schreef CaptainCookie het volgende:
Voor mijn PWS wil ik kijken of het mogelijk is om zelf een batterij te bouwen (om deze te vergelijken met een standaard Daniëllcel)
Hiervoor wilde ik deze 'bouwtekening' gebruiken:
[ afbeelding ]
Alleen, hoe krijg ik die 'vochtige pasta' zoals in het plaatje beschreven wordt?


Woeps, vergeten dat Daniëlcel 'tzelfde is als Zn + Cu  .
.
In dit boek kan je wel wat ideeën opdoen: http://books.google.be/books?id=LsBLFco09cUC&printsec=frontcover&dq=algemene+chemie&client=firefox-a&cd=2#v=onepage&q=&f=false
Maar die pasta is toch gewoon een verhouding (mij onbekend) van MnO2 en NH4Cl?
MnO2 kan je maken door middel van KMnO4 in zuur midden te brengen, voor ammoniumchloride heb je keukenzout en ammoniumhydroxide nodig (waterige variant van ammoniak)...
[ Bericht 38% gewijzigd door tony_clifton- op 10-02-2010 17:15:41 ]
In dit boek kan je wel wat ideeën opdoen: http://books.google.be/books?id=LsBLFco09cUC&printsec=frontcover&dq=algemene+chemie&client=firefox-a&cd=2#v=onepage&q=&f=false
Maar die pasta is toch gewoon een verhouding (mij onbekend) van MnO2 en NH4Cl?
MnO2 kan je maken door middel van KMnO4 in zuur midden te brengen, voor ammoniumchloride heb je keukenzout en ammoniumhydroxide nodig (waterige variant van ammoniak)...
[ Bericht 38% gewijzigd door tony_clifton- op 10-02-2010 17:15:41 ]


Het is de bedoeling om er een (klein) autootje op te laten rijden. Nou weet ik dat een citroen niet genoeg spanning levert (1 volt ongeveer, dacht ik) om een elektromotortje aan te drijven, maar kan zo'n salmiakoplossing dat wel?quote:Op woensdag 10 februari 2010 17:05 schreef Riparius het volgende:
[..]
Neem een citroen (ja echt, google er maar eens op). Of maak een batterij met een lege jampot met daarin een salmiakoplossing. Dat bruinsteen heb je niet nodig tenzij je persé een zogeheten droge batterij wil maken.
Het is wel weer eens wat anders, zo'n droge batterij..


Ja, als je een salmiakoplossing hebt en je hangt daarin een koolstaaf en een stuk zink dan krijg je precies dezelfde spanning (ca. 1,5 Volt) als van een klassieke batterij. En je kunt natuurlijk meerdere jampotten in serie zetten. Maar dat is niet handig om een autootje op te laten rijden.quote:Op woensdag 10 februari 2010 17:13 schreef CaptainCookie het volgende:
[..]
Het is de bedoeling om er een (klein) autootje op te laten rijden. Nou weet ik dat een citroen niet genoeg spanning levert (1 volt ongeveer, dacht ik) om een elektromotortje aan te drijven, maar kan zo'n salmiakoplossing dat wel?
Het is wel weer eens wat anders, zo'n droge batterij..


Ik snap de volgende opgave niet:
Stel de reactievergelijking op van de volgende vaste stoffen:
NaH2CO3(s) + NaHCO3(s) -> Na2HPO4 + ...
Ik heb de antwoorden:
Noteer de aanwezige deeltjes.
- natriumdiwaterstoffosfaat, NaH2PO4(s), en natriumwaterstofcarbonaat, NaHCO3
Wat is het zuur en wat is de base?
- H2PO4- in NaH2PO4 is het zuur, omdat het overgaat in monowaterstoffosfaat, HPO4-
- HCO3- in NaHCO3 is dan de base; er ontstaat dan CO2(g)
Waarom deze zuur en deze base?
Hoeveel H+ nemen het zuur en de base op?
- H2PO4- staat één H+ af, HCO3- neemt één H+ op.
Stel de reactievergelijking op.
- NaH2PO4(s) + NaHCO3(s) ---> Na2HPO4(s) + H2O(g) + CO2(g)
Het is een zuurbasereactie en ik snap niet waarom ik de base en het zuur moet nemen die in de antwoorden genoemd zijn.
Stel de reactievergelijking op van de volgende vaste stoffen:
NaH2CO3(s) + NaHCO3(s) -> Na2HPO4 + ...
Ik heb de antwoorden:
Noteer de aanwezige deeltjes.
- natriumdiwaterstoffosfaat, NaH2PO4(s), en natriumwaterstofcarbonaat, NaHCO3
Wat is het zuur en wat is de base?
- H2PO4- in NaH2PO4 is het zuur, omdat het overgaat in monowaterstoffosfaat, HPO4-
- HCO3- in NaHCO3 is dan de base; er ontstaat dan CO2(g)
Waarom deze zuur en deze base?
Hoeveel H+ nemen het zuur en de base op?
- H2PO4- staat één H+ af, HCO3- neemt één H+ op.
Stel de reactievergelijking op.
- NaH2PO4(s) + NaHCO3(s) ---> Na2HPO4(s) + H2O(g) + CO2(g)
Het is een zuurbasereactie en ik snap niet waarom ik de base en het zuur moet nemen die in de antwoorden genoemd zijn.
Finally, someone let me out of my cage


Allebei de deeltjes die genoemd zijn, dus het diwaterstoffosfaat en het waterstofcarbonaat kunnen zowel een H+ opnemen, als afstaan. Als je in je binas kijkt, in de zuur-base tabel, dan zoek je het sterkste zuur op en de sterkste base, die zullen namelijk met elkaar reageren.
je diwaterstoffosfaation is het sterkste zuur, waterstofcarbonaat moet dan wel je base zijn. Normaal zou je bij deze twee stoffen een evenwichtsreactie krijgen, maar waterstofcarbonaat reageert tot koolstofdioxide en water, en dat zorgt ervoor dat je reactie aflopend is..
je diwaterstoffosfaation is het sterkste zuur, waterstofcarbonaat moet dan wel je base zijn. Normaal zou je bij deze twee stoffen een evenwichtsreactie krijgen, maar waterstofcarbonaat reageert tot koolstofdioxide en water, en dat zorgt ervoor dat je reactie aflopend is..


Even een aanvulling hierop: in BINAS vind je een tabel met de zuur- en baseconstanten (bij mij tabel 49, maar misschien is dat veranderd). In de linkerkolom staan de zure verbindingen en in de rechter kolom de geconjugeerde basen, d.w.z. de basen die ontstaan als het zuur een proton (H+) heeft afgestaan. Hoe lager de pKa van het zuur, des te gemakkelijker geeft het zuur een H+ af. In dit geval is H2PO4- zuurder (pKa = 7,21) dan HCO3- (pKa = 10,25).quote:Op zondag 14 februari 2010 16:26 schreef Boadicea het volgende:
Allebei de deeltjes die genoemd zijn, dus het diwaterstoffosfaat en het waterstofcarbonaat kunnen zowel een H+ opnemen, als afstaan. Als je in je binas kijkt, in de zuur-base tabel, dan zoek je het sterkste zuur op en de sterkste base, die zullen namelijk met elkaar reageren.
je diwaterstoffosfaation is het sterkste zuur, waterstofcarbonaat moet dan wel je base zijn. Normaal zou je bij deze twee stoffen een evenwichtsreactie krijgen, maar waterstofcarbonaat reageert tot koolstofdioxide en water, en dat zorgt ervoor dat je reactie aflopend is..


Dankje, maar het gekke is deze tabel in dit hoofdstuk helemaal niet ter sprake komt, en het lijkt me dat je dat dus zonder hulp van deze tabel zou moeten doen...quote:Op zondag 14 februari 2010 16:38 schreef lyolyrc het volgende:
[..]
Even een aanvulling hierop: in BINAS vind je een tabel met de zuur- en baseconstanten (bij mij tabel 49, maar misschien is dat veranderd). In de linkerkolom staan de zure verbindingen en in de rechter kolom de geconjugeerde basen, d.w.z. de basen die ontstaan als het zuur een proton (H+) heeft afgestaan. Hoe lager de pKa van het zuur, des te gemakkelijker geeft het zuur een H+ af. In dit geval is H2PO4- zuurder (pKa = 7,21) dan HCO3- (pKa = 10,25).
Finally, someone let me out of my cage


Ok, zo uit jouw vraag te zien wordt een van de deeltjes die ontstaat al gegeven, namelijk monowaterstoffosfaat.
Daaruit kan je dus halen dat diwaterstoffosfaat een H[sup+[/sup] heeft afgestaan, en dus het zuur is.
De base is dan het waterstofcarbonaat, aangezien dat het enige deeltje is wat die H+ weer kan opnemen..
Daaruit kan je dus halen dat diwaterstoffosfaat een H[sup+[/sup] heeft afgestaan, en dus het zuur is.
De base is dan het waterstofcarbonaat, aangezien dat het enige deeltje is wat die H+ weer kan opnemen..


nice, bedanktquote:Op zondag 14 februari 2010 16:51 schreef Boadicea het volgende:
Ok, zo uit jouw vraag te zien wordt een van de deeltjes die ontstaat al gegeven, namelijk monowaterstoffosfaat.
Daaruit kan je dus halen dat diwaterstoffosfaat een H[sup+[/sup] heeft afgestaan, en dus het zuur is.
De base is dan het waterstofcarbonaat, aangezien dat het enige deeltje is wat die H+ weer kan opnemen..
Finally, someone let me out of my cage


Net in een verkeerd topic gepost. hier maar eens proberen :p
We weten inmiddels dat licht een dualistisch karakter vertoont, namelijk een deeltjes- en golfkarakter. Bij watergolven is het gewoon het water dat "trilt" en golven maakt. Wat trilt er eigenlijk bij licht?
We weten inmiddels dat licht een dualistisch karakter vertoont, namelijk een deeltjes- en golfkarakter. Bij watergolven is het gewoon het water dat "trilt" en golven maakt. Wat trilt er eigenlijk bij licht?
Moo


Licht heeft geen medium nodig. Op dit forum kan Haushofer je denk ik het beste uitleggen, maar ik weet niet of hij hier meeleest, anders kun je het kleine wetenschappelijke vragen topic in W&T proberen of er een topic openen.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


quote:Op dinsdag 16 februari 2010 19:59 schreef Zuivelkoe het volgende:
Net in een verkeerd topic gepost. hier maar eens proberen :p
We weten inmiddels dat licht een dualistisch karakter vertoont, namelijk een deeltjes- en golfkarakter. Bij watergolven is het gewoon het water dat "trilt" en golven maakt. Wat trilt er eigenlijk bij licht?
De snelheid van licht in het luchtledige is 3.108 m/s.
Deze snelheid kan men schrijven als lichtsnelheid (c) = golflengte (lambda) x frequentie (f).
Planck toonde aan dat de voortplanting van die straling continu is, dus een golfverschijnsel. En, de energie van de straling is evenredig met de frequentie: E = hf (met h een constante).
Uit de formule voor c kan je de formule voor de frequentie halen; f = c/golflengte, waardoor je de formule voor E als E = hc / golflengte kan schrijven.
Wat betreft het deeltjeskarakter -> Einstein!:
E = mc2, dus
mc2 = hc / golflengte (= karakteristiek voor de golflengte)
waaruit volgt dat
golflengte = h / mc (= karakteristiek voor een foton)
Dus, aan elk materiedeeltje in beweging kan een golfkarakter en een deeltjeskarakter toegekend worden, alhoewel er altijd één dominant is. Bij grote voorwerpen is dit het deeltjeskarakter (Newton-mechanica), bij kleine voorwerpen is dit het golfkarakter (kwantummechanica).
Beetje vaag, maar ms helpt het iets
[ Bericht 0% gewijzigd door tony_clifton- op 16-02-2010 21:00:30 ]


Ik moet morgen een practicum uitvoeren, voor de volledige beschrijf zie hier:
''Door een stijfseloplossing aan deze oplossing toe te voegen, kan ik een overmaat aan jodium aantonen. ''
Hoezo kan je het dan aantonen? Is het een reagens? En wat is uberhaupt een stijfseloplossing, welke heb ik nodig voor deze proef?
Ik snap het meeste, alleen het volgende niet:quote:Om tot een goed resultaat te komen, is ook een van tevoren opgezet werkplan van vitaal belang. Hierdoor voorkom je niet alleen uitvoeringsfouten, maar ook structurele fouten.
Bij deze praktische opdracht 'Wat is het zwavelgehalte in gedroogde abrikozen?' heb ik dus eerst informatie verzameld over wat er nou eigenlijk aan te tonen is, en zo ja, hoe?
In een gepubliceerd artikel uit de 'Allerhande' (magazine over voedsel, uitgegeven door Albert Heijn) stond de belangrijkste informatie over dit onderwerp. Volgens dit artikel bevatten de gedroogde abrikozen zwaveldioxide (E220). Een uitleg over waarom dit conserveermiddel is toegevoegd vertelt: 'Om te voorkomen dat gedroogde vruchten, zoals abrikozen, appels e.d., hun lichte kleur verliezen, worden ze met zwaveldioxide behandeld. Door deze zwavelbehandeling behouden ze niet alleen hun kleur, maar wordt ook schimmelvorming voorkomen.'.
Bij Albert Heijn heb ik dus een zakje met 200 gram gedroogde abrikozen gekocht. Bij de lijst met ingrediënten stond inderdaad abrikozen en conserveermiddel E220. Om dus de hoeveelheid zwaveldioxide te bepalen, is een redoxreactie mogelijk met bijvoorbeeld Jodium. Het volgende reactie zal dan plaatsvinden:
Reductor: SO2 + H2O >> SO4 (2-) + 4H+
Oxidator: I2 >> 2I- (Jodium)
Aan deze reactie is te zien dat de molverhoudingen 1:1 zijn. Omdat de zwaveldioxide in de abrikozen zit, moet ik dat er eerst uithalen. Een manier daarvoor is het laten weken in water. De meeste zwaveldioxide is dan hopelijk uit de abrikozen getrokken. De oplossing van zwaveldioxide en water kan ik dan testen op de hoeveelheid zwaveldioxide.
Door een stijfseloplossing aan deze oplossing toe te voegen, kan ik een overmaat aan jodium aantonen. Als ik namelijk jodium aan de oplossing toevoeg, zal op een gegeven moment alle zwaveldioxide zijn gereageerd. Op dat moment gaat de jodium met de stijfseloplossing reageren waardoor een blauw/paarse kleur zal ontstaan. Doordat de molverhouding tussen jodium en zwaveldioxide 1:1 is, is te bepalen aan de hoeveelheid toegevoegde jodium, hoeveel mol zwaveldioxide er is.
De molariteit van de jodium is daarbij van belang. Volgens de pot met jodium, is de molariteit ongeveer 0,05 mol per liter. Omdat deze molariteit niet nauwkeurig is aangegeven, heb ik eerst precies de molariteit van jodium door middel van een titratie met Natriumthiosulfaat gemeten. De molariteit van natriumthiosulfaat was namelijk al zeer nauwkeurig gevonden door een andere groep die dat voor hun praktische opdracht deden.
De oplossing met zwaveldioxide kan dan vervolgens getitreerd worden met de jodium. Daarmee is de hoeveelheid zwaveldioxide in de abrikozen te testen.
Verwachte benodigdheden:
- +/- 100 gram gedroogde abrikozen - maatcilinder (250 ml, 100ml)
- 200 ml gedestilleerd water - jampot met deksel
- jodium-oplossing
- natriumthiosulfaat-oplossing
- stijfseloplossing
- buret
- pipet (25 ml, 10 ml)
- bekerglazen
Uitvoering van de proef
Om de proef uit te voeren, moest ik eerst naar de plaatselijke Albert Heijn in Laren. Daar heb ik een zakje met de gedroogde (gewelde) abrikozen gekocht. De inhoud van dit zakje woog 200 gram. Vervolgens heb ik een jampot gepakt en hierin een aantal abrikozen gestopt (103,955 gram). Vervolgens heb ik 200 ml gedestilleerd water toegevoegd. Dit heb ik een nacht laten staan om de zwaveldioxide in het water te laten trekken.
Diezelfde middag heb ik door middel van een titratie de molariteit van de jodium bepaalt. De molariteit van de gebruikte natriumthiosulfaat is 0,0924. De molverhouding tussen de jodium en de natriumthiosulfaat is 1:2.
Bij de titratie van 25 ml natriumthiosulfaat had ik 24,6 ml (gemiddelde na 2 keer de proef te doen) jodium nodig.
Natriumthiosulfaat jood
2 : 1
25 ml 24,5 ml (2 * 24,5 = 49)
49 25
0,0924 0,04714
Hieruit blijkt dus dat de molariteit van de jodiumoplossing 0,04714 is. Dat is iets minder dan de aangegeven 0,05 op de fles. Dit is toch een afwijking van zo'n 6 procent!
De dag erna ben ik bezig geweest met de rest van de proef. Eerst heb ik de oplossing uit het jampotje gehaald. Hierbij kon ik 115 ml uit het potje krijgen. De rest is door de abrikozen geabsorbeerd. Hierbij ga ik er van uit dat ik ook 115/200 deel van de totale zwaveldioxide in mijn oplossing heb. Vervolgens heb ik deze oplossing aangevuld tot 250 ml. Door tweemaal (duplo uitgevoerd) 50 ml in een erlenmeyer te gieten, heb je nog maar 23/200 deel van de oorspronkelijke hoeveelheid zwaveldioxide in de erlenmeyer zitten. Bij beide oplossingen heb ik vervolgens een aantal ml stijfseloplossing toegevoegd om een overmaat aan jodium aan te tonen.
Vervolgens heb ik op beide erlenmeyers een titratie uitgevoerd. Eerst wist ik niet hoeveel jodium ik nodig zou hebben. Bij de eerste keer voegde ik jodium met een molariteit van 0,05 toe. Bij deze oplossing bleek ik al bij 2,7 ml een kleuruitslag te ontstaan (wat betekent dat de jodium al in overmaat aanwezig is. Om toch een nauwkeurigere meting te krijgen, heb ik de jodium 10 keer verdund. Zo ontstond een oplossing van jodium met een molariteit van 0,005. Bij de twee oplossingen van zwaveldioxide, had ik deze keer 25,6 en 25,7 ml jodium-oplossing nodig om een blauw/paarse kleur waar te nemen. Nu had ik alle informatie om uit te rekenen hoeveel zwaveldioxide zich in de abrikozen bevindt.
0,004714 * 0,0257 = 1,212 * 10 mol jood >>> dus ook 1,212 * 10 mol zwaveldioxide.
1,212 * 10 * (200/23) = 0,001054 mol zwaveldioxide in 103,955 gram abrikozen.
103,955 100
0,001054 0,001014
Dus zit er in 100 gram abrikozen 0,001014 mol zwaveldioxide. Een mol zwaveldioxide weegt 64,0628 gram (1 * 32,064 + 2 * 15,9994)
0,001014 * 64,0628 = 64,96 mg zwaveldioxide per 100 gram gedroogde abrikozen.
Conclusie
Het zwaveldioxide gehalte in 100 gram abrikozen is 64,96 mg per 100 gram gedroogde abrikozen. Deze waarde is uiterst nauwkeurig verkregen. Bij de titraties is steeds zeer zorgvuldig te werk gegaan. Daarbij werd bijvoorbeeld al het glaswerk eerst grondig gereinigd en vervolgens ook nog nagespoeld met gedestilleerd water. Ook de hoeveelheden zijn zeer nauwkeurig bepaald door middel van pipet en maatkolf. Zo werd er voor gezorgd dat er een zo klein mogelijke onnauwkeurigheid was.
Ondanks al deze maatregelen om de proef zeer nauwkeurig te laten verlopen, is het toch mogelijk dat mijn gevonden antwoord toch niet overeenkomt met de werkelijke hoeveelheid zwaveldioxide. Dat komt waarschijnlijk omdat niet alle zwaveldioxide uit de abrikozen is getrokken. Daardoor zou een antwoord erg kunnen verschillen bij een tweede meting. Desondanks ben ik toch zeer tevreden met mijn gevonden antwoord.
''Door een stijfseloplossing aan deze oplossing toe te voegen, kan ik een overmaat aan jodium aantonen. ''
Hoezo kan je het dan aantonen? Is het een reagens? En wat is uberhaupt een stijfseloplossing, welke heb ik nodig voor deze proef?


Stijfsel is zetmeel, wat weer bestaat uit lange suikerketens. Jodium is een reagens voor zetmeel en andersom. Zetmeel en jodium vormen samen een complex dat bepaalde golflengtes van licht absorbeert. De golflengtes die weerkaatst worden (blauw licht) leidt tot de blauwige kleur die je ziet.quote:Op dinsdag 16 februari 2010 21:14 schreef RacerDKB het volgende:
Ik moet morgen een practicum uitvoeren, voor de volledige beschrijf zie hier:
[..]
Ik snap het meeste, alleen het volgende niet:
''Door een stijfseloplossing aan deze oplossing toe te voegen, kan ik een overmaat aan jodium aantonen. ''
Hoezo kan je het dan aantonen? Is het een reagens? En wat is uberhaupt een stijfseloplossing, welke heb ik nodig voor deze proef?


Dus ik heb een zetmeeloplossing nodig om bij de jodium te gooien, om aan te tonen dat er een overmaat jodium is? Moet ik dit ook echt gaan uitvoeren of kan ik simpelweg verwijzen naar BINAS o.i.d.?quote:Op dinsdag 16 februari 2010 21:24 schreef lyolyrc het volgende:
[..]
Stijfsel is zetmeel, wat weer bestaat uit lange suikerketens. Jodium is een reagens voor zetmeel en andersom. Zetmeel en jodium vormen samen een complex dat bepaalde golflengtes van licht absorbeert. De golflengtes die weerkaatst worden (blauw licht) leidt tot de blauwige kleur die je ziet.
Met andere woorden, is het specifiek voor deze proef nodig of..


Ik heb de tekst niet echt (half) gelezen, maar je voegt jodium toe vanuit de buret bij je titratie, right? Het eindpunt dat je zoekt is het moment waarop er geen stof in de erlenmeyer over is om te reageren met de I2.I-. De minste druppel jood extra zal een overmaat geven, waardoor met zetmeel als indicator direct een héél licht blauwe kleur krijgt. Als je de kraan goed openzet natuurlijk krijg je een donkerblauwe kleur van het complex  .
.
Jood en zetmeel zijn een vaakgebruikte combi bij titraties omdat ze stabiele complexen met een uitgesproken kleur vormen en zetmeel de titratiereactie niet beïnvloedt...
Jood en zetmeel zijn een vaakgebruikte combi bij titraties omdat ze stabiele complexen met een uitgesproken kleur vormen en zetmeel de titratiereactie niet beïnvloedt...


Dit dus!quote:Op dinsdag 16 februari 2010 21:37 schreef tony_clifton- het volgende:
Ik heb de tekst niet echt (half) gelezen, maar je voegt jodium toe vanuit de buret bij je titratie, right? Het eindpunt dat je zoekt is het moment waarop er geen stof in de erlenmeyer over is om te reageren met de I2.I-. De minste druppel jood extra zal een overmaat geven, waardoor met zetmeel als indicator direct een héél licht blauwe kleur krijgt. Als je de kraan goed openzet natuurlijk krijg je een donkerblauwe kleur van het complex.
Jood en zetmeel zijn een vaakgebruikte combi bij titraties omdat ze stabiele complexen met een uitgesproken kleur vormen en zetmeel de titratiereactie niet beïnvloedt...
Een verwijzing naar BINAS toont niets aan in de praktijk. Dat is alleen theorie die vertelt wat er in de praktijk mogelijk is.quote:Op dinsdag 16 februari 2010 21:26 schreef RacerDKB het volgende:
Dus ik heb een zetmeeloplossing nodig om bij de jodium te gooien, om aan te tonen dat er een overmaat jodium is? Moet ik dit ook echt gaan uitvoeren of kan ik simpelweg verwijzen naar BINAS o.i.d.?
Met andere woorden, is het specifiek voor deze proef nodig of..


Een tabellenboek dat veel gebruikt wordt bij biologie, natuurkunde en scheikunde op de middelbare school.quote:Op dinsdag 16 februari 2010 22:03 schreef tony_clifton- het volgende:
Wat is BINAS btw?
Ken de Merck Index, CRC Bible, etc. maar van BINAS nog nooit gehoord...


Binas is een tabellenboek voor natuurkunde/scheikunde/biologie en een beetje wiskunde.
Het wordt op middelbare scholen in de bovenbouw wel veel gebruikt voor bovenstaande vakken.
Het wordt op middelbare scholen in de bovenbouw wel veel gebruikt voor bovenstaande vakken.


Ik kan me toch niet herinneren dat ik het gebruikte voor wiskunde. Maar misschien dat op dat gebied de eisen nog omlaag zijn gegaan, zodat het daar nu ook is toegestaan?quote:Op dinsdag 16 februari 2010 22:19 schreef Boadicea het volgende:
Binas is een tabellenboek voor natuurkunde/scheikunde/biologie en een beetje wiskunde.
Het wordt op middelbare scholen in de bovenbouw wel veel gebruikt voor bovenstaande vakken.


Er stond een bruin stukje bij met een paar formules, goniometrische identiteiten enzo. Maar wij kregen daarvoor een apart formuleblad zodat we binas niet meer nodig hadden.quote:Op dinsdag 16 februari 2010 22:22 schreef lyolyrc het volgende:
[..]
Ik kan me toch niet herinneren dat ik het gebruikte voor wiskunde. Maar misschien dat op dat gebied de eisen nog omlaag zijn gegaan, zodat het daar nu ook is toegestaan?


Nederlandse middelbare scholen wel te verstaan waarschijnlijk. 
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


BINAS in kleur.quote:Op dinsdag 16 februari 2010 22:23 schreef BasementDweller het volgende:
Er stond een bruin stukje bij met een paar formules, goniometrische identiteiten enzo. Maar wij kregen daarvoor een apart formuleblad zodat we binas niet meer nodig hadden.


The good ol' timesquote:Op dinsdag 16 februari 2010 22:28 schreef lyolyrc het volgende:
[..]
BINAS in kleur.Ik ben nog uit de tijd van de zwart-witpagina's. Alleen het spectrum dat je krijgt als je wit licht door een prisma leidt en emissiespectra van enkele stoffen zijn bij mij in kleur.


Deze vraag is voor mij niet echt duidelijk.... het is logisch dat je een ijklijn moet maken maar ik heb te weinig onderliggende kennis om deze opdracht te kunnen maken.
Zou iemand me een eindje op weg kunnen helpen ?
Zou iemand me een eindje op weg kunnen helpen ?


Eigenlijk "niets".quote:Op dinsdag 16 februari 2010 19:59 schreef Zuivelkoe het volgende:
Net in een verkeerd topic gepost. hier maar eens proberen :p
We weten inmiddels dat licht een dualistisch karakter vertoont, namelijk een deeltjes- en golfkarakter. Bij watergolven is het gewoon het water dat "trilt" en golven maakt. Wat trilt er eigenlijk bij licht?
Pas als je de Maxwell vergelijkingen hebt gehad, zul je helemaal begrijpen hoe het zit. Maar in een paar regels, om je een idee te geven:
Licht plant zich op een geniale manier voort: het is namelijk een opeenvolging van een elektrisch veld, dat een magnetisch veld creeert, dat op zichzelf weer voor een elektrisch veld zorgt en ga zo maar verder. En dat gebeurt allemaal zonder dat er ook maar het kleinste beetje energie verloren gaat.
Dat er niets trilt, blijkt ook wel uit het feit dat licht zich zonder problemen in een vacuum kan verplaatsen.
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson


http://en.wikipedia.org/wiki/Isotopes_of_poloniumquote:Op donderdag 18 februari 2010 11:18 schreef Pas259 het volgende:
Even een kleine vraag:
Wat is de halfwaardetijd van Po-216?
Zie tabel


Absorbtiespectrometriequote:Op donderdag 18 februari 2010 10:58 schreef horned_reaper het volgende:
Deze vraag is voor mij niet echt duidelijk.... het is logisch dat je een ijklijn moet maken maar ik heb te weinig onderliggende kennis om deze opdracht te kunnen maken.
Zou iemand me een eindje op weg kunnen helpen ?
[ afbeelding ]
Is dat in excel of op papier?
Anyway, wetten van Lambert/Beer = lineair verband tussen absorbtie en concentratie.
Je maakt een scatterplot van de metingen, en tekent de trendlijn (lineair dus). Via voorspellen kan je evt. regressieanalyse toepassen.
Indien je de waarden wil berekenen kan je dat via de functievergelijking van de trendlijn, of via de functies =snijpunt en =richting (=slope en =intersect ofzo?). De functies zijn wel nauwkeuriger. Stel dat excel als snijpunt 0,0009 geeft in de vergelijking, dan zit je er meer dan 40% af indien de werkelijke waarde via de functie 0,00094 is!
Vervolgens kan je je concentratie zoeken via deze parameters.
Heb zo'n hele reeks excelletjes voor zo'n labo's
Is er eentje om een equivalentiepunt van een titratie te bepalen bv.:
[ Bericht 11% gewijzigd door tony_clifton- op 18-02-2010 11:52:08 ]


Heel erg bedankt voor je antwoord !quote:Op donderdag 18 februari 2010 11:31 schreef tony_clifton- het volgende:
[..]
Absorbtiespectrometrie
Is dat in excel of op papier?
Anyway, wetten van Lambert/Beer = lineair verband tussen absorbtie en concentratie.
Je maakt een scatterplot van de metingen, en tekent de trendlijn (lineair dus). Via voorspellen kan je evt. regressieanalyse toepassen.
Indien je de waarden wil berekenen kan je dat via de functievergelijking van de trendlijn, of via de functies =snijpunt en =richting (=slope en =intersect ofzo?). De functies zijn wel nauwkeuriger. Stel dat excel als snijpunt 0,0009 geeft in de vergelijking, dan zit je er meer dan 40% af indien de werkelijke waarde via de functie 0,00094 is!
Vervolgens kan je je concentratie zoeken via deze parameters.
Heb zo'n hele reeks excelletjes voor zo'n labo's(was een goeie leekracht).
Is er eentje om een equivalentiepunt van een titratie te bepalen bv.:
[ afbeelding ]
Alleen moeten wij dit soort opgaven helaas op papier maken, dus de excel codes zijn dan niet echt van toepassing!
Maar wel fijn dat je hier even wat tijd in wou stoppen !


Snap niet goed waarom je dat op papier moet doen, want de methode kan niet erg anders zijn...
Je hebt daar een trendlijn voor nodig die je berekent via de methode van de kleinste kwadraten, maar da's niet echt simpel om manueel te doen...
Of op 't zicht, maar da's niet echt wetenschappelijk natuurlijk...
Je hebt daar een trendlijn voor nodig die je berekent via de methode van de kleinste kwadraten, maar da's niet echt simpel om manueel te doen...
Of op 't zicht, maar da's niet echt wetenschappelijk natuurlijk...


Scheikundig vraagje:
Weet iemand per ongeluk of ijzer(II)oxalaat (Fe2C2O4 * 2H2O) onder "kameromstandigheden" in zuiverheid kan afnemen? Als in, dat er CO2 vrijkomt en er ijzer ontstaat (zoals gebeurd wanneer het wordt verwarmt).
Het heeft gewoon in een potje gestaan op de kast.
Weet iemand per ongeluk of ijzer(II)oxalaat (Fe2C2O4 * 2H2O) onder "kameromstandigheden" in zuiverheid kan afnemen? Als in, dat er CO2 vrijkomt en er ijzer ontstaat (zoals gebeurd wanneer het wordt verwarmt).
Het heeft gewoon in een potje gestaan op de kast.
"Everything we are, we are when we're alone."


Nattevingerwerk: de C-C binding in oxaalzuur breekt bij 60°, dus op 't eerste zicht denk ik 't niet. Hydraten zijn meestal hygroscopisch, dus foute resultaten kunnen aan het kristalwater liggen?


Nadat het een paar weken in een potje in de woonkamer heeft gestaan moesten we opnieuw de zuiverheid meten - dit keer spectrofotometrisch.
Ik kom nu op een zuiverheid van 120%. (Vorige keer 98%)
(Vorige keer 98%)
Mijn berekeningen kloppen volgens mij gewoon, maar de fout kan aan vanalles liggen..
Ik kom nu op een zuiverheid van 120%.
Mijn berekeningen kloppen volgens mij gewoon, maar de fout kan aan vanalles liggen..
"Everything we are, we are when we're alone."


Heeft iemand weet van een toepassing van Ne@C60, of is dit een louter theoretisch molecule? Het is een Ne-atoom 'gevangen' in een buckyball (fullereen).
Wikipedia is wel interessant... Nooit gehoord van edelgasverbindingen, maar blijkbaar bestaan ze toch...
Wikipedia is wel interessant... Nooit gehoord van edelgasverbindingen, maar blijkbaar bestaan ze toch...


och, dr bestaan wel meer edelgasverbindingen hoor. Hoe lager je gaat in het rechterrijtje van de tabel van Mendelejev, hoe lager de 1ste ionisatiespanning van het atoom komt te liggen. Krypton en Xenon zijn electropositief genoeg om directe verbindingen met zuurstof en fluor aan te gaan.
een toepassing van Ne@C60 zou ik niet zo 1,2,3 kunnen noemen.
een toepassing van Ne@C60 zou ik niet zo 1,2,3 kunnen noemen.


Beste brontosaurussen der Wiskunde. Ik wou graag de top van een sinusperiode zijn voor julie door deze heerlijke vraag die ik ga stellen.
Mijn vraag gaat over, het voor jullie bekende, Matlab. We zijn net begonnen en de introductie opdracht is met een beetje bloed zweet en tranen goed en snel verlopen. We werken in groepjes van 2 en mijn groepje is een voorloper (met als nadeel dat we alle antwoorden voor "moeten" kauwen aan collegé).
Onze eerste echte opdracht is al een tandje moeilijker, maar toch zijn we vrijwel uit bijna alle vragen gekomen. Toch zijn er nog een paar onbeantwoorde vragen, waarmee ik hoopte dat één van jullie ons op weg zouden kunnen helpen.
We weten niet zeker of we een goed antwoord hebben, maar hier gaat ie:
4. We intend to make a plot of Xn as a function of n for a given x0. Write a Matlab program wich determines xn, n=1,...,50 for a given x0 and a given a.
Hiervoor hebben wij geschreven:
a=0.5
for n=1:50
x0=1
x(1)=x0*a
x(n+1)=x(n)*a
end
nu weet ik niet of dit antwoord goed is, maar de volgende vraag is ons echt een vraagteken
5. Suppose one is only interested in x50. Write a Matlab program that calculates x50 given x0 and a. This program must use less memory space than the program created in question 4. In question 4 you probably have used a vector of length 51 (klopt), among others saving up intermediate results ( ik neem aan dat hij hiermee de lengte van de verwerking in het command menu bedoelt, dat klopt die is erg lang ). This time usage of a vector of length 51 is not allowed for and intermediate results are overwritten (NB: do not attempt to solve the recursive equation!)
Nu hebben wij zelf al wat geprobeerd door bijvoorbeeld heel vals dit te doen:
a=0.5
for n=50
x0=1
x(1)=x0*a
x(n+1)=x(n)*a
end
Maar dit zal wel niet de bedoeling zijn? Iemand die ons uit de brand helpt?
Bij voorbaat dank,
Burak
Mijn vraag gaat over, het voor jullie bekende, Matlab. We zijn net begonnen en de introductie opdracht is met een beetje bloed zweet en tranen goed en snel verlopen. We werken in groepjes van 2 en mijn groepje is een voorloper (met als nadeel dat we alle antwoorden voor "moeten" kauwen aan collegé).
Onze eerste echte opdracht is al een tandje moeilijker, maar toch zijn we vrijwel uit bijna alle vragen gekomen. Toch zijn er nog een paar onbeantwoorde vragen, waarmee ik hoopte dat één van jullie ons op weg zouden kunnen helpen.
We weten niet zeker of we een goed antwoord hebben, maar hier gaat ie:
4. We intend to make a plot of Xn as a function of n for a given x0. Write a Matlab program wich determines xn, n=1,...,50 for a given x0 and a given a.
Hiervoor hebben wij geschreven:
a=0.5
for n=1:50
x0=1
x(1)=x0*a
x(n+1)=x(n)*a
end
nu weet ik niet of dit antwoord goed is, maar de volgende vraag is ons echt een vraagteken
5. Suppose one is only interested in x50. Write a Matlab program that calculates x50 given x0 and a. This program must use less memory space than the program created in question 4. In question 4 you probably have used a vector of length 51 (klopt), among others saving up intermediate results ( ik neem aan dat hij hiermee de lengte van de verwerking in het command menu bedoelt, dat klopt die is erg lang ). This time usage of a vector of length 51 is not allowed for and intermediate results are overwritten (NB: do not attempt to solve the recursive equation!)
Nu hebben wij zelf al wat geprobeerd door bijvoorbeeld heel vals dit te doen:
a=0.5
for n=50
x0=1
x(1)=x0*a
x(n+1)=x(n)*a
end
Maar dit zal wel niet de bedoeling zijn? Iemand die ons uit de brand helpt?
Bij voorbaat dank,
Burak
In fact, recent observations and simulations have suggested that a network of cosmic strings stretches across the entire universe.


Bij die tweede verloopt je berekening niet goed natuurlijk, je kunt x51 niet uitrekenen als x50 niet bekend is. Wat hij wil is dat je alleen maar het laatste antwoord bewaart: immers, nadat je x1 hebt uitgerekend, heb je x0 niet nodig om x2 uit te rekenen, en heb je x2, dan kun je x1 weggooien.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Dat is toch weg te halen door een --> ; <--- ????
Ik kan even geen command vinden waar ik dit kan doen.. hmm..
Zeer slechte begeleiding op school ook.
Ik kan even geen command vinden waar ik dit kan doen.. hmm..
Zeer slechte begeleiding op school ook.
In fact, recent observations and simulations have suggested that a network of cosmic strings stretches across the entire universe.


Je hebt dus dit programma (merk op dat x0 = 1 en x(1) = x(0) uit de for-loop kunnen worden gehaald en je maar tot 49 hoeft):
Je het dus de vector x, en die begint zo:
Na 1 iteratie heb je:
Na 2:
Na 3:
En zo voort.
Die onderste rij zijn je intermediate results. Maar uiteindelijk ben je alleen in x(50) geïnteresseerd, wat x(0) t/m x(49) precies, is niet boeiend. En je ziet dat je ook alleen telkens de vorige waarde nodig hebt om de nieuwe uit te rekenen, als je x43 weet kun je in principe x44 uitrekenen, ook al weet je x0 t/m x42 niet. Daar kun je gebruik van maken.
Wat je dan dus wilt is dit (pseudo code):
Als je dan kijkt dan zie je dat je dus maar 1 (of 2, inclusief a) variabele hebt, namelijk ‘antwoord’, die zo verloopt:
Dat is het idee dat je moet implementeren.
| 1 2 3 4 5 | x(0)=1 for n=0:49 x(n+1)=x(n)*a end |
Je het dus de vector x, en die begint zo:
| 1 2 | 1 ? ? ? ? ? ? ? ? ? ? .. ? |
Na 1 iteratie heb je:
| 1 2 | 1 .5 ? ? ? ? ? ? ? ? ? .. ? |
Na 2:
| 1 2 | 1 .5 .25 ? ? ? ? ? ? ? ? .. ? |
Na 3:
| 1 2 | 1 .5 .25 .125 ? ? ? ? ? ? ? .. ? |
En zo voort.
Die onderste rij zijn je intermediate results. Maar uiteindelijk ben je alleen in x(50) geïnteresseerd, wat x(0) t/m x(49) precies, is niet boeiend. En je ziet dat je ook alleen telkens de vorige waarde nodig hebt om de nieuwe uit te rekenen, als je x43 weet kun je in principe x44 uitrekenen, ook al weet je x0 t/m x42 niet. Daar kun je gebruik van maken.
Wat je dan dus wilt is dit (pseudo code):
| 1 2 3 4 5 6 | antwoord = 1 doe 50 keer: antwoord = antwoord * a eind print antwoord |
Als je dan kijkt dan zie je dat je dus maar 1 (of 2, inclusief a) variabele hebt, namelijk ‘antwoord’, die zo verloopt:
| 1 2 3 4 5 6 | 1 iteratie : antwoord = .5 2 iteraties: antwoord = .25 3 iteraties: antwoord = .125 ... 50 iteraties, klaar |
Dat is het idee dat je moet implementeren.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Ehm, één opmerking. Als ik x(0)= 1 invoer geeft het programma een error aan. Het geeft aan dat wat tussen de haakjes staat een positieve of integere ofzo getal moet zijn. ... Ik heb daarom zoals je misschien heb opgemerkt niet x(0) getikt, maar x0=1 . En dit trouwens in de For-loop.
Tevens had ik ook door dat x(1) er niet in hoefde, maar dat werd nogal stug volgehouden door mede-collega , maar goed.
Tevens had ik ook door dat x(1) er niet in hoefde, maar dat werd nogal stug volgehouden door mede-collega , maar goed.
In fact, recent observations and simulations have suggested that a network of cosmic strings stretches across the entire universe.


Oh ja, Matlab vectoren beginnen op 1, nou ja, maakt ook niet zoveel uit. Die x0 kan in ieder geval ook buiten de forloop, die hoeft niet telkens uitgevoerd te worden. Als je het programma snapt kun je ook beredeneren waarom die x0 niet telkens opnieuw gedaan hoeft te worden.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Oke dus kortgezegd. Ik wil een n=49:50, maar ik moet er voor zorgen dat het programma de n=49 niet laat zien. hmm....
In fact, recent observations and simulations have suggested that a network of cosmic strings stretches across the entire universe.


Ja klopt die slaat hij toch "op" in het venstertje rechtsboven van command. Even vergeten hoe het heetquote:Op zaterdag 20 februari 2010 13:07 schreef Iblis het volgende:
Oh ja, Matlab vectoren beginnen op 1, nou ja, maakt ook niet zoveel uit. Die x0 kan in ieder geval ook buiten de forloop, die hoeft niet telkens uitgevoerd te worden. Als je het programma snapt kun je ook beredeneren waarom die x0 niet telkens opnieuw gedaan hoeft te worden.
In fact, recent observations and simulations have suggested that a network of cosmic strings stretches across the entire universe.


Zou je 'power()' niet mogen gebruiken?
Edit: niet, lijkt me.
[ Bericht 30% gewijzigd door MichielPH op 21-02-2010 20:52:54 ]
Edit: niet, lijkt me.
[ Bericht 30% gewijzigd door MichielPH op 21-02-2010 20:52:54 ]
'To alcohol, the cause of and the solution to all of life's problems' - Homer J. Simpson


Nee, het gaat alleen om het geheugengebruik, niet om het cpu-gebruik. Dus je kunt het wel 50x uitvoeren, maar je moet niet 50 resultaten opslaan.quote:Op zaterdag 20 februari 2010 13:09 schreef Burakius het volgende:
Oke dus kortgezegd. Ik wil een n=49:50, maar ik moet er voor zorgen dat het programma de n=49 niet laat zien. hmm....
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Oke brontosaurussen.
1. Write a Matlab program that estimates p using the fixed point iteration with g(x)=x - f(x). The resulting program is called program I.
Voor deze vraag heeft men het over een vaste punt probleem. Er wordt een korte intro gegeven op de Newton-Raphson methode.
Met f(x) = x + ex , has a zero at p for some p in the interval [-2,0]. You are asked to give an estimate p* of p with a tolerance tol, i.e. etc. etc.
1. Write a Matlab program that estimates p using the fixed point iteration with g(x)=x - f(x). The resulting program is called program I.
Voor deze vraag heeft men het over een vaste punt probleem. Er wordt een korte intro gegeven op de Newton-Raphson methode.
Met f(x) = x + ex , has a zero at p for some p in the interval [-2,0]. You are asked to give an estimate p* of p with a tolerance tol, i.e. etc. etc.
In fact, recent observations and simulations have suggested that a network of cosmic strings stretches across the entire universe.


Een vaste punt probleem is een probleem waarbij je een waarde telkens verfijnt. Dus stel je wilt wortel 3 uitrekenen, dan convergeert dit programma van 3 → 1.5 → 1.75 → 1.70 → 1.725 → 1.735 → 1.732 → 1.7325 en dan kap je b.v. omdat de laatste verandering kleiner dan 0.001 is en dat je ‘tol’ is.
Je moet dus een soort lus bouwen die de waarde verfijnt totdat je de juist hebt. Het kan instructief zijn om met de hand een paar slagen van een Newton-Rapson met de hand uit te werken of op Wikipedia te lezen: Newton's method
Je moet dus een soort lus bouwen die de waarde verfijnt totdat je de juist hebt. Het kan instructief zijn om met de hand een paar slagen van een Newton-Rapson met de hand uit te werken of op Wikipedia te lezen: Newton's method
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Dat vorige is ons trouwens nog steeds niet gelukt. Kun je ons misschien een handje in de juiste richting helpen door toch een stukje van die code te tikken>?
In fact, recent observations and simulations have suggested that a network of cosmic strings stretches across the entire universe.


Wat is jouw code nu? En wat gaat er niet goed met het omzetten van de pseudo-code die ik gaf?quote:Op donderdag 25 februari 2010 15:31 schreef Burakius het volgende:
Dat vorige is ons trouwens nog steeds niet gelukt. Kun je ons misschien een handje in de juiste richting helpen door toch een stukje van die code te tikken>?
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


We hebben niet eens een begin van een code. Het omzetten etc. lukt ons al niet.
In fact, recent observations and simulations have suggested that a network of cosmic strings stretches across the entire universe.


Dan kan ik het wel voorkauwen maar dan begrijp je er gewoon niets van. En dat is niet als belediging bedoeld, maar een constatering. In deze post heb ik het zo goed mogelijk uitgelegd, en als je het dan niet snapt, dan weet ik zo ook niet iets beters.quote:Op donderdag 25 februari 2010 15:53 schreef Burakius het volgende:
We hebben niet eens een begin van een code. Het omzetten etc. lukt ons al niet.
Ik vermoed dat je überhaupt weinig programmeerervaring hebt?
Als je dat concept niet goed snapt van het vorige programma moet je niet aan deze Newton-Rapson iteratie beginnen, want die bouwt er op voort. Je moet echt zorgen dat je het vorige onder de knie hebt. Misschien dat iemand nog een goede tutorial weet die je programmeren in Matlab leert, zodat je die online kunt volgen.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Ik heb een schakeling en ik vroeg me af hoe ik nu de spanning kon berekenen tussen de rode lijnen. Dus als ik op die plaatsen een snoertje in de schakeling zou zetten.
De schakeling bestaat uit 2 spanningsbronnen van beide 100V. Met R1= 10, R2=100. R3=1.
De bronnen staan verticaal opgesteld in de schakeling. Dus de bovenste - en de onderste + horen bijelkaar en de bovenste + en de onderste -.
De schakeling bestaat uit 2 spanningsbronnen van beide 100V. Met R1= 10, R2=100. R3=1.
De bronnen staan verticaal opgesteld in de schakeling. Dus de bovenste - en de onderste + horen bijelkaar en de bovenste + en de onderste -.


Ik ben niet echt een expert, maar ik denk dat ik het weet:quote:Op donderdag 25 februari 2010 16:54 schreef Luciano23 het volgende:
Ik heb een schakeling en ik vroeg me af hoe ik nu de spanning kon berekenen tussen de rode lijnen. Dus als ik op die plaatsen een snoertje in de schakeling zou zetten.
De schakeling bestaat uit 2 spanningsbronnen van beide 100V. Met R1= 10, R2=100. R3=1.
De bronnen staan verticaal opgesteld in de schakeling. Dus de bovenste - en de onderste + horen bijelkaar en de bovenste + en de onderste -.
[ afbeelding ]
Begin met de polen onderin op 0V te stellen (je mag voltages schalen zoals je wilt, alleen voltageverschillen zijn belangrijk). Dan is de pool linksboven -100V en die rechtsboven +100V. Alle draden die aan een pool verbonden zijn nemen uiteraard de spanning van de pool aan.
Nu is er nog 1 onbekende spanning: die tussen de twee R2's en de R3:
| 1 2 3 4 5 | | R3 | 0V |
Als je naar de stroom van links naar rechts kijkt (door de R2's) zie je dat de spanning tussen hen ergens moet uitkomen tussen -100V en 100V. Omdat het probleem volledig symmetrisch is zie ik geen reden waarom die spanning een voorkeur zou hebben om dichter bij de waarde links dan de waarde rechts te liggen. Wat als optie overblijft is dan 0V, het gemiddelde tussen de twee.
Als je het rigoureuzer wilt doen kun je ook de polen die bij elkaar horen met elkaar verbinden in je tekening en ze als spanningsbron tekenen, om vervolgens met de Wetten van Kirchhoff een aantal vergelijkingen op te stellen die je dan kunt oplossen.
Op dinsdag 23 augustus 2011 23:18 schreef problematiQue het volgende:
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.


Bedankt voor je reactie.
Echter volgens mij klopt het niet helemaal want ik meet een spanning van 1V?
Echter volgens mij klopt het niet helemaal want ik meet een spanning van 1V?


Heb je er wel eens aan gedacht dat die weerstanden altijd een zekere tolerantie hebben?quote:Op zaterdag 27 februari 2010 16:22 schreef Luciano23 het volgende:
Bedankt voor je reactie.
Echter volgens mij klopt het niet helemaal want ik meet een spanning van 1V?


Meet inderdaad die weerstanden eens door als dat mogelijk is. 1V is maar een klein verschil met 0V als je van 100V komt.
Op dinsdag 23 augustus 2011 23:18 schreef problematiQue het volgende:
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.


als je de trillingstijd van een veer weet bij verschillende gewichtjes, hoe kun je hieruit dan de veerconstante berekenen?


quote:Op maandag 1 maart 2010 14:14 schreef poesemuis het volgende:
als je de trillingstijd van een veer weet bij verschillende gewichtjes, hoe kun je hieruit dan de veerconstante berekenen?


als je de trillingstijd van een veer uitzet tegen de massa (gewichtje dat eraan hangt) op ruitjespapier krijg je geen rechte lijn, weet iemand wat ik uit moet zetten tegen de massa om wel een rechte te krijgen? alvast bedankt 


Wat dacht je van het gebruik van een logaritmische schaal?quote:Op maandag 1 maart 2010 15:53 schreef poesemuis het volgende:
als je de trillingstijd van een veer uitzet tegen de massa (gewichtje dat eraan hangt) op ruitjespapier krijg je geen rechte lijn, weet iemand wat ik uit moet zetten tegen de massa om wel een rechte te krijgen? alvast bedankt


is het dan zoiets als log trillingstijd uitgezet tegen log massa?quote:Op maandag 1 maart 2010 15:59 schreef Riparius het volgende:
[..]
Wat dacht je van het gebruik van een logaritmische schaal?
[ Bericht 17% gewijzigd door poesemuis op 01-03-2010 16:17:21 ]


Je hebt:quote:Op maandag 1 maart 2010 16:10 schreef poesemuis het volgende:
[..]
is het dan zoiets als log trillingstijd uitgezet tegen log massa?
T = 2π√(m/C)
En dus:
log T = log(2π) + ½∙log m - ½∙log C
Zoals je ziet moet er dus een lineair verband zijn tussen log T en log m, dus als je die twee tegen elkaar uitzet bij je experiment, dan moeten de meetpunten op een rechte lijn komen te liggen. Gebruik hiervoor dubbellogaritmisch grafiekenpapier.


Oke, er is dus een rechte lijn op dubbellogaritmisch papier als je log T tegen log m uitzet. Maar is er ook iets wat je tegen m kunt uitzetten om ook op ruitjespapier een rechte te krijgen? Of is het dan gewoon hetzelfde en moet je maar heel erg je best doen om goede assen te krijgen.quote:Op maandag 1 maart 2010 16:23 schreef Riparius het volgende:
[..]
Je hebt:
T = 2π√(m/C)
En dus:
log T = log(2π) + ½∙log m - ½∙log C
Zoals je ziet moet er dus een lineair verband zijn tussen log T en log m, dus als je die twee tegen elkaar uitzet bij je experiment, dan moeten de meetpunten op een rechte lijn komen te liggen. Gebruik hiervoor dubbellogaritmisch grafiekenpapier.


Dat is zeker ook een mogelijkheid.quote:Op maandag 1 maart 2010 16:39 schreef poesemuis het volgende:
misschien T^2 tegen de m uitzetten?


Moet morgen scheikunde practicum doen voor een cijfer, o.a. een titratie.
Nu kan ik mij vaag herrinderen dat je van te voren kon bepalen hoeveel van de stof in de buret je ongeveer nodig hebt, zodat je in het begin snel kan en op het einde langzaam.
Hellaas ben ik het vergeten , kan iemand mijn geheugen opfrissen?
, kan iemand mijn geheugen opfrissen?
Nu kan ik mij vaag herrinderen dat je van te voren kon bepalen hoeveel van de stof in de buret je ongeveer nodig hebt, zodat je in het begin snel kan en op het einde langzaam.
Hellaas ben ik het vergeten


Het antwoordenmodel geeft als antwoord:
A (Persoon 8 is niet kleurenblind en heeft dus als genotype XKY. Dochter 9 erft het dominante allel XK van haar vader.)
Nou klopt dit wel, maar waarom neemt het boek aan dat persoon 8 een man is is (en dus XY is?)? Als persoon 8 een vrouw is en 7 een man, dan is 9 een jongetje, en dan is er een andere kansverdeling.


Mannen zijn vierkant, vrouwen rondquote:Op maandag 1 maart 2010 22:04 schreef Warren het volgende:
[ afbeelding ]
Het antwoordenmodel geeft als antwoord:
A (Persoon 8 is niet kleurenblind en heeft dus als genotype XKY. Dochter 9 erft het dominante allel XK van haar vader.)
Nou klopt dit wel, maar waarom neemt het boek aan dat persoon 8 een man is is (en dus XY is?)? Als persoon 8 een vrouw is en 7 een man, dan is 9 een jongetje, en dan is er een andere kansverdeling.


De te titreren stof is meestal rond de 0,1M, dus je kan adhv je standaardstof berekenen hoeveel je ongeveer gaat moeten toevoegen. Dit kan je doen aan de hand van normaliteiten, of gewoon op 't zicht; bv. een alkalihydroxidebase zal steeds 1:1 reageren met azijnzuur, 2:1 met H2SO4 (je moet beide protonen vervangen immers).quote:Op maandag 1 maart 2010 21:40 schreef Pencile het volgende:
Moet morgen scheikunde practicum doen voor een cijfer, o.a. een titratie.
Nu kan ik mij vaag herrinderen dat je van te voren kon bepalen hoeveel van de stof in de buret je ongeveer nodig hebt, zodat je in het begin snel kan en op het einde langzaam.
Hellaas ben ik het vergeten, kan iemand mijn geheugen opfrissen?
Ik deed meestal gewoon een snelle eerste titratie en zie waar de omslag ligt, en vervolgens nog 3x om de omslag precies te bepalen.
Hou er rekening mee dat wanneer je snel veel protonen aan een sterke oxidator zoals KMnO4 toevoegt, je MnO2 kan krijgen, waardoor de oxidatie (reductie) niet volledig gebeurt.


Ok, nog een genetica vraagje.
Antwoordmodel zegt: D. (Het genotype van beide zwarte honden is EeFf.)
Maar moet dit niet E zijn? Bij een EeFf krijg je toch een verdeling van 9:3:3:1... zie mijn tabel. Heb ik gelijk of niet?
Alvast bedankt.
[ Bericht 2% gewijzigd door Warren op 02-03-2010 18:09:54 ]
Antwoordmodel zegt: D. (Het genotype van beide zwarte honden is EeFf.)
Maar moet dit niet E zijn? Bij een EeFf krijg je toch een verdeling van 9:3:3:1... zie mijn tabel. Heb ik gelijk of niet?
Alvast bedankt.
[ Bericht 2% gewijzigd door Warren op 02-03-2010 18:09:54 ]


Ik kom op hetzelfde antwoord uit. Ik snap ook niet waar ze het andere antwoord vandaan halen.quote:Op dinsdag 2 maart 2010 18:04 schreef Warren het volgende:
Ok, nog een genetica vraagje.
[ afbeelding ]
Antwoordmodel zegt: D. (Het genotype van beide zwarte honden is EeFf.)
Maar moet dit niet E zijn? Bij een EeFf krijg je toch een verdeling van 9:3:3:1... zie mijn tabel. Heb ik gelijk of niet?
[ afbeelding ]
Alvast bedankt.


Ik had drie korte vragen over een elektrische lading...
Het handigst lijkt me om hier met de eenheid van Coulomb te werken....
1,
Q1 = +2 * 10 -4 C
Q2 = -5 * 10 -4 C
afstand = 0,1 m
Wat is de grootte en richting van de kracht ?
2,
Wat is de kracht tussen 2 protonen met afstand 5*10-10 m
3,
Wat is de kracht tussen een proton en een elektron in een H-atoom?
Gemiddelde afstand = 0,529 * 10-10 m
Het handigst lijkt me om hier met de eenheid van Coulomb te werken....
1,
Q1 = +2 * 10 -4 C
Q2 = -5 * 10 -4 C
afstand = 0,1 m
Wat is de grootte en richting van de kracht ?
2,
Wat is de kracht tussen 2 protonen met afstand 5*10-10 m
3,
Wat is de kracht tussen een proton en een elektron in een H-atoom?
Gemiddelde afstand = 0,529 * 10-10 m


Ik neem toch aan dat je Wet van Coulomb wel kent? Zo niet, dan eerst even inlezen.quote:Op woensdag 3 maart 2010 11:13 schreef horned_reaper het volgende:
Ik had drie korte vragen over een elektrische lading...
Het handigst lijkt me om hier met de eenheid van Coulomb te werken....
1,
Q1 = +2 * 10 -4 C
Q2 = -5 * 10 -4 C
afstand = 0,1 m
Wat is de grootte en richting van de kracht ?
2,
Wat is de kracht tussen 2 protonen met afstand 5*10-10 m
3,
Wat is de kracht tussen een proton en een elektron in een H-atoom?
Gemiddelde afstand = 0,529 * 10-10 m


Ja zeker wel.... vraag één is ook geen probleem.... vraag twee liep ik meer mee vastquote:Op woensdag 3 maart 2010 11:33 schreef Riparius het volgende:
[..]
Ik neem toch aan dat je Wet van Coulomb wel kent? Zo niet, dan eerst even inlezen.
Of ik zou in ieder geval willen weten of ik het goed heb gedaan!


Voor natuurkunde moet ik een practicum maken. De opdracht is 'bepaal de temperatuur van een gloeidraad'. De bedoeling was dat we aan de hand van de weerstand de temperatuur konden afleiden met behulp van de formule
dR = Ro . a . dT
met: dR = weerstandsverandering
Ro = beginweerstand
a = co"efficient, op te zoeken in binas
dT = temperatuursverandering, waarmee we de uiteindeiljke temperatuur kunnen berekenen aangezien we de begintemperatuur hebben genoteerd.
Wat we hebben gedaan is we hebben voor verschillende lampjes de spanning en de stroomsterkte bij verschillende spanningen gemeten. Hierdoor krijgen we bij elke spanning een bepaalde weerstand (bepaald door R = U/i).
Ons probleem is nu als volgt. De a in de formule kunnen we in binas opzoeken. de dT moeten we berekenen. Dan zitten we dus nog met de weerstanden. Als we de spanning veranderen verandert de weerstand, maar hoe weet je nou wat je als Ro moet pakken?
dR = Ro . a . dT
met: dR = weerstandsverandering
Ro = beginweerstand
a = co"efficient, op te zoeken in binas
dT = temperatuursverandering, waarmee we de uiteindeiljke temperatuur kunnen berekenen aangezien we de begintemperatuur hebben genoteerd.
Wat we hebben gedaan is we hebben voor verschillende lampjes de spanning en de stroomsterkte bij verschillende spanningen gemeten. Hierdoor krijgen we bij elke spanning een bepaalde weerstand (bepaald door R = U/i).
Ons probleem is nu als volgt. De a in de formule kunnen we in binas opzoeken. de dT moeten we berekenen. Dan zitten we dus nog met de weerstanden. Als we de spanning veranderen verandert de weerstand, maar hoe weet je nou wat je als Ro moet pakken?
Play hard, go pro.


Voor de tweede vraag moet je alleen nog de lading van een Proton weten, uitgedrukt in Coulomb. Dat mag je zelf even opzoeken, niets moeilijks aan.quote:Op woensdag 3 maart 2010 11:38 schreef horned_reaper het volgende:
[..]
Ja zeker wel.... vraag één is ook geen probleem.... vraag twee liep ik meer mee vast
Of ik zou in ieder geval willen weten of ik het goed heb gedaan!


Niemand?quote:Op woensdag 3 maart 2010 11:38 schreef Aethereal het volgende:
Voor natuurkunde moet ik een practicum maken. De opdracht is 'bepaal de temperatuur van een gloeidraad'. De bedoeling was dat we aan de hand van de weerstand de temperatuur konden afleiden met behulp van de formule
dR = Ro . a . dT
met: dR = weerstandsverandering
Ro = beginweerstand
a = co"efficient, op te zoeken in binas
dT = temperatuursverandering, waarmee we de uiteindeiljke temperatuur kunnen berekenen aangezien we de begintemperatuur hebben genoteerd.
Wat we hebben gedaan is we hebben voor verschillende lampjes de spanning en de stroomsterkte bij verschillende spanningen gemeten. Hierdoor krijgen we bij elke spanning een bepaalde weerstand (bepaald door R = U/i).
Ons probleem is nu als volgt. De a in de formule kunnen we in binas opzoeken. de dT moeten we berekenen. Dan zitten we dus nog met de weerstanden. Als we de spanning veranderen verandert de weerstand, maar hoe weet je nou wat je als Ro moet pakken?
Play hard, go pro.


Goed proefje. Dat heeft jouw leraar goed opgezet.quote:Op woensdag 3 maart 2010 11:38 schreef Aethereal het volgende:
Voor natuurkunde moet ik een practicum maken. De opdracht is 'bepaal de temperatuur van een gloeidraad'. De bedoeling was dat we aan de hand van de weerstand de temperatuur konden afleiden met behulp van de formule
dR = Ro . a . dT
met: dR = weerstandsverandering
Ro = beginweerstand
a = co"efficient, op te zoeken in binas
dT = temperatuursverandering, waarmee we de uiteindeiljke temperatuur kunnen berekenen aangezien we de begintemperatuur hebben genoteerd.
Wat we hebben gedaan is we hebben voor verschillende lampjes de spanning en de stroomsterkte bij verschillende spanningen gemeten. Hierdoor krijgen we bij elke spanning een bepaalde weerstand (bepaald door R = U/i).
Ons probleem is nu als volgt. De a in de formule kunnen we in binas opzoeken. de dT moeten we berekenen. Dan zitten we dus nog met de weerstanden. Als we de spanning veranderen verandert de weerstand, maar hoe weet je nou wat je als Ro moet pakken?
Wat is de weerstand van je lampje als er (bijna) geen stroom door het lampje gaat? Dit is namelijk de beginweerstand Ro. Een beetje multimeter kan de weerstand ook zo meten, in de weerstandsmeet optie.
Kijk, als er namelijk maar heel weinig stroom door zo'n lampje gaat, wat je dus alleen lukt bij een lage spanning, dan zal het lampje niet gaan "branden", wat dus automatisch betekent dat de temperatuur laag zal zijn. De weerstand van het lampje op dat moment is je Ro. Dat is de laagst mogelijke weerstand van het lampje. Als je er namelijk meer spanning op zet, en er dus meer stroom door het lampje heengaat, dan zal het lampje warmer worden, waardoor de weerstand vergroot wordt etc.
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson


Wij moeten voor chemie een practicum maken over de sulfietbepaling in wijn.
We moesten een simpele titratie uitvoeren. In de maatbeker deden we 25 ml wijn, daarbij voegden we 10 ml zetmeeloplossing en de buret vulden we met jodide-jodaat oplossing. Na een 6tal ml bereikten we de gevraagde kleuromslag. We titreerden nog twee keer en bepaalden het gemiddelde van deze berekeningen.
Dan vroeg men om de redoxreactie uit te werken.
dit was de opgave: SO2 + I2 => H2So4 + HI
Ik kwam dit uit als eindresultaat:
H2O + SO2 + I2 => H2So4 + HI
Dit lijkt mij juist te zijn.
Dan was er een bewering namelijk de deze:
dank bij voorbaat,
Ben
We moesten een simpele titratie uitvoeren. In de maatbeker deden we 25 ml wijn, daarbij voegden we 10 ml zetmeeloplossing en de buret vulden we met jodide-jodaat oplossing. Na een 6tal ml bereikten we de gevraagde kleuromslag. We titreerden nog twee keer en bepaalden het gemiddelde van deze berekeningen.
Dan vroeg men om de redoxreactie uit te werken.
dit was de opgave: SO2 + I2 => H2So4 + HI
Ik kwam dit uit als eindresultaat:
H2O + SO2 + I2 => H2So4 + HI
Dit lijkt mij juist te zijn.
Dan was er een bewering namelijk de deze:
ik zou dus op een of andere manier het aantal SO2 moeten kunnen vinden zodat ik kan bewijzen dat het wel of niet klopt wat de bewering zegt. Ik vindt het niet, kheb al heel het internet afgezocht, jullie zijn dus mijn laatste hoop. (op de chemieleerkracht na dan [:)] )quote:In de wijnclub gebruikt men deze methode om het sulfietgehalte te bepalen in wijn. het aantal ml toegevoegde jodide-jodaat oplossing wordt met 10 x en komt overeen met de hoeveelheid SO2; toon met berekeningen aan dat deze methode juist is.
dank bij voorbaat,
Ben


Ten eerste kan je reactie nooit kloppen, het aantal H's en I's is niet gelijk aan beide kanten. Ten tweede ontbreekt er een woord in je bewering, ik neem aan dat er nog 'vermenigvuldigd' moet staan?
Tenslotte heb je door titratie bepaald hoeveel jood je hebt toegevoegd om al het sulfaat te laten reageren. Met je reactievergelijking kan je dan uitrekenen hoeveel sulfaat het was.
Edit: bovendien is onduidelijk wat bedoeld wordt met "hoeveelheid SO2." Is dat in mol?
Tenslotte heb je door titratie bepaald hoeveel jood je hebt toegevoegd om al het sulfaat te laten reageren. Met je reactievergelijking kan je dan uitrekenen hoeveel sulfaat het was.
Edit: bovendien is onduidelijk wat bedoeld wordt met "hoeveelheid SO2." Is dat in mol?
Op dinsdag 23 augustus 2011 23:18 schreef problematiQue het volgende:
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.


Ik ben echt slecht in scheikunde en moet morgen een proef uitvoeren, een titratie. ik heb hier geen verstand van, wat moet nou in die buis en wat voor indicator moet ik gebruiken etc.??
Vooraf:
Wij zijn Csi agenten ( ) en een partij 7up is wss vergiftigd (te zuur voor consumptie).
) en een partij 7up is wss vergiftigd (te zuur voor consumptie).
De opdracht:
Bedenk een geschikte methode om de hoeveelheid citroenzuur in de verschillende 7up monsters te onderzoeken. Bedenk daarbij dat je alleen de hoeveelheid citroenzuur wilt bepalen. Schrijf d bed8e methode in detail uit
Ik heb de beschikking over de volgende materialen:
-1 buret van 25 mL
-1 pipet van 5 mL
-1 pipet v. 10 mL
-4 erlenmeyers 250mL
-oplossingen van 0,100 M NaOH
-8 bekerglazen van 100 mL
-4 trechters
-5 indicator oplossingen (oplossingen v. Methyloranje, Methylrood, Broomthymolblauw, fenolftaleine, thymolftaleien)
-3 te onderzoeken monsters
-gedestileerd water
-branders
Ik hoop dat jullie mij dit kunnen uitlegen
Vooraf:
Wij zijn Csi agenten (
De opdracht:
Bedenk een geschikte methode om de hoeveelheid citroenzuur in de verschillende 7up monsters te onderzoeken. Bedenk daarbij dat je alleen de hoeveelheid citroenzuur wilt bepalen. Schrijf d bed8e methode in detail uit
Ik heb de beschikking over de volgende materialen:
-1 buret van 25 mL
-1 pipet van 5 mL
-1 pipet v. 10 mL
-4 erlenmeyers 250mL
-oplossingen van 0,100 M NaOH
-8 bekerglazen van 100 mL
-4 trechters
-5 indicator oplossingen (oplossingen v. Methyloranje, Methylrood, Broomthymolblauw, fenolftaleine, thymolftaleien)
-3 te onderzoeken monsters
-gedestileerd water
-branders
Ik hoop dat jullie mij dit kunnen uitlegen


Mag je je base als 0,1 M nemen? Ik heb namelijk altijd moeten werken tot 0,0001 gram. Een bulkoplossing van 0,1 M kan zo bijvoorbeeld in werkelijkheid 0,0982 M zijn. Dus, indien nodig eerst standaardiseren met een primaire standaard afgewogen op een analytische balans.
Je NaOH gaat in de buret, je 7up in de erlenmeyer. Doe daar nog een kwak water bij (hoeft niet precies afgemeten te zijn daar je base slechts reageert met het zuur (en water vormt). Het enige waar je moet voor oppassen is dat je kleuromslag duidelijk is.
Je pH-indicator kan je kiezen aan de hand van deze tabel: http://nl.wikipedia.org/wiki/PH-indicator
Wanneer er zuur in de erlenmeyer zit zit er GEEN base in, hoeveel je ook toevoegt. Wanneer je dus base in de erlenmeyer hebt is de pH hoger dan 7. Je indicator moet dus omslaan rond de 7.
De anderen kan je gebruiken wanneer je een polyprotonisch zuur wilt titreren. Cola bv. bevat fosforzuur, en bijgevolg zal je verschillende indicators moeten gebruiken voor de omslag van H3PO4 naar H2PO4- en H2PO4- naar HPO42- etc.
Tussen haakjes, methylrood is bijvoorbeeld ook geschikt daar de pH exponentieel toeneemt. Een klein druppeltje base geeft rond het equivalentiepunt een grote sprong in pH.
Achteraf kan je aan de hand van het toegevoegde volume berekenen hoeveel M de zure oplossing was met de formule V1N1 = V2N2. In dit geval is N gelijk aan M daar er één proton uitgewisseld wordt. (whoops, CZ heeft 3 carboxylfuncties)
Heb je geen labhandleiding waar de handelingen instaan? Wanneer je een volpipet moet gebruiken, hoe je je pipetten moet laten uitlopen enz?
Hier vind je een voorbeeld: http://nl.wikipedia.org/wiki/Titratie
[ Bericht 3% gewijzigd door tony_clifton- op 08-03-2010 21:56:59 ]
Je NaOH gaat in de buret, je 7up in de erlenmeyer. Doe daar nog een kwak water bij (hoeft niet precies afgemeten te zijn daar je base slechts reageert met het zuur (en water vormt). Het enige waar je moet voor oppassen is dat je kleuromslag duidelijk is.
Je pH-indicator kan je kiezen aan de hand van deze tabel: http://nl.wikipedia.org/wiki/PH-indicator
Wanneer er zuur in de erlenmeyer zit zit er GEEN base in, hoeveel je ook toevoegt. Wanneer je dus base in de erlenmeyer hebt is de pH hoger dan 7. Je indicator moet dus omslaan rond de 7.
De anderen kan je gebruiken wanneer je een polyprotonisch zuur wilt titreren. Cola bv. bevat fosforzuur, en bijgevolg zal je verschillende indicators moeten gebruiken voor de omslag van H3PO4 naar H2PO4- en H2PO4- naar HPO42- etc.
Tussen haakjes, methylrood is bijvoorbeeld ook geschikt daar de pH exponentieel toeneemt. Een klein druppeltje base geeft rond het equivalentiepunt een grote sprong in pH.
Achteraf kan je aan de hand van het toegevoegde volume berekenen hoeveel M de zure oplossing was met de formule V1N1 = V2N2. In dit geval is N gelijk aan M daar er één proton uitgewisseld wordt. (whoops, CZ heeft 3 carboxylfuncties)
Heb je geen labhandleiding waar de handelingen instaan? Wanneer je een volpipet moet gebruiken, hoe je je pipetten moet laten uitlopen enz?
Hier vind je een voorbeeld: http://nl.wikipedia.org/wiki/Titratie
[ Bericht 3% gewijzigd door tony_clifton- op 08-03-2010 21:56:59 ]


Bedankt voor je bericht.
Alleen is het me nog niet helemaal duidelijk. Ik moet morgen eerst aan mijn leraar laten zien hoe ik die proef ga uitvoeren. En ik weet nog niet welke indicator ik moet gebruiken voor het omslagpunt.
Ik moet dus de hoeveelheid citroenzuur in de 7up bepalen alleen hoe ga ik dat berekenen? Wat is de verhouding ervan?
En hoe ik de buret enzo moet voorbereiden weet ik wel ongeveer.
Alvast bedankt.
Grtn
Alleen is het me nog niet helemaal duidelijk. Ik moet morgen eerst aan mijn leraar laten zien hoe ik die proef ga uitvoeren. En ik weet nog niet welke indicator ik moet gebruiken voor het omslagpunt.
Ik moet dus de hoeveelheid citroenzuur in de 7up bepalen alleen hoe ga ik dat berekenen? Wat is de verhouding ervan?
En hoe ik de buret enzo moet voorbereiden weet ik wel ongeveer.
Alvast bedankt.
Grtn


Om te beginnen, het zit ver dus ik zou mijn nota's ff moeten opduikelen om zeker te zijn, maargoed, dat lukt vandaag nietmeer.
In ieder geval; citroenzuur is een zwak organisch zuur met blijkbaar 3 carboxylfuncties; dus je moet per mol zuur 3 mol base toevoegen. Immers, elke COOH-groep moet naar COONa omgezet worden.
Als je de pH wil bepalen is enkel het 3e omslagpunt van belang. Je moet dus geen indicator kiezen die aangeeft wanneer de pH bereikt is waarop 1 ipv 3 zuurgroepen geneutraliseerd zijn. Voor jou is dus enkel de omslag op pH 7 van belang. Ik zou methylrood of fenolftaleïne als indicator gebruiken.
Ik weet niet hoe je 't op school gezien hebt, maar ik zou met normaliteiten werken. NaOH kan 1 proton opnemen dus de normaliteit is 1, citroenzuur kan er 3 afgeven, dus de normaliteit is 3.
Voor de rest gebruik je de VN=VN formule; bv.
toegevoegd volume NaOH * 0,1N = volume in erlenmeyer * ?N met ?N de onbekende concentratie van je zuur.
daaruit ?N zoeken.
Merk op dat je in ml bezig bent endus millimol uitkomt.
Vervolgens de onbekende normaliteit omrekenen naar molariteit (1M = 3N -> 1N = 1/3M).
Hoop dat je de redenering een beetje snapt...
Als je het aantal mol hebt kan je vanwege de structuurformule en het moleculair gewicht omrekenen naar gram per mol, gram per ml, gram per 100 ml etc...
Het komt er gewoon op neer dat het aantal hydroxylionen dat je toevoegt gelijk is aan het aantal protonen dat je onttrekt, waardoor je de initiële pH kan berekenen, immers pH = -log [H+] (het omgekeerde logaritme van de concentratie aan protonen (of H3O+, zoals je wil).
[ Bericht 3% gewijzigd door tony_clifton- op 08-03-2010 22:06:34 ]
In ieder geval; citroenzuur is een zwak organisch zuur met blijkbaar 3 carboxylfuncties; dus je moet per mol zuur 3 mol base toevoegen. Immers, elke COOH-groep moet naar COONa omgezet worden.
Als je de pH wil bepalen is enkel het 3e omslagpunt van belang. Je moet dus geen indicator kiezen die aangeeft wanneer de pH bereikt is waarop 1 ipv 3 zuurgroepen geneutraliseerd zijn. Voor jou is dus enkel de omslag op pH 7 van belang. Ik zou methylrood of fenolftaleïne als indicator gebruiken.
Ik weet niet hoe je 't op school gezien hebt, maar ik zou met normaliteiten werken. NaOH kan 1 proton opnemen dus de normaliteit is 1, citroenzuur kan er 3 afgeven, dus de normaliteit is 3.
Voor de rest gebruik je de VN=VN formule; bv.
toegevoegd volume NaOH * 0,1N = volume in erlenmeyer * ?N met ?N de onbekende concentratie van je zuur.
daaruit ?N zoeken.
Merk op dat je in ml bezig bent endus millimol uitkomt.
Vervolgens de onbekende normaliteit omrekenen naar molariteit (1M = 3N -> 1N = 1/3M).
Hoop dat je de redenering een beetje snapt...
Als je het aantal mol hebt kan je vanwege de structuurformule en het moleculair gewicht omrekenen naar gram per mol, gram per ml, gram per 100 ml etc...
Het komt er gewoon op neer dat het aantal hydroxylionen dat je toevoegt gelijk is aan het aantal protonen dat je onttrekt, waardoor je de initiële pH kan berekenen, immers pH = -log [H+] (het omgekeerde logaritme van de concentratie aan protonen (of H3O+, zoals je wil).
[ Bericht 3% gewijzigd door tony_clifton- op 08-03-2010 22:06:34 ]


Oja, pas trouwens wel op met normaliteit in latere lessen chemie; in een zuur/base-reactie is de normaliteit van salpeterzuur (HNO3) 1, terwijl bij een redoxtitratie deze 5 kan zijn! Als je ziet waarom denk ik dat je normaal wel snapt  .
.


quote:Op zondag 7 maart 2010 15:10 schreef Bennieboj het volgende:
Wij moeten voor chemie een practicum maken over de sulfietbepaling in wijn.
We moesten een simpele titratie uitvoeren. In de maatbeker deden we 25 ml wijn, daarbij voegden we 10 ml zetmeeloplossing en de buret vulden we met jodide-jodaat oplossing. Na een 6tal ml bereikten we de gevraagde kleuromslag. We titreerden nog twee keer en bepaalden het gemiddelde van deze berekeningen.
Dan vroeg men om de redoxreactie uit te werken.
dit was de opgave: SO2 + I2 => H2So4 + HI
Ik kwam dit uit als eindresultaat:
H2O + SO2 + I2 => H2So4 + 2HI
Dit lijkt mij juist te zijn.
Dan was er een bewering namelijk de deze:
[..]
ik zou dus op een of andere manier het aantal SO2 moeten kunnen vinden zodat ik kan bewijzen dat het wel of niet klopt wat de bewering zegt. Ik vindt het niet, kheb al heel het internet afgezocht, jullie zijn dus mijn laatste hoop. (op de chemieleerkracht na dan [:)] )
dank bij voorbaat,
Ben
eerste antwoord: ja ik was een "2" vergeten voor HI, mijn foutquote:Op zondag 7 maart 2010 17:52 schreef Gebraden_Wombat het volgende:
Ten eerste kan je reactie nooit kloppen, het aantal H's en I's is niet gelijk aan beide kanten. Ten tweede ontbreekt er een woord in je bewering, ik neem aan dat er nog 'vermenigvuldigd' moet staan?
Tenslotte heb je door titratie bepaald hoeveel jood je hebt toegevoegd om al het sulfaat te laten reageren. Met je reactievergelijking kan je dan uitrekenen hoeveel sulfaat het was.
Edit: bovendien is onduidelijk wat bedoeld wordt met "hoeveelheid SO2." Is dat in mol?
tweede antwoord: ik heb de bewering letterlijk overgetypt maar als je de zin duidelijker wilt maken moet er idd nog "vermenigvuldigd" bij
derde antwoord: dus in feite als ik bvb 3 mol jood heb toegevoegd dan zat er ook 3 mol SO2 want de coëfficiënten zijn dezelfde. Is dit juist ?
dank je voor je tijd
ps: ja dit is in mol


Als je weet dat 6% van een bepaald getal bijv. 150 is, hoeveel is dan 8%?
Hoe reken je dat simpel uit?

Hoe reken je dat simpel uit?


Als 6% overeenkomt met 150, dan komt 1% overeen met 150/6 = 25. Dus 8% is dan 8x25 = 200quote:Op woensdag 10 maart 2010 15:37 schreef DRidder het volgende:
Als je weet dat 6% van een bepaald getal bijv. 150 is, hoeveel is dan 8%?
Hoe reken je dat simpel uit?


Ziet er uit als mijn boek van vorig jaar: 'Biologie Voor Jou VWO'.quote:Op dinsdag 2 maart 2010 18:04 schreef Warren het volgende:
Ok, nog een genetica vraagje.
[ afbeelding ]
Antwoordmodel zegt: D. (Het genotype van beide zwarte honden is EeFf.)
Maar moet dit niet E zijn? Bij een EeFf krijg je toch een verdeling van 9:3:3:1... zie mijn tabel. Heb ik gelijk of niet?
[ afbeelding ]
Alvast bedankt.
Heb het boek van vorig jaar nog wel (moeten nog enkele hoofdstukken behandelen), antwoordenboek helaas niet. Maar mijn schrift wel.
En het moet inderdaad E zijn, zowel mijn schrift als het boek zeggen dat; iemand heeft hiervoor een rondje om E gezet
Op woensdag 20 april 2011 23:38 schreef luckass het volgende:
bazen zijn alleen vindbaar voor de chicks.
bazen zijn alleen vindbaar voor de chicks.


Even en snelle vraag...
Hoe kan ik zien dat een Alpha-Helix rechtsdraaiend is en een collageen triple helix linksdraaiend.....
En dan ze dan samengevoegd weer rechtsdraaiend zijn?
Alvast bedankt
Hoe kan ik zien dat een Alpha-Helix rechtsdraaiend is en een collageen triple helix linksdraaiend.....
En dan ze dan samengevoegd weer rechtsdraaiend zijn?
Alvast bedankt


In Matlab heb ik een aantal XY-tabellen in 1 assenstelsel geplot. Alle N-de waarden uit de tabel zijn op hetzelfde moment gesampled. Is het mogelijk dat ik bijvoorbeeld een marker laat zien, waarbij ik het tijdstip selecteer met een schuifbalk?
Edit: Ok, heb zelf wat zitten prutsen en het enige wat ik nog nodig heb is een scrollback, die een event genereerd als hij gewijzigd is. Iemand tips?
Edit2: for-loopje bood eigenlijk genoeg soelaas, never mind
[ Bericht 12% gewijzigd door MichielPH op 16-03-2010 23:47:05 ]
Edit: Ok, heb zelf wat zitten prutsen en het enige wat ik nog nodig heb is een scrollback, die een event genereerd als hij gewijzigd is. Iemand tips?
Edit2: for-loopje bood eigenlijk genoeg soelaas, never mind
[ Bericht 12% gewijzigd door MichielPH op 16-03-2010 23:47:05 ]
'To alcohol, the cause of and the solution to all of life's problems' - Homer J. Simpson


Bedankt, iedereen die mij geholpen heeft.
Een vraag m.b.t. natuurkunde.
Hoe kan het, dat het antwoordenmodel zo nauwkeurig Fgem kan bepalen? Ik zie niet echt hoe dat moet bij zo'n kromme grafiek.
Een vraag m.b.t. natuurkunde.
Hoe kan het, dat het antwoordenmodel zo nauwkeurig Fgem kan bepalen? Ik zie niet echt hoe dat moet bij zo'n kromme grafiek.


Als je weet hoe F afhangt van u dan wordt het gemiddelde over het interval [0,4] gegeven doorquote:Op woensdag 17 maart 2010 00:25 schreef Warren het volgende:
Bedankt, iedereen die mij geholpen heeft.
Een vraag m.b.t. natuurkunde.
[ afbeelding ]
Hoe kan het, dat het antwoordenmodel zo nauwkeurig Fgem kan bepalen? Ik zie niet echt hoe dat moet bij zo'n kromme grafiek.
Fgem = ( ∫04 F(u)du ) / 4


Echt niemand ?quote:Op dinsdag 16 maart 2010 13:00 schreef horned_reaper het volgende:
Even en snelle vraag...
Hoe kan ik zien dat een Alpha-Helix rechtsdraaiend is en een collageen triple helix linksdraaiend.....
En dan ze dan samengevoegd weer rechtsdraaiend zijn?
Alvast bedankt