SES School, Studie en Onderwijs
Wiskunde in de brugklas, Frans voor het examen of een studie Personeel en Arbeid? Moeilijke formulieren van DUO? Iets weten over studiefinanciering of studentenverenigingen? Dit is het forum voor leerkrachten, scholieren en studenten, van brugklas tot uni



nu je het zegt klinkt dat best logisch jaquote:Op dinsdag 14 december 2010 01:12 schreef horned_reaper het volgende:
Ik zat er inderdaad ook al vreemd naar te kijken ^^
Leuk hoe Maarten een abstracte gedachte op twee manieren zo verschillend van elkaar weet neer te zetten.
Energie is natuurlijk precies hetzelfde als bewegende deeltjes (golven)


Welke reactie bedoel je hier? Ik neem aan N2O4 -> 2 NO2. Zorg altijd dat je specifiek bent in wat je bedoelt; dat voorkomt misverstanden.quote:Op dinsdag 14 december 2010 09:44 schreef Maarten302 het volgende:
[..]
Hee dankjewel man, ik snap het wat beter! De reactie kan dus eigenlijk niet lopen bij een lage temperatuur toch?
In mijn vorige antwoord zei ik dat ik aanneem dat afstotende krachten verantwoordelijk zijn voor dissociatie van N2O4. Als je kijkt naar onderstaande molecuulstructuren (voor het gemak heb ik beide resonantiestructuren van N2O4 gegeven), dan zie je dat beide stikstofatomen positief geladen zijn.quote:Wat is dan precies de reden hiervoor? Als er een lage temperatuur is, heeft de reactie 2NO2(g) --> N2O4(g) de overhand. Waarom is dat dan? Heeft het te maken met het feit dat er nu minder effectieve botsingen tussen N2O4 plaatsvinden?
Beide stoten elkaar al af, waardoor de N-N-binding niet bijzonder sterk is. Door toevoeren van warmte ontstaan er hevigere trillingen in het molecuul. Logischerwijs breekt dan als eerste de zwakste van de bindingen, namelijk de N-N-binding.
De vorming van N2O4 is inderdaad exotherm, wat betekent dat er warmte vrijkomt. Volgens wikipedia: ΔH = -57 kJ/mol.quote:Is het trouwens ook zo dat de temperatuur nu wat toeneemt als deze reactie ( 2NO2(g) --> N2O4(g)) plaatsvindt? Dit is exotherme reactie waarbij energie in de omgeving opgaat toch?
bedankt dat je de moeite neemt om mij te helpen!
Maarten
Over deeltjes- en golfkarakter van elektronen ben ik maar niet begonnen. Ik neem van harte aan dat het zo is, maar het is voor mij nogal abstract. Ik ben geen natuurkundige.quote:Op dinsdag 14 december 2010 01:12 schreef horned_reaper het volgende:
Ik zat er inderdaad ook al vreemd naar te kijken ^^
Leuk hoe Maarten een abstracte gedachte op twee manieren zo verschillend van elkaar weet neer te zetten.
Energie is natuurlijk precies hetzelfde als bewegende deeltjes (golven)


Jij bent echt mijn held lyolyrc!! Ik zag net dat jij ook degene was die mijn eerdere probleempje over de aflopende- of evenwichtsreactie hebt opgelost. Ik ben je echt heel dankbaar, ga zo doorquote:Op dinsdag 14 december 2010 16:05 schreef lyolyrc het volgende:
[..]
Welke reactie bedoel je hier? Ik neem aan N2O4 -> 2 NO2. Zorg altijd dat je specifiek bent in wat je bedoelt; dat voorkomt misverstanden.
[..]
In mijn vorige antwoord zei ik dat ik aanneem dat afstotende krachten verantwoordelijk zijn voor dissociatie van N2O4. Als je kijkt naar onderstaande molecuulstructuren (voor het gemak heb ik beide resonantiestructuren van N2O4 gegeven), dan zie je dat beide stikstofatomen positief geladen zijn.
[ afbeelding ]
Beide stoten elkaar al af, waardoor de N-N-binding niet bijzonder sterk is. Door toevoeren van warmte ontstaan er hevigere trillingen in het molecuul. Logischerwijs breekt dan als eerste de zwakste van de bindingen, namelijk de N-N-binding.
[..]
De vorming van N2O4 is inderdaad exotherm, wat betekent dat er warmte vrijkomt. Volgens wikipedia: ΔH = -57 kJ/mol.
[..]
Over deeltjes- en golfkarakter van elektronen ben ik maar niet begonnen. Ik neem van harte aan dat het zo is, maar het is voor mij nogal abstract. Ik ben geen natuurkundige.


bij de kieming van een zaad. welke kleur heeft de stengel en welke kleur heeft de wortel?
Welke is wit en welke bruin?
Welke is wit en welke bruin?


Kan iemand mij even met deze opgave helpen (alvast bedankt):
Ik snap alleen f niet helemaal. De situatie is als volgt:
Links - negatieve pool - reductor
Ag (s) + Cl- <> AgCl(s) + e-
Rechts - positieve pool - oxidator
Ag+ + e- <> Ag(s)
Nou snap ik niet hoe het transport van Cl- loopt. Het antwoordmodel zegt Cl- naar links in het linker bekerglas. Dit vind ik onlogisch.
Bij de oxidator worden Ag+ met de aangevoerde elektronen omgezet in Ag(s) dus Ag+ naar rechts in het rechter bekerglas.
Bij de reductor verwacht je het omgekeerde: Cl- wordt met Ag(s) omgezet in AgCl(s) waardoor elektronen vrijkomen. Dus Cl- gaat naar rechts... toch?
Waar klopt mijn redenering niet?
| 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 | Een galvanische cel is opgebouwd uit twee bekerglazen en een zoutbrug. In het linker bekerglas bevindt zich een 1,0 M NaCl-oplossing. In het rechter bekerglas bevindt zich een 1,0 M zilvernitraatoplossing. In beide oplossingen staat een elektrode van zilver. De zoutbrug bevat kaliumnitraat. Als de elektroden door een koperdraad met elkaar worden verbonden gaat er een stroom lopen. De elektrode die in de keukenzout-oplossing staat wordt daarbij bedekt met een laagje zilverchloride. a. Teken de opstelling. b. Leg uit wat de functie van de zoutbrug is. c. Geef de positieve en de negatieve pool aan, en leg uit hoe u tot die keuze komt. d. Geef de vergelijkingen van halfreacties die aan de polen in de bekerglazen plaatsvinden wanneer de cel stroom levert. e. Bereken de bronspanning. In de cel vindt transport plaats van elektronen en ionen. De media waardoor dit transport plaatsvindt zijn de stroomdraad, de oplossingen in de bekerglazen, de zoutbrug en de elektroden. f. Geef van elk van de geladen deeltjes Cl, Ag+, K+, NO3 en e aan hoe het transport verloopt en in welke richting. |
Ik snap alleen f niet helemaal. De situatie is als volgt:
Links - negatieve pool - reductor
Ag (s) + Cl- <> AgCl(s) + e-
Rechts - positieve pool - oxidator
Ag+ + e- <> Ag(s)
Nou snap ik niet hoe het transport van Cl- loopt. Het antwoordmodel zegt Cl- naar links in het linker bekerglas. Dit vind ik onlogisch.
Bij de oxidator worden Ag+ met de aangevoerde elektronen omgezet in Ag(s) dus Ag+ naar rechts in het rechter bekerglas.
Bij de reductor verwacht je het omgekeerde: Cl- wordt met Ag(s) omgezet in AgCl(s) waardoor elektronen vrijkomen. Dus Cl- gaat naar rechts... toch?
Waar klopt mijn redenering niet?


Volgens mij klopt je redenering wel. Bij de oxidatie van Ag ontstaat Ag+, wat vervolgens reageert met opgelost Cl- tot slecht oplosbaar AgCl. Er wordt dus Cl- uit de oplossing getrokken.quote:Op woensdag 15 december 2010 14:40 schreef Warren het volgende:
Kan iemand mij even met deze opgave helpen (alvast bedankt):
[ code verwijderd ]
Ik snap alleen f niet helemaal. De situatie is als volgt:
Links - negatieve pool - reductor
Ag (s) + Cl- <> AgCl(s) + e-
Rechts - positieve pool - oxidator
Ag+ + e- <> Ag(s)
Nou snap ik niet hoe het transport van Cl- loopt. Het antwoordmodel zegt Cl- naar links in het linker bekerglas. Dit vind ik onlogisch.
Bij de oxidator worden Ag+ met de aangevoerde elektronen omgezet in Ag(s) dus Ag+ naar rechts in het rechter bekerglas.
Bij de reductor verwacht je het omgekeerde: Cl- wordt met Ag(s) omgezet in AgCl(s) waardoor elektronen vrijkomen. Dus Cl- gaat naar rechts... toch?
Waar klopt mijn redenering niet?
Ik vind de omschrijvingen "naar links" en "naar rechts" nogal onduidelijk. Cl- gaat van de oplossing naar de elektrode.
Door de notatie krijg ik ook de indruk dat je de reacties als evenwichtsreacties beschouwt. Dat klopt niet. De vorming van slecht oplosbaar AgCl is de drijvende kracht die de reacties doet aflopen.


Bedankt. Het klopt zoals je zegt, het moeten aflopende reacties zijn en geen evenwichtsreacties. Mijn notatie was inderdaad fout. En vandaar zijn de "naar links/rechts" opmerkingen inderdaad raar, want Ag (s) + Cl- -> AgCl(s) + e- loopt af naar rechts (en niet zoals in het antwoordmodel staat: "naar links").


Maar hoe omschrijven ze het transport van NO3- dan in het antwoordmodel? Ook met "naar links" of iets dergelijks?quote:Op woensdag 15 december 2010 16:11 schreef Warren het volgende:
Bedankt. Het klopt zoals je zegt, het moeten aflopende reacties zijn en geen evenwichtsreacties. Mijn notatie was inderdaad fout. En vandaar zijn de "naar links/rechts" opmerkingen inderdaad raar, want Ag (s) + Cl- -> AgCl(s) + e- loopt af naar rechts (en niet zoals in het antwoordmodel staat: "naar links").


Die omschrijven ze zo:quote:Op woensdag 15 december 2010 16:19 schreef lyolyrc het volgende:
[..]
Maar hoe omschrijven ze het transport van NO3- dan in het antwoordmodel? Ook met "naar links" of iets dergelijks?
NO3- vanuit de zoutbrug naar het linkerbekerglas (vult daar de verdwenen Cl-
aan)


Omdat Cl- uit oplossing gaat, moet er inderdaad NO3- bijkomen vanuit de zoutbrug, om de verdwenen anionen aan te vullen. Maar in het rechterbekerglas ontstaat een overschot aan NO3- wat ook ergens heen moet. Dat gaat uiteraard de zoutbrug in. Het antwoordmodel is daar dus niet volledig.quote:Op woensdag 15 december 2010 16:20 schreef Warren het volgende:
[..]
Die omschrijven ze zo:
NO3- vanuit de zoutbrug naar het linkerbekerglas (vult daar de verdwenen Cl-
aan)


Deze zie ik niet helemaal. Een overschot in het rechter bekerglas aan NO3-? Ik dacht juist dat K+ naar het rechterbekerglas ging... ( om daar de verdwenen Ag+quote:Op woensdag 15 december 2010 16:26 schreef lyolyrc het volgende:
[..]
Maar in het rechterbekerglas ontstaat een overschot aan NO3- wat ook ergens heen moet.
aan te vullen)


Dom, ik heb mijn oogkleppen weer eens op.quote:Op woensdag 15 december 2010 16:47 schreef Warren het volgende:
[..]
Deze zie ik niet helemaal. Een overschot in het rechter bekerglas aan NO3-? Ik dacht juist dat K+ naar het rechterbekerglas ging... ( om daar de verdwenen Ag+
aan te vullen)


Ik heb een vraagje over de volgende tekst, uit een opgave:
[ Bericht 0% gewijzigd door M.rak op 03-01-2011 16:20:22 ]
Ik maak hier uit op dat R0 een constante is. In het antwoord staat echter dat dat niet het geval is (Het is in de opgave de bedoeling de formule om te schrijven, om vanuit meetgegevens mu te bepalen.):quote:Volgens de theorie wordt het verband tussen de telsnelheid (in pulsen/s) van de gamma-straling en de aluminium dikte gegeven door
R=R0*exp(-mu*d)
waarbij R0 de telsnelheid is zonder aluminium en mu de lineaire verzwakkingcoëfficiënt.
Waarom is R0 hier geen constante?quote:Door de metingen logaritmisch uit te zetten (x-as , y-as ) krijgen we:
Ln(R)=-mu*d+ln(R0)
In feite moeten we R eerst delen door “1”met de eenheid s-1.
De helling van de rechte lijn is gelijk aan – lineaire verzwakkingcoëfficiënt (mu).
De lijn gaat niet door de oorsprong (is geen constante !!!!)
[ Bericht 0% gewijzigd door M.rak op 03-01-2011 16:20:22 ]
The biggest argument against democracy is a five minute discussion with the average voter.


Voor een bepaalde bron op een bepaald tijdstip is hij wel constant. Hij verandert in de tijd uiteraard, omdat de bron vervalt.
Het antwoord is waardeloos. Er wordt een (lnR-as, d-as) bedoeld ipv een (x-as,y-as), er staat niet wat een constante zou zijn, en waarom een constante door de oorsprong zou moeten gaan is me ook niet duidelijk.
Het antwoord is waardeloos. Er wordt een (lnR-as, d-as) bedoeld ipv een (x-as,y-as), er staat niet wat een constante zou zijn, en waarom een constante door de oorsprong zou moeten gaan is me ook niet duidelijk.
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


Er geldt dat R0 = R(d=0). Als er verder niet bijstaat of R0 van de tijd oid afhangt, dan lijkt me dat R0 constant is.quote:Op maandag 3 januari 2011 15:55 schreef M.rak het volgende:
Ik heb een vraagje over de volgende tekst, uit een opgave:
[..]
Ik maak hier uit op dat R0 een constante is. In het antwoord staat echter dat dat niet het geval is (Het is in de opgave de bedoeling de formule om te schrijven, om vanuit meetgegevens mu te bepalen.):
Als je nu ln(R) uitzet tegen d, dan kun je R0 aflezen bij d=0. ln(R) is een rechte lijn, maar deze gaat natuurlijk niet door de oorsprong van je ln(R)-d diagram als R0 niet gelijk is aan 0.
Waarom zou dit impliceren dat R0 niet constant is?
Ik schrijf boeken over wetenschap en filosofie!
https://www.epsilon-uitga(...)e-tijd-materie/10996
https://www.spectrumboeke(...)k-niet-9789000386765
https://www.spectrumboeke(...)tronen-9789000395071
https://www.epsilon-uitga(...)e-tijd-materie/10996
https://www.spectrumboeke(...)k-niet-9789000386765
https://www.spectrumboeke(...)tronen-9789000395071


Misschien begrijp ik de vraag niet, maar waarom hangt R0 van de tijd af?quote:Op maandag 3 januari 2011 16:06 schreef GlowMouse het volgende:
Voor een bepaalde bron op een bepaald tijdstip is hij wel constant. Hij verandert in de tijd uiteraard, omdat de bron vervalt.
Ik schrijf boeken over wetenschap en filosofie!
https://www.epsilon-uitga(...)e-tijd-materie/10996
https://www.spectrumboeke(...)k-niet-9789000386765
https://www.spectrumboeke(...)tronen-9789000395071
https://www.epsilon-uitga(...)e-tijd-materie/10996
https://www.spectrumboeke(...)k-niet-9789000386765
https://www.spectrumboeke(...)tronen-9789000395071


Dat is eigenlijk precies mijn vraag, alles wijst er op dat het een constante is, maar er staat duidelijk 'is geen constante'.quote:Op maandag 3 januari 2011 16:13 schreef Haushofer het volgende:
[..]
Er geldt dat R0 = R(d=0). Als er verder niet bijstaat of R0 van de tijd oid afhangt, dan lijkt me dat R0 constant is.
Als je nu ln(R) uitzet tegen d, dan kun je R0 aflezen bij d=0. ln(R) is een rechte lijn, maar deze gaat natuurlijk niet door de oorsprong van je ln(R)-d diagram als R0 niet gelijk is aan 0.
Waarom zou dit impliceren dat R0 niet constant is?
Ik denk dat Glowmouse bedoelt dat de waarde van die constante niet helemaal constant is, alleen voor een tijd veel kleiner dan de halveringstijd. Als je de bron een jaar laat liggen, zal hij voor een deel vervallen zijn, en zal er dus een andere waarde voor R0 uitkomen (correct me if I'm wrong).quote:Op maandag 3 januari 2011 16:15 schreef Haushofer het volgende:
[..]
Misschien begrijp ik de vraag niet, maar waarom hangt R0 van de tijd af?
The biggest argument against democracy is a five minute discussion with the average voter.


Zou dan zeggen dat het een typo isquote:Op maandag 3 januari 2011 16:25 schreef M.rak het volgende:
[..]
Dat is eigenlijk precies mijn vraag, alles wijst er op dat het een constante is, maar er staat duidelijk 'is geen constante'.
Ja, inderdaad, dat zag ik over het hoofd.quote:Ik denk dat Glowmouse bedoelt dat de waarde van die constante niet helemaal constant is, alleen voor een tijd veel kleiner dan de halveringstijd. Als je de bron een jaar laat liggen, zal hij voor een deel vervallen zijn, en zal er dus een andere waarde voor R0 uitkomen (correct me if I'm wrong).
Ik schrijf boeken over wetenschap en filosofie!
https://www.epsilon-uitga(...)e-tijd-materie/10996
https://www.spectrumboeke(...)k-niet-9789000386765
https://www.spectrumboeke(...)tronen-9789000395071
https://www.epsilon-uitga(...)e-tijd-materie/10996
https://www.spectrumboeke(...)k-niet-9789000386765
https://www.spectrumboeke(...)tronen-9789000395071


Im de opgave staan i en j, in het plaatje bij de opgave x, y en z. Dat is verwarrend. En nu is de opgave weg 
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


oh als je het zelf wilt maken voor de lol kan ik hem wel terug zetten of course 
Blues ain't nothing but a good man feeling bad...


Wellicht moet dit in het wiskunde topic, maar ik vroeg me zo af
je hebt in de statistiek dingen zoals correlatie... nou kan het zijn dat ik me vergis, maar bestaat er eigenlijk ook iets als correlatie tussen 2 verschillende functies/matrices? Dus dat je bijvoorbeeld een matrix A en matrix B hebt en dat je probeert te kijken in hoeverre mate deze overeenkomen, of liever nog een beschrijving kunt doen d.m.v. een soort van gaussian, met een mean en covariance en wellicht nog een parameter?
je hebt in de statistiek dingen zoals correlatie... nou kan het zijn dat ik me vergis, maar bestaat er eigenlijk ook iets als correlatie tussen 2 verschillende functies/matrices? Dus dat je bijvoorbeeld een matrix A en matrix B hebt en dat je probeert te kijken in hoeverre mate deze overeenkomen, of liever nog een beschrijving kunt doen d.m.v. een soort van gaussian, met een mean en covariance en wellicht nog een parameter?


Kan iemand mij uitleggen wat het betekent als een electron zero angular momentum heeft? Volgens de quantum mechanica bezit de electron een duaal karakter; zowel deeltje als golf. Maar een golf moet toch over angular momentum beschikken? Waarschijnlijk begrijp ik de definitie van angular momentum niet goed. Alle hulp is welkom!
-


Een functie is geen grootheid die afhankelijk van het toeval een bepaalde waarde aanneemt, dus die kun je niet bestuderen in de kansrekening. Vectoren van toevalsvariabelen zijn wel heel gangbaar, en dan krijg je een covariantiematrix. Zoek daar maar eens opquote:Op maandag 10 januari 2011 21:38 schreef koffiegast het volgende:
Wellicht moet dit in het wiskunde topic, maar ik vroeg me zo af
je hebt in de statistiekkansrekening dingen zoals correlatie... nou kan het zijn dat ik me vergis, maar bestaat er eigenlijk ook iets als correlatie tussen 2 verschillende functies/matrices? Dus dat je bijvoorbeeld een matrix A en matrix B hebt en dat je probeert te kijken in hoeverre mate deze overeenkomen, of liever nog een beschrijving kunt doen d.m.v. een soort van gaussian, met een mean en covariance en wellicht nog een parameter?
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


Da's een goede vraagquote:Op maandag 10 januari 2011 21:49 schreef gaussie het volgende:
Kan iemand mij uitleggen wat het betekent als een electron zero angular momentum heeft? Volgens de quantum mechanica bezit de electron een duaal karakter; zowel deeltje als golf. Maar een golf moet toch over angular momentum beschikken? Waarschijnlijk begrijp ik de definitie van angular momentum niet goed. Alle hulp is welkom!
Zie ook deze thread op Physicsforums
-edit: dit ziet er zo bij een tweede kijk wel uit als een makkelijk antwoord, maar als je meer vragen hierover hebt, hoor ik het wel
[ Bericht 9% gewijzigd door Haushofer op 10-01-2011 22:55:12 ]
Ik schrijf boeken over wetenschap en filosofie!
https://www.epsilon-uitga(...)e-tijd-materie/10996
https://www.spectrumboeke(...)k-niet-9789000386765
https://www.spectrumboeke(...)tronen-9789000395071
https://www.epsilon-uitga(...)e-tijd-materie/10996
https://www.spectrumboeke(...)k-niet-9789000386765
https://www.spectrumboeke(...)tronen-9789000395071


Mja covariantiematrix ken ik wel, maar ik vroeg me af of er ook zoiets was als een soort methode/geval/etc was die direct een relatie beschrijft tussen 2 verschillende matricesquote:Op maandag 10 januari 2011 21:55 schreef GlowMouse het volgende:
[..]
Een functie is geen grootheid die afhankelijk van het toeval een bepaalde waarde aanneemt, dus die kun je niet bestuderen in de kansrekening. Vectoren van toevalsvariabelen zijn wel heel gangbaar, en dan krijg je een covariantiematrix. Zoek daar maar eens op


Je kunt een matrix vectoriserenquote:Op maandag 10 januari 2011 23:11 schreef koffiegast het volgende:
[..]
Mja covariantiematrix ken ik wel, maar ik vroeg me af of er ook zoiets was als een soort methode/geval/etc was die direct een relatie beschrijft tussen 2 verschillende matrices
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


Ik kom toch nog terug op dat ding van gisteren:
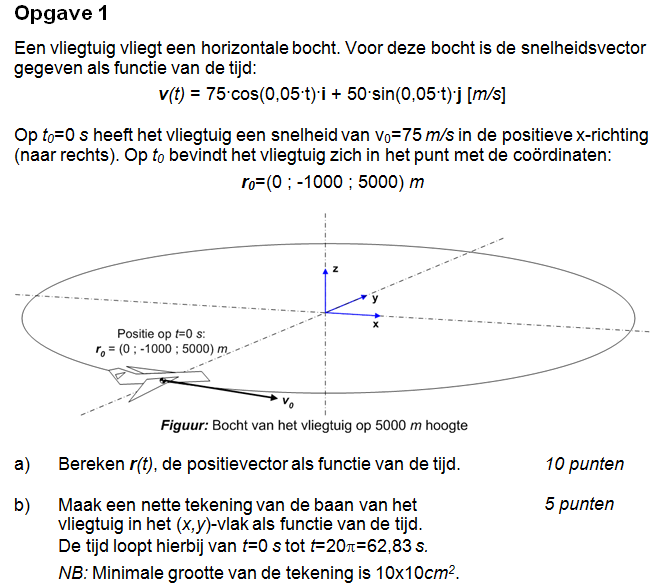
vraag 1 a
Waarom is Cy eigenlijk nul? (of Cj) x y z = i j k
vraag 1 a
Waarom is Cy eigenlijk nul? (of Cj) x y z = i j k
Blues ain't nothing but a good man feeling bad...


Je moet de integraal van 0 t/m t nemen, en dan zie je ook dat je dt beter iets van dx kan zijn omdat je anders twee t's hebt. Daarna kun je r(t) wel juist bepalen want dat gaat nu fout. De c_x/y/z vallen dan uiteraard allemaal weg.
Je wilt dat r(0) is zoals in het plaatje, en dat doe je door r(t) = r(0) + die integraal te pakken.
Je wilt dat r(0) is zoals in het plaatje, en dat doe je door r(t) = r(0) + die integraal te pakken.
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


Thenk yoe, ik snap trouwens nog steeds niet wanneer je nou radian of degrees gebruikt op je GR. Ik probeer ze gewoon allebei en dan het logisch antwoord neem ik v_v
Blues ain't nothing but a good man feeling bad...


Altijd radialen, tenzij het duidelijk over graden gaat (opgemeten met een geodriehoek ofzo).
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


In mijn boek staat de volgende vuistregel:
Bij toevoeren van warmte verschuift een evenwicht naar de endotherme kant. Dat is de kans met het grootste aantal deeltjes.
Dit vetgedrukte is mij niet duidelijk.
Stel we hebben:
N2 + O2 <> 2NO
De vorming van NO is endotherm. Dus bij een temperatuurstijging verschuift het evenwicht naar NO, maar waarom is deze kant de kant met het grootste aantal deeltjes??
Bij toevoeren van warmte verschuift een evenwicht naar de endotherme kant. Dat is de kans met het grootste aantal deeltjes.
Dit vetgedrukte is mij niet duidelijk.
Stel we hebben:
N2 + O2 <> 2NO
De vorming van NO is endotherm. Dus bij een temperatuurstijging verschuift het evenwicht naar NO, maar waarom is deze kant de kant met het grootste aantal deeltjes??


Links en rechts staan twee deeltjes, dus de vuistregel biedt hier geen uitkomst.
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


Ik denk dat je het als volgt kunt verklaren: stel je hebt een molecuul A en een molecuul B die door zich met elkaar te verbinden het molecuul AB vormen. Tenzij A en B uitzonderlijk stabiele moleculen zijn, zal AB op een lager energieniveau zitten dan A en B, omdat er energie vrijkomt bij de vorming van de binding tussen A en B (ΔH < 0). Als het energieverschil klein is en de reactie niet totaal afloopt, zul je een evenwicht krijgen: A + B <-> AB.quote:Op woensdag 12 januari 2011 12:36 schreef Warren het volgende:
In mijn boek staat de volgende vuistregel:
Bij toevoeren van warmte verschuift een evenwicht naar de endotherme kant. Dat is de kanst met het grootste aantal deeltjes.
Dit vetgedrukte is mij niet duidelijk.
Stel we hebben:
N2 + O2 <> 2NO
De vorming van NO is endotherm. Dus bij een temperatuurstijging verschuift het evenwicht naar NO, maar waarom is deze kant de kant met het grootste aantal deeltjes??
Op het moment dat er warmte toegevoerd wordt, komt er energie beschikbaar om de binding in AB te breken en dus het verschil tussen de energieniveaus te overbruggen. Toevoeren van energie zorgt er dus voor dat het evenwicht verschuift naar de gedissocieerde kant, A en B.


Klein vraagje, over iets van mechanica.
Je hebt de totale versnelling die je bijv kan ontbinden in een tangentiale en normale versnelling.
Als de tangentiale snelheid nul is. Is de tangentiale versnelling dan per defenitie nul?
Je hebt de totale versnelling die je bijv kan ontbinden in een tangentiale en normale versnelling.
Als de tangentiale snelheid nul is. Is de tangentiale versnelling dan per defenitie nul?
Blues ain't nothing but a good man feeling bad...


Nee, hij kan eerst negatief zijn en daarna positief worden.
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


Lyolyrc, bedankt.. ik doelde meer op waarom er een endotherme kant kan zijn terwijl het aantal deeltjes links en rechts gelijk is. Maar zoals Glowmouse zegt, biedt zo'n vuistregel dus niet altijd uitkomst.
Ik heb nog een vraag:
Men lost 2,0 mol ammoniumchloride in water op tot 1,0 Liter.
Vraag: Hoeveel liter ammoniakgas van p=p0 en T= 298K moet men in deze oplossing inleiden om pH op 9,2 te brengen?
Ik heb een andere redenering en ik kom niet op het juiste anwtwoord.
NH4 + H2O --> NH3- + H3O+
Kz = [NH3-] [H3O+] / [NH4]
Kz = 5,6 x 10-10
Ik bereken eerst hoeveel H30+ er zit.
x2/2,0 = 5,6 x 10-10
x = h30+ = 4,73*10^-5.
De pH moet naar 9,2 dus de [H30+] moet omlaag van 4,73*10^-5 naar 6,31*10^-10... klopt dit? hoe kom ik er achter hoeveel ammoniak ik dan nodig heb??
Ik heb nog een vraag:
Men lost 2,0 mol ammoniumchloride in water op tot 1,0 Liter.
Vraag: Hoeveel liter ammoniakgas van p=p0 en T= 298K moet men in deze oplossing inleiden om pH op 9,2 te brengen?
Ik heb een andere redenering en ik kom niet op het juiste anwtwoord.
NH4 + H2O --> NH3- + H3O+
Kz = [NH3-] [H3O+] / [NH4]
Kz = 5,6 x 10-10
Ik bereken eerst hoeveel H30+ er zit.
x2/2,0 = 5,6 x 10-10
x = h30+ = 4,73*10^-5.
De pH moet naar 9,2 dus de [H30+] moet omlaag van 4,73*10^-5 naar 6,31*10^-10... klopt dit? hoe kom ik er achter hoeveel ammoniak ik dan nodig heb??


Ik had de vraag iets anders opgevat, vandaar het antwoord dat ik heb gegeven. Door je af te vragen waarom er een endotherme kant kan zijn als er links en rechts evenveel deeltjes zijn, verwissel je regel en vuistregel. Dat bij warmte toevoeren het evenwicht naar de endotherme kant verschuift is een feit. Dat volgt immers uit de wetten van de thermodynamica. Dat er aan de endotherme kant meestal meer deeltjes staan, dat is de vuistregel.quote:Op vrijdag 14 januari 2011 13:09 schreef Warren het volgende:
Lyolyrc, bedankt.. ik doelde meer op waarom er een endotherme kant kan zijn terwijl het aantal deeltjes links en rechts gelijk is. Maar zoals Glowmouse zegt, biedt zo'n vuistregel dus niet altijd uitkomst.
Dit klopt niet. Ammonium is NH4+, niet NH4. Bij het afstaan van een proton (H+) onstaat er NH3, dat is ammoniak. NH3- bestaat niet eens, want dat zou betekenen dat het stikstofatoom 9 elektronen om zich heen heeft, wat in strijd is met de octetregel.quote:Ik heb nog een vraag:
Men lost 2,0 mol ammoniumchloride in water op tot 1,0 Liter.
Vraag: Hoeveel liter ammoniakgas van p=p0 en T= 298K moet men in deze oplossing inleiden om pH op 9,2 te brengen?
Ik heb een andere redenering en ik kom niet op het juiste anwtwoord.
NH4 + H2O --> NH3- + H3O+
Kz = [NH3-] [H3O+] / [NH4]
De juiste reactievergelijking wordt dus:
NH4+ + H2O <- -> NH3 + H3O+
Omdat NH4+ een zwakke base is, ligt het evenwicht niet totaal naar rechts. Verderop zal ik nog laten zien waar het evenwicht ligt.
De evenwichtsvoorwaarde wordt dan:
Kz = [NH3]*[H3O+] / [NH4+]
Je methode van berekenen klopt, maar de uitkomst niet. Je moet inderdaad stellen dat er x mol NH3 en ook x mol H3O+ is gevormd en dat er nog 2 - x mol NH4+ over is. Als we dan even aannemen dat x klein is (dat betekent dat het evenwicht sterk naar links ligt), dan heb je:quote:Kz = 5,6 x 10-10
Ik bereken eerst hoeveel H30+ er zit.
x2/2,0 = 5,6 x 10-10
x = h30+ = 4,73*10^-5.
x2/2,0 = 5,6 * 10-10
x = √(2,0 * 5,6 * 10-10) = 3,3 * 10-5
Hieruit volgt dat x inderdaad erg klein is, eigenlijk verwaarloosbaar klein. Ammonium dissocieert dus nagenoeg niet in water!
Nee. Uit de evenwichtsvoorwaarde volgt:quote:De pH moet naar 9,2 dus de [H30+] moet omlaag van 4,73*10^-5 naar 6,31*10^-10... klopt dit? hoe kom ik er achter hoeveel ammoniak ik dan nodig heb??
pKz = pH - log([NH3]/[NH4+])
pH - pKz = log([NH3]/[NH4+])
10(pH - pKz) = [NH3]/[NH4+]
Invullen van de gewenste pH (9,2) en pKz (-log(5,6 * 10-10)) geeft:
[NH3]/[NH4+] = 0,89
Met andere woorden, [NH3] moet 0,89 * 2,0 = 1,78 M worden. Het kleine beetje NH3 dat er gevormd wordt bij oplossen van de ammoniumchloride is uiteraard verwaarloosbaar.
Het molair volume is 24,5 dm3/mol onder gegeven omstandigheden. Dat betekent dat er 24,5 * 1,78 = 43,6 dm3 NH3 nodig is.
[ Bericht 0% gewijzigd door lyolyrc op 14-01-2011 17:45:44 ]


Bedankt voor deze uitleg. Ik heb als een kip zonder kop de reactievergelijking en evenwichtsvoorwaarde gekopieerd uit een andere topic waar iemand met hetzelfde probleem kwam.. maar ik heb niet opgemerkt dat die niet klopte. Excuses voor het bezorgen van extra werk.
Het is nu veel helderder.
- Ik vond het ten eerste raar dat men voor [NH4+] 2,0 mol/L nam.. maar aangezien het een zwakke zuur is, is het wel logisch want maar een klein gedeelte gaat over in H30+ ionen.
- Ik vond het ook raar dat al het NH3 afkomstig zou zijn van het ammoniakgas, maar aangezien x verwaarloosbaar klein is, lijkt het nu wel logisch.
- In feite laat deze berekening (x2/2,0 = 5,6 * 10-10
x = (2,0 * 5,6 * 10-10) = 3,3 * 10-5) alleen zien dat x verwaarloosbaar klein is en met dit gegeven doe je niks voor het eindantwoord.
Het is nu veel helderder.
- Ik vond het ten eerste raar dat men voor [NH4+] 2,0 mol/L nam.. maar aangezien het een zwakke zuur is, is het wel logisch want maar een klein gedeelte gaat over in H30+ ionen.
- Ik vond het ook raar dat al het NH3 afkomstig zou zijn van het ammoniakgas, maar aangezien x verwaarloosbaar klein is, lijkt het nu wel logisch.
- In feite laat deze berekening (x2/2,0 = 5,6 * 10-10
x = (2,0 * 5,6 * 10-10) = 3,3 * 10-5) alleen zien dat x verwaarloosbaar klein is en met dit gegeven doe je niks voor het eindantwoord.


Maakt niet uit. De volgende die op iets dergelijks googlet, vindt dan ook deze uitleg waar het wel goed staat.quote:Op vrijdag 14 januari 2011 23:29 schreef Warren het volgende:
Bedankt voor deze uitleg. Ik heb als een kip zonder kop de reactievergelijking en evenwichtsvoorwaarde gekopieerd uit een andere topic waar iemand met hetzelfde probleem kwam.. maar ik heb niet opgemerkt dat die niet klopte. Excuses voor het bezorgen van extra werk.
Het ligt inderdaad aan de heel beperkte dissociatie. Als je de fractie die wel omzet naar NH3 er afhaalt, dan heb je 1,9999665 mol/l, wat we natuurlijk gewoon afronden op 2,0 M.quote:Het is nu veel helderder.
- Ik vond het ten eerste raar dat men voor [NH4+] 2,0 mol/L nam.. maar aangezien het een zwakke zuur is, is het wel logisch want maar een klein gedeelte gaat over in H30+ ionen.
Als x veel groter was geweest, had je die fractie uiteraard in mindering moeten brengen op de benodigde hoeveelheid NH3 (g).quote:- Ik vond het ook raar dat al het NH3 afkomstig zou zijn van het ammoniakgas, maar aangezien x verwaarloosbaar klein is, lijkt het nu wel logisch.
Deze berekening heb ik gedaan met de aanname dat x te verwaarlozen is. Als uit de berekening was gevolgd dat x een substantiële fractie was geweest van 2,0 M, dan had ik de berekening moeten herhalen met de abc-formule. En die fractie had ik dan ook verrekend met de 1,78 M NH3.quote:- In feite laat deze berekening (x2/2,0 = 5,6 * 10-10
x = (2,0 * 5,6 * 10-10) = 3,3 * 10-5) alleen zien dat x verwaarloosbaar klein is en met dit gegeven doe je niks voor het eindantwoord.


lyolyrc, je bent een held voor het helder uitleggen van de materie 
Ik heb nog een kort vraagje n.a.v. een vraag uit een Scheikunde 1,2 examen.
Om het even kort te houden: in de vraag komt deze zin voor:
"Bij het blok legering wordt het aluminium omgezet tot aluminiumhydroxide"
Nou moet je dus hiervan een halfreactie nemen. In het antw. model staat: Al + 3 OH- --> Al(OH)3 + 3e-. Maar deze komt in binas niet voor. In binas staat wel: Al + 4OH- --> Al(OH)4- + 3e-.
Hoe zit dit nu? Ik ben een beetje in de war... welke vergelijking klopt dan?
Ik heb nog een kort vraagje n.a.v. een vraag uit een Scheikunde 1,2 examen.
Om het even kort te houden: in de vraag komt deze zin voor:
"Bij het blok legering wordt het aluminium omgezet tot aluminiumhydroxide"
Nou moet je dus hiervan een halfreactie nemen. In het antw. model staat: Al + 3 OH- --> Al(OH)3 + 3e-. Maar deze komt in binas niet voor. In binas staat wel: Al + 4OH- --> Al(OH)4- + 3e-.
Hoe zit dit nu? Ik ben een beetje in de war... welke vergelijking klopt dan?


Beide reactievergelijkingen zijn op zich correct. Zie ook deze tabel in wikipedia bij -2.31 en -2.33 V. Maar aluminiumhydroxide is Al(OH)3. Al(OH)4- is een andere stof die tetrahydroxyaluminaat heet.quote:Op zondag 16 januari 2011 23:44 schreef Warren het volgende:
lyolyrc, je bent een held voor het helder uitleggen van de materie
Ik heb nog een kort vraagje n.a.v. een vraag uit een Scheikunde 1,2 examen.
Om het even kort te houden: in de vraag komt deze zin voor:
"Bij het blok legering wordt het aluminium omgezet tot aluminiumhydroxide"
Nou moet je dus hiervan een halfreactie nemen. In het antw. model staat: Al + 3 OH- --> Al(OH)3 + 3e-. Maar deze komt in binas niet voor. In binas staat wel: Al + 4OH- --> Al(OH)4- + 3e-.
Hoe zit dit nu? Ik ben een beetje in de war... welke vergelijking klopt dan?
Maar je moet voor een redoxreactie 2 halfreacties hebben. De eerste is gemakkelijk, namelijk de oxidatie van aluminium: Al (s) -> Al3+ + 3 e-
Omdat ik het gevoel had dat er nog wat nuttige en noodzakelijke extra informatie in het examen stond, heb ik het hele examen maar even opgezocht.
In het examen staat:
Deze halfreactie staat ook in Binas: O2 (g) + 2 H2O (l) + 4 e- -> 4 OH-quote:Bij het gaasje reageert zuurstof uit de lucht met water onder vorming van hydroxide-ionen.
Dan hoef je alleen nog maar de elektronen in balans te brengen door 4x de halfreactie van aluminium op te tellen bij 3x de halfreactie van zuurstof en water.
Al (s) -> Al3+ + 3 e- |4x|
O2 (g) + 2 H2O (l) + 4 e- -> 4 OH- |3x|
-------------------------------------------------------------------------------------- +
Je zou dan dit verwachten:
4 Al (s) + 3 O2 (g) + 6 H2O (l) -> 4 Al3+ + 12 OH-
Maar als je even een stukje terug bladert in Binas, staat er een tabel met de oplosbaarheid in water van verschillende zouten (bij mij tabel 45a). Je vindt dan dat aluminiumhydroxide slecht oplosbaar is. Met andere woorden hydroxide en aluminum vormen een neerslag, dus de totaalreactie wordt:
4 Al (s) + 3 O2 (g) + 6 H2O (l) -> 4 Al(OH)3 (s)


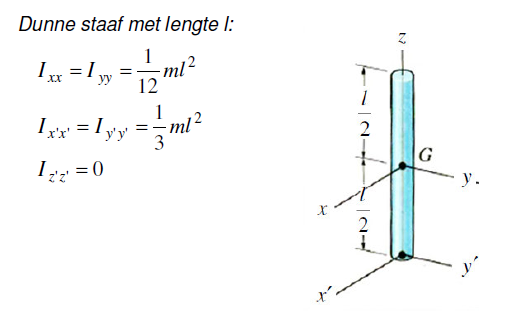
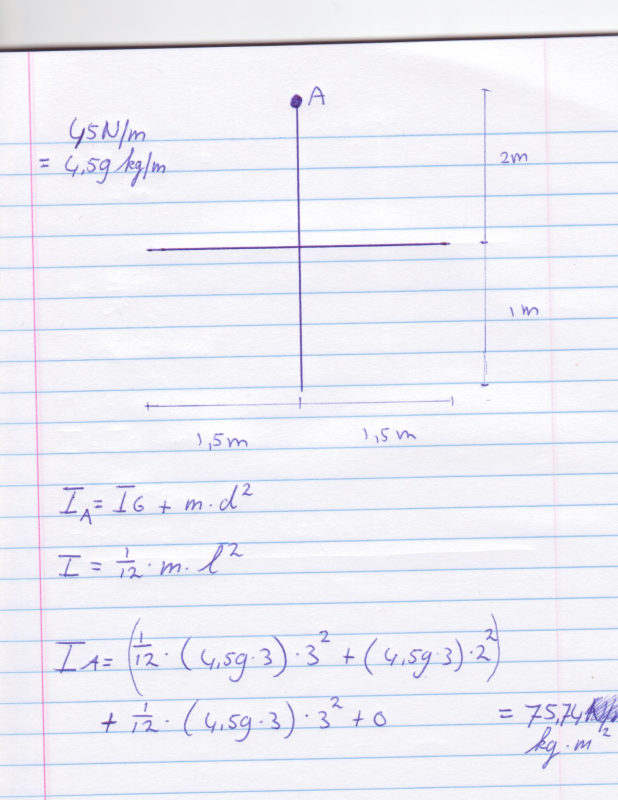
Ik was net bezig met het traagheidsmoment van het stelsel om as A van het stelsel van staven hieronder te bepalen. Ik heb er geen antwoorden bij, dus ik vroeg me af of ik deze wel goed heb aangepakt?
Eerst de algemenen formule daarna de formule voor een staaf. Eerst heb ik de horizontale staaf gedaan en daarna gewoon de verticale er bij opgeteld. Klopt dit wel?
Eerst de algemenen formule daarna de formule voor een staaf. Eerst heb ik de horizontale staaf gedaan en daarna gewoon de verticale er bij opgeteld. Klopt dit wel?
Blues ain't nothing but a good man feeling bad...


Ik zie niet echt goed wat het precies is, is het een soort + profiel ofzo?quote:Op woensdag 19 januari 2011 14:35 schreef GoodGawd het volgende:
Ik was net bezig met het traagheidsmoment van het stelsel om as A van het stelsel van staven hieronder te bepalen. Ik heb er geen antwoorden bij, dus ik vroeg me af of ik deze wel goed heb aangepakt?
Eerst de algemenen formule daarna de formule voor een staaf. Eerst heb ik de horizontale staaf gedaan en daarna gewoon de verticale er bij opgeteld. Klopt dit wel?
[ afbeelding ]


wie kan mij uitleggen, hoe de formule van de halveringsdikte precies werkt?
in het boek staat de formule I (n) = I (0) × (1/2)n
I(n) = de intensiteit na n halveringsdiktes (in W/m²)
bij dikte x geldt x= n × d1/2 (met x en d1/2 in gelijke eenheden).
ik snap niet precies wat ik hiermee moet doen, wat ik waar in moet vullen?
kan iemand dit verduidelijken voor mij?
alvast bedankt
in het boek staat de formule I (n) = I (0) × (1/2)n
I(n) = de intensiteit na n halveringsdiktes (in W/m²)
bij dikte x geldt x= n × d1/2 (met x en d1/2 in gelijke eenheden).
ik snap niet precies wat ik hiermee moet doen, wat ik waar in moet vullen?
kan iemand dit verduidelijken voor mij?
alvast bedankt


Ja het, zie het als een ijzeren constructie van een kruis, uit 1 stuk metaal.quote:Op vrijdag 21 januari 2011 14:25 schreef vaasinbloem het volgende:
[..]
Ik zie niet echt goed wat het precies is, is het een soort + profiel ofzo?Bij het elkaar optellen, heb je dan geen probleem met de overlapping?
Blues ain't nothing but a good man feeling bad...


Een kruis met een rotatiepunt aan de top toch? Die A? Als ik het even snel bekijk heb je gebruikt gemaakt van (en dan maal 2):quote:Op zondag 23 januari 2011 12:18 schreef GoodGawd het volgende:
[..]
Ja het, zie het als een ijzeren constructie van een kruis, uit 1 stuk metaal.
?
http://homepages.which.ne(...)s/MOI/MOIproofs.html
Zo ja, dat is een formule als de rotatie in het middelpunt zit en niet aan de top.
Volgens mij moet je deze gebruiken:
Ik zou eerst het hele grid maken en telkens rekenen en dan telkens kleine stukjes eruit halen. De rotatiepunt moet hetzelfde blijven (boven 2).
1 2 3
4 5 6
7 8 9
Dus eerst 1-9, dan 258, 1-6, 1-3, 2.
2
5
8
1 2 3
4 5 6
1 2 3
2
Kan iemand dit bevestigen dat het klopt? En of het makkelijker kan, vind het nogal omslachtig namelijk. Is er niet op internet een kant en klare formule te vinden?


Ik neem aan dat het hier gaat over straling, die gedeeltelijk doorgelaten wordt door een materiaal? Dat materiaal heeft dan een halveringsdikte, een maat voor hoeveel straling er wordt doorgelaten. Als je straling door een materiaal stuurt, is de intensiteit van die straling na één halveringsdikte nog maar de helft van de oorspronkelijke intensiteit. Voor de intensiteit na n halveringsdiktes geldt dan je eerste formule. I (n) is die gezochte intensiteit, I(0) is de oorspronkelijke intensiteit, en bij n vul je het aantal halveringsdiktes dat je materiaal dik is in.quote:Op zondag 23 januari 2011 12:00 schreef snellehenk het volgende:
wie kan mij uitleggen, hoe de formule van de halveringsdikte precies werkt?
in het boek staat de formule I (n) = I (0) × (1/2)n
I(n) = de intensiteit na n halveringsdiktes (in W/m²)
bij dikte x geldt x= n × d1/2 (met x en d1/2 in gelijke eenheden).
ik snap niet precies wat ik hiermee moet doen, wat ik waar in moet vullen?
kan iemand dit verduidelijken voor mij?
alvast bedankt
De tweede formule geeft aan hoe je n kan berekenen, n=x/d1/2, met x de dikte van je materiaal, en d1/2 de halveringsdikte van je materiaal. Dat x en d1/2 gelijke eenheden moeten hebben betekent dat je niet de ene in meters mag zetten als de andere in centimeters staat, de eenheden moeten gelijk zijn.
Ik hoop dat het wat duidelijker is nu
The biggest argument against democracy is a five minute discussion with the average voter.


Ja het ging idd over de straling, bedankt (Y)quote:Op zondag 23 januari 2011 15:38 schreef M.rak het volgende:
[..]
Ik neem aan dat het hier gaat over straling, die gedeeltelijk doorgelaten wordt door een materiaal? Dat materiaal heeft dan een halveringsdikte, een maat voor hoeveel straling er wordt doorgelaten. Als je straling door een materiaal stuurt, is de intensiteit van die straling na één halveringsdikte nog maar de helft van de oorspronkelijke intensiteit. Voor de intensiteit na n halveringsdiktes geldt dan je eerste formule. I (n) is die gezochte intensiteit, I(0) is de oorspronkelijke intensiteit, en bij n vul je het aantal halveringsdiktes dat je materiaal dik is in.
De tweede formule geeft aan hoe je n kan berekenen, n=x/d1/2, met x de dikte van je materiaal, en d1/2 de halveringsdikte van je materiaal. Dat x en d1/2 gelijke eenheden moeten hebben betekent dat je niet de ene in meters mag zetten als de andere in centimeters staat, de eenheden moeten gelijk zijn.
Ik hoop dat het wat duidelijker is nu.
Het begint al duidelijker te worden, maar zou je misschien nog iets duidelijker voor me kunnen maken, door een voorbeeld te geven?
alvast bedankt



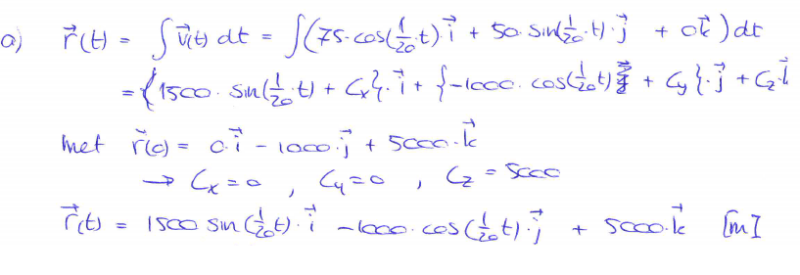

 ?
?