SES School, Studie en Onderwijs
Wiskunde in de brugklas, Frans voor het examen of een studie Personeel en Arbeid? Moeilijke formulieren van DUO? Iets weten over studiefinanciering of studentenverenigingen? Dit is het forum voor leerkrachten, scholieren en studenten, van brugklas tot uni



Het rare is die dichtheid die wordt opgegeven. De dichtheid van ethanol is 0.78, niet 0.93. Dus ik neem aan dat 0.93 de dichtheid van whiskey is.
Dit kun je ook berekenen: 0.35*0.78 + 0.65*1.0 = 0.92 g/ml. Als je er dan van uitgaat dat er nog wat zwaardere zooi inzit, dan klopt die 0.93 g/ml wel, maar dan voor de whiskey.
Aan de spelling te zien is die trouwens Iers.
Dit kun je ook berekenen: 0.35*0.78 + 0.65*1.0 = 0.92 g/ml. Als je er dan van uitgaat dat er nog wat zwaardere zooi inzit, dan klopt die 0.93 g/ml wel, maar dan voor de whiskey.
Aan de spelling te zien is die trouwens Iers.


Mijn oplossing:
1 liter whiskey van 35° weegt 930 gram en bevat 325,5 gram EtOH
(s.g. = m/v, dus m = s.g.*v -> 1000x0,93 = 930g/l )
(930x0,35 = 325,5, ik heb 35% als massaprocent geïnterpreteerd, hetgeen in de chemie gebruikelijk is bij het maken van oplossingen)
325,5 gram EtOH met molmassa 46 maakt dus 7,07 mol EtOH (massa gedeeld door molmassa). Dit is gelijk aan de molariteit (= mol per liter)
Indien je dus 1/40e van een liter neemt (1000 ml/25 ml) zal dat 0,18 mol stof bevatten, hetgeen vermenigvuldigd met de molmassa 8,14 gram C2H5OH maakt.
[ Bericht 0% gewijzigd door tony_clifton- op 03-11-2009 17:03:30 ]
1 liter whiskey van 35° weegt 930 gram en bevat 325,5 gram EtOH
(s.g. = m/v, dus m = s.g.*v -> 1000x0,93 = 930g/l )
(930x0,35 = 325,5, ik heb 35% als massaprocent geïnterpreteerd, hetgeen in de chemie gebruikelijk is bij het maken van oplossingen)
325,5 gram EtOH met molmassa 46 maakt dus 7,07 mol EtOH (massa gedeeld door molmassa). Dit is gelijk aan de molariteit (= mol per liter)
Indien je dus 1/40e van een liter neemt (1000 ml/25 ml) zal dat 0,18 mol stof bevatten, hetgeen vermenigvuldigd met de molmassa 8,14 gram C2H5OH maakt.
[ Bericht 0% gewijzigd door tony_clifton- op 03-11-2009 17:03:30 ]


Daar doen chemisten niet aan meequote:Op dinsdag 3 november 2009 16:31 schreef Iblis het volgende:
Overigens verzaak je je significantie een beetje.
Ik las de dichtheid als de dichtheid van de whiskey, omdat 't anders nogal een vreemde opgave geweest zou zijn.quote:Op dinsdag 3 november 2009 16:37 schreef lyolyrc het volgende:
Het rare is die dichtheid die wordt opgegeven. De dichtheid van ethanol is 0.78, niet 0.93. Dus ik neem aan dat 0.93 de dichtheid van whiskey is.
Dit kun je ook berekenen: 0.35*0.78 + 0.65*1.0 = 0.92 g/ml. Als je er dan van uitgaat dat er nog wat zwaardere zooi inzit, dan klopt die 0.93 g/ml wel, maar dan voor de whiskey.
Aan de spelling te zien is die trouwens Iers.
Overigens, buiten suikers en aanwezige zuren wordt de smaak van gedestilleerde alcoholische dranken vooral bepaald door zogenaamde foezelalcoholen. Bijvoorbeeld 1-methyl-2-butanol. Geen idee van dichtheden maar die verschillen zullen wel niet veel uitmaken.
[ Bericht 8% gewijzigd door tony_clifton- op 03-11-2009 16:59:10 ]


Heel erg bedankt allemaal, als ik dadelijk nog meer vragen heb val ik jullie nog wel een keer lastig. 


quote:Op dinsdag 3 november 2009 16:47 schreef tony_clifton- het volgende:
[..]
Daar doen chemisten niet aan mee


Avond, ben ik weer.
Jorien heeft op vakantie wat erts gevonden. Zijn twijfelt of het nikkelarsenide, NiAs(s), is of cupriet. Zij gaat dit onderzoeken en weegt daartoe 20,0 gram erts af en leidt daarover waterstof. Als het nikkelarsenide is, treedt een reactie op die je als volgt kunt weergeven:
2 NiAs(s) + 3 H2 (g) -> 2 Ni (s) + AsH3 (g)
Als het erts cupriet is treedt de volgende reactie op:
Cu2O(s) + H2(g) -> 2 Cu (s) + H2O(g)
Jorien verwacht dat door te meten hoeveel gram vaste stof na de reactie aanwezig is, bepaald kan worden welk erts aanwezig is.
Zij heeft al uitgerekend dat uit 20,0 g Cu2O(s) bij deze reactie 17,8 g koper ontstaat.
Bereken hoeveel gram nikkel ontstaat uit 20,0 g nikkelarsenide en leg uit of Jorien gelijk heeft datje door weging van de massa van de vaste stof na afloop kunt bepalen welk erts het is.
Kan iemand me op weg helpen, ik snap niet waar ik moet beginnen en ik snap er dus ook helemaal niks van.
Jorien heeft op vakantie wat erts gevonden. Zijn twijfelt of het nikkelarsenide, NiAs(s), is of cupriet. Zij gaat dit onderzoeken en weegt daartoe 20,0 gram erts af en leidt daarover waterstof. Als het nikkelarsenide is, treedt een reactie op die je als volgt kunt weergeven:
2 NiAs(s) + 3 H2 (g) -> 2 Ni (s) + AsH3 (g)
Als het erts cupriet is treedt de volgende reactie op:
Cu2O(s) + H2(g) -> 2 Cu (s) + H2O(g)
Jorien verwacht dat door te meten hoeveel gram vaste stof na de reactie aanwezig is, bepaald kan worden welk erts aanwezig is.
Zij heeft al uitgerekend dat uit 20,0 g Cu2O(s) bij deze reactie 17,8 g koper ontstaat.
Bereken hoeveel gram nikkel ontstaat uit 20,0 g nikkelarsenide en leg uit of Jorien gelijk heeft datje door weging van de massa van de vaste stof na afloop kunt bepalen welk erts het is.
Kan iemand me op weg helpen, ik snap niet waar ik moet beginnen en ik snap er dus ook helemaal niks van.


Je ziet aan de reactie vergelijkingen dat van de 2NiAs de As ‘verdwijnt’, d.w.z. AsH3 is gasvormig. Je kunt dus nagaan hoeveel mol 2NiAs je hebt, en dus hoeveel mol Ni je dan zou moeten krijgen, en hoeveel dat zou wegen.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


2 mol NiAs en 1 mol Niquote:Op dinsdag 3 november 2009 20:19 schreef Iblis het volgende:
Je ziet aan de reactie vergelijkingen dat van de 2NiAs de As ‘verdwijnt’, d.w.z. AsH3 is gasvormig. Je kunt dus nagaan hoeveel mol 2NiAs je hebt, en dus hoeveel mol Ni je dan zou moeten krijgen, en hoeveel dat zou wegen.
NiAs weegt 133,63 gram (of hoe noem je dat?) en Ni 58,71
Maar wat moet ik dan gaan doen?
Want ik snap ook niet hoe ze aan die 20,0 gram en 17,8 gram zijn gekomen...


Zoals de mijnwerkers, parkiet in een kooitje naastzetten, als 't arsine is merk je 't wel 
Mijn hoofd zit momenteel te vast om na te denken, maar je moet gewoon opschrijven hoeveel mol je hebt indien je van een stof uitgaat, H2 is altijd overmaat, dus ontstaat er evenveel mol arsine als nikkel(III)arsenide, en evenveel mol koper als koper(II)oxide.
Dit kan je zien aan de reactievergelijking, alhoewel je er een fout in hebt zitten. Arsenide is drie- of vijfwaardig, dus hier heb je inderdaad 3 waterstofmoleculen en 2 nikkel(III)arsenides nodig. Je houdt aan de andere kant dus 2 moleculen arsine over, in plaats van 1.
De gegeven massa koper is dus volgens mij al de oplossing voor de 2e vergelijking, je moet enkel de eerste doen.
Zal er ff papier bij nemen .
.
Mijn hoofd zit momenteel te vast om na te denken, maar je moet gewoon opschrijven hoeveel mol je hebt indien je van een stof uitgaat, H2 is altijd overmaat, dus ontstaat er evenveel mol arsine als nikkel(III)arsenide, en evenveel mol koper als koper(II)oxide.
Dit kan je zien aan de reactievergelijking, alhoewel je er een fout in hebt zitten. Arsenide is drie- of vijfwaardig, dus hier heb je inderdaad 3 waterstofmoleculen en 2 nikkel(III)arsenides nodig. Je houdt aan de andere kant dus 2 moleculen arsine over, in plaats van 1.
De gegeven massa koper is dus volgens mij al de oplossing voor de 2e vergelijking, je moet enkel de eerste doen.
Zal er ff papier bij nemen


Kijk, 20 gram van die stof is ofwel 0,15 mol NiAs, ofwel 0,14 mol Cu2O.
Je moet mol gewoon zien als een vermenigvuldiging, dus 0,14 mol betekent eigenlijk 0,14*6,023*1023 atomen/moleculen/whatever. Je kan dus het aantal bits en bytes op een harde schijf ook in mol uitdrukken desnoods, ook al zou 't een beetje dom zijn.
In ieder geval, 0,15 mol NiAs bevat 0,15 mol nikkelatomen en 0,15 mol arseenatomen.
0,14 mol Cu2O bevat dan 0,28 mol koperatomen, en 0,14 mol zuurstofatomen, zie je dan ook waarom?
Concreet in je voorstel betekent het dat je 8,80 gram Ni zou overhouden. Hoe je daarmee aan een oplossing komt, geen idee. Hetzelfde aantal mol arseen weegt 11,24g, wat zou beteken dat je 0,04 gram waterstof toegevoegd hebt (wet van behoud van massa). (afgerond op 2 cijfers na de komma)
Theoretisch: Je voegt per 2 mol erts 6 mol waterstof toe, dus 3x zoveel als je aantal mol erts: 0,45 mol of 45 gram waterstof.
Dus, indien ze 8,80 gram vaste stof heeft is het nikkel, als het 17,80 gram weegt heb je koper en weet je dus wat in het erts zit.
Vaag vraagstuk, of ik zie er gewoon los over.
Je moet mol gewoon zien als een vermenigvuldiging, dus 0,14 mol betekent eigenlijk 0,14*6,023*1023 atomen/moleculen/whatever. Je kan dus het aantal bits en bytes op een harde schijf ook in mol uitdrukken desnoods, ook al zou 't een beetje dom zijn.
In ieder geval, 0,15 mol NiAs bevat 0,15 mol nikkelatomen en 0,15 mol arseenatomen.
0,14 mol Cu2O bevat dan 0,28 mol koperatomen, en 0,14 mol zuurstofatomen, zie je dan ook waarom?
Concreet in je voorstel betekent het dat je 8,80 gram Ni zou overhouden. Hoe je daarmee aan een oplossing komt, geen idee. Hetzelfde aantal mol arseen weegt 11,24g, wat zou beteken dat je 0,04 gram waterstof toegevoegd hebt (wet van behoud van massa). (afgerond op 2 cijfers na de komma)
Theoretisch: Je voegt per 2 mol erts 6 mol waterstof toe, dus 3x zoveel als je aantal mol erts: 0,45 mol of 45 gram waterstof.
Dus, indien ze 8,80 gram vaste stof heeft is het nikkel, als het 17,80 gram weegt heb je koper en weet je dus wat in het erts zit.
Vaag vraagstuk, of ik zie er gewoon los over.


Bedankt, ik denk dat het begint te dagen. Doe je een scheikunde-opleiding of ben je al afgestudeerd ofzo?


Met een volumepercentage alcohol en de dichtheid van ethanol was de vraag ook op te lossen. Dus zo vreemd is het niet. Zeker niet aangezien alcoholische dranken meestal een volumepercentage alcohol opgeven en er vooral dichtheden van zuivere stoffen bekend zijn.quote:Op dinsdag 3 november 2009 16:47 schreef tony_clifton- het volgende:
Ik las de dichtheid als de dichtheid van de whiskey, omdat 't anders nogal een vreemde opgave geweest zou zijn.
1-methyl-2-butanol? Dat bestaat niet!quote:Overigens, buiten suikers en aanwezige zuren wordt de smaak van gedestilleerde alcoholische dranken vooral bepaald door zogenaamde foezelalcoholen. Bijvoorbeeld 1-methyl-2-butanol. Geen idee van dichtheden maar die verschillen zullen wel niet veel uitmaken.
Bedoel je 2-methyl-1-butanol of 3-pentanol?


2-methyl idd, stom 
Geeft smaak aan sherry btw...
Ach, maakt niet uit, ik vind die middelbareschoolvraagstukken altijd wel vaag gesteld. Lang leve hogeschool en unif .
.
(geen idee hoe 't nederlandse onderwijssysteem is opgedeeld dus kan vreemd overkomen )
)
Geeft smaak aan sherry btw...
Ach, maakt niet uit, ik vind die middelbareschoolvraagstukken altijd wel vaag gesteld. Lang leve hogeschool en unif
(geen idee hoe 't nederlandse onderwijssysteem is opgedeeld dus kan vreemd overkomen


Ik ben druk aan het leren voor een tentamen van morgen en ik heb hier een aantal oefenvragen maar ik heb geen antwoordbladen  en de docent wil ze ook niet geven.
en de docent wil ze ook niet geven.
Dus misschien zijn er scheikundige genieën die me hier wel mee kunnen helpen...
Ik moet de verkorte electronenconfiguratie van Br- opschrijven.
Dit wordt dan toch gewoon ... "[Ar] - 4S2 - 3d10 - 4p6"
Of heb ik nu iets verkeerd gedaan ?
Edit: En hoe zit het met de verkorte electronenconfiguratie van Ca2+
Want deze stof heeft min 2 e-, 18 elektronen dat zijn er net zoveel als Ar
Moet ik dan alleen maar [Ar] opschrijven of weer terug revereren naar Ne ?
Dus misschien zijn er scheikundige genieën die me hier wel mee kunnen helpen...
Ik moet de verkorte electronenconfiguratie van Br- opschrijven.
Dit wordt dan toch gewoon ... "[Ar] - 4S2 - 3d10 - 4p6"
Of heb ik nu iets verkeerd gedaan ?
Edit: En hoe zit het met de verkorte electronenconfiguratie van Ca2+
Want deze stof heeft min 2 e-, 18 elektronen dat zijn er net zoveel als Ar
Moet ik dan alleen maar [Ar] opschrijven of weer terug revereren naar Ne ?


Klopt, dit komt overeen met de elektronenconfiguratie van krypton. Vergeet niet de superscripten, dus: [Ar] - 4s2 - 3d10 - 4p6. Maar ik ga er vanuit dat je die niet hier had opgeschreven, omdat het nogal wat werk is.quote:Op donderdag 5 november 2009 15:56 schreef horned_reaper het volgende:
Ik ben druk aan het leren voor een tentamen van morgen en ik heb hier een aantal oefenvragen maar ik heb geen antwoordbladenen de docent wil ze ook niet geven.
Dus misschien zijn er scheikundige genieën die me hier wel mee kunnen helpen...
Ik moet de verkorte electronenconfiguratie van Br- opschrijven.
Dit wordt dan toch gewoon ... "[Ar] - 4S2 - 3d10 - 4p6"
Of heb ik nu iets verkeerd gedaan ?
Terugredeneren naar neon en het op een vergelijkbare manier opschrijven als je hierboven hebt gedaan voor bromide.quote:Edit: En hoe zit het met de verkorte electronenconfiguratie van Ca2+
Want deze stof heeft min 2 e-, 18 elektronen dat zijn er net zoveel als Ar
Moet ik dan alleen maar [Ar] opschrijven of weer terug revereren naar Ne ?


Bedankt ! Ben je toevallig scheikunde docent ? of iets in die richting ?quote:Op donderdag 5 november 2009 16:18 schreef lyolyrc het volgende:
[..]
Klopt, dit komt overeen met de elektronenconfiguratie van krypton. Vergeet niet de superscripten, dus: [Ar] - 4s2 - 3d10 - 4p6. Maar ik ga er vanuit dat je die niet hier had opgeschreven, omdat het nogal wat werk is.
[..]
Terugredeneren naar neon en het op een vergelijkbare manier opschrijven als je hierboven hebt gedaan voor bromide.


Student Biomedische Technologie aan de TU/e, met organische chemie als afstudeerrichting.quote:Op donderdag 5 november 2009 16:22 schreef horned_reaper het volgende:
Bedankt ! Ben je toevallig scheikunde docent ? of iets in die richting ?


Nog even een korte vraag... wat is het verschil tussen een elektron en een P-elektron ?
Aan de hand van de "P-elektronen" moet ik de plaatsen in het periodieke systeem van een x aantal elementen kunnen bepalen.
Maar het is me blijkbaar een keer ontgaan waar nu precies die P voor staat bij een P-elektron.
Aan de hand van de "P-elektronen" moet ik de plaatsen in het periodieke systeem van een x aantal elementen kunnen bepalen.
Maar het is me blijkbaar een keer ontgaan waar nu precies die P voor staat bij een P-elektron.


De p-electronen zijn electronen in de p-orbitalen. Als de electronenconfiguratie op npx eindigt (met n = een periodenummer en x = aantal electronen), dan weet je dat het bijbehorende element in een van de 6 rechtse groepen zit.


Daar ben ik weer met nog een korte scheikundige vraag.
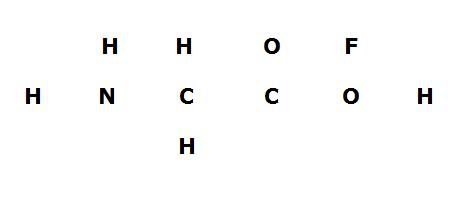
Ik net de volgende vraag: "Geef de volledige Lew-structuur en specificatielijst van de volgende verbinding".
En daar stond het volgende (zelfgemaakt paint plaatje) onder.
Toen ben ik dus alles gaan invullen en kwam ik ongeveer op het volgende uit:
Zoals je kunt zien houd ik bij het F element een punt over, want F heeft normaal 7 valentie elektronen om zich heen.
Dus is dit nu de goede oplossing ? en kan ik er dan vanuit gaan dat het molecul 1- geladen is ? of moet het op een totaal andere manier ?
Ik net de volgende vraag: "Geef de volledige Lew-structuur en specificatielijst van de volgende verbinding".
En daar stond het volgende (zelfgemaakt paint plaatje) onder.
Toen ben ik dus alles gaan invullen en kwam ik ongeveer op het volgende uit:
Zoals je kunt zien houd ik bij het F element een punt over, want F heeft normaal 7 valentie elektronen om zich heen.
Dus is dit nu de goede oplossing ? en kan ik er dan vanuit gaan dat het molecul 1- geladen is ? of moet het op een totaal andere manier ?


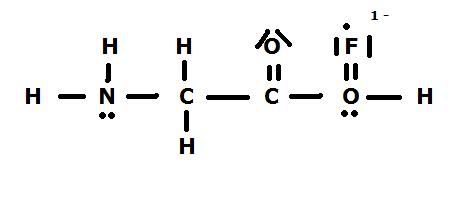
Dit is sowieso niet goed. In een molecuul moet een atoom een vol octet (= 8 elektronen) hebben. En Fluor heeft er nu 9.
Wat is de naam en molecuulformule van de stof waar het over gaat?
Disclaimer: eerstejaars student
Wat is de naam en molecuulformule van de stof waar het over gaat?
Disclaimer: eerstejaars student
"Everything we are, we are when we're alone."


ik denk dat het iets NH3-CHF-COOH moet zijn. Enige verbinding dat nog een beetje logisch is. Een soort fluorazijnzuurverbinding met nog een extra aminefunctie op de alfakoolstof. Dan is 't trouwens ook niet moeilijk om de elektronen te verdelen.


Fluor moet er 7 hebben (kijk maar in het periodiek systeem) en fluor heeft er ook 7 in mijn tekening.quote:Op donderdag 5 november 2009 21:47 schreef Meursault het volgende:
Dit is sowieso niet goed. In een molecuul moet een atoom een vol octet (= 8 elektronen) hebben. En Fluor heeft er nu 9.
Wat is de naam en molecuulformule van de stof waar het over gaat?
Disclaimer: eerstejaars student
Elk streepje bestaat, zoals je vast wel zult weten, uit 2 stippen, dus heeft hij 2 halve streepjes, twee hele, en een extra, en dat is dus 7.


Het zou er niet toe moeten doen wat voor soort stof het isquote:Op donderdag 5 november 2009 21:49 schreef tony_clifton- het volgende:
Ik niet echt...
Ik zou zeggen dat je waterstofkes aan die stikstof onder elkaar moeten (hoogste symmetrie). Voor de rest zou 't mij sterk verbazen moest die fluor daar goed staan... Ik zou de theorie er nog eens moeten bijnemen mbt verdelen van formele ladingen enz., maar heb 't nog maar weinig moeten toepassen dus echt veel kan ik je er niet bij helpen.
En ik kan me niet voorstellen dat de vraagstelling op een proeftentamen verkeerd is....


Ja idd, maar een atoom gaat net bindingen aan om aan de octetstructuur te voldoen... teken H2O maar eens ofzo... Ik blijf bij 1-aminofluorazijnzuur, maar ben er niet zeker van.quote:Op donderdag 5 november 2009 21:56 schreef horned_reaper het volgende:
[..]
Fluor moet er 7 hebben (kijk maar in het periodiek systeem) en fluor heeft er ook 7 in mijn tekening.
Elk streepje bestaat, zoals je vast wel zult weten, uit 2 stippen, dus heeft hij 2 halve streepjes, twee hele, en een extra, en dat is dus 7.


Fluor heeft 7 valantie elektronen. Maar in een molecuul moet elk atoom een vol octet hebben = 8 al dan niet gedeelde elektronen = een volle S en P orbitaal.quote:Op donderdag 5 november 2009 21:56 schreef horned_reaper het volgende:
[..]
Fluor moet er 7 hebben (kijk maar in het periodiek systeem) en fluor heeft er ook 7 in mijn tekening.
Elk streepje bestaat, zoals je vast wel zult weten, uit 2 stippen, dus heeft hij 2 halve streepjes, twee hele, en een extra, en dat is dus 7.
In bovenstaand geval heeft Fluor nu 9 elektronen: 7 van zichzelf en 2 gedeeld met het zuurstofatoom. Dat kan niet.
"Everything we are, we are when we're alone."


Bij lewisstructuren is een deel van de oefeningen net het centraal atoom vinden. Hier heb je m.i. een fout tegen gemaakt aangezien een fluoratoom nooit op een zuurstof kan voorkomen. Regel van markovnikov- een nucleofiel valt aan op het atoom met de meeste waterstoffen..., of een nucleofiel valt een elektrofiel aan, geen ander nucleofiel. Dit zou zijn alsof je 2 magneetjes met dezelfde pool tegen elkaar wil drukken en houden - lukt niet...quote:Op donderdag 5 november 2009 21:58 schreef horned_reaper het volgende:
[..]
Het zou er niet toe moeten doen wat voor soort stof het isnormaal zou je het gewoon moeten zien... maar hier kom ik dus neit uit.
En ik kan me niet voorstellen dat de vraagstelling op een proeftentamen verkeerd is....
Halogenatie is trouwens een manier om dubbele bindingen experimenteel te bepalen, door markovnikov.


Wat zou jij dan doen als je puur even naar het bovenste plaatje kijkt, waar de bindingen nog niet bij staan ?quote:Op donderdag 5 november 2009 22:01 schreef tony_clifton- het volgende:
[..]
Bij lewisstructuren is een deel van de oefeningen net het centraal atoom vinden. Hier heb je m.i. een fout tegen gemaakt aangezien een fluoratoom nooit op een zuurstof kan voorkomen. Regel van markovnikov- een nucleofiel valt aan op het atoom met de meeste waterstoffen..., of een nucleofiel valt een elektrofiel aan, geen ander nucleofiel. Dit zou zijn alsof je 2 magneetjes met dezelfde pool tegen elkaar wil drukken en houden - lukt niet...
Halogenatie is trouwens een manier om dubbele bindingen experimenteel te bepalen, door markovnikov.


Maar wat zou ik dan moeten doen met die 9de valentie elektron die ik nog over heb ? gewoon weggooien ?quote:Op donderdag 5 november 2009 22:00 schreef Meursault het volgende:
[..]
Fluor heeft 7 valantie elektronen. Maar in een molecuul moet elk atoom een vol octet hebben = 8 al dan niet gedeelde elektronen = een volle S en P orbitaal.
In bovenstaand geval heeft Fluor nu 9 elektronen: 7 van zichzelf en 2 gedeeld met het zuurstofatoom. Dat kan niet.


3HNCHFCOOH
Ik hou vast aan wat ik ken - azijnzuur: CH3COOH, trifluorazijnzuur - CF3COOH, en ammoniak NH3
Bovendien komen halogeniden sowiezo niet voor op sterk elektronegatieve atomen - dat zo geweldig instabiele verbindingen geven.
Ik hou vast aan wat ik ken - azijnzuur: CH3COOH, trifluorazijnzuur - CF3COOH, en ammoniak NH3
Bovendien komen halogeniden sowiezo niet voor op sterk elektronegatieve atomen - dat zo geweldig instabiele verbindingen geven.


Geen idee. Ik ben benieuwd wat de stof is waar het over gaat. Ik kan niets vinden met die atomen.quote:Op donderdag 5 november 2009 22:05 schreef horned_reaper het volgende:
[..]
Maar wat zou ik dan moeten doen met die 9de valentie elektron die ik nog over heb ? gewoon weggooien ?
C2H5NO2 komt in een aantal vormen voor, maar bij geen van de vormen zie ik ruimte om een F atoom te koppelen..
Die stof zou dan toch wel googlebaar moeten zijn?quote:Op donderdag 5 november 2009 22:07 schreef tony_clifton- het volgende:
3HNCHFCOOH
Ik hou vast aan wat ik ken - azijnzuur: CH3COOH, trifluorazijnzuur - CF3COOH, en ammoniak NH3
Bovendien komen halogeniden sowiezo niet voor op sterk elektronegatieve atomen - dat zo geweldig instabiele verbindingen geven.
"Everything we are, we are when we're alone."


Je zou 't in SciFinder moeten kunnen tekenen - krijg je alle wet. artikels waar ze dat molecule in vermelden
Ik ga 't ff tekenen en infotograferen (heb geen tekenprogramma en zit met de laptop voor tv en wil niet zitten klooien in javaeditors )
)
Ik ga 't ff tekenen en infotograferen (heb geen tekenprogramma en zit met de laptop voor tv en wil niet zitten klooien in javaeditors


Oja, die zuurstof van de carboxylfunctie heeft dus 2 elektronenparen nog, vergeten aan te duiden...
Ben dus niet zeker, maar dit is gewoon logisch. Een gehalogeneerd aminoazijnzuurmolecule. Why not?


Yeah why not !quote:Op donderdag 5 november 2009 22:18 schreef tony_clifton- het volgende:
[ afbeelding ]
Oja, die zuurstof van de carboxylfunctie heeft dus 2 elektronenparen nog, vergeten aan te duiden...
Ben dus niet zeker, maar dit is gewoon logisch. Een gehalogeneerd aminoazijnzuurmolecule. Why not?
Ik probeer het gewoon, heel erg bedankt in ieder geval !


Laat nog maar even horen of het klopt. Ik ben wel benieuwd..quote:Op donderdag 5 november 2009 22:24 schreef horned_reaper het volgende:
[..]
Yeah why not !
Ik probeer het gewoon, heel erg bedankt in ieder geval !
"Everything we are, we are when we're alone."


Het lijkt trouwens een beetje op Glycine, een aminozuur.
Alleen is de structuur van dit laatste 2HN=CH2-COOH
(maar ben te laat zie ik net )
)
Oja, kan je verklaren waaorm ik die fluor niet op de stikstof gezet heb? Heb de oplossing al gegeven btw .
.
Alleen is de structuur van dit laatste 2HN=CH2-COOH
(maar ben te laat zie ik net
Oja, kan je verklaren waaorm ik die fluor niet op de stikstof gezet heb? Heb de oplossing al gegeven btw


Beste betaboys/girls.
Ik heb:
TW = 2q – 4√q
Als TW = totale winst functie. Nu wil ik de marginale kosten bereken. Dat betekent differentiëren.
Is dat:
MW= 2 - 2q^-(1/2)
Is dat waar?
En zo ja waarom?
Ik heb:
TW = 2q – 4√q
Als TW = totale winst functie. Nu wil ik de marginale kosten bereken. Dat betekent differentiëren.
Is dat:
MW= 2 - 2q^-(1/2)
Is dat waar?
En zo ja waarom?
--------------------------------------------------------------------------------------------
Als je gewoon je bek dicht houdt, is er niets aan de hand!
Als je gewoon je bek dicht houdt, is er niets aan de hand!


Ja, dat is waar. Ben je bekend met de normale regels voor het differentiëren van machten, zoals:
2x -> 2
x^2 -> 2x
7x^5 -> 5*7x^4
?
Zo ja, dan hoef je alleen maar te weten dat √x = x^(1/2), en diezelfde regels toe te passen.
Er is trouwens ook een centraal wiskunde-topic:
[Bèta wiskunde] Huiswerk- en vragentopic
2x -> 2
x^2 -> 2x
7x^5 -> 5*7x^4
?
Zo ja, dan hoef je alleen maar te weten dat √x = x^(1/2), en diezelfde regels toe te passen.
Er is trouwens ook een centraal wiskunde-topic:
[Bèta wiskunde] Huiswerk- en vragentopic
Op dinsdag 23 augustus 2011 23:18 schreef problematiQue het volgende:
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.


1/f = 1/v + 1/b
De lenzenwet is symmetrische in b en v, dit betekent dat je b en v mag verwisselen zonder dat je een andere uitkomst krijgt.
Vraag: Toon dit aan. Leg ook uit wat het voordeel is van deze symmetrie.
Dat het waar is weet ik natuurlijk wel, maar hoe toon je het aan? Ik geloof niet dat willekeurige getallen invullen een bewijs is. Weet iemand een goede methode of is het een domme vraag met een dom antwoord?
De lenzenwet is symmetrische in b en v, dit betekent dat je b en v mag verwisselen zonder dat je een andere uitkomst krijgt.
Vraag: Toon dit aan. Leg ook uit wat het voordeel is van deze symmetrie.
Dat het waar is weet ik natuurlijk wel, maar hoe toon je het aan? Ik geloof niet dat willekeurige getallen invullen een bewijs is. Weet iemand een goede methode of is het een domme vraag met een dom antwoord?


wissel b en v om:
1/f = 1/b + 1/v. Dit rechterdeel kun je natuurlijk herschrijven tot 1/v + 1/b dus de formule is inderdaad identiek.
1/f = 1/b + 1/v. Dit rechterdeel kun je natuurlijk herschrijven tot 1/v + 1/b dus de formule is inderdaad identiek.
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


In een bedrijf zijn 9 werknemers.
Er is voor elke werknemer een kans van 5,8% dat hij zich voor een werkdag ziek belt.
Hoe groot is de kans dat 1 werknemer ziek is?
En 2?
Ik heb al op internet gekeken maar ik kom er maar niet uit.
Er is voor elke werknemer een kans van 5,8% dat hij zich voor een werkdag ziek belt.
Hoe groot is de kans dat 1 werknemer ziek is?
En 2?
Ik heb al op internet gekeken maar ik kom er maar niet uit.
When I get sad, I stop being sad and just be awesome instead.


Om de kans te berekenen dat precies één werknemer zich op een gegeven dag ziek meldt, moet je in feite de kans berekenen dat er één werknemer ziek is en de andere acht niet. Helpt dat?quote:Op zaterdag 14 november 2009 18:30 schreef MouzurX het volgende:
In een bedrijf zijn 9 werknemers.
Er is voor elke werknemer een kans van 5,8% dat hij zich voor een werkdag ziek belt.
Hoe groot is de kans dat 1 werknemer ziek is?
En 2?
Ik heb al op internet gekeken maar ik kom er maar niet uit.


Dit kun je niet berekenen met deze gegevens.
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


Dit is iets meer een vraag voor de wiskundetopic, maar goed. De vraagstelling lijkt wat onvolledig. Immers, als er eentje ziek is, is het niet onwaarschijnlijk dat hij de dag ervoor een ander al heeft aangestoken, en zijn de kansen niet onderling onafhankelijk. Dat is voor de vraagsteller.quote:Op zaterdag 14 november 2009 18:30 schreef MouzurX het volgende:
In een bedrijf zijn 9 werknemers.
Er is voor elke werknemer een kans van 5,8% dat hij zich voor een werkdag ziek belt.
Hoe groot is de kans dat 1 werknemer ziek is?
En 2?
Ik heb al op internet gekeken maar ik kom er maar niet uit.
Dan verder, het gaat dan (zo interpreteer ik het) om de kans dat er precies één werknemer ziek is. En de rest niet. De kans dat iemand dus niet ziek is is 94,2%.
rest even weggehaald
[ Bericht 8% gewijzigd door Iblis op 14-11-2009 19:27:48 ]
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Dat lijkt me zo niet goed ... Als je de werknemers A t/m I noemt dan heb je zo de kans berekend dat één of twee specifieke werknemers op een gegeven dag ziek zijn, niet één of twee willekeurige werknemers van die negen ...quote:Op zaterdag 14 november 2009 19:12 schreef Iblis het volgende:
[..]
Dit is iets meer een vraag voor de wiskundetopic, maar goed. De vraagstelling lijkt wat onvolledig. Immers, als er eentje ziek is, is het niet onwaarschijnlijk dat hij de dag ervoor een ander al heeft aangestoken, en zijn de kansen niet onderling onafhankelijk. Dat is voor de vraagsteller.
Dan verder, het gaat dan (zo interpreteer ik het) om de kans dat er precies één werknemer ziek is. En de rest niet. De kans dat iemand dus niet ziek is is 94,2%. Dat maakt: 1 ziek en 8 niet-ziek is:
0,058·0,9428 = 3,6%
En voor 2:
0,0582·0,9427 = 0,2%


Ja zo had ik het ook uitgerekend maar dat klopt toch niet?quote:Op zaterdag 14 november 2009 19:12 schreef Iblis het volgende:
[..]
Dit is iets meer een vraag voor de wiskundetopic, maar goed. De vraagstelling lijkt wat onvolledig. Immers, als er eentje ziek is, is het niet onwaarschijnlijk dat hij de dag ervoor een ander al heeft aangestoken, en zijn de kansen niet onderling onafhankelijk. Dat is voor de vraagsteller.
Dan verder, het gaat dan (zo interpreteer ik het) om de kans dat er precies één werknemer ziek is. En de rest niet. De kans dat iemand dus niet ziek is is 94,2%. Dat maakt: 1 ziek en 8 niet-ziek is:
0,058·0,9428 = 3,6%
En voor 2:
0,0582·0,9427 = 0,2%
Want de kans voor 1 werknemer was 5,8% dat hij ziek zou zijn.
En nu heb je 9 werknemers en ligt de kans lager, die kans moet toch juist hoger liggen?
When I get sad, I stop being sad and just be awesome instead.


Inderdaad, je hebt al door dat het antwoord van Iblis niet kan kloppen. Nu nog even bedenken waarom niet ...quote:Op zaterdag 14 november 2009 19:19 schreef MouzurX het volgende:
[..]
Ja zo had ik het ook uitgerekend maar dat klopt toch niet?
Want de kans voor 1 werknemer was 5,8% dat hij ziek zou zijn.
En nu heb je 9 werknemers en ligt de kans lager, die kans moet toch juist hoger liggen?


Hmm, ja, m'n brein maakte even een ommetje.quote:
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Ja omdat dus die kansen van iedere werknemer onafhankelijk van elkaar zijn dus je niet kan vermenigvuldigen .. en je het vraagstuk dus eig helemaal niet kan uitrekenen(zoals al eerder gezegd) ?quote:Op zaterdag 14 november 2009 19:21 schreef Riparius het volgende:
[..]
Inderdaad, je hebt al door dat het antwoord van Iblis niet kan kloppen. Nu nog even bedenken waarom niet ...
(het vraagstuk is gewoon iets waar we tegenaan liepen tijdens een project, dus zelf verzonnen)
When I get sad, I stop being sad and just be awesome instead.


Nee, de reden die je geeft klopt niet. En het is best uit te rekenen (onder bepaalde aannames). Zegt het begrip binomiale verdeling je iets?quote:Op zaterdag 14 november 2009 19:24 schreef MouzurX het volgende:
[..]
Ja omdat dus die kansen van iedere werknemer onafhankelijk van elkaar zijn dus je niet kan vermenigvuldigen .. en je het vraagstuk dus eig helemaal niet kan uitrekenen(zoals al eerder gezegd) ?
(het vraagstuk is gewoon iets waar we tegenaan liepen tijdens een project, dus zelf verzonnen)


Kijk, met bepaalde aannames kún je het wel uitrekenen, maar de vraag is of die realistisch zijn.quote:Op zaterdag 14 november 2009 19:24 schreef MouzurX het volgende:
[..]
Ja omdat dus die kansen van iedere werknemer onafhankelijk van elkaar zijn dus je niet kan vermenigvuldigen .. en je het vraagstuk dus eig helemaal niet kan uitrekenen(zoals al eerder gezegd) ?
(het vraagstuk is gewoon iets waar we tegenaan liepen tijdens een project, dus zelf verzonnen)
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Dat maakt niet uit.quote:Op zaterdag 14 november 2009 19:28 schreef Iblis het volgende:
[..]
Kijk, met bepaalde aannames kún je het wel uitrekenen, maar de vraag is of die realistisch zijn.
Dus ehm:
=BINOMINAAL(1;9;0,058) = 0,323651575
Een kans van 32,4% dat er iemand ziek is zou dat kunnen kloppen ?
When I get sad, I stop being sad and just be awesome instead.


Ja, dat is correct, zo reken je dat eigenlijk uit:quote:Op zaterdag 14 november 2009 19:52 schreef MouzurX het volgende:
[..]
Dat maakt niet uit.
Dus ehm:
=BINOMINAAL(1;9;0,058) = 0,323651575
Een kans van 32,4% dat er iemand ziek is zou dat kunnen kloppen ?
En voor 2:
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Ja. Maar begrijp je nu ook wat je doet (behalve wat toetsen indrukken op je rekenmachine omdat je hebt gehoord dat je 'iets' met een binomiale verdeling moest doen)?quote:Op zaterdag 14 november 2009 19:52 schreef MouzurX het volgende:
[..]
Dat maakt niet uit.
Dus ehm:
=BINOMINAAL(1;9;0,058) = 0,323651575
Een kans van 32,4% dat er iemand ziek is zou dat kunnen kloppen ?
Overigens is dit volkomen onrealistisch. Stel dat de vrouw van werknemer B. maandagochtend opbelt dat haar man niet kan komen werken omdat deze in het weekend een motorongeluk heeft gehad en nu met een gecompliceerde beenbreuk en een dwarslesie in het ziekenhuis ligt. Dan denk je toch hopelijk niet dat de kans dat B. dinsdagochtend weer volkomen fit op zijn werk verschijnt nog steeds 94,2% is?


Niet echt om eerlijk te zijn, die ( ) snap ik niet, hoe die ook alweer berekent wordt.quote:Op zaterdag 14 november 2009 20:01 schreef Riparius het volgende:
[..]
Ja. Maar begrijp je nu ook wat je doet (behalve wat toetsen indrukken op je rekenmachine omdat je hebt gehoord dat je 'iets' met een binomiale verdeling moest doen)?
Overigens is dit volkomen onrealistisch. Stel dat de vrouw van werknemer B. maandagochtend opbelt dat haar man niet kan komen werken omdat deze in het weekend een motorongeluk heeft gehad en nu met een gecompliceerde beenbreuk en een dwarslesie in het ziekenhuis ligt. Dan denk je toch hopelijk niet dat de kans dat B. dinsdagochtend weer volkomen fit op zijn werk verschijnt nog steeds 94,2% is?
Klopt maar het gaat niet echt om enorm realistisch te zijn.
When I get sad, I stop being sad and just be awesome instead.


(nk) uitgesproken als 'n over k', stelt het aantal mogelijke combinaties (c.q. deelverzamelingen) voor van k elementen uit een verzameling van n elementen (sorry voor de wat onbeholpen 'scheve' notatie).quote:Op zaterdag 14 november 2009 20:28 schreef MouzurX het volgende:
[..]
Niet echt om eerlijk te zijn, die ( ) snap ik niet, hoe die ook alweer berekend wordt.
Klopt maar het gaat niet echt om enorm realistisch te zijn.
Dus, om een voorbeeld te geven: op een schaal liggen 9 verschillende bonbons en je mag er twee uitkiezen. Hoeveel verschillende keuzes kun je dan maken?
Als het goed is, zou je, als je het echt begrijpt, moeten kunnen beredeneren dat geldt:
(nk) = n!/(k!(n-k)!)


Ah oke ik snap het al weerquote:Op zaterdag 14 november 2009 20:39 schreef Riparius het volgende:
[..]
(nk) uitgesproken als 'n over k', stelt het aantal mogelijke combinaties (c.q. deelverzamelingen) voor van k elementen uit een verzameling van n elementen (sorry voor de wat onbeholpen 'scheve' notatie).
Dus, om een voorbeeld te geven: op een schaal liggen 9 verschillende bonbons en je mag er twee uitkiezen. Hoeveel verschillende keuzes kun je dan maken?
Als het goed is, zou je, als je het echt begrijpt, moeten kunnen beredeneren dat geldt:
(nk) = n!/(k!(n-k)!)
When I get sad, I stop being sad and just be awesome instead.


Aan 500 milliliter 2,0*10^-3 M NaHCO3-oplossing voeg je 500 milliliter 2,0*10^-3 zoutzuur toe.
a) Geef de vergelijking voor de reactie.
b) Bereken de pH van de oplossing.
Vraag a snap ik, maar vraag b wordt ik gek van. Weet iemand hoe ik hier uit kom? Ik zal je eeuwig dankbaar zijn
a) Geef de vergelijking voor de reactie.
b) Bereken de pH van de oplossing.
Vraag a snap ik, maar vraag b wordt ik gek van. Weet iemand hoe ik hier uit kom? Ik zal je eeuwig dankbaar zijn


vraag B is niets anders als een meer uitgewijde versie van "je hebt 1 L van een oplossing van 2 mM koolzuur; bereken de pH". Dan is het niets anders als het uitwerken van:quote:Op woensdag 25 november 2009 23:36 schreef RacerDKB het volgende:
Aan 500 milliliter 2,0*10^-3 M NaHCO3-oplossing voeg je 500 milliliter 2,0*10^-3 zoutzuur toe.
a) Geef de vergelijking voor de reactie.
b) Bereken de pH van de oplossing.
Vraag a snap ik, maar vraag b wordt ik gek van. Weet iemand hoe ik hier uit kom? Ik zal je eeuwig dankbaar zijn
Kacid = [bicarbonaat][H+]/[koolzuur]


http://upload.wikimedia.o(...)_electron_shells.png
Dit is een perodiek systeem, de meeste mensen zullen het wel herkennen. Ik denk niet dat velen er om mee kunnen gaan.
maar nu het volgende.
De opdracht is gegeven om 2 elementen te laten reageren met elkaar.
maar om het duidelijk te houden nemen we deze 2:
11 Sodium.
2.8.1
13 alluminium
2.8.3
wie kan me daar verder mee helpen?
mvg
ik weet trouwens dat die sodium 1 molecuul in de buitenste schil wilt afstaan en de alluminium 3 wilt afstaan
[ Bericht 3% gewijzigd door Cumshooter op 26-11-2009 22:46:22 ]
Dit is een perodiek systeem, de meeste mensen zullen het wel herkennen. Ik denk niet dat velen er om mee kunnen gaan.
maar nu het volgende.
De opdracht is gegeven om 2 elementen te laten reageren met elkaar.
maar om het duidelijk te houden nemen we deze 2:
11 Sodium.
2.8.1
13 alluminium
2.8.3
wie kan me daar verder mee helpen?
mvg
ik weet trouwens dat die sodium 1 molecuul in de buitenste schil wilt afstaan en de alluminium 3 wilt afstaan
[ Bericht 3% gewijzigd door Cumshooter op 26-11-2009 22:46:22 ]
beter spijt van je daden, als spijt omdat je het hebt gelaten!!!


Eerst even wat verbeteringen aangebrachtquote:Op donderdag 26 november 2009 22:39 schreef Cumshooter het volgende:
http://upload.wikimedia.o(...)_electron_shells.png
Dit is een perodiek systeem, de meeste mensen zullen het wel herkennen. Ik denk niet dat velen er om mee kunnen gaan.
maar nu het volgende.
De opdracht is gegeven om 2 elementen te laten reageren met elkaar.
maar om het duidelijk te houden nemen we deze 2:
11 Sodium.Natrium
2.8.1
13 alluminium
2.8.3
wie kan me daar verder mee helpen?
mvg
ik weet trouwens dat die sodium natrium 1 molecuul elektron (!!!) in de buitenste schil wilt afstaan en de alluminium 3 wilt afstaan
Je moet wat specifieker zijn in wat je bedoelt. Ongeladen natrium en aluminium doen niets met elkaar, want beide willen in die toestand alleen elektronen afstaan. Er kan wel een redoxreactie plaatsvinden tussen ongeladen natrium (Na) en geladen aluminium (Al3+). 3 Atomen natrium staan dan elk een elektron af aan 1 aluminiumion:
3 Na + Al3+ -> 3 Na+ + Al
Je kunt dit afleiden uit de elektrodepotentialen. De reactie met de laagste potentiaal is de reductie, de hogere potentiaal de oxidatie.


Scheikunde
Opgave : http://i49.tinypic.com/qntfnp.jpg
Uitwerkingen: http://i48.tinypic.com/121r7nm.jpg
Bij vraag 4E snap ik niet hoe ze aan het antwoord komen.
Ik weet dit:
2 CH3OH -><- CH3OCH3 + H20
begin 9,25 mol 0mol 0mol
reactie
einde
en Kc=333
Hoe komen ze aan de andere waardes?
Opgave : http://i49.tinypic.com/qntfnp.jpg
Uitwerkingen: http://i48.tinypic.com/121r7nm.jpg
Bij vraag 4E snap ik niet hoe ze aan het antwoord komen.
Ik weet dit:
2 CH3OH -><- CH3OCH3 + H20
begin 9,25 mol 0mol 0mol
reactie
einde
en Kc=333
Hoe komen ze aan de andere waardes?


Het ziet ernaar uit dat je antwoorden van e betrekking hebben op een andere som dan die nu op je opgavenblad staat. In de oorspronkelijke som wordt waarschijnlijk die verandering in hoeveelheid stof van een van de componenten gegeven, en wordt je daarmee gevraagd Kc uit te rekenen.quote:Op zaterdag 28 november 2009 14:15 schreef Joewy het volgende:
Scheikunde
Opgave : http://i49.tinypic.com/qntfnp.jpg
Uitwerkingen: http://i48.tinypic.com/121r7nm.jpg
Bij vraag 4E snap ik niet hoe ze aan het antwoord komen.
Ik weet dit:
2 CH3OH -><- CH3OCH3 + H20
begin 9,25 mol 0mol 0mol
reactie
einde
en Kc=333
Hoe komen ze aan de andere waardes?
Op dinsdag 23 augustus 2011 23:18 schreef problematiQue het volgende:
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.


Ik had wel een vermoeden dat er iets niet klopte, er wordt gevraagd naar de massa van een stof en die is niet terug te vinden in het antwoord. Maar misschien zag ik iets over het hoofd, dus vroeg ik het hier.
Bedankt voor de hulp.
Bedankt voor de hulp.


-edit
[ Bericht 97% gewijzigd door sitting_elfling op 29-11-2009 01:39:29 ]
[ Bericht 97% gewijzigd door sitting_elfling op 29-11-2009 01:39:29 ]
People once tried to make Chuck Norris toilet paper. He said no because Chuck Norris takes crap from NOBODY!!!!
Megan Fox makes my balls look like vannilla ice cream.
Megan Fox makes my balls look like vannilla ice cream.


Vraagje betreft natuurkunde:
Hoe kan ik de volgende formule ombouwen zodat ik ook alle andere waarden kan berekenen als daar om gevraagd wordt? Oftewel, via welke formule bereken ik C of m als deze gevraagd wordt, en de andere waarden wel beschikbaar zijn.
Hoe kan ik de volgende formule ombouwen zodat ik ook alle andere waarden kan berekenen als daar om gevraagd wordt? Oftewel, via welke formule bereken ik C of m als deze gevraagd wordt, en de andere waarden wel beschikbaar zijn.
A "Nederlands restaurant" is a 'contradictio in terminus'.
If it don't matter to you, it don't matter to me
If it don't matter to you, it don't matter to me


ik heb geen idee, anders had ik het niet gevraagd  aangezien mijn algebra ook niet heel denderend is, zou ik graag willen zien hoe ik dit moet aanpakken. De reden waarom ik het hier vraag is om niet op mijn tentamen straks deze fout te maken.
aangezien mijn algebra ook niet heel denderend is, zou ik graag willen zien hoe ik dit moet aanpakken. De reden waarom ik het hier vraag is om niet op mijn tentamen straks deze fout te maken.
A "Nederlands restaurant" is a 'contradictio in terminus'.
If it don't matter to you, it don't matter to me
If it don't matter to you, it don't matter to me


Dat is standaard formulemanipulatie:
Stel, je wilt m, dan moet je die vrij maken, deel eerst eens door 2π aan beide kanten:
En kwadrateer nu aan beide zijden:
En vermenigvuldig nu beide kanten met C:
Door nu links en rechts door T²/(4π²) te delen krijg je C:
Stel, je wilt m, dan moet je die vrij maken, deel eerst eens door 2π aan beide kanten:
En kwadrateer nu aan beide zijden:
En vermenigvuldig nu beide kanten met C:
Door nu links en rechts door T²/(4π²) te delen krijg je C:
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


A "Nederlands restaurant" is a 'contradictio in terminus'.
If it don't matter to you, it don't matter to me
If it don't matter to you, it don't matter to me


Korte vraag:
Er is een hydrodam gepland in Kameroen, deze heeft een capaciteit van 200MW.
De kosten voor energie in Kameroen zijn 10 tot 12 cent. EDIT: per KwH
Wat zijn de opbrengsten per jaar van deze dam?
Er is een hydrodam gepland in Kameroen, deze heeft een capaciteit van 200MW.
De kosten voor energie in Kameroen zijn 10 tot 12 cent. EDIT: per KwH
Wat zijn de opbrengsten per jaar van deze dam?


Ik neem aan dat de "kosten" gelijk staan aan de opbrengsten, en dat de dam vol continu stroom kan afleveren?quote:Op maandag 30 november 2009 13:00 schreef denkjedat het volgende:
Korte vraag:
Er is een hydrodam gepland in Kameroen, deze heeft een capaciteit van 200MW.
De kosten voor energie in Kameroen zijn 10 tot 12 cent. EDIT: per KwH
Wat zijn de opbrengsten per jaar van deze dam?
200 MW x hoe veel uur zitten er in een jaar / 1 kWh * 10cent
Houd er rekening mee dat een MW gelijk is aan ... kW
De rest kun je zelf invullen?
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson


Dat is trouwens prima business, zo'n dam! Voor zo'n $400 miljoen heb je er al eentje die 300 MW kan genereren.
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson


Met de kosten bedoelde ik inderdaag opbrengsten. Voor de bevolking zijn dit naturlijk kosten.
Met jouw rekenvoorbeeld kom ik dus uit op:
200.000 KW * 8760 / kWh * 10 cent ($) = 175.200.000 $
Dit lijkt me wel erg veel :p
Wat er fout gaat, en ik ook niet snap, is de omrekening van MW naar kWh. iemand?
[ Bericht 8% gewijzigd door denkjedat op 30-11-2009 13:44:24 ]
Met jouw rekenvoorbeeld kom ik dus uit op:
200.000 KW * 8760 / kWh * 10 cent ($) = 175.200.000 $
Dit lijkt me wel erg veel :p
Wat er fout gaat, en ik ook niet snap, is de omrekening van MW naar kWh. iemand?
[ Bericht 8% gewijzigd door denkjedat op 30-11-2009 13:44:24 ]


MW is een vermogen, dat wil zeggen een hoeveelheid energie die per tijdseenheid wordt gegenereerd. kWh is een energie-eenheid. Reken eerst MW om kW en vermenigvuldig dan met het aantal uren.quote:Op maandag 30 november 2009 13:38 schreef denkjedat het volgende:
Met de kosten bedoelde ik inderdaag opbrengsten. Voor de bevolking zijn dit naturlijk kosten.
Met jouw rekenvoorbeeld kom ik dus uit op:
200.000 KW * 8760 / kWh * 10 cent ($) = 175.200.000 $
Dit lijkt me wel erg veel :p
De berekening klopt wel, maar ik snap de omrekening van MW naar kWh niet. iemand?


Ik heb niet veel geslapen, dus ik zie het allemaal niet meer zo helder, maar ik kan geen fout ontdekken. Die centrale genereert inderdaad 200.000 kW, en in een jaar zitten 8760 uur, dus in totaal genereert dat ding 200.000 x 8760 = 1.75 x 109 kWh. Vermenigvuldig dat met 0.1$ en je komt inderdaad op $175 miljoen uit. In de praktijk zal het zo'n vaart niet lopen, omdat er 's nachts weinig vraag is en grote afnemers die stroom voor een prikkie krijgen. Maar toch, een netto opbrengst (na aftrek kosten) van zo'n $100 miljoen per jaar, voor een investering van zeg $400 miljoen, dat tikt aan.quote:Op maandag 30 november 2009 13:38 schreef denkjedat het volgende:
Met de kosten bedoelde ik inderdaag opbrengsten. Voor de bevolking zijn dit naturlijk kosten.
Met jouw rekenvoorbeeld kom ik dus uit op:
200.000 KW * 8760 / kWh * 10 cent ($) = 175.200.000 $
Dit lijkt me wel erg veel :p
Wat er fout gaat, en ik ook niet snap, is de omrekening van MW naar kWh. iemand?
Good intentions and tender feelings may do credit to those who possess them, but they often lead to ineffective — or positively destructive — policies ... Kevin D. Williamson


Lyrebird legt het goed uit volgens mij. Wat je je even (als je het nog niet gedaan had) goed moet realiseren is dat W een eenheid is per tijd. Watt is Joule per seconde. Een 200 MW centrale is een beschrijving van een centrale die continu een bepaalde hoeveelheid energie ‘produceert’, net zoals een 40W gloeilamp elke seconde 40 J energie ‘verstookt’.
kWh is (ondanks de h) gewoon een eenheid die een bepaalde hoeveelheid energie aanduidt. Het is dus niet kilowatt PER uur maar kilowatt * uur. Als je dat uitschrijft dan vind je 1 kWh = 3,6 miljoen Joule.
Ik hoop dat het nu niet nog waziger wordt.
kWh is (ondanks de h) gewoon een eenheid die een bepaalde hoeveelheid energie aanduidt. Het is dus niet kilowatt PER uur maar kilowatt * uur. Als je dat uitschrijft dan vind je 1 kWh = 3,6 miljoen Joule.
Ik hoop dat het nu niet nog waziger wordt.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Ik heb even een vraagje aangaande een reactiesnelheidsvergelijking.
We nemen hypotetisch gezien even de vergelijking, A + B --> C + D
Hierop wordt de regel toegepast, r = k * [A]2 * [B]
Hierbij is [B] de 1e orde en [A]2 de 2e orde.
Maar je schijnt ook nog op de een of andere manier gebruik te kunnen maken van een 0e orde.... heeft iemand enig idee hoe dat zit
We nemen hypotetisch gezien even de vergelijking, A + B --> C + D
Hierop wordt de regel toegepast, r = k * [A]2 * [B]
Hierbij is [B] de 1e orde en [A]2 de 2e orde.
Maar je schijnt ook nog op de een of andere manier gebruik te kunnen maken van een 0e orde.... heeft iemand enig idee hoe dat zit


Dat is de constante omzetting, onafhankelijk van de concentratie. Je kunt het ook beredeneren:quote:Op dinsdag 1 december 2009 12:05 schreef horned_reaper het volgende:
Ik heb even een vraagje aangaande een reactiesnelheidsvergelijking.
We nemen hypotetisch gezien even de vergelijking, A + B --> C + D
Hierop wordt de regel toegepast, r = k * [A]2 * [B]
Hierbij is [B] de 1e orde en [A]2 de 2e orde.
Maar je schijnt ook nog op de een of andere manier gebruik te kunnen maken van een 0e orde.... heeft iemand enig idee hoe dat zit
[X]: 1e orde
[X]2: 2e orde
Hieruit volgt logisch: 0e orde = [X]0 = 1 = constant


Wie kan me hierbij helpen?
Dit is het stappenplan die ik volgens de leraar het best kan hanteren
1. Noteren
2. Noteer lading
3. Maak ze gelijk
4. 2 atomige elementen?
5. Gelijkmaken
De atoom Be en F gaan nu reageren.
1. Be + F -> BeF
2. Be = 2 teveel F = 1 teweinig
3. Nu moeten ze de zelfde Concentratie krijgen dat is 2
2x1 2x1
2x1 -----
---- 2
2
Be = 1 + F = 2
4. 2 atomige moleculen?
de F is 2 atomig
Be1 + 2F2
5. Snap ik niet
Dit is het stappenplan die ik volgens de leraar het best kan hanteren
1. Noteren
2. Noteer lading
3. Maak ze gelijk
4. 2 atomige elementen?
5. Gelijkmaken
De atoom Be en F gaan nu reageren.
1. Be + F -> BeF
2. Be = 2 teveel F = 1 teweinig
3. Nu moeten ze de zelfde Concentratie krijgen dat is 2
2x1 2x1
2x1 -----
---- 2
2
Be = 1 + F = 2
4. 2 atomige moleculen?
de F is 2 atomig
Be1 + 2F2
5. Snap ik niet
beter spijt van je daden, als spijt omdat je het hebt gelaten!!!


ah, je had zelfs dit topic al gevonden en hebt daarna nog een topic geopend? Als iemand de tijd en de kennis heeft word je heus wel geholpen! Heb geduld! 
Ja doei.


Het stappenplan klopt, maar je uitvoering niet helemaal. Ik zou het als volgt opschrijven:quote:Op woensdag 2 december 2009 11:51 schreef Cumshooter het volgende:
Wie kan me hierbij helpen?
Dit is het stappenplan die ik volgens de leraar het best kan hanteren
1. Noteren
2. Noteer lading
3. Maak ze gelijk
4. 2 atomige elementen?
5. Gelijkmaken
De atoom Be en F gaan nu reageren.
1. Be + F -> BeF
2. Be = 2 teveel F = 1 teweinig
3. Nu moeten ze de zelfde Concentratie krijgen dat is 2
2x1 2x1
2x1 -----
---- 2
2
Be = 1 + F = 2
4. 2 atomige moleculen?
de F is 2 atomig
Be1 + 2F2
5. Snap ik niet
1. x Be + y F -> BexFy
2. Be staat inderdaad 2 elektronen af, dit geeft Be2+. F wil inderdaad een elektron opnemen, dit geeft F-.
3. Be staat 2 elektronen af, F neemt er slechts 1 op. Je hebt dus twee keer zoveel F nodig als Be. Be + 2F -> BeF2
4. Fluor is inderdaad een diatomisch molecuul: F2
5. Punt 4 betekent dat elk fluormolecuul je twee atomen fluor levert. Dus in plaats van Be + 2F -> BeF2 wordt de reactievergelijking Be+ F2 -> BeF2


en als ik deze laad reageren?
Fe (wilt 2 afstaan) As (wilt 3 erbij)
[ Bericht 2% gewijzigd door Cumshooter op 02-12-2009 13:14:16 ]
Fe (wilt 2 afstaan) As (wilt 3 erbij)
[ Bericht 2% gewijzigd door Cumshooter op 02-12-2009 13:14:16 ]
beter spijt van je daden, als spijt omdat je het hebt gelaten!!!


Moet ik nou jouw huiswerk gaan doen?quote:Op woensdag 2 december 2009 13:07 schreef Cumshooter het volgende:
en als ik deze laad reageren?
Fe (wilt 2 afstaan) As (wilt 3 erbij)
Als Fe 2 elektronen afstaat, welk ion ontstaat dan? En als As 3 elektronen opneemt, welk ion ontstaat dan?
Hoeveel positieve lading geeft ijzer je dan en hoeveel arseen? Breng dit in balans. Tegenover elke positieve lading moet een negatieve lading staan. Het aantal ionen dat je nodig hebt om dit te doen, bepaalt wat de molecuulformule van het product wordt.
Toon anders even wat je zelf hebt opgeschreven, dan wordt ook duidelijk wat je niet snapt.


dan had je niet zo'n einstein moeten zijnquote:Op woensdag 2 december 2009 13:22 schreef lyolyrc het volgende:
[..]
Moet ik nou jouw huiswerk gaan doen?Stap 1, 2 en 3 van het stappenplan is voldoende.
Als Fe 2 elektronen afstaat, welk ion ontstaat dan? En als As 3 elektronen opneemt, welk ion ontstaat dan?
Hoeveel positieve lading geeft ijzer je dan en hoeveel arseen? Breng dit in balans. Tegenover elke positieve lading moet een negatieve lading staan. Het aantal ionen dat je nodig hebt om dit te doen, bepaalt wat de molecuulformule van het product wordt.
Toon anders even wat je zelf hebt opgeschreven, dan wordt ook duidelijk wat je niet snapt.
beter spijt van je daden, als spijt omdat je het hebt gelaten!!!


Je notatie is abominabel, maar toch denk ik dat het idee er is.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


juist jaquote:Op woensdag 2 december 2009 14:48 schreef Iblis het volgende:
Je notatie is abominabel, maar toch denk ik dat het idee er is.
beter spijt van je daden, als spijt omdat je het hebt gelaten!!!


Scheikunde is mijn vakgebied, niet de natuurkunde.quote:Op woensdag 2 december 2009 14:45 schreef Cumshooter het volgende:
dan had je niet zo'n einstein moeten zijn
Het idee is er inderdaad: schrijf wel Fe3As2 i.p.v. Fe3As2.quote:[ afbeelding ]
Een simpel ezelsbruggetje dat je kunt onthouden is het volgende: je kunt de grootte van de lading en index verwisselen om het product te krijgen.
Fe2+: grootte van de lading = 2
As3- : grootte van de lading = 3
Dan wordt de index voor Fe 3 en voor As 2. Product: Fe3As2


Oke bedankt!!quote:Op woensdag 2 december 2009 15:06 schreef lyolyrc het volgende:
[..]
Scheikunde is mijn vakgebied, niet de natuurkunde.
[..]
Het idee is er inderdaad: schrijf wel Fe3As2 i.p.v. Fe3As2.
Een simpel ezelsbruggetje dat je kunt onthouden is het volgende: je kunt de grootte van de lading en index verwisselen om het product te krijgen.
Fe2+: grootte van de lading = 2
As3- : grootte van de lading = 3
Dan wordt de index voor Fe 3 en voor As 2. Product: Fe3As2
Heb ik btw zo de molecuul berekend?
beter spijt van je daden, als spijt omdat je het hebt gelaten!!!


Je uitkomst is juist, maar de uitwerking vind ik persoonlijk te complex en daarom te vatbaar voor fouten.quote:Op woensdag 2 december 2009 15:10 schreef Cumshooter het volgende:
Oke bedankt!!
Heb ik btw zo de molecuul berekend?
Ik doe niets anders dan:
3 * 2+ = 6+
2 * 3- = 6-
(zie je hoe ik de grootte van de lading en de index verwissel???) Positieve en negatieve lading zijn dan in balans. Hou wel de diatomaire stoffen in de gaten (F2, Cl2, Br2, I2, H2, N2,O2)!
Ik vraag me alleen af of je docent zo'n korte uitwerking goedkeurt...


ik zat al hetzelfde te denkenquote:Op woensdag 2 december 2009 15:21 schreef lyolyrc het volgende:
[..]
Je uitkomst is juist, maar de uitwerking vind ik persoonlijk te complex en daarom te vatbaar voor fouten.
Ik doe niets anders dan:
3 * 2+ = 6+
2 * 3- = 6-
(zie je hoe ik de grootte van de lading en de index verwissel???) Positieve en negatieve lading zijn dan in balans. Hou wel de diatomaire stoffen in de gaten (F2, Cl2, Br2, I2, H2, N2,O2)!
Ik vraag me alleen af of je docent zo'n korte uitwerking goedkeurt...
ik denk helaas van niet
beter spijt van je daden, als spijt omdat je het hebt gelaten!!!


Hey allemaal,
Ik ben bezig met het produceren van geluiden in(harmonische) geluiden binnen Matlab. Ik moet hier enkele vragen over beantwoorden, waarvan ik soms de achterliggende gedachte niet van snap:
1) Hoe hoor je het verschil tussen harmonische geluiden en in-harmonische geluiden?
2) Het schijnt dat ons menselijk gehoor bij een bepaald aantal Hz (laag getal) het verschil niet meer kan tussen harmonische geluiden en in-harmonische geluiden. Weet iemand waar dit omslagpunt ergens ligt?
3) Hoe komt het dat ons gehoor dat niet meer kan onderscheiden?
Als iemand hulp wil bieden; graag!
Ik ben bezig met het produceren van geluiden in(harmonische) geluiden binnen Matlab. Ik moet hier enkele vragen over beantwoorden, waarvan ik soms de achterliggende gedachte niet van snap:
1) Hoe hoor je het verschil tussen harmonische geluiden en in-harmonische geluiden?
2) Het schijnt dat ons menselijk gehoor bij een bepaald aantal Hz (laag getal) het verschil niet meer kan tussen harmonische geluiden en in-harmonische geluiden. Weet iemand waar dit omslagpunt ergens ligt?
3) Hoe komt het dat ons gehoor dat niet meer kan onderscheiden?
Als iemand hulp wil bieden; graag!