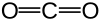SES School, Studie en Onderwijs
Wiskunde in de brugklas, Frans voor het examen of een studie Personeel en Arbeid? Moeilijke formulieren van DUO? Iets weten over studiefinanciering of studentenverenigingen? Dit is het forum voor leerkrachten, scholieren en studenten, van brugklas tot uni



opgelost dacht (veels) te moeilijk na 
[ Bericht 20% gewijzigd door WasMachinator op 19-11-2008 23:57:46 ]
[ Bericht 20% gewijzigd door WasMachinator op 19-11-2008 23:57:46 ]
Let me occupy your mind
As you do mine
As you do mine


Lijn trekken tussen de punten, hokjes tellen onder de grafiek = afgelegde weg in meters. (daar snelheid m/s en tijd in s is)
Dum de dum


Ik weet het al:quote:Op woensdag 19 november 2008 21:08 schreef Mr.Houdoe het volgende:
Hoe ziet de reactievergelijking er uit als bariumfosfaat verdwijnt in zoutzuur?
Ik kijk in Binas 45 maar daar zie ik onder PO4 3- alleen bij Na+ en K+ een g staan.
Ik dacht eigenlijk dat het splitste in ionen maar dan klopt het weer niet want er staat een s bij barium en fosfaat
EDIT: Ik denk nu dat het ook een zuur-base reactie kan zijn, moment
Klopt het dan dat PO4,3- reageert tot H3PO4?
Ba3(PO4)2 (s) + 6H3O+ (aq) --> 2H3PO4 (aq) + 3Ba2+ (aq) + 6H2O (l)
Voor als iemand het ook zocht


Ik moet laten zien dat de totale arbeid die wordt verricht door een Carnot-'engine' gelijk is aan de oppervlakte ingesloten door de Carnotcyclus in een PV-diagram.
Moet je dan laten zien dat de arbeid per stap gelijk is aan de oppervlakte ingesloten door die Carnotcyclus? Ik heb het gevoel dat ik dan twee dezelfde dingen laat zien...
Moet je dan laten zien dat de arbeid per stap gelijk is aan de oppervlakte ingesloten door die Carnotcyclus? Ik heb het gevoel dat ik dan twee dezelfde dingen laat zien...


integraal p dV is in het algemeen de verrichte arbeid, ook zonder Carnotcyclus.
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


Thnx, maar dat weet ik. Maar ik snap inmiddels de vraag al.quote:Op donderdag 20 november 2008 21:14 schreef GlowMouse het volgende:
integraal p dV is in het algemeen de verrichte arbeid, ook zonder Carnotcyclus.
De totale arbeid is W1+W2+W3+W4. W2 en W4 zijn 0 dus blijven de 1e en 3e term over. En die zijn gelijk aan de oppervlakte integraal.
Integraal van de bovenste lijn - integraal van onderste deel.


Heey,
Kan iemand mij uitleggen wat een dipool moment precies is, en hoe je het dipoolmoment berekent, want de uitleg in het boek is een beetje vaag.
Kan iemand mij uitleggen wat een dipool moment precies is, en hoe je het dipoolmoment berekent, want de uitleg in het boek is een beetje vaag.


quote:Op woensdag 26 november 2008 14:21 schreef Silentalarm het volgende:
Heey,
Kan iemand mij uitleggen wat een dipool moment precies is, en hoe je het dipoolmoment berekent, want de uitleg in het boek is een beetje vaag.
Of scheikunde?


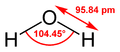
dipoolmoment is het verschijnsel wanneer er 2 polen zijn in een molecuul.
Bijvoorbeeld bij H2O:
De bovenkant is een beetje minnig, en de onderkant een beetje positief. Zuurstof (O 2-) is negatief, en Waterstof(H 1+) is positief
Bij een linear molecuul zoals CO2
de twee O's zijn hier ook minnig natuurlijk, maar omdat ze tegengesteld zijn heffen ze elkaar op, hier is er dus geen streep te trekken waar het + en - is, oftewel CO2 heeft geen dipoolmoment
Bijvoorbeeld bij H2O:
De bovenkant is een beetje minnig, en de onderkant een beetje positief. Zuurstof (O 2-) is negatief, en Waterstof(H 1+) is positief
Bij een linear molecuul zoals CO2
de twee O's zijn hier ook minnig natuurlijk, maar omdat ze tegengesteld zijn heffen ze elkaar op, hier is er dus geen streep te trekken waar het + en - is, oftewel CO2 heeft geen dipoolmoment
The whole problem with the world is that fools and fanatics are always so certain of themselves, and wiser people so full of doubt


Vluchtige terugvindpost hier. Vooral voor de kunst van het scheiden.
Achter-elkaar-bezochte-Ajax-thuiswedstrijden-meter: [b]29[/b].
[b]Laatste wedstrijd:[/b] FC Timişoara. [b]Volgende:[/b] ADO Den Haag.
Ray's Statshoekje - 2009/2010.
[b]Laatste wedstrijd:[/b] FC Timişoara. [b]Volgende:[/b] ADO Den Haag.
Ray's Statshoekje - 2009/2010.


Hey
ik weet dat het zo is maar kan er nu ff niet meer bij met mn hoofd. en wil weten hoe het zit. Dus hierbij mn vraag haha.
als je verschillende kolommen met water hebt die even hoog zijn en voor evenhoog gevuld zijn met water. Het maakt het niet uit hoe breed die kolom is de druk is in iedere kolom op de bodem gelijk. maar waaarom is dit ook al weer...?
het heeft toch iets met alzijdige druk van water te maken, maar ik kom er ff niet meer aan uiit.
Alvast bedankt!
ik weet dat het zo is maar kan er nu ff niet meer bij met mn hoofd. en wil weten hoe het zit. Dus hierbij mn vraag haha.
als je verschillende kolommen met water hebt die even hoog zijn en voor evenhoog gevuld zijn met water. Het maakt het niet uit hoe breed die kolom is de druk is in iedere kolom op de bodem gelijk. maar waaarom is dit ook al weer...?
het heeft toch iets met alzijdige druk van water te maken, maar ik kom er ff niet meer aan uiit.
Alvast bedankt!


Dat is de hydrostatische paradox, en dat heeft met de wet van Pascal te maken. Alzijdige druk is dacht ik meer voor iets wat je ín het water stopt.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Heeft iemand antwoorde informatica fundament module 1 ?
havo 4
havo 4
|| FOK!Stok || tatatatatataatatatattaaaaapiediedieuwtididipieuwpidibididi She said I'll throw myself away pididididum They're just photos after all! || Den Helder || Winnaar VBL Wijndal-award 2020: beste AZ-user! || Mijn concertstatistieken ||


Nou ik moet dus een verslag maken voor scheikunde, maar ik snap er geen zak van
Doel van de proef: Het aantal moleculen kristalwater bepalen in kristalsoda (Na2CO3 * x H2O)
Werkwijze:
We wogen 2,03 gram Na2CO3 * x H2O af, en brachten dit over in een maatkolf van 100 mL.
Deze vulden we aan met demiwater totdat de maatkolf ongeveer halfvol zat. Toen zwenkten we de kolf totdat het zout volledig was opgelost. We vulden daarna de maatkolf weer aan met demiwater, tot de aangegeven streep, zodat er 100 mL oplossing was. De oplossing moest toen nog gehomogeniseerd worden, dit deden we door 10 keer de maatkolf om te draaien.
We vulden een maatbeker met de oplossing, aangezien het gepipetteerd moest worden, en je niet uit een maatkolf mag pipetteren. We pipetteerden 10,00 mL van de oplossing in een erlenmeyer.
De erlenmeyer werd onder de buret geplaatst, na er eerst 2 druppels indicator (methyloranje) bij te hebben gevoegd, en we titreerden met 0,100 M HCl-oplossing. Deze titratie voerden we tweemaal uit, om een goed resultaat te verkrijgen.
Maar nu is de vraag: Hoeveel is X in Na2CO3 * x H2O?
Na2CO3 * x H2O was dus 2,03 gram, opgelost in 100mL demiwater, daar 10mL van in een erlenmeyer, die onder de buret met 2 druppeltjes methyloranje, en dan uit de buret heb ik 16,1 mL HCl oplossing toegevoegd totdat de kleur veranderde naar lichtroze.
1 mol HCl = 36,46 gram
En de HCl oplossing die ik dus toevoegde was 16,1 mL ( 0,100 M)
Wie kan mij helpen?
Doel van de proef: Het aantal moleculen kristalwater bepalen in kristalsoda (Na2CO3 * x H2O)
Werkwijze:
We wogen 2,03 gram Na2CO3 * x H2O af, en brachten dit over in een maatkolf van 100 mL.
Deze vulden we aan met demiwater totdat de maatkolf ongeveer halfvol zat. Toen zwenkten we de kolf totdat het zout volledig was opgelost. We vulden daarna de maatkolf weer aan met demiwater, tot de aangegeven streep, zodat er 100 mL oplossing was. De oplossing moest toen nog gehomogeniseerd worden, dit deden we door 10 keer de maatkolf om te draaien.
We vulden een maatbeker met de oplossing, aangezien het gepipetteerd moest worden, en je niet uit een maatkolf mag pipetteren. We pipetteerden 10,00 mL van de oplossing in een erlenmeyer.
De erlenmeyer werd onder de buret geplaatst, na er eerst 2 druppels indicator (methyloranje) bij te hebben gevoegd, en we titreerden met 0,100 M HCl-oplossing. Deze titratie voerden we tweemaal uit, om een goed resultaat te verkrijgen.
Maar nu is de vraag: Hoeveel is X in Na2CO3 * x H2O?
Na2CO3 * x H2O was dus 2,03 gram, opgelost in 100mL demiwater, daar 10mL van in een erlenmeyer, die onder de buret met 2 druppeltjes methyloranje, en dan uit de buret heb ik 16,1 mL HCl oplossing toegevoegd totdat de kleur veranderde naar lichtroze.
1 mol HCl = 36,46 gram
En de HCl oplossing die ik dus toevoegde was 16,1 mL ( 0,100 M)
Wie kan mij helpen?


96% is duurder en met 70% gaat alles ook wel dood.quote:
En over je hypothese. Een opgezwollen bacterie lijkt mij niet direct een optimale conditie. Je moet denk ik vertellen waarom water minder goed reinigt dan andere middelen. Water dood een bacterie niet en je andere middelen waarschijnlijk wel.


Alweer een tijdje geleden dit, volgens mij is het in deze richting.
Je gebruikt 1.61mmol HCl. Probeer te achterhalen hoeveel mol Na2CO3xH20 je hebt gebruikt.Kijk naar de verhouding van de reactie tussen de twee stoffen (1 mol hcl reageert met x mol Na2CO3xH20) en daaruit kun je afleiden hoeveel mol Na2CO3xH20 je hebt gebruikt. Met behulp van de molecuulmassa die je zelf kunt opstellen uit de losse componenten kun je het antwoord halen.
Even heel kort maar ik hoop dat dit je op weg helpt. Als je weet hoeveel mol Na2CO3 het is, kun je uitrekenen hoeveel H2O erbij zit. Bereken het molecuulgewicht (som losse atoomgewichten) dan zie je vanzelf hoeveel H2O het is.
Het kan vast veel makkelijker
Je gebruikt 1.61mmol HCl. Probeer te achterhalen hoeveel mol Na2CO3xH20 je hebt gebruikt.Kijk naar de verhouding van de reactie tussen de twee stoffen (1 mol hcl reageert met x mol Na2CO3xH20) en daaruit kun je afleiden hoeveel mol Na2CO3xH20 je hebt gebruikt. Met behulp van de molecuulmassa die je zelf kunt opstellen uit de losse componenten kun je het antwoord halen.
Even heel kort maar ik hoop dat dit je op weg helpt. Als je weet hoeveel mol Na2CO3 het is, kun je uitrekenen hoeveel H2O erbij zit. Bereken het molecuulgewicht (som losse atoomgewichten) dan zie je vanzelf hoeveel H2O het is.
Het kan vast veel makkelijker
"Happiness is not getting more, but wanting less"


Edit, wilde helpen, maar aangezien de vraag al van twee weken terug is heeft het denk ik weinig zin...
You don't have to know why you do something to stop doing it. All you have to do is to take a close look at what you are actually doing and decide to stop doing it for that moment!"


Help mij dan maar 
Bufferoplossing van 1 L met daarin 0,10 mol azijnzuur en 0,20 mol natriumacetaat opgelost. De pH = 5,1, dat is nog vrij eenvoudig.
Nu heb ik een voorbeeld waarbij er 0,010 mol zoutzuur aan deze oplossing wordt toegevoegd. Nou, dan krijg je dus een oplossing van 0,19 M CH3COO- en 0,11 M CH3COOH. Maar dan, de evenwichtsvoorwaarde:

En ik vraag mij af waarom er in evenwicht nog steeds die 0.19 en 0.11 hebt. Zou je niet de vergelijking op moeten lossen?VWO bovenbouw, Chemie, Scheikunde 1 deel 2, Wolters Noordhoff, blz 221
op moeten lossen?VWO bovenbouw, Chemie, Scheikunde 1 deel 2, Wolters Noordhoff, blz 221
Bufferoplossing van 1 L met daarin 0,10 mol azijnzuur en 0,20 mol natriumacetaat opgelost. De pH = 5,1, dat is nog vrij eenvoudig.
Nu heb ik een voorbeeld waarbij er 0,010 mol zoutzuur aan deze oplossing wordt toegevoegd. Nou, dan krijg je dus een oplossing van 0,19 M CH3COO- en 0,11 M CH3COOH. Maar dan, de evenwichtsvoorwaarde:
En ik vraag mij af waarom er in evenwicht nog steeds die 0.19 en 0.11 hebt. Zou je niet de vergelijking
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


Daar heb je op zich gelijk in, maar in het eerste voorbeeld heb je gezien, dat de x die daar gevonden is zo klein was dat hij te verwaarlozen was. Aangezien je het nog steeds over hetzelfde evenwicht hebt, kan je er vanuit gaan dat dit bij deze evenwichtsvoorwaarde ook zo is, vandaar dat ze die stap overslaan. Je mag x verwaarlozen als hij minder dan 10% is van je oorspronkelijke concentratie, en dat is hier zeker weten het geval.
You don't have to know why you do something to stop doing it. All you have to do is to take a close look at what you are actually doing and decide to stop doing it for that moment!"


Thx, zoiets vermoedde ik al, maar omdat het boek erover niets vermeldde (en daarvoor wel deed, tot de controle of x inderdaad verwaarloosbaar klein was toe) begon ik te twijfelen. Ben ik gelukkig nog niet seniel 
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


Komt ook denk ik omdat ze bij dit voorbeeld alleen maar willen laten zien dat de pH nauwelijks veranderd met toevoeging van wat zuur.. Het is meer een verstoring van een evenwichtsom, dan echt de pH van de bufferoplossing bepalen. Ik denk dat ze het daarom ineens weglaten..
You don't have to know why you do something to stop doing it. All you have to do is to take a close look at what you are actually doing and decide to stop doing it for that moment!"


Daarom heet het dan ook een bufferoplossingquote:Op maandag 15 december 2008 20:48 schreef teigan het volgende:
Komt ook denk ik omdat ze bij dit voorbeeld alleen maar willen laten zien dat de pH nauwelijks veranderd met toevoeging van wat zuur..
The whole problem with the world is that fools and fanatics are always so certain of themselves, and wiser people so full of doubt


Klopt, maar vandaar dat ze dus de hele benadering met x weglaten. Eigenlijk best slordig..quote:Op zaterdag 20 december 2008 19:46 schreef fusionfake het volgende:
[..]
Daarom heet het dan ook een bufferoplossing
You don't have to know why you do something to stop doing it. All you have to do is to take a close look at what you are actually doing and decide to stop doing it for that moment!"


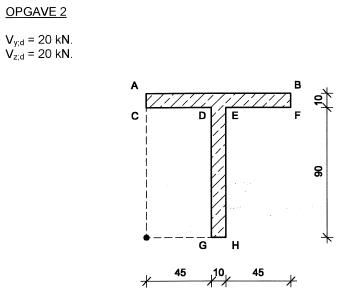
Mijn mechanica vraag gaat over schuifspanningsverloop van het bovenstaande profiel, het gaat mij om het berekenen van het schuifspanningsverloop van DG lijf en DG flens t.o.v. de z-as.
Ik weet niet welke axiaal oppervlakte momenten en afschuifbreedtes ik moet pakken in de formule:
Schuifspanningverloop t.o.v. de z-as = (Vy . S) / (b . Iz)
Gevonden waarden:
- Iz = 840833 mm4
- Zzw (afstand tussen de z-as linkerkant en z-positie zwaartepunt) = 50 mm
- Yzw (afstand tussen de y-as onderkant en y-positie zwaartepunt) = 71,32 mm
S = axiaal oppervlakte moment (mm3) .... formule: Sz = A1 . bzw1 + A2 . azw2... + of Sy = A1 . azw1 + A2 . azw2... +
This signature was placed by Mr_Booze, and not FA ;)