W&T Wetenschap & Technologie
Een plek om te discussiëren over wetenschappelijke onderwerpen, wetenschappelijke problemen, technologische projecten en grootse uitvindingen.



Voor de vorming van eiwitten in cellen is dit inderdaad de juist uitleg. De holte in het ribosoom staat geen vorming van andere bindingen toe, dan de peptidebinding. Dit is een kwestie van een holte met de juiste vorm en zorgvuldige coördinatie van de betrokken groepen in de holte door het ribosoom. De R-zijketen van aminozuren kan ook COOH- of NH2-groepn bevatten, maar het ribosoom verhindert dat deze kunnen meereageren.quote:Op zondag 11 april 2010 22:50 schreef Chemiu het volgende:
De aminozuren worden aan elkaar geplakt in een bepaalde omgeving, die ervoor zorgt dat deze groepen (de NH2 en COOH) wel bij elkaar kunnen komen, en andere groepen niet. Min of meer (ben vooral op de hoogte hoe eiwitten gevormd worden buiten de levende cel, en hoeveel moeite chemici daarvoor moeten doen).
Buiten de cel kunnen eiwitten gevormd worden met behulp van solid phase synthesis. Hierbij wordt een eiwit vanaf dragermateriaal aminozuur voor aminozuur opgebouwd door gebruik te maken van beschermde-groepstategieën. Dit is een interessant onderwerp, maar totaal geen stof voor beginners!
In de praktijk is volgens mij zelfs zo dat er niet een echt watermolecuul wordt afgesplitst, maar juist twee ionen, namelijk H+ en OH-.quote:Als de NH2 en de COOH met elkaar reageren, vormen ze een peptidebinding die bestaat uit een NH-CO. Je houdt dan een H over (NH2 wordt NH) en een OH (COOH wordt CO). Die H en OH vormen samen een H2O = water. Daarom 'verdwijnt' er een watermolecuul als NH2 en COOH met elkaar reageren.
Edit: ik zie nu dat ik ongeveer hetzelfde heb gezegd als degene waarop je reageerde, dus ik betwijfel of mijn uitleg wel nuttig is dan.


Zoals ik al in mijn vorige post zei, ik betwijfel of dit laatste werkelijk het geval is. Netto gaat er water uit, maar ik denk dat het realistisch is om aan te nemen dat er zich OH- en H+ afsplitst.quote:Op maandag 12 april 2010 00:24 schreef Gray het volgende:
Dat komt omdat deze twee sterk reactieve groepen zijn door vrije elektronen. Zo gaan bij COOH de elektronen continu van O -> C -> OH en terug en heeft stikstof ongebonden elektronen die door de gehele groep gaan.
Daarbij komt nog dat O en N sterker trekken aan de elektronen dan de H'tjes waardoor de H'tjes enigzins los zitten. De O van OH reageert met een 'los' H'tje van de NH2 en dan hou je water over.
Het klopt dat er onder fysiologische omstandigheden eerder sprake is van een zwitterion. Maar ik vraag me wel af of COO- en NH3+ reactiever zijn. Kun je dit toelichten?quote:Ook heeft een aminozuur een groot deel van de tijd geen COOH en NH2, maar COO- en NH3+. Dit reageert zoals je kan verwachten nog sneller. Een aminozuur behoort dan ook tot de scheikundige groep van de zogeheten 'zwitter'-ionen.


Wat je zegt is waar, aminozuren komen in het lichaam meestal voor als zwitterion. Maar buiten de cel reageert dat juist helemaal niet sneller dan de ongeladen variant. Chemici moeten een activerende stof toevoegen (DCC) om de reactie aan de gang te krijgen. Hier diep op in gaan zonder voorkennis is imho onmogelijk, heeft te maken met vertrekkende groepen en reactiemechanismen. Of iig, ik kan het niet makkelijk uitleggen, misschien dat een van de anderen hier het wel kanquote:Op maandag 12 april 2010 00:24 schreef Gray het volgende:
Ook heeft een aminozuur een groot deel van de tijd geen COOH en NH2, maar COO- en NH3+. Dit reageert zoals je kan verwachten nog sneller. Een aminozuur behoort dan ook tot de scheikundige groep van de zogeheten 'zwitter'-ionen.
Ah het ribosoom is de holte. Ik wist het niet zeker, had daarom maar weggelaten wat die 'omgeving' precies vormde.quote:Op maandag 12 april 2010 11:25 schreef lyolyrc het volgende:
[..]
Voor de vorming van eiwitten in cellen is dit inderdaad de juist uitleg. De holte in het ribosoom staat geen vorming van andere bindingen toe, dan de peptidebinding. Dit is een kwestie van een holte met de juiste vorm en zorgvuldige coördinatie van de betrokken groepen in de holte door het ribosoom. De R-zijketen van aminozuren kan ook COOH- of NH2-groepn bevatten, maar het ribosoom verhindert dat deze kunnen meereageren.
Buiten de cel kunnen eiwitten gevormd worden met behulp van solid phase synthesis. Hierbij wordt een eiwit vanaf dragermateriaal aminozuur voor aminozuur opgebouwd door gebruik te maken van beschermde-groepstategieën. Dit is een interessant onderwerp, maar totaal geen stof voor beginners!
Eiwitten buiten de cel maken is echt een hel voor chemici inderdaad


Je hebt gelijk, al dit is vrijwel altijd het geval. Water bestaat sowieso voor een deel uit OH- en H+. 'Puur' water bestaat niet. Het is een optelsom van H2O, OH- en H+.quote:Op maandag 12 april 2010 11:31 schreef lyolyrc het volgende:
[..]
Zoals ik al in mijn vorige post zei, ik betwijfel of dit laatste werkelijk het geval is. Netto gaat er water uit, maar ik denk dat het realistisch is om aan te nemen dat er zich OH- en H+ afsplitst.
[..]
COO- is zeer sterk reactief door de extra vrije elektronen. NH3+ levert het substraat nodig voor deze reactie. Het reactiemechanisme wordt overigens gewoon met NH2 en COOH geschreven, anders kan de nitride groep volgens de gestelde voorwaarden niet reageren, want geen vrij elektronenpaar. Als je het héél erg lief vraagt wil ik wel een reactiemechanisme uitschrijven. Of opzoeken.quote:Het klopt dat er onder fysiologische omstandigheden eerder sprake is van een zwitterion. Maar ik vraag me wel af of COO- en NH3+ reactiever zijn. Kun je dit toelichten?


COO- is niet zo heel erg reactief omdat het gestabiliseerd wordt door conjugatie (negatieve lading is verdeeld over de beide bindingen. Dit is de sterkste soort stabilisatie). Daarbij is in deze reactie de COO- het elektrofiel (datgene wat elektronen gaan ontvangen). Een negatieve lading op een elektrofiel maakt het nog minder reactief (want het heeft al een overschot aan elektronen, zit niet op nog meer extra te wachten. Die extra elektronen waar jij het over hebt werken de reactie alleen maar tegen in dit geval). NH3+ is het nucleofiel, terwijl het een positieve lading heeft (en dus niet nog meer elektronen kwijt wil).quote:Op dinsdag 13 april 2010 08:34 schreef Gray het volgende:
[..]
Je hebt gelijk, al dit is vrijwel altijd het geval. Water bestaat sowieso voor een deel uit OH- en H+. 'Puur' water bestaat niet. Het is een optelsom van H2O, OH- en H+.
[..]
COO- is zeer sterk reactief door de extra vrije elektronen. NH3+ levert het substraat nodig voor deze reactie. Het reactiemechanisme wordt overigens gewoon met NH2 en COOH geschreven, anders kan de nitride groep volgens de gestelde voorwaarden niet reageren, want geen vrij elektronenpaar. Als je het héél erg lief vraagt wil ik wel een reactiemechanisme uitschrijven. Of opzoeken.
Heb je nog het probleem met de vertrekkende groep: van COO- zou een O2- moeten vertrekken om de peptide binding te maken. Dat is absoluut geen goede vertrekkende groep, omdat het die minladingen niet goed kan stabiliseren. Daarom voegen chemici DCC (maar er zijn ook andere stoffen mogelijk) toe: dat gaan aan de O die moet vertrekken zitten en stabiliseert de negatieve lading waardoor het wel een goede vertrekkende groep wordt.
Ik ken het reactiemechanisme, maar kan het even niet zo snel vinden. Misschien dat ik vanmiddag mn aantekeningen inscan.
[ Bericht 1% gewijzigd door Chemiu op 13-04-2010 11:23:10 ]


En die kun je vinden op het ruw endoplasmatisch reticulum.quote:Op dinsdag 13 april 2010 00:12 schreef Chemiu het volgende:
Wat je zegt is waar, aminozuren komen in het lichaam meestal voor als zwitterion. Maar buiten de cel reageert dat juist helemaal niet sneller dan de ongeladen variant. Chemici moeten een activerende stof toevoegen (DCC) om de reactie aan de gang te krijgen. Hier diep op in gaan zonder voorkennis is imho onmogelijk, heeft te maken met vertrekkende groepen en reactiemechanismen. Of iig, ik kan het niet makkelijk uitleggen, misschien dat een van de anderen hier het wel kan.
[..]
Ah het ribosoom is de holte. Ik wist het niet zeker, had daarom maar weggelaten wat die 'omgeving' precies vormde.
En dan heb je het nog niet eens over de zuiverheid. Als je te lange ketens probeert te maken, krijg je door het onherroepelijk optreden van fouten een mengelmoesje waar je niet blij van wordt.quote:Eiwitten buiten de cel maken is echt een hel voor chemici inderdaad. Beschermgroep erop, weer eraf, nieuwe erop, weer eraf etc. En allemaal onder andere omstandigheden omdat je niet de verkeerde groepen eraf wil slopen (de beschermgroepen op de -COOH of -NH2 in de zijketens moeten erop blijven zitten). Wat het ribosoom in een keer kan, hebben chemici ongelooflijk veel verschillende stappen voor nodig. Wel een van de interessantste onderwerpen die ik tot nu toe gehad heb.
Ik zat aan dit mechanisme te denken en dan heb je niets aan NH3, want die groep heeft geen vrij elektronenpaar:quote:Op dinsdag 13 april 2010 08:34 schreef Gray het volgende:
Je hebt gelijk, al dit is vrijwel altijd het geval. Water bestaat sowieso voor een deel uit OH- en H+. 'Puur' water bestaat niet. Het is een optelsom van H2O, OH- en H+.
[..]
COO- is zeer sterk reactief door de extra vrije elektronen. NH3+ levert het substraat nodig voor deze reactie. Het reactiemechanisme wordt overigens gewoon met NH2 en COOH geschreven, anders kan de nitride groep volgens de gestelde voorwaarden niet reageren, want geen vrij elektronenpaar. Als je het héél erg lief vraagt wil ik wel een reactiemechanisme uitschrijven. Of opzoeken.
[ Bericht 0% gewijzigd door lyolyrc op 13-04-2010 17:40:05 (ontbrekend elektronpaar) ]


De kracht van enzymen 
En mochten we vallen dan is het omhoog. - Krang (uit: Pantani)
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna
My favourite music is the music I haven't yet heard - John Cage
Water: ijskoud de hardste - Gehenna


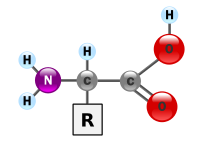
Wat geven de minnetjes en plusjes aan?quote:Op maandag 12 april 2010 00:24 schreef Gray het volgende:
Ook heeft een aminozuur een groot deel van de tijd geen COOH en NH2, maar COO- en NH3+.
In dit geval zie ik dat er een H van COOH naar NH2 is gegaan, welk "groot deel van de tijd" gebeurt dat? Is dat een soort vrije waterstofatoom die soms van plaats vewisseld, en heeft het nog een bepaalde functie?
Oh, en wat geeft de dubbele verbinding aan, in zo'n molecuulplaatje?
Ik zie een dubbele lijn tussen C en O, en bij de rest maar een enkele.
Géén kloon van tvlxd!


De minnetjes en plusjes geven lading aan van de groepen. De groep met de pluslading komt een elektron tekort, de groep met de minlading heeft een elektron te veel. Het is geen H die 'van plaats verwisselt', maar een H+. Een zure groep staat H+ gemakkelijk af, in dit geval is dat COOH. Daardoor blijft er COO- over. De NH2-groep neemt juist graag die H+ op, zo'n groep noemen we basisch. Er onstaat dan NH3+. Dit gedrag komt voort uit de eigenschap van de groepen en de zuurtegraad van de cel. In een veel zuurdere omgeving, bijvoorbeeld de maag, heb je NH3+ en COOH, in een heel weinig zure omgeving heb je juist NH2 en COO-.quote:Op dinsdag 13 april 2010 16:48 schreef Montov het volgende:
Wat geven de minnetjes en plusjes aan?
In dit geval zie ik dat er een H van COOH naar NH2 is gegaan, welk "groot deel van de tijd" gebeurt dat? Is dat een soort vrije waterstofatoom die soms van plaats vewisseld, en heeft het nog een bepaalde functie?
Een dubbel lijntje betekent dat er een dubbele binding is tussen twee atomen. Een binding tussen atomen ontstaat als ze een elektronpaar gaan delen. Een zo'n lijntje staat hier voor een elektronpaar. C en O delen in dit geval twee elektronparen.quote:Oh, en wat geeft de dubbele verbinding aan, in zo'n molecuulplaatje?
[ afbeelding ]
Ik zie een dubbele lijn tussen C en O, en bij de rest maar een enkele.


Klopt. Ik bedoelde niet dat O-2 zou vertrekken, maar dat er een H+ snel bijkomt. Al is dat in deze reactie niet belangrijk. Maar COO- gaat hier toch geen elektronen erbij krijgen? Het bindt een H+ en vervolgens nog een waterstof van de nitride groep, wat betekent dat het meer van zijn elektronen gaat delen.quote:Op dinsdag 13 april 2010 11:16 schreef Chemiu het volgende:
[..]
COO- is niet zo heel erg reactief omdat het gestabiliseerd wordt door conjugatie (negatieve lading is verdeeld over de beide bindingen. Dit is de sterkste soort stabilisatie). Daarbij is in deze reactie de COO- het elektrofiel (datgene wat elektronen gaan ontvangen). Een negatieve lading op een elektrofiel maakt het nog minder reactief (want het heeft al een overschot aan elektronen, zit niet op nog meer extra te wachten. Die extra elektronen waar jij het over hebt werken de reactie alleen maar tegen in dit geval). NH3+ is het nucleofiel, terwijl het een positieve lading heeft (en dus niet nog meer elektronen kwijt wil).
Heb je nog het probleem met de vertrekkende groep: van COO- zou een O2- moeten vertrekken om de peptide binding te maken. Dat is absoluut geen goede vertrekkende groep, omdat het die minladingen niet goed kan stabiliseren. Daarom voegen chemici DCC (maar er zijn ook andere stoffen mogelijk) toe: dat gaan aan de O die moet vertrekken zitten en stabiliseert de negatieve lading waardoor het wel een goede vertrekkende groep wordt.
Ik ken het reactiemechanisme, maar kan het even niet zo snel vinden. Misschien dat ik vanmiddag mn aantekeningen inscan.
Organische chemie is alweer enkele jaren geleden voor mij en is bij mijn huidig onderzoek (nog) niet nodig. Dank je voor de opfrisbeurt.
|
|