SES School, Studie en Onderwijs
Wiskunde in de brugklas, Frans voor het examen of een studie Personeel en Arbeid? Moeilijke formulieren van DUO? Iets weten over studiefinanciering of studentenverenigingen? Dit is het forum voor leerkrachten, scholieren en studenten, van brugklas tot uni



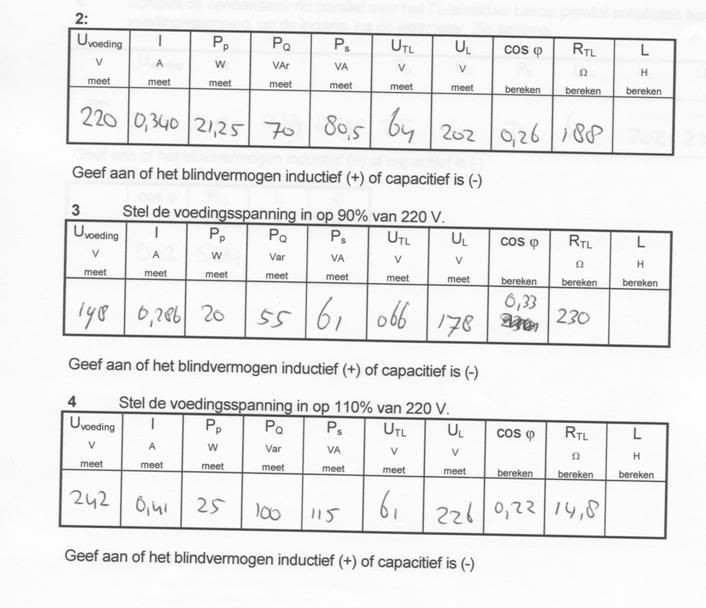
Kan ik mbv deze formules L te weten komen?
[ Bericht 20% gewijzigd door GoodGawd op 07-04-2010 22:36:49 ]
[ Bericht 20% gewijzigd door GoodGawd op 07-04-2010 22:36:49 ]
Blues ain't nothing but a good man feeling bad...


Z² = R² + X²
X = 2Pi* f * L
cos phi = R / Z
Dit zou je moeten kunnen herschrijven tot je L krijgt.
X = 2Pi* f * L
cos phi = R / Z
Dit zou je moeten kunnen herschrijven tot je L krijgt.
'To alcohol, the cause of and the solution to all of life's problems' - Homer J. Simpson


Ik ben eruit, merciquote:Op woensdag 7 april 2010 22:38 schreef MichielPH het volgende:
Z² = R² + X²
X = 2Pi* f * L
cos phi = R / Z
Dit zou je moeten kunnen herschrijven tot je L krijgt.
Blues ain't nothing but a good man feeling bad...


Heeft iemand hier verstand van Elektronica? If yes, mijn vraagje:
Kan je tussen Blind vermogen, werkelijk vermogen en schijnbaar vermogen onderling afleiden of het blind vermogen inductief is?
Kan je tussen Blind vermogen, werkelijk vermogen en schijnbaar vermogen onderling afleiden of het blind vermogen inductief is?
Blues ain't nothing but a good man feeling bad...


De volgende irreversibele gasfase reactie wordt isotherm uitgevoerd in een buisreactor:
A → P + X
De reactie is tweede orde in A. Bereken de benodigde buislengte om 60% conversie te halen.
Gegevens:
k2 = 5.0 dm3/mol.s
CA,0 = 0.2 mol/dm3
v,0 = 1.0 dm3/s
Ac = 1.0 dm2
Nu had ik het volgende bedacht:
molbalans:
- Fa,0 * dX/dV = -k * Ca0^2(1-X)^2 omzetten naar:
dX/(1-X)^2 = k * Ca0^2 / Fa0 * dV differentiaal wegwerken:
X/1-X = k * Ca0^2 * V / Fa0 invullen geeft:
0.6/(1-0.6) = 1.5
1.5 = 5 * 0.2^2 * V / 0.2 en dit geeft aan dat 1.5 = 0.2 * V / 0.2 dus V = 1.5 dm^3
Maar hoe kom ik nou aan de lengte van de buis???
EDIT:
Nog een probleem:
De reversibele vloeistoffase reactie:
A ↔ P
Is eerste orde in zowel A als P. De reactie wordt isotherm uitgevoerd in een batch reactor met een volume van 2 m3. Op het tijdstip t = 0 geldt dat CA,0 = 2000 mol/m3 en CP,0 = 0 mol/m3.
Gegevens:
k1 = 1.4 x 10-3 s-1
k-1 = 0.7 x 10-3 s-1
Evenwichtsconversie = 67%
Bereken het tijdstip waarop de conversie van A 10% afwijkt van de evenwichtsconversie.
-ra = k1 * (Ca - Cp / Kc) vervangen Ca = Ca0*(1-X) en Cp = Ca0*X
molbalans en kinetiek combineren:
-k1 * (Ca0*(1-X) - Ca0 * X / Kc) = dCa0*(1-X) / dt tijd naar links brengen:
-k1*dt = dCa0*(1-X) / (Ca0*(1-X) - Ca0*X / Kc) hoe nu verder?
[ Bericht 34% gewijzigd door karelsmits87 op 09-04-2010 15:45:10 ]
A → P + X
De reactie is tweede orde in A. Bereken de benodigde buislengte om 60% conversie te halen.
Gegevens:
k2 = 5.0 dm3/mol.s
CA,0 = 0.2 mol/dm3
v,0 = 1.0 dm3/s
Ac = 1.0 dm2
Nu had ik het volgende bedacht:
molbalans:
- Fa,0 * dX/dV = -k * Ca0^2(1-X)^2 omzetten naar:
dX/(1-X)^2 = k * Ca0^2 / Fa0 * dV differentiaal wegwerken:
X/1-X = k * Ca0^2 * V / Fa0 invullen geeft:
0.6/(1-0.6) = 1.5
1.5 = 5 * 0.2^2 * V / 0.2 en dit geeft aan dat 1.5 = 0.2 * V / 0.2 dus V = 1.5 dm^3
Maar hoe kom ik nou aan de lengte van de buis???
EDIT:
Nog een probleem:
De reversibele vloeistoffase reactie:
A ↔ P
Is eerste orde in zowel A als P. De reactie wordt isotherm uitgevoerd in een batch reactor met een volume van 2 m3. Op het tijdstip t = 0 geldt dat CA,0 = 2000 mol/m3 en CP,0 = 0 mol/m3.
Gegevens:
k1 = 1.4 x 10-3 s-1
k-1 = 0.7 x 10-3 s-1
Evenwichtsconversie = 67%
Bereken het tijdstip waarop de conversie van A 10% afwijkt van de evenwichtsconversie.
-ra = k1 * (Ca - Cp / Kc) vervangen Ca = Ca0*(1-X) en Cp = Ca0*X
molbalans en kinetiek combineren:
-k1 * (Ca0*(1-X) - Ca0 * X / Kc) = dCa0*(1-X) / dt tijd naar links brengen:
-k1*dt = dCa0*(1-X) / (Ca0*(1-X) - Ca0*X / Kc) hoe nu verder?
[ Bericht 34% gewijzigd door karelsmits87 op 09-04-2010 15:45:10 ]


Even een snelle en hele domme vraag van me.... want ik ben het echt even kwijt.
Wanneer ik een evewichtsreactie heb.. en tijdens het evenwicht zijn de molaire verdelingen als volgt is: 0,02 <--> 0,04 + 0,04
En hier moet ik de K van uitrekenen.
Dan schrijf je de evenwichtsconstante op: K = [0,04] * [0,04] / [0,02] = 0,08
Maar dit klopt niet, want het antwoord zou 4 moeten zijn.....
PS: De reactie verloopt in een volume van 2 liter!
Wanneer ik een evewichtsreactie heb.. en tijdens het evenwicht zijn de molaire verdelingen als volgt is: 0,02 <--> 0,04 + 0,04
En hier moet ik de K van uitrekenen.
Dan schrijf je de evenwichtsconstante op: K = [0,04] * [0,04] / [0,02] = 0,08
Maar dit klopt niet, want het antwoord zou 4 moeten zijn.....
PS: De reactie verloopt in een volume van 2 liter!


Heb je niet meer info? Want hiermee kan ik je niet echt van advies dienen.quote:Op vrijdag 9 april 2010 14:33 schreef horned_reaper het volgende:
Even een snelle en hele domme vraag van me.... want ik ben het echt even kwijt.
Wanneer ik een evewichtsreactie heb.. en tijdens het evenwicht zijn de molaire verdelingen als volgt is: 0,02 <--> 0,04 + 0,04
En hier moet ik de K van uitrekenen.
Dan schrijf je de evenwichtsconstante op: K = [0,04] * [0,04] / [0,02] = 0,08
Maar dit klopt niet, want het antwoord zou 4 moeten zijn.....
PS: De reactie verloopt in een volume van 2 liter!


We beschouwen nu de volgende evenwichtsreactie:
2 HI (g) <--> H2 (g) + I2 (g) met ∆H > 0
In een afgesloten reactievat (volume = 2 liter) wordt op tijdstip t0 0,10 mol HI gebracht. Na instelling van het evenwicht op tew blijkt er 0,04 mol I2 te zijn ontstaan.
b. Bereken de evenwichtsconstante K.
2 HI (g) <--> H2 (g) + I2 (g) met ∆H > 0
In een afgesloten reactievat (volume = 2 liter) wordt op tijdstip t0 0,10 mol HI gebracht. Na instelling van het evenwicht op tew blijkt er 0,04 mol I2 te zijn ontstaan.
b. Bereken de evenwichtsconstante K.


Op t0 heb je 0,10 mol HI, en 0 mol van zowel H2 als I2. Het eerste is gegeven, het andere weet je. Bij evenwichtsinstelling is er 0,04 mol I2 gevormd. Je had zelf al correct beredeneerd dat er dan ook 0,04 mol H2 gevormd moet zijn en dat 0,04 mol I2 en H2 gevormd wordt uit 0,08 mol HI, zodat er bij evenwicht nog maar 0,02 mol HI over is.
Het probleem zit hem in je berekening van het evenwicht, dat moet namelijk zijn: K = [H2]*[I2]/[HI]2. Je vergeet het kwadraat! Uitrekenen van dit evenwicht geeft 0,042/0,022 = 4
Het probleem zit hem in je berekening van het evenwicht, dat moet namelijk zijn: K = [H2]*[I2]/[HI]2. Je vergeet het kwadraat! Uitrekenen van dit evenwicht geeft 0,042/0,022 = 4


Ik zie het nuquote:Op vrijdag 9 april 2010 14:53 schreef lyolyrc het volgende:
Op t0 heb je 0,10 mol HI, en 0 mol van zowel H2 als I2. Het eerste is gegeven, het andere weet je. Bij evenwichtsinstelling is er 0,04 mol I2 gevormd. Je had zelf al correct beredeneerd dat er dan ook 0,04 mol H2 gevormd moet zijn en dat 0,04 mol I2 en H2 gevormd wordt uit 0,08 mol HI, zodat er bij evenwicht nog maar 0,02 mol HI over is.
Het probleem zit hem in je berekening van het evenwicht, dat moet namelijk zijn: K = [H2]*[I2]/[HI]2. Je vergeet het kwadraat! Uitrekenen van dit evenwicht geeft 0,042/0,022 = 4
Dankjewel


Dan nog even een snelle.... het blijkt maar weer dat ik echt een chemicus ben van de biochemie en de koolstofchemie 
Bereken hoeveel gram ijzerfosfaat, Fe3(PO4)2, je moet afwegen om 200 ml ijzerfosfaat-oplossing te maken die 150 mmol Fe2+-ionen per liter bevat.
Nou, de massa van Fe3(PO4)2 = 357,4 g/mol als je die waarden optelt uit het periodiek systeem...
Als er dus 357,4 gram in 1 mol zit... zou dit volgens mij ook moeten betekenen dat je 357,4 gram Fe3(PO)4 moet oplossen in 1 liter water om 1M te krijgen...
Waarna ik zeg, 357,4*0,15 = 53,61 g/150mmol
Maar blijkbaar ga ik hier al helemaal de mist in omdat het uiteindelijk antwoord toch echt 3,57g hoort te zijn....
omdat het uiteindelijk antwoord toch echt 3,57g hoort te zijn....
Bereken hoeveel gram ijzerfosfaat, Fe3(PO4)2, je moet afwegen om 200 ml ijzerfosfaat-oplossing te maken die 150 mmol Fe2+-ionen per liter bevat.
Nou, de massa van Fe3(PO4)2 = 357,4 g/mol als je die waarden optelt uit het periodiek systeem...
Als er dus 357,4 gram in 1 mol zit... zou dit volgens mij ook moeten betekenen dat je 357,4 gram Fe3(PO)4 moet oplossen in 1 liter water om 1M te krijgen...
Waarna ik zeg, 357,4*0,15 = 53,61 g/150mmol
Maar blijkbaar ga ik hier al helemaal de mist in


Ik zou zelf de andere kant op redeneren. Je hebt een 200 ml oplossing nodig met [Fe2+]=150 mM. Dit betekent dat de oplossing 0,150*0,200 = 0,030 mol Fe2+ moet bevatten. Aangezien het oplossen van 1 mol Fe3(PO4)2 leidt tot 3 mol Fe2+, betekent het dat je 30 mmol Fe2+ kunt halen uit 10 mmol Fe3(PO4)2. 10 mmol Fe3(PO4)2 komt overeen met 3,57 g.quote:Op vrijdag 9 april 2010 15:26 schreef horned_reaper het volgende:
Dan nog even een snelle.... het blijkt maar weer dat ik echt een chemicus ben van de biochemie en de koolstofchemie
Bereken hoeveel gram ijzerfosfaat, Fe3(PO4)2, je moet afwegen om 200 ml ijzerfosfaat-oplossing te maken die 150 mmol Fe2+-ionen per liter bevat.
Nou, de massa van Fe3(PO4)2 = 357,4 g/mol als je die waarden optelt uit het periodiek systeem...
Als er dus 357,4 gram in 1 mol zit... zou dit volgens mij ook moeten betekenen dat je 357,4 gram Fe3(PO)4 moet oplossen in 1 liter water om 1M te krijgen...
Waarna ik zeg, 357,4*0,15 = 53,61 g/150mmol
Maar blijkbaar ga ik hier al helemaal de mist inomdat het uiteindelijk antwoord toch echt 3,57g hoort te zijn....


Dankje voor je uitleg, maar ik snap de logica nog steeds niet helemaal....quote:Op vrijdag 9 april 2010 16:41 schreef lyolyrc het volgende:
[..]
Ik zou zelf de andere kant op redeneren. Je hebt een 200 ml oplossing nodig met [Fe2+]=150 mM. Dit betekent dat de oplossing 0,150*0,200 = 0,030 mol Fe2+ moet bevatten. Aangezien het oplossen van 1 mol Fe3(PO4)2 leidt tot 3 mol Fe2+, betekent het dat je 30 mmol Fe2+ kunt halen uit 10 mmol Fe3(PO4)2. 10 mmol Fe3(PO4)2 komt overeen met 3,57 g.
Ik kan je stap, "Dit betekent dat de oplossing 0,150*0,200 = 0,030 mol Fe2+ moet bevatten", nog niet helemaal volgen.... waarom doe je 0,150mol * 0,200L ? ... ik zie niet in waarom ik die stap zou nemen wanneer ik de vraag volgende week in een andere context zou krijgen....


Er is een gewenst volume gegeven (200 ml) en een gewenste concentratie van 150 mmol Fe2+/l = 150 mM. Als je het volume vermenigvuldigt met de concentratie, krijg je aantal mol Fe2+ dat de oplossing moet bevatten. Samengevat: liter*mol/liter = mol.quote:Op vrijdag 9 april 2010 16:54 schreef horned_reaper het volgende:
Dankje voor je uitleg, maar ik snap de logica nog steeds niet helemaal....
Ik kan je stap, "Dit betekent dat de oplossing 0,150*0,200 = 0,030 mol Fe2+ moet bevatten", nog niet helemaal volgen.... waarom doe je 0,150mol * 0,200L ? ... ik zie niet in waarom ik die stap zou nemen wanneer ik de vraag volgende week in een andere context zou krijgen....
Vanuit het aantal mol dat die vermenigvuldiging oplevert, bereken ik eerst hoeveel mol ijzersulfaat je nodig hebt en dan hoeveel gram dat is.


Ah, dus wanneer ik heb berekend hoeveel mol er in totaal in de oplossing moet, 0,150*0,200 = 0,030... is dat uitgedrukt in Fe2+ maar aangezien ik met een stof te maken heeft die Fe3 bevat, moet die 0,030 gedeeld door 3.... dat wordt 0,010 en wanneer ik mijn 357* 0,010 doe is dat = 3,57g ?quote:Op vrijdag 9 april 2010 17:00 schreef lyolyrc het volgende:
[..]
Er is een gewenst volume gegeven (200 ml) en een gewenste concentratie van 150 mmol Fe2+/l = 150 mM. Als je het volume vermenigvuldigt met de concentratie, krijg je aantal mol Fe2+ dat de oplossing moet bevatten. Samengevat: liter*mol/liter = mol.
Vanuit het aantal mol dat die vermenigvuldiging oplevert, bereken ik eerst hoeveel mol ijzersulfaat je nodig hebt en dan hoeveel gram dat is.


Je hebt hem door!quote:Op vrijdag 9 april 2010 17:15 schreef horned_reaper het volgende:
Ah, dus wanneer ik heb berekend hoeveel mol er in totaal in de oplossing moet, 0,150*0,200 = 0,030... is dat uitgedrukt in Fe2+ maar aangezien ik met een stof te maken heeft die Fe3 bevat, moet die 0,030 gedeeld door 3.... dat wordt 0,010 en wanneer ik mijn 357* 0,010 doe is dat = 3,57g ?
Aangezien de concentratie 150 mmol Fe2+ per liter is, zal 200 ml van die oplossing maar een vijfde van 150 mmol = 30 mmol bevatten. Dan maak je de stap naar het zout: 3 ionen Fe2+ haal je uit 1 zoutmolecuul Fe3(PO4)2. Vandaar dat je de 30 mmol door 3 moet delen. De laatste stap spreekt voor zich: je gaat van mol naar gram door te vermenigvuldigen met de molmassa.
Sowieso moet je zulk soort sommetjes altijd in deze volgorde oplossen. De manier waarop je begonnen was, werkt wel, maar is omslachtig.


Helemaal tegek lyolyrc ! 
Als ik dan nog één aller laatste vraag aan je zou mogen stellen, zal ik je niet meer lastig vallen
De vraag gaat als volgt: "We maken 2 liter acetaatbuffer met pH 5,0 en een sterkte van 0,1 M (dus [CH3COOH] + [CH3COO-] = 0,1 M) door de juiste hoeveelheid vast natriumacetaat (CH3COONa) en het juiste volume azijnzuur op te nemen in 2 liter water. Hoeveel gram natriumacetaat weeg je af en hoeveel ml azijnzuur (werkoplossing in de zuurkast is 4 M) heb je nodig?"
Waarschijnlijk zal ik eerste de fracties ten opzichte van elkaar moeten uitrekenen... en als ik dat weet kan ik aan de hand daarvan vrij makkelijk het aantal gram van beide stoffen uitrekenen.
Maar hoe bereken ik die fracties?
Als ik dan nog één aller laatste vraag aan je zou mogen stellen, zal ik je niet meer lastig vallen
De vraag gaat als volgt: "We maken 2 liter acetaatbuffer met pH 5,0 en een sterkte van 0,1 M (dus [CH3COOH] + [CH3COO-] = 0,1 M) door de juiste hoeveelheid vast natriumacetaat (CH3COONa) en het juiste volume azijnzuur op te nemen in 2 liter water. Hoeveel gram natriumacetaat weeg je af en hoeveel ml azijnzuur (werkoplossing in de zuurkast is 4 M) heb je nodig?"
Waarschijnlijk zal ik eerste de fracties ten opzichte van elkaar moeten uitrekenen... en als ik dat weet kan ik aan de hand daarvan vrij makkelijk het aantal gram van beide stoffen uitrekenen.
Maar hoe bereken ik die fracties?


Als je niet erg vindt, ga ik eerst even eten. Misschien dat een eerder antwoord over buffers je al een beetje op weg kan helpen.


We beginnen met de evenwichtsvergelijking (Ac- = CH3COO-): Ka = [H+]*[Ac-]/[HAc]
Hieruit volgt: Ka/[H+] = [Ac-]/[HAc]
substitueer: Ka = 10^-4.75 en [H+] = 10^-5.0
dat geeft [Ac-]/[HAc] = 10^0.25 = 1.78
daaruit leid je af dat: [Ac-] = 1.78*[HAc]
gegeven is dat: [Ac-]+[HAc] = 1.0 M
substitueer daarin [Ac-] = 1.78*[HAc], dat geeft: 2.78*[HAc] = 1.0 M
dan is [HAc] = 1.0/2.78 = 0.36 M
en [Ac-] = 1.0 M - [HAc] = 0.64 M
Gebruik deze concentraties om uit te rekenen hoeveel van de werkoplossing je nodig hebt en hoeveel gram natriumacetaat.
Hieruit volgt: Ka/[H+] = [Ac-]/[HAc]
substitueer: Ka = 10^-4.75 en [H+] = 10^-5.0
dat geeft [Ac-]/[HAc] = 10^0.25 = 1.78
daaruit leid je af dat: [Ac-] = 1.78*[HAc]
gegeven is dat: [Ac-]+[HAc] = 1.0 M
substitueer daarin [Ac-] = 1.78*[HAc], dat geeft: 2.78*[HAc] = 1.0 M
dan is [HAc] = 1.0/2.78 = 0.36 M
en [Ac-] = 1.0 M - [HAc] = 0.64 M
Gebruik deze concentraties om uit te rekenen hoeveel van de werkoplossing je nodig hebt en hoeveel gram natriumacetaat.


Hoe kom je in het begin aan de 4,75 ?quote:Op vrijdag 9 april 2010 20:00 schreef lyolyrc het volgende:
We beginnen met de evenwichtsvergelijking (Ac- = CH3COO-): Ka = [H+]*[Ac-]/[HAc]
Hieruit volgt: Ka/[H+] = [Ac-]/[HAc]
substitueer: Ka = 10^-4.75 en [H+] = 10^-5.0
dat geeft [Ac-]/[HAc] = 10^0.25 = 1.78
daaruit leid je af dat: [Ac-] = 1.78*[HAc]
gegeven is dat: [Ac-]+[HAc] = 1.0 M
substitueer daarin [Ac-] = 1.78*[HAc], dat geeft: 2.78*[HAc] = 1.0 M
dan is [HAc] = 1.0/2.78 = 0.36 M
en [Ac-] = 1.0 M - [HAc] = 0.64 M
Gebruik deze concentraties om uit te rekenen hoeveel van de werkoplossing je nodig hebt en hoeveel gram natriumacetaat.


Dat is de pKa van azijnzuur.quote:Op vrijdag 9 april 2010 20:04 schreef horned_reaper het volgende:
Hoe kom je in het begin aan de 4,75 ?
[ Bericht 0% gewijzigd door lyolyrc op 09-04-2010 20:10:31 (pKa uiteraard) ]


Kijk, daar liep ik dus vastquote:
Maar hoe zou ik zo uit m'n hoofd moeten weten wat een pKa van een willekeurige stof is ?


Lijkt me dat die op een tentamen gegeven wordt. Ik heb hem nu van wikipedia geplukt, maar het staat ook in Binas of meer professionele naslagwerken. Wellicht zelfs ergens in een scheikundeboek dat je hebt, aan de binnenkant van de kaft bijvoorbeeld.quote:Op vrijdag 9 april 2010 20:13 schreef horned_reaper het volgende:
Kijk, daar liep ik dus vastwant de rest lukt me wel....
Maar hoe zou ik zo uit m'n hoofd moeten weten wat een pKa van een willekeurige stof is ?


We mogen geen binas of naslagwerk gebruiken, en er is echt helemaal nergens een pKa gegeven, dus daarom vindt ik het nogal vreemd....quote:Op vrijdag 9 april 2010 20:17 schreef lyolyrc het volgende:
[..]
Lijkt me dat die op een tentamen gegeven wordt. Ik heb hem nu van wikipedia geplukt, maar het staat ook in Binas of meer professionele naslagwerken. Wellicht zelfs ergens in een scheikundeboek dat je hebt, aan de binnenkant van de kaft bijvoorbeeld.
Het enige dat van tevoren gegeven is is dat acetaatbuffer (Ka azijnzuur = 1,8.10-5) en fosfaatbuffer (Ka H2PO4- = 6,2.10-8)... had ik het daar uit kunnen halen dan ?