SES School, Studie en Onderwijs
Wiskunde in de brugklas, Frans voor het examen of een studie Personeel en Arbeid? Moeilijke formulieren van DUO? Iets weten over studiefinanciering of studentenverenigingen? Dit is het forum voor leerkrachten, scholieren en studenten, van brugklas tot uni



Het rare is die dichtheid die wordt opgegeven. De dichtheid van ethanol is 0.78, niet 0.93. Dus ik neem aan dat 0.93 de dichtheid van whiskey is.
Dit kun je ook berekenen: 0.35*0.78 + 0.65*1.0 = 0.92 g/ml. Als je er dan van uitgaat dat er nog wat zwaardere zooi inzit, dan klopt die 0.93 g/ml wel, maar dan voor de whiskey.
Aan de spelling te zien is die trouwens Iers.
Dit kun je ook berekenen: 0.35*0.78 + 0.65*1.0 = 0.92 g/ml. Als je er dan van uitgaat dat er nog wat zwaardere zooi inzit, dan klopt die 0.93 g/ml wel, maar dan voor de whiskey.
Aan de spelling te zien is die trouwens Iers.


Mijn oplossing:
1 liter whiskey van 35° weegt 930 gram en bevat 325,5 gram EtOH
(s.g. = m/v, dus m = s.g.*v -> 1000x0,93 = 930g/l )
(930x0,35 = 325,5, ik heb 35% als massaprocent geïnterpreteerd, hetgeen in de chemie gebruikelijk is bij het maken van oplossingen)
325,5 gram EtOH met molmassa 46 maakt dus 7,07 mol EtOH (massa gedeeld door molmassa). Dit is gelijk aan de molariteit (= mol per liter)
Indien je dus 1/40e van een liter neemt (1000 ml/25 ml) zal dat 0,18 mol stof bevatten, hetgeen vermenigvuldigd met de molmassa 8,14 gram C2H5OH maakt.
[ Bericht 0% gewijzigd door tony_clifton- op 03-11-2009 17:03:30 ]
1 liter whiskey van 35° weegt 930 gram en bevat 325,5 gram EtOH
(s.g. = m/v, dus m = s.g.*v -> 1000x0,93 = 930g/l )
(930x0,35 = 325,5, ik heb 35% als massaprocent geïnterpreteerd, hetgeen in de chemie gebruikelijk is bij het maken van oplossingen)
325,5 gram EtOH met molmassa 46 maakt dus 7,07 mol EtOH (massa gedeeld door molmassa). Dit is gelijk aan de molariteit (= mol per liter)
Indien je dus 1/40e van een liter neemt (1000 ml/25 ml) zal dat 0,18 mol stof bevatten, hetgeen vermenigvuldigd met de molmassa 8,14 gram C2H5OH maakt.
[ Bericht 0% gewijzigd door tony_clifton- op 03-11-2009 17:03:30 ]


Daar doen chemisten niet aan meequote:Op dinsdag 3 november 2009 16:31 schreef Iblis het volgende:
Overigens verzaak je je significantie een beetje.
Ik las de dichtheid als de dichtheid van de whiskey, omdat 't anders nogal een vreemde opgave geweest zou zijn.quote:Op dinsdag 3 november 2009 16:37 schreef lyolyrc het volgende:
Het rare is die dichtheid die wordt opgegeven. De dichtheid van ethanol is 0.78, niet 0.93. Dus ik neem aan dat 0.93 de dichtheid van whiskey is.
Dit kun je ook berekenen: 0.35*0.78 + 0.65*1.0 = 0.92 g/ml. Als je er dan van uitgaat dat er nog wat zwaardere zooi inzit, dan klopt die 0.93 g/ml wel, maar dan voor de whiskey.
Aan de spelling te zien is die trouwens Iers.
Overigens, buiten suikers en aanwezige zuren wordt de smaak van gedestilleerde alcoholische dranken vooral bepaald door zogenaamde foezelalcoholen. Bijvoorbeeld 1-methyl-2-butanol. Geen idee van dichtheden maar die verschillen zullen wel niet veel uitmaken.
[ Bericht 8% gewijzigd door tony_clifton- op 03-11-2009 16:59:10 ]


Heel erg bedankt allemaal, als ik dadelijk nog meer vragen heb val ik jullie nog wel een keer lastig. 


quote:Op dinsdag 3 november 2009 16:47 schreef tony_clifton- het volgende:
[..]
Daar doen chemisten niet aan mee


Avond, ben ik weer.
Jorien heeft op vakantie wat erts gevonden. Zijn twijfelt of het nikkelarsenide, NiAs(s), is of cupriet. Zij gaat dit onderzoeken en weegt daartoe 20,0 gram erts af en leidt daarover waterstof. Als het nikkelarsenide is, treedt een reactie op die je als volgt kunt weergeven:
2 NiAs(s) + 3 H2 (g) -> 2 Ni (s) + AsH3 (g)
Als het erts cupriet is treedt de volgende reactie op:
Cu2O(s) + H2(g) -> 2 Cu (s) + H2O(g)
Jorien verwacht dat door te meten hoeveel gram vaste stof na de reactie aanwezig is, bepaald kan worden welk erts aanwezig is.
Zij heeft al uitgerekend dat uit 20,0 g Cu2O(s) bij deze reactie 17,8 g koper ontstaat.
Bereken hoeveel gram nikkel ontstaat uit 20,0 g nikkelarsenide en leg uit of Jorien gelijk heeft datje door weging van de massa van de vaste stof na afloop kunt bepalen welk erts het is.
Kan iemand me op weg helpen, ik snap niet waar ik moet beginnen en ik snap er dus ook helemaal niks van.
Jorien heeft op vakantie wat erts gevonden. Zijn twijfelt of het nikkelarsenide, NiAs(s), is of cupriet. Zij gaat dit onderzoeken en weegt daartoe 20,0 gram erts af en leidt daarover waterstof. Als het nikkelarsenide is, treedt een reactie op die je als volgt kunt weergeven:
2 NiAs(s) + 3 H2 (g) -> 2 Ni (s) + AsH3 (g)
Als het erts cupriet is treedt de volgende reactie op:
Cu2O(s) + H2(g) -> 2 Cu (s) + H2O(g)
Jorien verwacht dat door te meten hoeveel gram vaste stof na de reactie aanwezig is, bepaald kan worden welk erts aanwezig is.
Zij heeft al uitgerekend dat uit 20,0 g Cu2O(s) bij deze reactie 17,8 g koper ontstaat.
Bereken hoeveel gram nikkel ontstaat uit 20,0 g nikkelarsenide en leg uit of Jorien gelijk heeft datje door weging van de massa van de vaste stof na afloop kunt bepalen welk erts het is.
Kan iemand me op weg helpen, ik snap niet waar ik moet beginnen en ik snap er dus ook helemaal niks van.


Je ziet aan de reactie vergelijkingen dat van de 2NiAs de As ‘verdwijnt’, d.w.z. AsH3 is gasvormig. Je kunt dus nagaan hoeveel mol 2NiAs je hebt, en dus hoeveel mol Ni je dan zou moeten krijgen, en hoeveel dat zou wegen.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


2 mol NiAs en 1 mol Niquote:Op dinsdag 3 november 2009 20:19 schreef Iblis het volgende:
Je ziet aan de reactie vergelijkingen dat van de 2NiAs de As ‘verdwijnt’, d.w.z. AsH3 is gasvormig. Je kunt dus nagaan hoeveel mol 2NiAs je hebt, en dus hoeveel mol Ni je dan zou moeten krijgen, en hoeveel dat zou wegen.
NiAs weegt 133,63 gram (of hoe noem je dat?) en Ni 58,71
Maar wat moet ik dan gaan doen?
Want ik snap ook niet hoe ze aan die 20,0 gram en 17,8 gram zijn gekomen...


Zoals de mijnwerkers, parkiet in een kooitje naastzetten, als 't arsine is merk je 't wel 
Mijn hoofd zit momenteel te vast om na te denken, maar je moet gewoon opschrijven hoeveel mol je hebt indien je van een stof uitgaat, H2 is altijd overmaat, dus ontstaat er evenveel mol arsine als nikkel(III)arsenide, en evenveel mol koper als koper(II)oxide.
Dit kan je zien aan de reactievergelijking, alhoewel je er een fout in hebt zitten. Arsenide is drie- of vijfwaardig, dus hier heb je inderdaad 3 waterstofmoleculen en 2 nikkel(III)arsenides nodig. Je houdt aan de andere kant dus 2 moleculen arsine over, in plaats van 1.
De gegeven massa koper is dus volgens mij al de oplossing voor de 2e vergelijking, je moet enkel de eerste doen.
Zal er ff papier bij nemen .
.
Mijn hoofd zit momenteel te vast om na te denken, maar je moet gewoon opschrijven hoeveel mol je hebt indien je van een stof uitgaat, H2 is altijd overmaat, dus ontstaat er evenveel mol arsine als nikkel(III)arsenide, en evenveel mol koper als koper(II)oxide.
Dit kan je zien aan de reactievergelijking, alhoewel je er een fout in hebt zitten. Arsenide is drie- of vijfwaardig, dus hier heb je inderdaad 3 waterstofmoleculen en 2 nikkel(III)arsenides nodig. Je houdt aan de andere kant dus 2 moleculen arsine over, in plaats van 1.
De gegeven massa koper is dus volgens mij al de oplossing voor de 2e vergelijking, je moet enkel de eerste doen.
Zal er ff papier bij nemen


Kijk, 20 gram van die stof is ofwel 0,15 mol NiAs, ofwel 0,14 mol Cu2O.
Je moet mol gewoon zien als een vermenigvuldiging, dus 0,14 mol betekent eigenlijk 0,14*6,023*1023 atomen/moleculen/whatever. Je kan dus het aantal bits en bytes op een harde schijf ook in mol uitdrukken desnoods, ook al zou 't een beetje dom zijn.
In ieder geval, 0,15 mol NiAs bevat 0,15 mol nikkelatomen en 0,15 mol arseenatomen.
0,14 mol Cu2O bevat dan 0,28 mol koperatomen, en 0,14 mol zuurstofatomen, zie je dan ook waarom?
Concreet in je voorstel betekent het dat je 8,80 gram Ni zou overhouden. Hoe je daarmee aan een oplossing komt, geen idee. Hetzelfde aantal mol arseen weegt 11,24g, wat zou beteken dat je 0,04 gram waterstof toegevoegd hebt (wet van behoud van massa). (afgerond op 2 cijfers na de komma)
Theoretisch: Je voegt per 2 mol erts 6 mol waterstof toe, dus 3x zoveel als je aantal mol erts: 0,45 mol of 45 gram waterstof.
Dus, indien ze 8,80 gram vaste stof heeft is het nikkel, als het 17,80 gram weegt heb je koper en weet je dus wat in het erts zit.
Vaag vraagstuk, of ik zie er gewoon los over.
Je moet mol gewoon zien als een vermenigvuldiging, dus 0,14 mol betekent eigenlijk 0,14*6,023*1023 atomen/moleculen/whatever. Je kan dus het aantal bits en bytes op een harde schijf ook in mol uitdrukken desnoods, ook al zou 't een beetje dom zijn.
In ieder geval, 0,15 mol NiAs bevat 0,15 mol nikkelatomen en 0,15 mol arseenatomen.
0,14 mol Cu2O bevat dan 0,28 mol koperatomen, en 0,14 mol zuurstofatomen, zie je dan ook waarom?
Concreet in je voorstel betekent het dat je 8,80 gram Ni zou overhouden. Hoe je daarmee aan een oplossing komt, geen idee. Hetzelfde aantal mol arseen weegt 11,24g, wat zou beteken dat je 0,04 gram waterstof toegevoegd hebt (wet van behoud van massa). (afgerond op 2 cijfers na de komma)
Theoretisch: Je voegt per 2 mol erts 6 mol waterstof toe, dus 3x zoveel als je aantal mol erts: 0,45 mol of 45 gram waterstof.
Dus, indien ze 8,80 gram vaste stof heeft is het nikkel, als het 17,80 gram weegt heb je koper en weet je dus wat in het erts zit.
Vaag vraagstuk, of ik zie er gewoon los over.


Bedankt, ik denk dat het begint te dagen. Doe je een scheikunde-opleiding of ben je al afgestudeerd ofzo?


Met een volumepercentage alcohol en de dichtheid van ethanol was de vraag ook op te lossen. Dus zo vreemd is het niet. Zeker niet aangezien alcoholische dranken meestal een volumepercentage alcohol opgeven en er vooral dichtheden van zuivere stoffen bekend zijn.quote:Op dinsdag 3 november 2009 16:47 schreef tony_clifton- het volgende:
Ik las de dichtheid als de dichtheid van de whiskey, omdat 't anders nogal een vreemde opgave geweest zou zijn.
1-methyl-2-butanol? Dat bestaat niet!quote:Overigens, buiten suikers en aanwezige zuren wordt de smaak van gedestilleerde alcoholische dranken vooral bepaald door zogenaamde foezelalcoholen. Bijvoorbeeld 1-methyl-2-butanol. Geen idee van dichtheden maar die verschillen zullen wel niet veel uitmaken.
Bedoel je 2-methyl-1-butanol of 3-pentanol?


2-methyl idd, stom 
Geeft smaak aan sherry btw...
Ach, maakt niet uit, ik vind die middelbareschoolvraagstukken altijd wel vaag gesteld. Lang leve hogeschool en unif .
.
(geen idee hoe 't nederlandse onderwijssysteem is opgedeeld dus kan vreemd overkomen )
)
Geeft smaak aan sherry btw...
Ach, maakt niet uit, ik vind die middelbareschoolvraagstukken altijd wel vaag gesteld. Lang leve hogeschool en unif
(geen idee hoe 't nederlandse onderwijssysteem is opgedeeld dus kan vreemd overkomen


Ik ben druk aan het leren voor een tentamen van morgen en ik heb hier een aantal oefenvragen maar ik heb geen antwoordbladen  en de docent wil ze ook niet geven.
en de docent wil ze ook niet geven.
Dus misschien zijn er scheikundige genieën die me hier wel mee kunnen helpen...
Ik moet de verkorte electronenconfiguratie van Br- opschrijven.
Dit wordt dan toch gewoon ... "[Ar] - 4S2 - 3d10 - 4p6"
Of heb ik nu iets verkeerd gedaan ?
Edit: En hoe zit het met de verkorte electronenconfiguratie van Ca2+
Want deze stof heeft min 2 e-, 18 elektronen dat zijn er net zoveel als Ar
Moet ik dan alleen maar [Ar] opschrijven of weer terug revereren naar Ne ?
Dus misschien zijn er scheikundige genieën die me hier wel mee kunnen helpen...
Ik moet de verkorte electronenconfiguratie van Br- opschrijven.
Dit wordt dan toch gewoon ... "[Ar] - 4S2 - 3d10 - 4p6"
Of heb ik nu iets verkeerd gedaan ?
Edit: En hoe zit het met de verkorte electronenconfiguratie van Ca2+
Want deze stof heeft min 2 e-, 18 elektronen dat zijn er net zoveel als Ar
Moet ik dan alleen maar [Ar] opschrijven of weer terug revereren naar Ne ?


Klopt, dit komt overeen met de elektronenconfiguratie van krypton. Vergeet niet de superscripten, dus: [Ar] - 4s2 - 3d10 - 4p6. Maar ik ga er vanuit dat je die niet hier had opgeschreven, omdat het nogal wat werk is.quote:Op donderdag 5 november 2009 15:56 schreef horned_reaper het volgende:
Ik ben druk aan het leren voor een tentamen van morgen en ik heb hier een aantal oefenvragen maar ik heb geen antwoordbladenen de docent wil ze ook niet geven.
Dus misschien zijn er scheikundige genieën die me hier wel mee kunnen helpen...
Ik moet de verkorte electronenconfiguratie van Br- opschrijven.
Dit wordt dan toch gewoon ... "[Ar] - 4S2 - 3d10 - 4p6"
Of heb ik nu iets verkeerd gedaan ?
Terugredeneren naar neon en het op een vergelijkbare manier opschrijven als je hierboven hebt gedaan voor bromide.quote:Edit: En hoe zit het met de verkorte electronenconfiguratie van Ca2+
Want deze stof heeft min 2 e-, 18 elektronen dat zijn er net zoveel als Ar
Moet ik dan alleen maar [Ar] opschrijven of weer terug revereren naar Ne ?


Bedankt ! Ben je toevallig scheikunde docent ? of iets in die richting ?quote:Op donderdag 5 november 2009 16:18 schreef lyolyrc het volgende:
[..]
Klopt, dit komt overeen met de elektronenconfiguratie van krypton. Vergeet niet de superscripten, dus: [Ar] - 4s2 - 3d10 - 4p6. Maar ik ga er vanuit dat je die niet hier had opgeschreven, omdat het nogal wat werk is.
[..]
Terugredeneren naar neon en het op een vergelijkbare manier opschrijven als je hierboven hebt gedaan voor bromide.


Student Biomedische Technologie aan de TU/e, met organische chemie als afstudeerrichting.quote:Op donderdag 5 november 2009 16:22 schreef horned_reaper het volgende:
Bedankt ! Ben je toevallig scheikunde docent ? of iets in die richting ?


Nog even een korte vraag... wat is het verschil tussen een elektron en een P-elektron ?
Aan de hand van de "P-elektronen" moet ik de plaatsen in het periodieke systeem van een x aantal elementen kunnen bepalen.
Maar het is me blijkbaar een keer ontgaan waar nu precies die P voor staat bij een P-elektron.
Aan de hand van de "P-elektronen" moet ik de plaatsen in het periodieke systeem van een x aantal elementen kunnen bepalen.
Maar het is me blijkbaar een keer ontgaan waar nu precies die P voor staat bij een P-elektron.


De p-electronen zijn electronen in de p-orbitalen. Als de electronenconfiguratie op npx eindigt (met n = een periodenummer en x = aantal electronen), dan weet je dat het bijbehorende element in een van de 6 rechtse groepen zit.


Daar ben ik weer met nog een korte scheikundige vraag.
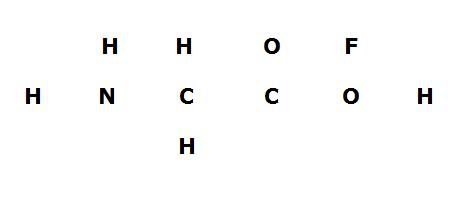
Ik net de volgende vraag: "Geef de volledige Lew-structuur en specificatielijst van de volgende verbinding".
En daar stond het volgende (zelfgemaakt paint plaatje) onder.
Toen ben ik dus alles gaan invullen en kwam ik ongeveer op het volgende uit:
Zoals je kunt zien houd ik bij het F element een punt over, want F heeft normaal 7 valentie elektronen om zich heen.
Dus is dit nu de goede oplossing ? en kan ik er dan vanuit gaan dat het molecul 1- geladen is ? of moet het op een totaal andere manier ?
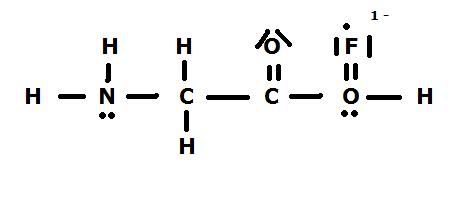
Ik net de volgende vraag: "Geef de volledige Lew-structuur en specificatielijst van de volgende verbinding".
En daar stond het volgende (zelfgemaakt paint plaatje) onder.
Toen ben ik dus alles gaan invullen en kwam ik ongeveer op het volgende uit:
Zoals je kunt zien houd ik bij het F element een punt over, want F heeft normaal 7 valentie elektronen om zich heen.
Dus is dit nu de goede oplossing ? en kan ik er dan vanuit gaan dat het molecul 1- geladen is ? of moet het op een totaal andere manier ?