quote:Die wikipediapagina's heb ik bekeken en die snapte ik niet.Op dinsdag 6 april 2010 21:56 schreef Prometheus4096 het volgende:
Bekijk eens de wikipedia pagina's van eitwitten en aminozuren. Je kunt ook, oa op youtube, lectures vinden over eiwitten als onderdeel van een biologie introductie.
quote:Op Wikipedia zit een lijstje met talen, kun je zo op "English" (dat is Engels voor "Engels") klikken.Op dinsdag 6 april 2010 21:58 schreef Federer-fan het volgende:
[..]
Die wikipediapagina's heb ik bekeken en die snapte ik niet.Ik zal op YouTube kijken naar lezingen. Wat is eiwit in het Engels, eggnog?
quote:Op dinsdag 6 april 2010 22:01 schreef thabit het volgende:
[..]
Op Wikipedia zit een lijstje met talen, kun je zo op "English" (dat is Engels voor "Engels") klikken.
quote:Zelfde als in het Nederlands, proteïne. Duh.Op dinsdag 6 april 2010 21:58 schreef Federer-fan het volgende:
[..]
Die wikipediapagina's heb ik bekeken en die snapte ik niet.Ik zal op YouTube kijken naar lezingen. Wat is eiwit in het Engels, eggnog?
quote:Wat dacht je van ... egg white?Op dinsdag 6 april 2010 21:58 schreef Federer-fan het volgende:
[..]
Die wikipediapagina's heb ik bekeken en die snapte ik niet.Ik zal op YouTube kijken naar lezingen. Wat is eiwit in het Engels, eggnog?
Allereerst is het van belang om te begrijpen dat met eiwitten niet het wit van een ei wordt bedoeld, maar een bepaalde klasse van chemische verbindingen die alle levende organismen vormen. Andere namen hiervoor zijn polypeptiden en proteïnes. (Formeel bestaat er een onderscheid tussen polypeptiden en proteïnes, maar dat doet hier niet echt ter zake)
Eiwitten worden gevormd door het aaneen rijgen van aminozuren, met andere woorden aminozuren zijn de bouwstenen van eiwitten. Er zijn 20 verschillende aminozuren beschikbaar waaruit de eiwitten kunnen worden gevormd. Deze aminozuren kun je je voorstellen als een bolletje waar vier verschillende uitsteeksels (in de scheikunde noemen we die uitsteeksels groepen of substituenten) aanhangen: een waterstofgroep, een aminogroep, een carbonzuurgroep en een groep die per aminozuur wisselt. (alleen deze laatste groep bepaalt het verschil tussen de aminozuren onderling).
Het aaneen rijgen van de aminozuren tot een polypeptide kun je een beetje vergelijken met het rijgen van kralen, er ontstaat een lange keten. Bij eiwitten ontstaat deze keten doordat de carbonzuurgroep van het 1e aminozuur koppelt met de aminogroep van het 2e aminozuur in de keten. De carbonzuurgroep van het 2e aminozuur kan weer koppelen met de aminogroep van het 3e aminozuur, de carbonzuurgroep van het 3e aminozuur weer met de aminogroep van het 4e aminozuur enzovoort. Omdat er 20 verschillende aminozuren beschikbaar zijn, kun je heel diverse ketens krijgen. Ketens zijn bestaan vaak uit al meer dan 100 aminozuren, soms wel honderden aminozuren.
Eiwitten worden pas functioneel als ze gaan vouwen, dit houdt in dat de keten zich op een speciale manier gaat oprollen: hierbij ontstaan bijvoorbeeld vormen die er uitzien als springveren of zigzagstructuren. Deze vormen geven het eiwit een driedimensionale structuur. Dankzij deze 3D-structuur zijn eiwitten in staat om allerlei functies te vervullen (elk eiwit heeft een unieke functie): bijvoorbeeld chemische stoffen veranderen (dit wordt gedaan door een klasse van eiwitten die we enzymen noemen), stoffen binden en transporteren, mechanische eigenschappen (eiwitten zorgen dat je spieren kunnen bewegen; ook de elasticiteit van je huid is te danken aan eiwitten).
Als dingen onduidelijk zijn, laat het maar weten.
je het onderwerp van de ts kan beantwoorden. Ik zou bijna zeggen: Opgelost
quote:De discussie gaat inmiddels hier verder!Op woensdag 7 april 2010 18:01 schreef FP128 het volgende:
Volgens mij heeft de user boven mij al een aardige indicatie gegeven met zijn uitleg hoe
je het onderwerp van de ts kan beantwoorden. Ik zou bijna zeggen: Opgelost
quote:Het was een grap.
quote:Wat je hieronder schrijft, kan ik wel volgen. Klasse hoor.Op dinsdag 6 april 2010 23:12 schreef lyolyrc het volgende:
Ik denk dat de verhaaltjes op wikipedia iets te gespecialiseerd zijn als je weinig van scheikunde snapt. Ik heb daarom een stukje geschreven waarbij ik alles zo simpel mogelijk uitleg:
quote:Betekent dat dat levende organismen alleen maar bestaan uit eiwitten? Of zink er ook andere bouwstenen?Allereerst is het van belang om te begrijpen dat met eiwitten niet het wit van een ei wordt bedoeld, maar een bepaalde klasse van chemische verbindingen die alle levende organismen vormen.
quote:Dus elk individueel aminozuur is een bolletje met vier uitsteeksels?Eiwitten worden gevormd door het aaneen rijgen van aminozuren, met andere woorden aminozuren zijn de bouwstenen van eiwitten. Er zijn 20 verschillende aminozuren beschikbaar waaruit de eiwitten kunnen worden gevormd. Deze aminozuren kun je je voorstellen als een bolletje waar vier verschillende uitsteeksels (in de scheikunde noemen we die uitsteeksels groepen of substituenten) aanhangen: een waterstofgroep, een aminogroep, een carbonzuurgroep en een groep die per aminozuur wisselt. (alleen deze laatste groep bepaalt het verschil tussen de aminozuren onderling).
quote:Dus groep/substituent A van aminozuur X 'zoekt' groep substituent A van aminozuur Y op?Het aaneen rijgen van de aminozuren tot een polypeptide kun je een beetje vergelijken met het rijgen van kralen, er ontstaat een lange keten. Bij eiwitten ontstaat deze keten doordat de carbonzuurgroep van het 1e aminozuur koppelt met de aminogroep van het 2e aminozuur in de keten. De carbonzuurgroep van het 2e aminozuur kan weer koppelen met de aminogroep van het 3e aminozuur, de carbonzuurgroep van het 3e aminozuur weer met de aminogroep van het 4e aminozuur enzovoort. Omdat er 20 verschillende aminozuren beschikbaar zijn, kun je heel diverse ketens krijgen. Ketens zijn bestaan vaak uit al meer dan 100 aminozuren, soms wel honderden aminozuren.
quote:Maar ze bevatten geen genetische informatie want die zit in je DNA? Maar bestaat DNA ook uit eiwit?Eiwitten worden pas functioneel als ze gaan vouwen, dit houdt in dat de keten zich op een speciale manier gaat oprollen: hierbij ontstaan bijvoorbeeld vormen die er uitzien als springveren of zigzagstructuren. Deze vormen geven het eiwit een driedimensionale structuur. Dankzij deze 3D-structuur zijn eiwitten in staat om allerlei functies te vervullen (elk eiwit heeft een unieke functie): bijvoorbeeld chemische stoffen veranderen (dit wordt gedaan door een klasse van eiwitten die we enzymen noemen), stoffen binden en transporteren, mechanische eigenschappen (eiwitten zorgen dat je spieren kunnen bewegen; ook de elasticiteit van je huid is te danken aan eiwitten).
quote:Ik heb vast nog wel een paar honderd vragen.Als dingen onduidelijk zijn, laat het maar weten.
quote:Top!Op woensdag 7 april 2010 20:35 schreef Federer-fan het volgende:
Wat je hieronder schrijft, kan ik wel volgen. Klasse hoor.
quote:Nee, sowieso bestaan organismen voor het grootste gedeelte uit water. Verder spelen fosfolipiden een grote rol. Dit zijn stoffen die een dubbele laag vormen om een cel af te bakenen. Verder heb je nog DNA en RNA. Ook heb je allerlei kleine moleculen die rondzwemmen in het lichaam (bijvoorbeeld afbraakproducten van eiwitten)Betekent dat dat levende organismen alleen maar bestaan uit eiwitten? Of zink er ook andere bouwstenen?
quote:Dit is de uitleg die ik heb gehanteerd om je duidelijk te maken waar de overeenkomsten zitten tussen de aminozuren onderling. In principe zijn atomen (dit zijn de bouwsten van moleculen) voor te stellen als bolletjes. Bosbeetle plaatste in het andere topic dit plaatje, wat een aminozuurmolecuul voorstelt:Dus elk individueel aminozuur is een bolletje met vier uitsteeksels?
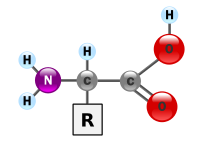
Allemaal bolletjes!
quote:Koppeling van aminozuren gebeurt als de NH2-groep reageert met de COOH-groep. Van de NH2-groep laat 1 H (=waterstofatoom) los, van de COOH-groep laat 1 O (=zuurstofatoom)en 1 H (=waterstofatoom) los. De resten van de aminogroep en van de carbonzuurgroep gaan aan elkaar zitten. Omdat elk aminozuur een NH2- en COOH-groep bevat, kun je op deze manier aminozuren aaneen rijgen.Dus groep/substituent A van aminozuur X 'zoekt' groep substituent A van aminozuur Y op?
quote:Eiwitten zijn een expressie van genetische infomatie. Het DNA dicteert in welke volgorde aminozuren gekoppeld moeten worden en bepaalt op die manier hoe het eiwit eruit komt te zien. DNA bestaat zelf niet uit eiwit. Het is opgebouwd uit groepen die zijn afgeleid van een molecuul dat we purine noemen en een molecuul dat we pyrimidine noemen. Verder bevat DNA fosfaatgroepen en een suikerachtige groep die deoxyribose wordt genoemd.Maar ze bevatten geen genetische informatie want die zit in je DNA? Maar bestaat DNA ook uit eiwit?
quote:Hopelijk hebben wij evenveel antwoorden!Ik heb vast nog wel een paar honderd vragen.
Vaak zijn medicijnen kleine moleculen die kunnen binden (lees plakken dus geen onderdeel worden van) aan eiwitten en er zo voor zorgen dat dat specifieke eiwit niet meer doet wat hij normaal doet of juist beter doet wat hij normaal doet. In de OP heb jij het over een medicijn dat zelf een eiwit is vaak is het dan een eiwit wat ook normaal voorkomt, denk aan hormonen als insuline dat in het vorige topic ook ter sprake kwam. Insuline komt normaal ook in je bloed voor en reguleert de opname van suiker. Dus als wij insuline namaken dan werkt het net zo als normaal voorkomend insuline. Deze insuline wordt op de buitenkant van cellen herkent door zogenaamde receptoren (ook eiwitten die door het celmembraan heen zitten) zogauw de insuline bind aan zo'n receptor dan gaat de receptor aan staan en doet de cel wat hij moet. (Daarna gaat de receptor met insuline en al naar binnen in de cel en wordt afgebroken dan staat hij weer uit, (erg versimpeld))

hier is een plaatje van insuline nu weet je ongeveer hoe eiwit eruit ziet dus de bolletjes zijn de amminozuren, insuline is bijzonder want hij bestaat uit twee losse stuken (en is daarom lastiger om te maken)

Hier zie je een makkelijk plaatje van een receptor in de celmembraan, een cel is een soort zak (dat gele balkje moet je zien als een stukje ervan en loopt dus helemaal om de cel heen) en dit soort eiwiten die zowel buiten als binnen zitten zorgen er voor dat de cel binnen weet wat er buiten gebeurt.
Medicinale eiwitten die binnen in de cel werken zijn nog weinig succesvol omdat het vrij moeilijk is om deze eiwitjes (het zijn vaak korte stukjes) binnen in de cel te krijgen.
quote:Epo is ook een eiwit!Op vrijdag 9 april 2010 23:51 schreef Anoniemst het volgende:
Vraag ik me af welke medicijnen opgebouwd uit eiwitten en aminozuren een rol kunnen spelen in een juridische procedure. Denk meteen aan veel te dure voedingssuplementen voor bodybuilders en aanverwanten...
quote:Waarom reageren de NH2 en de COOH-groep met elkaar, en niet andere groepen? Wat zorgt daarvoor? En waarom moet er een watermolecuul verdwijnen voor dit proces?Op woensdag 7 april 2010 21:16 schreef lyolyrc het volgende:
[..]
Koppeling van aminozuren gebeurt als de NH2-groep reageert met de COOH-groep. Van de NH2-groep laat 1 H (=waterstofatoom) los, van de COOH-groep laat 1 O (=zuurstofatoom)en 1 H (=waterstofatoom) los. De resten van de aminogroep en van de carbonzuurgroep gaan aan elkaar zitten. Omdat elk aminozuur een NH2- en COOH-groep bevat, kun je op deze manier aminozuren aaneen rijgen.
quote:dit is altijd komisch om te lezen.Op dinsdag 6 april 2010 21:47 schreef Federer-fan het volgende:
Ik moet in het kader van een juridische procedure iets weten over werkzame stoffen in geneesmiddelen. Zo gaat het o de werkzame stof, die is opgebouwd uit eiwitten en aminozuren. Kan iemand me heel simpel uitleggen wat dat betekent? Ik kan me er geen voorstelling van maken.
ten eerste: een jurist begrijpt in het algemeen niets over scheikunde.
b.v. als in de wet staat dat het kookpunt van water 300 graden celsius is, dan accepteert hij dat zonder omhalen, zolang hij maar kan declareren.
ten tweede: de geneesmiddelen-industrie is zodanig corrupt en verweven met corrupte wetgeving dat het niet uitmaakt of een scheikundige er zich serieus over gebogen heeft of niet.
ten derde: het algemene niveau van de openbare "officiele" scheikundige wetenschap is beperkt tot fysieke verschijnselen; het is altijd noodzakelijk een veel bredere insteek te nemen dan scheikunde.
Biologie en nog beter: psychologie en meer, zijn evenzo noodzakelijk terrein voor dit soort research.
quote:De aminozuren worden aan elkaar geplakt in een bepaalde omgeving, die ervoor zorgt dat deze groepen (de NH2 en COOH) wel bij elkaar kunnen komen, en andere groepen niet. Min of meer (ben vooral op de hoogte hoe eiwitten gevormd worden buiten de levende cel, en hoeveel moeite chemici daarvoor moeten doen).Op zondag 11 april 2010 10:59 schreef Montov het volgende:
[..]
Waarom reageren de NH2 en de COOH-groep met elkaar, en niet andere groepen? Wat zorgt daarvoor? En waarom moet er een watermolecuul verdwijnen voor dit proces?
Als de NH2 en de COOH met elkaar reageren, vormen ze een peptidebinding die bestaat uit een NH-CO. Je houdt dan een H over (NH2 wordt NH) en een OH (COOH wordt CO). Die H en OH vormen samen een H2O = water. Daarom 'verdwijnt' er een watermolecuul als NH2 en COOH met elkaar reageren.
Edit: ik zie nu dat ik ongeveer hetzelfde heb gezegd als degene waarop je reageerde, dus ik betwijfel of mijn uitleg wel nuttig is dan.
quote:Dat komt omdat deze twee sterk reactieve groepen zijn door vrije elektronen. Zo gaan bij COOH de elektronen continu van O -> C -> OH en terug en heeft stikstof ongebonden elektronen die door de gehele groep gaan.Op zondag 11 april 2010 10:59 schreef Montov het volgende:
[..]
Waarom reageren de NH2 en de COOH-groep met elkaar, en niet andere groepen? Wat zorgt daarvoor? En waarom moet er een watermolecuul verdwijnen voor dit proces?
Daarbij komt nog dat O en N sterker trekken aan de elektronen dan de H'tjes waardoor de H'tjes enigzins los zitten. De O van OH reageert met een 'los' H'tje van de NH2 en dan hou je water over.
Ook heeft een aminozuur een groot deel van de tijd geen COOH en NH2, maar COO- en NH3+. Dit reageert zoals je kan verwachten nog sneller. Een aminozuur behoort dan ook tot de scheikundige groep van de zogeheten 'zwitter'-ionen.
quote:Voor de vorming van eiwitten in cellen is dit inderdaad de juist uitleg. De holte in het ribosoom staat geen vorming van andere bindingen toe, dan de peptidebinding. Dit is een kwestie van een holte met de juiste vorm en zorgvuldige coördinatie van de betrokken groepen in de holte door het ribosoom. De R-zijketen van aminozuren kan ook COOH- of NH2-groepn bevatten, maar het ribosoom verhindert dat deze kunnen meereageren.Op zondag 11 april 2010 22:50 schreef Chemiu het volgende:
De aminozuren worden aan elkaar geplakt in een bepaalde omgeving, die ervoor zorgt dat deze groepen (de NH2 en COOH) wel bij elkaar kunnen komen, en andere groepen niet. Min of meer (ben vooral op de hoogte hoe eiwitten gevormd worden buiten de levende cel, en hoeveel moeite chemici daarvoor moeten doen).
Buiten de cel kunnen eiwitten gevormd worden met behulp van solid phase synthesis. Hierbij wordt een eiwit vanaf dragermateriaal aminozuur voor aminozuur opgebouwd door gebruik te maken van beschermde-groepstategieën. Dit is een interessant onderwerp, maar totaal geen stof voor beginners!
quote:In de praktijk is volgens mij zelfs zo dat er niet een echt watermolecuul wordt afgesplitst, maar juist twee ionen, namelijk H+ en OH-.Als de NH2 en de COOH met elkaar reageren, vormen ze een peptidebinding die bestaat uit een NH-CO. Je houdt dan een H over (NH2 wordt NH) en een OH (COOH wordt CO). Die H en OH vormen samen een H2O = water. Daarom 'verdwijnt' er een watermolecuul als NH2 en COOH met elkaar reageren.
Edit: ik zie nu dat ik ongeveer hetzelfde heb gezegd als degene waarop je reageerde, dus ik betwijfel of mijn uitleg wel nuttig is dan.
quote:Zoals ik al in mijn vorige post zei, ik betwijfel of dit laatste werkelijk het geval is. Netto gaat er water uit, maar ik denk dat het realistisch is om aan te nemen dat er zich OH- en H+ afsplitst.Op maandag 12 april 2010 00:24 schreef Gray het volgende:
Dat komt omdat deze twee sterk reactieve groepen zijn door vrije elektronen. Zo gaan bij COOH de elektronen continu van O -> C -> OH en terug en heeft stikstof ongebonden elektronen die door de gehele groep gaan.
Daarbij komt nog dat O en N sterker trekken aan de elektronen dan de H'tjes waardoor de H'tjes enigzins los zitten. De O van OH reageert met een 'los' H'tje van de NH2 en dan hou je water over.
quote:Het klopt dat er onder fysiologische omstandigheden eerder sprake is van een zwitterion. Maar ik vraag me wel af of COO- en NH3+ reactiever zijn. Kun je dit toelichten?Ook heeft een aminozuur een groot deel van de tijd geen COOH en NH2, maar COO- en NH3+. Dit reageert zoals je kan verwachten nog sneller. Een aminozuur behoort dan ook tot de scheikundige groep van de zogeheten 'zwitter'-ionen.
quote:Wat je zegt is waar, aminozuren komen in het lichaam meestal voor als zwitterion. Maar buiten de cel reageert dat juist helemaal niet sneller dan de ongeladen variant. Chemici moeten een activerende stof toevoegen (DCC) om de reactie aan de gang te krijgen. Hier diep op in gaan zonder voorkennis is imho onmogelijk, heeft te maken met vertrekkende groepen en reactiemechanismen. Of iig, ik kan het niet makkelijk uitleggen, misschien dat een van de anderen hier het wel kanOp maandag 12 april 2010 00:24 schreef Gray het volgende:
Ook heeft een aminozuur een groot deel van de tijd geen COOH en NH2, maar COO- en NH3+. Dit reageert zoals je kan verwachten nog sneller. Een aminozuur behoort dan ook tot de scheikundige groep van de zogeheten 'zwitter'-ionen.
quote:Ah het ribosoom is de holte. Ik wist het niet zeker, had daarom maar weggelaten wat die 'omgeving' precies vormde.Op maandag 12 april 2010 11:25 schreef lyolyrc het volgende:
[..]
Voor de vorming van eiwitten in cellen is dit inderdaad de juist uitleg. De holte in het ribosoom staat geen vorming van andere bindingen toe, dan de peptidebinding. Dit is een kwestie van een holte met de juiste vorm en zorgvuldige coördinatie van de betrokken groepen in de holte door het ribosoom. De R-zijketen van aminozuren kan ook COOH- of NH2-groepn bevatten, maar het ribosoom verhindert dat deze kunnen meereageren.
Buiten de cel kunnen eiwitten gevormd worden met behulp van solid phase synthesis. Hierbij wordt een eiwit vanaf dragermateriaal aminozuur voor aminozuur opgebouwd door gebruik te maken van beschermde-groepstategieën. Dit is een interessant onderwerp, maar totaal geen stof voor beginners!
Eiwitten buiten de cel maken is echt een hel voor chemici inderdaad
quote:Je hebt gelijk, al dit is vrijwel altijd het geval. Water bestaat sowieso voor een deel uit OH- en H+. 'Puur' water bestaat niet. Het is een optelsom van H2O, OH- en H+.Op maandag 12 april 2010 11:31 schreef lyolyrc het volgende:
[..]
Zoals ik al in mijn vorige post zei, ik betwijfel of dit laatste werkelijk het geval is. Netto gaat er water uit, maar ik denk dat het realistisch is om aan te nemen dat er zich OH- en H+ afsplitst.
[..]
quote:COO- is zeer sterk reactief door de extra vrije elektronen. NH3+ levert het substraat nodig voor deze reactie. Het reactiemechanisme wordt overigens gewoon met NH2 en COOH geschreven, anders kan de nitride groep volgens de gestelde voorwaarden niet reageren, want geen vrij elektronenpaar. Als je het héél erg lief vraagt wil ik wel een reactiemechanisme uitschrijven. Of opzoeken.Het klopt dat er onder fysiologische omstandigheden eerder sprake is van een zwitterion. Maar ik vraag me wel af of COO- en NH3+ reactiever zijn. Kun je dit toelichten?
quote:COO- is niet zo heel erg reactief omdat het gestabiliseerd wordt door conjugatie (negatieve lading is verdeeld over de beide bindingen. Dit is de sterkste soort stabilisatie). Daarbij is in deze reactie de COO- het elektrofiel (datgene wat elektronen gaan ontvangen). Een negatieve lading op een elektrofiel maakt het nog minder reactief (want het heeft al een overschot aan elektronen, zit niet op nog meer extra te wachten. Die extra elektronen waar jij het over hebt werken de reactie alleen maar tegen in dit geval). NH3+ is het nucleofiel, terwijl het een positieve lading heeft (en dus niet nog meer elektronen kwijt wil).Op dinsdag 13 april 2010 08:34 schreef Gray het volgende:
[..]
Je hebt gelijk, al dit is vrijwel altijd het geval. Water bestaat sowieso voor een deel uit OH- en H+. 'Puur' water bestaat niet. Het is een optelsom van H2O, OH- en H+.
[..]
COO- is zeer sterk reactief door de extra vrije elektronen. NH3+ levert het substraat nodig voor deze reactie. Het reactiemechanisme wordt overigens gewoon met NH2 en COOH geschreven, anders kan de nitride groep volgens de gestelde voorwaarden niet reageren, want geen vrij elektronenpaar. Als je het héél erg lief vraagt wil ik wel een reactiemechanisme uitschrijven. Of opzoeken.
Heb je nog het probleem met de vertrekkende groep: van COO- zou een O2- moeten vertrekken om de peptide binding te maken. Dat is absoluut geen goede vertrekkende groep, omdat het die minladingen niet goed kan stabiliseren. Daarom voegen chemici DCC (maar er zijn ook andere stoffen mogelijk) toe: dat gaan aan de O die moet vertrekken zitten en stabiliseert de negatieve lading waardoor het wel een goede vertrekkende groep wordt.
Ik ken het reactiemechanisme, maar kan het even niet zo snel vinden. Misschien dat ik vanmiddag mn aantekeningen inscan.
[ Bericht 1% gewijzigd door Chemiu op 13-04-2010 11:23:10 ]
quote:En die kun je vinden op het ruw endoplasmatisch reticulum.Op dinsdag 13 april 2010 00:12 schreef Chemiu het volgende:
Wat je zegt is waar, aminozuren komen in het lichaam meestal voor als zwitterion. Maar buiten de cel reageert dat juist helemaal niet sneller dan de ongeladen variant. Chemici moeten een activerende stof toevoegen (DCC) om de reactie aan de gang te krijgen. Hier diep op in gaan zonder voorkennis is imho onmogelijk, heeft te maken met vertrekkende groepen en reactiemechanismen. Of iig, ik kan het niet makkelijk uitleggen, misschien dat een van de anderen hier het wel kan.
[..]
Ah het ribosoom is de holte. Ik wist het niet zeker, had daarom maar weggelaten wat die 'omgeving' precies vormde.
quote:En dan heb je het nog niet eens over de zuiverheid. Als je te lange ketens probeert te maken, krijg je door het onherroepelijk optreden van fouten een mengelmoesje waar je niet blij van wordt.Eiwitten buiten de cel maken is echt een hel voor chemici inderdaad. Beschermgroep erop, weer eraf, nieuwe erop, weer eraf etc. En allemaal onder andere omstandigheden omdat je niet de verkeerde groepen eraf wil slopen (de beschermgroepen op de -COOH of -NH2 in de zijketens moeten erop blijven zitten). Wat het ribosoom in een keer kan, hebben chemici ongelooflijk veel verschillende stappen voor nodig. Wel een van de interessantste onderwerpen die ik tot nu toe gehad heb.
quote:Ik zat aan dit mechanisme te denken en dan heb je niets aan NH3, want die groep heeft geen vrij elektronenpaar:Op dinsdag 13 april 2010 08:34 schreef Gray het volgende:
Je hebt gelijk, al dit is vrijwel altijd het geval. Water bestaat sowieso voor een deel uit OH- en H+. 'Puur' water bestaat niet. Het is een optelsom van H2O, OH- en H+.
[..]
COO- is zeer sterk reactief door de extra vrije elektronen. NH3+ levert het substraat nodig voor deze reactie. Het reactiemechanisme wordt overigens gewoon met NH2 en COOH geschreven, anders kan de nitride groep volgens de gestelde voorwaarden niet reageren, want geen vrij elektronenpaar. Als je het héél erg lief vraagt wil ik wel een reactiemechanisme uitschrijven. Of opzoeken.

[ Bericht 0% gewijzigd door lyolyrc op 13-04-2010 17:40:05 (ontbrekend elektronpaar) ]
quote:Wat geven de minnetjes en plusjes aan?Op maandag 12 april 2010 00:24 schreef Gray het volgende:
Ook heeft een aminozuur een groot deel van de tijd geen COOH en NH2, maar COO- en NH3+.
In dit geval zie ik dat er een H van COOH naar NH2 is gegaan, welk "groot deel van de tijd" gebeurt dat? Is dat een soort vrije waterstofatoom die soms van plaats vewisseld, en heeft het nog een bepaalde functie?
Oh, en wat geeft de dubbele verbinding aan, in zo'n molecuulplaatje?

Ik zie een dubbele lijn tussen C en O, en bij de rest maar een enkele.
quote:De minnetjes en plusjes geven lading aan van de groepen. De groep met de pluslading komt een elektron tekort, de groep met de minlading heeft een elektron te veel. Het is geen H die 'van plaats verwisselt', maar een H+. Een zure groep staat H+ gemakkelijk af, in dit geval is dat COOH. Daardoor blijft er COO- over. De NH2-groep neemt juist graag die H+ op, zo'n groep noemen we basisch. Er onstaat dan NH3+. Dit gedrag komt voort uit de eigenschap van de groepen en de zuurtegraad van de cel. In een veel zuurdere omgeving, bijvoorbeeld de maag, heb je NH3+ en COOH, in een heel weinig zure omgeving heb je juist NH2 en COO-.Op dinsdag 13 april 2010 16:48 schreef Montov het volgende:
Wat geven de minnetjes en plusjes aan?
In dit geval zie ik dat er een H van COOH naar NH2 is gegaan, welk "groot deel van de tijd" gebeurt dat? Is dat een soort vrije waterstofatoom die soms van plaats vewisseld, en heeft het nog een bepaalde functie?
quote:Een dubbel lijntje betekent dat er een dubbele binding is tussen twee atomen. Een binding tussen atomen ontstaat als ze een elektronpaar gaan delen. Een zo'n lijntje staat hier voor een elektronpaar. C en O delen in dit geval twee elektronparen.Oh, en wat geeft de dubbele verbinding aan, in zo'n molecuulplaatje?
[ afbeelding ]
Ik zie een dubbele lijn tussen C en O, en bij de rest maar een enkele.
quote:Klopt. Ik bedoelde niet dat O-2 zou vertrekken, maar dat er een H+ snel bijkomt. Al is dat in deze reactie niet belangrijk. Maar COO- gaat hier toch geen elektronen erbij krijgen? Het bindt een H+ en vervolgens nog een waterstof van de nitride groep, wat betekent dat het meer van zijn elektronen gaat delen.Op dinsdag 13 april 2010 11:16 schreef Chemiu het volgende:
[..]
COO- is niet zo heel erg reactief omdat het gestabiliseerd wordt door conjugatie (negatieve lading is verdeeld over de beide bindingen. Dit is de sterkste soort stabilisatie). Daarbij is in deze reactie de COO- het elektrofiel (datgene wat elektronen gaan ontvangen). Een negatieve lading op een elektrofiel maakt het nog minder reactief (want het heeft al een overschot aan elektronen, zit niet op nog meer extra te wachten. Die extra elektronen waar jij het over hebt werken de reactie alleen maar tegen in dit geval). NH3+ is het nucleofiel, terwijl het een positieve lading heeft (en dus niet nog meer elektronen kwijt wil).
Heb je nog het probleem met de vertrekkende groep: van COO- zou een O2- moeten vertrekken om de peptide binding te maken. Dat is absoluut geen goede vertrekkende groep, omdat het die minladingen niet goed kan stabiliseren. Daarom voegen chemici DCC (maar er zijn ook andere stoffen mogelijk) toe: dat gaan aan de O die moet vertrekken zitten en stabiliseert de negatieve lading waardoor het wel een goede vertrekkende groep wordt.
Ik ken het reactiemechanisme, maar kan het even niet zo snel vinden. Misschien dat ik vanmiddag mn aantekeningen inscan.
Organische chemie is alweer enkele jaren geleden voor mij en is bij mijn huidig onderzoek (nog) niet nodig. Dank je voor de opfrisbeurt.