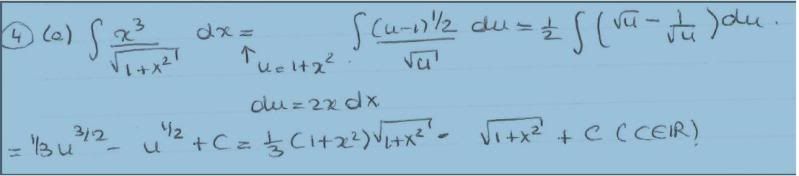SES School, Studie en Onderwijs
Wiskunde in de brugklas, Frans voor het examen of een studie Personeel en Arbeid? Moeilijke formulieren van DUO? Iets weten over studiefinanciering of studentenverenigingen? Dit is het forum voor leerkrachten, scholieren en studenten, van brugklas tot uni



Ze beginnen met een tweede gelijkheid die moet gelden: de totale impuls moet gelijk blijven.
eee7a201261dfdad9fdfe74277d27e68890cf0a220f41425870f2ca26e0521b0


En dan hebben ze dus 2 vergelijkingen met 2 onbekenden.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


En dit zijn nog de makkelijke sommen, het volgende hoofdstuk is geen touw aan vast te knopen.
Blues ain't nothing but a good man feeling bad...


Nee dat zie je verkeerd. Er wordt eerst met de Wet van behoud van energie een betrekking afgeleid tussen de kwadraten van de beide snelheden vb en vc. Vervolgens wordt met de Wet van behoud van impuls een tweede betrekking afgeleid, nu tussen vb en vc zelf. Dan heb je twee vergelijkingen in twee onbekenden en kun je dus vb en vc beide uitrekenen.quote:Op woensdag 20 januari 2010 14:20 schreef GoodGawd het volgende:
Meer mechanica vragen:
[ afbeelding ]
Ik snap niet wat ze bij de 5e regel opeens doen. Opeens zijn die 2e machten verdwenen en is die 12 foetsie. Wat is er aan de hand?


ik weet het al 
[ Bericht 98% gewijzigd door GoodGawd op 20-01-2010 18:01:17 ]
[ Bericht 98% gewijzigd door GoodGawd op 20-01-2010 18:01:17 ]
Blues ain't nothing but a good man feeling bad...


Ik loop een beetje vast!
De vraag op zich is wel redelijk te begrijpen.... maar de manier om het uit te werken
De vraag op zich is wel redelijk te begrijpen.... maar de manier om het uit te werken
Het antwoord is in ieder geval: 1,4 : 1quote:Je hebt een HCO3- / CO32- buffer nodig met pH = 10,40.
Bereken in welke molverhouding je de stoffen NaHCO3 en Na2CO3 moet oplossen om een bufferoplossing te krijgen met pH = 10,40. Gegeven: Ka (H2CO¬3) = 4,4∙10-7 en Ka (HCO3-) = 5,6∙10-11.


quote:Op woensdag 20 januari 2010 17:51 schreef horned_reaper het volgende:
Ik loop een beetje vast!
De vraag op zich is wel redelijk te begrijpen.... maar de manier om het uit te werken
[..]
Het antwoord is in ieder geval: 1,4 : 1
nou, om te beginnen moet je de evenwichtsvergelijking opstellen:
Kacid = [H+]*[Base-]/[HB]
deze omvormen naar de pH-buffervergelijking door links en rechts de -10log te nemen:
pKacid = pH - log([Base-]/[HB])
nu is het een kwestie van invullen van gegevens
Je hebt een HCO3- / CO32- buffer nodig met pH = 10,40.
Bereken in welke molverhouding je de stoffen NaHCO3 en Na2CO3 moet oplossen om een bufferoplossing te krijgen met pH = 10,40.
Gegeven:
Kacid(H2CO3) = 4,4∙10-7 en Kacid(HCO3-) = 5,6∙10-11.
Je hebt een waterstofcarbonaat/carbonaat buffer nodig dus NaHCO3 is hier je zuur.
De vgl. wordt daarmee: pK[HCO3-] = 10.40 -log([CO3--]/[HCO3-])
constanten bij elkaar voegen: pK[HCO3-] - 10.40 = -log([CO3--]/[HCO3-])
aan de linkerkant komt een getal te staan, dus betekent dat er rechts hetzelfde getal moet komen te staan. Door links en rechts met -1 te vermenigvuldigen en vervolgens 10 te verheffen tot die macht, rolt direct je molverhouding uit de buffervgl.
[ Bericht 17% gewijzigd door ErictheSwift op 21-01-2010 17:42:29 ]


Kan iemand mij dit uitleggen.
0,5 * Integraal (u-1)/ wortel( u) wordt opeens --> 0,5 * integraal wortel( u) - 1/ wortel (u).
Dat vetgedrukte snap ik niet. Hoe kan u/wortel (u) nou wortel (u) zijn?
0,5 * Integraal (u-1)/ wortel( u) wordt opeens --> 0,5 * integraal wortel( u) - 1/ wortel (u).
Dat vetgedrukte snap ik niet. Hoe kan u/wortel (u) nou wortel (u) zijn?
In fact, recent observations and simulations have suggested that a network of cosmic strings stretches across the entire universe.


Hierbij toch maar een plaatje upgeload van het probleem:
In fact, recent observations and simulations have suggested that a network of cosmic strings stretches across the entire universe.


Even lang uitgeschreven:

Op dinsdag 23 augustus 2011 23:18 schreef problematiQue het volgende:
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.
Mensen die zomaar claimen dat A beter is dan B moet je gewoon negeren. Internetruis.


Ah stom, ik had het ook zo uitgeschreven, maar op een of andere vaag manier had ik U2 - U-1/2 gebruikt. Vermoeiing he  hehhe.
hehhe.
In fact, recent observations and simulations have suggested that a network of cosmic strings stretches across the entire universe.


Ja, of √u√u = u, dus u/√u = √u, dat is net zo helder hoop ik als dat 2·2 = 4 dus 4/2 = 2  .
.
Daher iſt die Aufgabe nicht ſowohl, zu ſehn was noch Keiner geſehn hat, als, bei Dem, was Jeder ſieht, zu denken was noch Keiner gedacht hat.


Heb een paar maanden terug een proef gedaan maar ben alles kwijt en heb nu last van een black out.
Als jullie mijn vragen willen beantwoorden zou ik erg blij zijn!
Vierkantsvergelijking van broomwater en heptaan
Welk type reactie is er opgetreden
Geef de namen voor de gevormde reactieproducten
Welke reactie treedt erop tussen 3-deceen en broom, geef de reactie vergelijking.
Welk type reactie is er opgetreden?
Geef de namen voor de gevormde reactie producten
Mijn dank is groot
Als jullie mijn vragen willen beantwoorden zou ik erg blij zijn!
Vierkantsvergelijking van broomwater en heptaan
Welk type reactie is er opgetreden
Geef de namen voor de gevormde reactieproducten
Welke reactie treedt erop tussen 3-deceen en broom, geef de reactie vergelijking.
Welk type reactie is er opgetreden?
Geef de namen voor de gevormde reactie producten
Mijn dank is groot


zoek eens op reactie van alkanen met halogenen, volgens mij kom je dan maar 1 type tegen.
Voor reacties tussen alkenen en halogenen kom je ook maar 1 type tegen..
En dan is het een kwestie van tekenen.
Voor reacties tussen alkenen en halogenen kom je ook maar 1 type tegen..
En dan is het een kwestie van tekenen.


Tekenen met structuurformules.
Dus heptaan even uittekenen, en kijken hoeveel producten daarbij kunnen ontstaan.
Het zelfde voor de reactie van 3-deceen en broom(daar ben je ws. sneller klaar).
Dus heptaan even uittekenen, en kijken hoeveel producten daarbij kunnen ontstaan.
Het zelfde voor de reactie van 3-deceen en broom(daar ben je ws. sneller klaar).


Gegoogled, kom er nog steeds niet uit... Liefst heb ik het antwoord met uitleg erbij ipv hint...
[ Bericht 82% gewijzigd door vault_tec op 21-01-2010 21:19:31 ]
[ Bericht 82% gewijzigd door vault_tec op 21-01-2010 21:19:31 ]


Ter illustratie:
De reacties tussen halogenen en alkanen vallen onder de zgn. substitutiereactie (substitutie oftewel omwisseling/vervanging) en gaat schematisch als volgt:
broomwater is niet meer als broom opgelost/gedispergeerd in water, zeg maar Br2(aq). Onder invloed van licht (hf) valt het broommolekuul Br2(aq) uiteen in twee losse broomatomen met elk een ongepaard electron, twee Br* -radicalen dus.
1 zo'n broomradicaal reageert met een alkaan tot een monohalogeenalkaan en HBr. Zolang er maar genoeg broom is zal op ten duur elk waterstofatoom van de alkanen gesubstitueerd worden voor een broomatoom.
Deze reactie verloopt, zoals je boven al hebt kunnen raden, alleen in licht.
De reacties tussen halogenen en alkenen behoren tot de zgn. additiereacties (additie oftewel toevoeging/optelling). Alkenen hebben die dubbele binding (-HC=CH-) die bol staat van elektronen(dichtheid), en halogenen zijn maar wat gek op elektronen dankzij die BIJ-NA volle buitenste schil. Dr zal dus een complex gevormd worden waarbij een broommolekuul met 1 kant/atoom aan de dubbele binding gaat hechten. Het buitenste broomatoom splitst zich af, er ontstaat een -HCBr-CH*- reactie-intermediair, en vervolgens zal het tweede broomatoom, dat zich zojuist heeft afgesplitst, vanaf de andere kant aan het andere C-atoom hechten. Uiteindelijk krijg je dan een dihalogeenkoolwaterstof met een -HCBr-CHBr- waarbij de broomatomen zich elk aan de andere kant van het molekuul begeven dankzij de sterische belemmering (broomatomen zijn groot ivm koolstof en waterstof).
Additiereacties verlopen dus zowel in het donker als in het licht. Merk op dat in het licht de substitutiereactie tegelijk met de additiereactie optreedt.
Voor een betere visualisatie kan je beter even je organisch chemisch boek erbij pakken of naar de wikipedia-page surfen.
De reacties tussen halogenen en alkanen vallen onder de zgn. substitutiereactie (substitutie oftewel omwisseling/vervanging) en gaat schematisch als volgt:
broomwater is niet meer als broom opgelost/gedispergeerd in water, zeg maar Br2(aq). Onder invloed van licht (hf) valt het broommolekuul Br2(aq) uiteen in twee losse broomatomen met elk een ongepaard electron, twee Br* -radicalen dus.
1 zo'n broomradicaal reageert met een alkaan tot een monohalogeenalkaan en HBr. Zolang er maar genoeg broom is zal op ten duur elk waterstofatoom van de alkanen gesubstitueerd worden voor een broomatoom.
Deze reactie verloopt, zoals je boven al hebt kunnen raden, alleen in licht.
De reacties tussen halogenen en alkenen behoren tot de zgn. additiereacties (additie oftewel toevoeging/optelling). Alkenen hebben die dubbele binding (-HC=CH-) die bol staat van elektronen(dichtheid), en halogenen zijn maar wat gek op elektronen dankzij die BIJ-NA volle buitenste schil. Dr zal dus een complex gevormd worden waarbij een broommolekuul met 1 kant/atoom aan de dubbele binding gaat hechten. Het buitenste broomatoom splitst zich af, er ontstaat een -HCBr-CH*- reactie-intermediair, en vervolgens zal het tweede broomatoom, dat zich zojuist heeft afgesplitst, vanaf de andere kant aan het andere C-atoom hechten. Uiteindelijk krijg je dan een dihalogeenkoolwaterstof met een -HCBr-CHBr- waarbij de broomatomen zich elk aan de andere kant van het molekuul begeven dankzij de sterische belemmering (broomatomen zijn groot ivm koolstof en waterstof).
Additiereacties verlopen dus zowel in het donker als in het licht. Merk op dat in het licht de substitutiereactie tegelijk met de additiereactie optreedt.
Voor een betere visualisatie kan je beter even je organisch chemisch boek erbij pakken of naar de wikipedia-page surfen.


Dank je wel, zo was het even helemaal kwijt terwijl ik dit al 8 weken langs op school behandel.
Fijne avond verder
Fijne avond verder


Dringende vraag!
Hoe kan ik dit met Excel uitrekenen?
"Het gewicht van appel is normaal verdeeld met "mU" (Gemiddelde) = 100 en Sigma (St,afw) = 20"
"Wel percentage appels heeft een gewicht tussen 70 en 110 g? "
Hoe kan ik dit met Excel uitrekenen?
"Het gewicht van appel is normaal verdeeld met "mU" (Gemiddelde) = 100 en Sigma (St,afw) = 20"
"Wel percentage appels heeft een gewicht tussen 70 en 110 g? "


NORMDIST(x;mu;sigma;TRUE) geeft de kans dat X<x.quote:Op vrijdag 22 januari 2010 09:04 schreef horned_reaper het volgende:
Dringende vraag!
Hoe kan ik dit met Excel uitrekenen?
"Het gewicht van appel is normaal verdeeld met "mU" (Gemiddelde) = 100 en Sigma (St,afw) = 20"
"Wel percentage appels heeft een gewicht tussen 70 en 110 g? "
Dus bereken NORMDIST(110;100;20;TRUE) en NORMDIST(70;100;20;TRUE). Het verschil van deze twee waarden is de waarde die je zoekt.


Ik heb drie (even grote) massa's en die geef ik een beginpositie en beginsnelheid. De differentiaalvergelijkingen los ik numeriek op met een programma, waarmee ik op ieder tijdstip de positie, snelheid en versnelling van elke drie massa's kan uitrekenen.
Hoe kan ik de totale potentiële energie berekenen in het systeem met de drie massa's op verschillende tijdstippen?
Moet je dan als referentiepunt het massamiddelpunt van de drie massa's nemen?
[ Bericht 19% gewijzigd door BasementDweller op 24-01-2010 00:27:42 ]
Hoe kan ik de totale potentiële energie berekenen in het systeem met de drie massa's op verschillende tijdstippen?
Moet je dan als referentiepunt het massamiddelpunt van de drie massa's nemen?
[ Bericht 19% gewijzigd door BasementDweller op 24-01-2010 00:27:42 ]